高考二轮复习知识点:常用仪器及其使用1
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 下列玻璃仪器在相应实验中选用不合理的是
 A、重结晶法提纯苯甲酸:①②③ B、蒸馏法分离CH2Cl2和CCl4:③⑤⑥ C、浓硫酸催化乙醇制备乙烯:③⑤ D、酸碱滴定法测定NaOH溶液浓度:④⑥
A、重结晶法提纯苯甲酸:①②③ B、蒸馏法分离CH2Cl2和CCl4:③⑤⑥ C、浓硫酸催化乙醇制备乙烯:③⑤ D、酸碱滴定法测定NaOH溶液浓度:④⑥ -
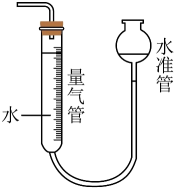
2. 利用如图所示的装置(夹持及加热装置略)制备高纯白磷的流程如下:

下列操作错误的是
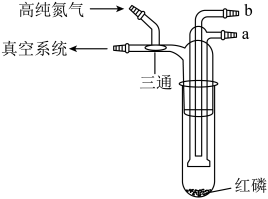 A、红磷使用前洗涤以除去表面杂质 B、将红磷转入装置,抽真空后加热外管以去除水和氧气 C、从a口通入冷凝水,升温使红磷转化 D、冷凝管外壁出现白磷,冷却后在氮气氛围下收集
A、红磷使用前洗涤以除去表面杂质 B、将红磷转入装置,抽真空后加热外管以去除水和氧气 C、从a口通入冷凝水,升温使红磷转化 D、冷凝管外壁出现白磷,冷却后在氮气氛围下收集 -
3. 下列装置可以用于相应实验的是
A
B
C
D
制备
分离乙醇和乙酸
验证酸性
测量体积
A、A B、B C、C D、D -
4. 下列实验操作中选用仪器正确的是( )




用量筒量取10.00mL盐酸
用瓷坩埚加热熔化NaOH固体
用分液漏斗分离乙酸异戊酯和水的混合物
配制一定温度的NaCl饱和溶液,用温度计测温并搅拌
A
B
C
D
A、A B、B C、C D、D -
5. 某实验小组用如下实验用品检验黑木耳中铁元素。下列说法错误的是( )
 A、将黑木耳灼烧灰化,选用的仪器有①、②、⑥、⑦和⑨ B、用浓硝酸溶解木耳灰并获得滤液,选用的仪器有④、⑤、⑦和⑩ C、检验滤液中的 , 选用③、⑧和⑩ D、利用上述仪器也可进行硫酸铜结晶水含量的测定
A、将黑木耳灼烧灰化,选用的仪器有①、②、⑥、⑦和⑨ B、用浓硝酸溶解木耳灰并获得滤液,选用的仪器有④、⑤、⑦和⑩ C、检验滤液中的 , 选用③、⑧和⑩ D、利用上述仪器也可进行硫酸铜结晶水含量的测定 -
6. 从海带中提取碘元素的步骤中,选用的实验仪器不能都用到的是
 A、海带灼烧灰化,选用①②⑧ B、加水浸泡加热,选用②④⑦ C、过滤得到滤液,选用④⑤⑦ D、萃取和分液,选用③④⑥
A、海带灼烧灰化,选用①②⑧ B、加水浸泡加热,选用②④⑦ C、过滤得到滤液,选用④⑤⑦ D、萃取和分液,选用③④⑥ -
7. 下列关于仪器使用的说法正确的是( )
 A、a可用于溶液的蒸发浓缩 B、b可用于物质分离 C、c受热时不需要垫石棉网 D、d通冷凝水的方向是上进下出
A、a可用于溶液的蒸发浓缩 B、b可用于物质分离 C、c受热时不需要垫石棉网 D、d通冷凝水的方向是上进下出 -
8. 实验室利用下列仪器(不考虑夹持装置和塞子及导管)不能制备的气体是( )
 A、C2H2 B、H2 C、CO2 D、C2H4
A、C2H2 B、H2 C、CO2 D、C2H4 -
9. 茶叶中铁元素检验可用以下步骤完成,各步选用的实验用品不需要的是( )
A
B
C
D




将茶叶灼烧灰化
用浓硝酸溶解茶叶灰并加蒸馏水稀释
过滤得到滤液
检验滤液中的
A、A B、B C、C D、D -
10. 掌握化学实验技能是进行科学探究的基本保证。下列有关说法正确的是
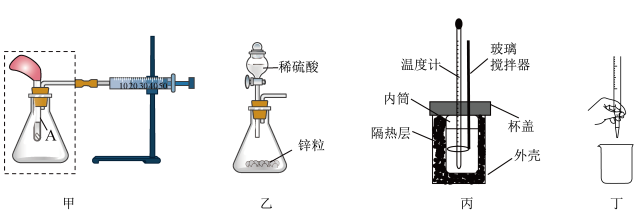 A、若将甲中注射器的活塞往右拉,能自动恢复到原位,说明甲装置气密性好 B、将甲虚线框中的装置换为乙装置,滴入稀硫酸后若注射器活塞右移,说明锌与硫酸反应为放热反应 C、用丙装置进行中和反应反应热的测定实验时,NaOH要缓慢倒入稀硫酸中 D、丁装置是排出碱式滴定管中的气泡操作
A、若将甲中注射器的活塞往右拉,能自动恢复到原位,说明甲装置气密性好 B、将甲虚线框中的装置换为乙装置,滴入稀硫酸后若注射器活塞右移,说明锌与硫酸反应为放热反应 C、用丙装置进行中和反应反应热的测定实验时,NaOH要缓慢倒入稀硫酸中 D、丁装置是排出碱式滴定管中的气泡操作 -
11. 下列实验操作或实验仪器的使用正确的是A、做“海带中碘元素的分离及检验”实验时,须用过量的氯气或双氧水氧化I- B、用剩的药品能否放回原瓶,应视具体情况而定 C、其他条件相同时,双氧水在碱性溶液中分解速率比在酸性溶液中慢 D、滴定接近终点时,滴定管的尖嘴不能接触锥形瓶内壁
-
12. 实验改进与优化应遵循科学性、直观性、易操作性、安全性的原则,提升化学实验效率。下列有关实验改进分析错误的是
 A、使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利流下 B、用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气产生 C、该改进装置可用于性质的探究实验 D、利用此装置可较长时间看到白色絮状沉淀
A、使用恒压滴液漏斗可防止浓氨水污染环境,并使漏斗内液体顺利流下 B、用点燃的木条靠近肥皂泡,听到爆鸣声,可检验产物中有氢气产生 C、该改进装置可用于性质的探究实验 D、利用此装置可较长时间看到白色絮状沉淀 -
13. 下列实验装置及表述正确的是
A
B
C
D




(经酸化3%NaCl溶液)
蒸干AlCl3溶液制无水AlCl3固体
实验室制乙炔
实验室制备Fe(OH)3胶体
在Fe表面生成蓝色沉淀,无法验证Zn保护了Fe
A、A B、B C、C D、D -
14. 下列实验中,所选装置(可添加试剂,可重复使用)不合理的是
 A、盛放NaOH溶液,选用③ B、用NH4Cl和Ca(OH)2固体制备氨,选用② C、配制100mL1.00mol•L-1NaCl溶液,选用⑤ D、用大理石和盐酸制取CO2并比较碳酸和苯酚的酸性强弱,选用①④
A、盛放NaOH溶液,选用③ B、用NH4Cl和Ca(OH)2固体制备氨,选用② C、配制100mL1.00mol•L-1NaCl溶液,选用⑤ D、用大理石和盐酸制取CO2并比较碳酸和苯酚的酸性强弱,选用①④ -
15. 甲~丁图为中学化学常用仪器的全部或局部,下列说法正确的是
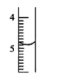



甲
乙
丙
丁
A、甲图所示仪器使用前需检查是否漏水 B、乙图所示仪器用于蒸馏时,冷却水应从下口通入 C、丙图所示仪器用于观察氯化钠的焰色试验 D、丁图所示仪器可用于酸碱中和滴定和减压过滤 -
16. 下列有关实验操作的叙述错误的是A、滴定管用水洗净后,加入待装液 B、配制溶液时,容量瓶不需干燥 C、测结晶水含量时,加热后的坩埚必须放在干燥器中冷却 D、过滤操作中,漏斗的尖端应接触烧杯内壁
-
17. 实验室制备下列物质不需要用到酒精灯的是A、乙烯 B、乙炔 C、乙酸乙酯 D、乙酸丁酯
-
18. 下列实验操作规范的是
 A、①灼烧干海带 B、②检验铜与浓硫酸反应的氧化产物 C、③用萃取碘水中的碘,振荡、放气 D、④配制溶液定容后摇匀
A、①灼烧干海带 B、②检验铜与浓硫酸反应的氧化产物 C、③用萃取碘水中的碘,振荡、放气 D、④配制溶液定容后摇匀 -
19. 球形干燥管是中学化学常用的一种玻璃仪器。下列有关球形干燥管的创新用途,错误的是
选项
A
B
C
D
装置

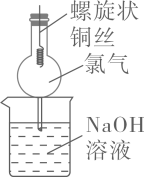


用途
用于尾气处理,防倒吸
用于铜丝与Cl2反应,防污染
简易的天 然水净化过滤器
用Na2CO3固体与稀硫酸反应制备CO2气体,可随制随停
A、A B、B C、C D、D -
20. 下列有关实验方法正确的是A、用X射线衍射实验可获得青蒿素分子的结构 B、用广泛pH试纸测得醋酸溶液的pH为2.0 C、用淀粉溶液检验海水中的碘元素 D、用25 mL碱式滴定管量取16.60 mL高锰酸钾溶液
-
21. 《医学入门》中记载我国传统中医提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干”。若在实验室里完成文中操作,不需要的仪器是A、
 B、
B、 C、
C、 D、
D、
-
22. 下列叙述正确的是A、容量瓶、滴定管、分液漏斗使用前均需要检验是否漏水 B、可用氢氟酸清洗做过硅酸分解实验的瓷坩埚 C、金属镁着火时,可用泡沫灭火器灭火 D、可将硝酸银固体保存在棕色细口瓶中
-
23. 学习小组用废弃的铝制易拉罐按如下流程制备明矾,并测定明矾中结晶水的含量。

上述实验中不需要用到的操作是
A、 B、
B、 C、
C、 D、
D、
-
24. 某化学兴趣小组为检验菠菜中是否含有铁元素,进行如下步骤:①将菠菜研磨成汁,加水溶解,过滤得到滤液;②加入稀硝酸进行氧化;③滴加KSCN溶液检验溶液中是否含有Fe3+。上述操作中,不需要用到的仪器为( )A、
 B、
B、 C、
C、 D、
D、
-
25. 化学实验是化学探究的一种重要途径。下列有关实验的描述正确的是A、用湿润的蓝色石蕊试纸检验 B、中学实验室中,可将未用完的钠放回原试剂瓶 C、进行焰色试验时,可用玻璃棒替代铂丝 D、酸碱中和滴定实验中,应先用待测液润洗锥形瓶
-
26. 欲分离某CCl4和H2O的混合液,需要用到的仪器是A、
 B、
B、 C、
C、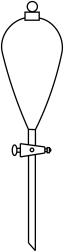 D、
D、
-
27. 下列仪器可加热的是A、
 B、
B、 C、
C、 D、
D、
-
28. 下列实验操作规范且能达到实验目的的是( )
选项
A
B
C
D
操作


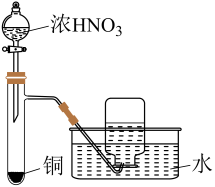
实验目的
制备氢氧化铁胶体
定容
除去中的少量HCl
制备并收集
A、A B、B C、C D、D -
29. 下列实验装置及操作均合理的是( )
 A、用装置甲测定污水样品中 B、用装置乙制备乙酸乙酯 C、用装置丙灼烧海带 D、用装置丁测定中和热
A、用装置甲测定污水样品中 B、用装置乙制备乙酸乙酯 C、用装置丙灼烧海带 D、用装置丁测定中和热
二、多选题
-
30. 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器和连接装置)( )
选项
实验目的
玻璃仪器
试剂
A
比较Mg、Al金属性的强弱
试管、胶头滴管
MgCl2溶液、AlCl3溶液、浓NaOH溶液
B
观察[Cu(NH3)4]SO4•H2O晶体的形成和析出
试管、胶头滴管、玻璃棒
CuSO4溶液、氨水
C
通过气味消失的快慢比较乙酸乙酯的水解速率
试管、烧杯、量筒、胶头滴管、酒精灯
乙酸乙酯、蒸馏水、H2SO4溶液、NaOH溶液
D
实验室由粗盐(含Mg2+、Ca2+、SO)制备精盐
漏斗、烧杯、玻璃棒、酒精灯
粗食盐水、NaOH溶液、Na2CO3溶液、BaCl2溶液
A、A B、B C、C D、D -
31. 为完成下列各组实验,所选玻璃仪器和试剂均符合题意、完整的是(不考虑存放试剂的容器)( )
实验目的
玻璃仪器
试剂
A
检验中的溴元素
胶头滴管、试管、酒精灯
、NaOH溶液、硝酸、溶液
B
测定盐酸浓度
碱式滴定管、锥形瓶、烧杯、胶头滴管
标准NaOH溶液、待测盐酸溶液、甲基橙试剂
C
检验某补铁口服液中铁元素的价态
试管、胶头滴管
某补铁口服液、氯水、KSCN溶液
D
比较亚硫酸和碳酸酸性强弱
玻璃棒、表面皿
pH试纸、饱和溶液、饱和溶液
A、A B、B C、C D、D
三、非选择题
-
32. 2—噻吩乙醇()是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:

Ⅰ.制钠砂。向烧瓶中加入液体A和金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至 , 加入噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至 , 加入稍过量的环氧乙烷的四氢呋喃溶液,反应。
Ⅳ.水解。恢复室温,加入水,搅拌;加盐酸调至4~6,继续反应 , 分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水 , 静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品。
回答下列问题:
(1)、步骤Ⅰ中液体A可以选择。a.乙醇 b.水 c.甲苯 d.液氨
(2)、噻吩沸点低于吡咯(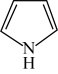 )的原因是。 (3)、步骤Ⅱ的化学方程式为。(4)、步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是。(5)、步骤Ⅳ中用盐酸调节的目的是。(6)、下列仪器在步骤Ⅴ中无需使用的是(填名称):无水的作用为。
)的原因是。 (3)、步骤Ⅱ的化学方程式为。(4)、步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是。(5)、步骤Ⅳ中用盐酸调节的目的是。(6)、下列仪器在步骤Ⅴ中无需使用的是(填名称):无水的作用为。 (7)、产品的产率为(用计算,精确至0.1%)。
(7)、产品的产率为(用计算,精确至0.1%)。 -
33. 钴配合物溶于热水,在冷水中微溶,可通过如下反应制备:。
具体步骤如下:
Ⅰ.称取 , 用水溶解。
Ⅱ.分批加入后,将溶液温度降至以下,加入活性炭、浓氨水,搅拌下逐滴加入的双氧水。
Ⅲ.加热至反应。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)、步骤Ⅰ中使用的部分仪器如下。
仪器a的名称是。加快NH4Cl溶解的操作有。
(2)、步骤Ⅱ中,将温度降至10℃以下以避免、;可选用降低溶液温度。(3)、指出下列过滤操作中不规范之处:。 (4)、步骤Ⅳ中,趁热过滤,除掉的不溶物主要为。(5)、步骤Ⅴ中加入浓盐酸的目的是。
(4)、步骤Ⅳ中,趁热过滤,除掉的不溶物主要为。(5)、步骤Ⅴ中加入浓盐酸的目的是。 -
34. 高纯氟化镁具备优异的光学性质和抗腐蚀性被广泛应用于高端领域。某研究小组利用镁片(含及少量惰性杂质)制备高纯氟化镁流程如下,请回答:

已知:
①甲醇沸点:
②该实验条件得到的氟化镁并不是晶型沉淀,其颗粒细小,常常吸附水分成黏稠胶状。
(1)、利用图1装置可检测镁与甲醇反应速率。仪器A的名称。 (2)、写出氟化反应涉及的化学方程式。(3)、下列有关说法不正确的是____。A、步骤Ⅰ:反应温度不选择 , 主要由于在反应过于剧烈难以控制。 B、步骤Ⅱ:待镁片上不再有微小气泡生成时,可进行步骤Ⅱ。 C、步骤Ⅲ:制备悬浊液B,应先将通入高纯水达到饱和,再加到固体A中。 D、步骤Ⅳ:在进行氟化反应时,应做好防护措施和配备应急药品。(4)、步骤Ⅱ的一系列操作目的是为获得固体A.从下列选项中选择合理的仪器和操作,补全如下步骤[“ ”上填写一件最关键仪器 , “( )”内填写一种操作 , 均用字母表示]。
(2)、写出氟化反应涉及的化学方程式。(3)、下列有关说法不正确的是____。A、步骤Ⅰ:反应温度不选择 , 主要由于在反应过于剧烈难以控制。 B、步骤Ⅱ:待镁片上不再有微小气泡生成时,可进行步骤Ⅱ。 C、步骤Ⅲ:制备悬浊液B,应先将通入高纯水达到饱和,再加到固体A中。 D、步骤Ⅳ:在进行氟化反应时,应做好防护措施和配备应急药品。(4)、步骤Ⅱ的一系列操作目的是为获得固体A.从下列选项中选择合理的仪器和操作,补全如下步骤[“ ”上填写一件最关键仪器 , “( )”内填写一种操作 , 均用字母表示]。取仪器A中的溶液,用()→用(蒸馏减少溶剂)→用()→用漏斗(过滤得到固体A)
【仪器】a.烧杯;b.铜质保温漏斗;c.漏斗;d.空气冷凝管;e.直形冷凝管;f.球形冷凝管
【操作】g.过滤;h.趁热过滤;i.冷却结晶;j.蒸发结晶
(5)、步骤Ⅴ:产品在不同温度下干燥 , 对其进行红外光谱分析如下图,已知羟基引起的吸收峰在波数处请选择最合适的温度。(填“、、或”)
-
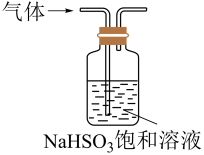
35. 化学工业为疫情防控提供了强有力的物质支撑,氯的许多化合物广泛应用于杀菌、消毒及化工领域。实验室中利用图装置(部分装置省略)制备和NaClO。

回答下列问题:
(1)、A中盛放浓盐酸的仪器名称为 , A中反应的化学方程式为。(2)、B装置的作用是。C中发生反应的离子方程式为 , D中使用冰水冷却的目的是。(3)、E中棉花团应蘸取的溶液是(填化学式),其作用是。(4)、也可用于消毒,则0.1mol的有效氯含量为g。(“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克的氧化能力。)
