高考二轮复习知识点:有关混合物反应的计算
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 称取(NH4)2SO4和NH4HSO4混合物样品7.24g,加入含0.1molNaOH的溶液,完全反应,生成NH3 1792mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )A、1:1 B、1:2 C、1.87:1 D、3.65:12. 已知有机物C2H4O、C3H6O2和C4H8组成的混合物中,碳元素的质量分数为a%,则氧元素的质量分数为A、(100-)% B、% C、% D、无法计算3. 某碳酸钾和碳酸氢钾组成的混合物样品61.4 g,加水溶解后,取所得溶液的十分之一,向其中缓缓加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗稀盐酸的体积,得到如图所示的曲线。下列说法错误的是( )
 A、该过程所发生反应的化学方程式:K2CO3+HCl =KCl+KHCO3;KHCO3+HCl=KCl+H2O+CO2↑ B、混合物样品中含碳酸钾20.0g C、混合物中碳元素的质量分数为9. 77% D、若将61.4 g原混合物样品充分加热,放出CO2的质量为4.40g4. 取一定质量铁和氧化铁的混合物加入100 mL 1 mol.L-1盐酸中,两者恰好完全反应,产生标准状况下气体0.448 L,且反应后溶液中滴加KSCN溶液无明显现象。原混合物中铁和氧化铁的物质的量比是( )A、1:1 B、2:1 C、3:1 D、1:25. 甲胺( )的性质与氨气相似,将pOH相同、体积均为 的CH3NH2∙H2O和 两种溶液分别加水稀释至体积为V,pOH随 的变化关系如图所示,下列叙述错误的是( )
A、该过程所发生反应的化学方程式:K2CO3+HCl =KCl+KHCO3;KHCO3+HCl=KCl+H2O+CO2↑ B、混合物样品中含碳酸钾20.0g C、混合物中碳元素的质量分数为9. 77% D、若将61.4 g原混合物样品充分加热,放出CO2的质量为4.40g4. 取一定质量铁和氧化铁的混合物加入100 mL 1 mol.L-1盐酸中,两者恰好完全反应,产生标准状况下气体0.448 L,且反应后溶液中滴加KSCN溶液无明显现象。原混合物中铁和氧化铁的物质的量比是( )A、1:1 B、2:1 C、3:1 D、1:25. 甲胺( )的性质与氨气相似,将pOH相同、体积均为 的CH3NH2∙H2O和 两种溶液分别加水稀释至体积为V,pOH随 的变化关系如图所示,下列叙述错误的是( )
已知:常温下, ,pOH=-lgc(OH-)。
A、稀释相同倍数时,CH3NH2∙H2O的浓度比 的浓度大 B、溶液中水的电离程度:b点大于c点 C、由c点到d点,溶液中 保持不变 D、常温下,某盐酸的 ,a点时CH3NH2∙H2O的 ,当 时,取等体积的两溶液混合,充分反应后:n(Cl-)>n(CH3NH3+)>n(H+)>n(OH-)6. 某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100 mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4g硫单质、0.425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法不正确的是( )A、该盐酸的物质的量浓度为8.5 mol·L-1 B、生成的H2S气体在标准状况下的体积为9.52L C、该磁黄铁矿FexS中,x=0.85 D、该磁黄铁矿FexS中,Fe2+的物质的量为0.15 mol7. 25℃时,将浓度均为0.1 mol•L-1、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( )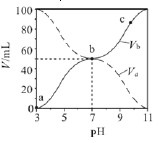 A、Ka(HA)=10-6 B、b点时,c(B+)+c(HA)=0.05mol/L C、c点时 随温度升高而增大 D、a→c过程中水的电离程度始终增大8. 在铁的氧化物和氧化铝组成的混合物中,加入 2 mol/L 硫酸溶液 65 mL,恰好完全反应,所得溶液中Fe2+能被标准状况下 112 mL 氯气氧化。则原混合物中金属元素和氧元素的原子个数之比为( )A、9∶13 B、5∶7 C、4∶3 D、3∶49. 将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为amol•L﹣1的HCl溶液,过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L.将溶液蒸干并充分灼烧得到固体W2g.下列关系式中错误的是( )A、24n(Al)+35.5n(Na)=W2﹣W1 B、n(Na)+3n(Al)=aV2 C、n(Na)+3n(Al)= D、aV2=10. 把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )A、 B、(2b﹣a)mol/L C、 D、(10b﹣5a)mol/L11. 将充有m mL NO和n mL NO2的量筒倒立于水槽中,然后通入m mL O2 , 若m<n,则充分反应后,量筒内气体的体积为( )A、3(m﹣n)mL B、 mL C、 mL D、 mL12. 向mg镁和铝的混合物重加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL.向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng.再将得到的沉淀灼烧至质量不再改变为止,得到固体pg.则下列关系不正确的是( )A、c= B、p=m+ C、n=m+17Vc D、 m<p< m13. 1.52g 铜镁合金完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )A、该合金中铜与镁的物质的量之比是2:1 B、该浓硝酸中HNO3的物质的量浓度是14.0 mol/L C、NO2和N2O4的混合气体中,NO2的体积分数是80% D、得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL14. 将一定量Fe、FeO和Fe2O3的混合物放入2mol/L的HNO3溶液25mL中,反应完全后,无固体剩余,生成224mL NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )A、40mL B、45mL C、50mL D、无法确定15. 取Xg镁和铝的混合物,向其中加入适量的稀盐酸,恰好完全反应生成标准状况下的气体BL向反应后的溶液中加入VmLCmol/L氢氧化钠溶液,使金属离子刚好沉淀完全,得到的沉淀质量为Yg.再将得到的沉淀灼烧至质量不再改变为止,得到固体Pg.则下列关系不正确的是( )A、 X<P< X B、P=X+ C、Y=X+V•C D、C=16. 将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO,N2O4 , NO2)的混合物共0.8mol,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,生成的盐溶液中NaNO3的物质的量为(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O,NO+NO2+2NaOH=2NaNO2+H2O.)( )A、0.2 mol B、0.4 mol C、0.6 mol D、0.8 mol
A、Ka(HA)=10-6 B、b点时,c(B+)+c(HA)=0.05mol/L C、c点时 随温度升高而增大 D、a→c过程中水的电离程度始终增大8. 在铁的氧化物和氧化铝组成的混合物中,加入 2 mol/L 硫酸溶液 65 mL,恰好完全反应,所得溶液中Fe2+能被标准状况下 112 mL 氯气氧化。则原混合物中金属元素和氧元素的原子个数之比为( )A、9∶13 B、5∶7 C、4∶3 D、3∶49. 将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为amol•L﹣1的HCl溶液,过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L.将溶液蒸干并充分灼烧得到固体W2g.下列关系式中错误的是( )A、24n(Al)+35.5n(Na)=W2﹣W1 B、n(Na)+3n(Al)=aV2 C、n(Na)+3n(Al)= D、aV2=10. 把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )A、 B、(2b﹣a)mol/L C、 D、(10b﹣5a)mol/L11. 将充有m mL NO和n mL NO2的量筒倒立于水槽中,然后通入m mL O2 , 若m<n,则充分反应后,量筒内气体的体积为( )A、3(m﹣n)mL B、 mL C、 mL D、 mL12. 向mg镁和铝的混合物重加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL.向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng.再将得到的沉淀灼烧至质量不再改变为止,得到固体pg.则下列关系不正确的是( )A、c= B、p=m+ C、n=m+17Vc D、 m<p< m13. 1.52g 铜镁合金完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )A、该合金中铜与镁的物质的量之比是2:1 B、该浓硝酸中HNO3的物质的量浓度是14.0 mol/L C、NO2和N2O4的混合气体中,NO2的体积分数是80% D、得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL14. 将一定量Fe、FeO和Fe2O3的混合物放入2mol/L的HNO3溶液25mL中,反应完全后,无固体剩余,生成224mL NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )A、40mL B、45mL C、50mL D、无法确定15. 取Xg镁和铝的混合物,向其中加入适量的稀盐酸,恰好完全反应生成标准状况下的气体BL向反应后的溶液中加入VmLCmol/L氢氧化钠溶液,使金属离子刚好沉淀完全,得到的沉淀质量为Yg.再将得到的沉淀灼烧至质量不再改变为止,得到固体Pg.则下列关系不正确的是( )A、 X<P< X B、P=X+ C、Y=X+V•C D、C=16. 将51.2g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO,N2O4 , NO2)的混合物共0.8mol,这些气体恰好能被500mL 2mol/L NaOH溶液完全吸收,生成的盐溶液中NaNO3的物质的量为(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O,NO+NO2+2NaOH=2NaNO2+H2O.)( )A、0.2 mol B、0.4 mol C、0.6 mol D、0.8 mol二、多选题
-
17. 有两份组成及质量都相等的Na2O2和Na2CO3的混合物,向第一份中加入足量的稀硫酸,放出的气体共4.48L.将此气体通入第二份混合物,充分反应后,气体体积变为4.032L(均为标准状况下体积).则原混合物中Na2O2和Na2CO3的物质的量之比为( )A、2:9 B、3:2 C、2:1 D、8:118. 现有氢气与氯气的混合气体0.1mol,经充分反应后,通入60mL 2mol/L的NaOH溶液中,所得溶液中只含有2种溶质,其中NaCl为0.1mol.则原混合气体中氢气的物质的量可能是( )A、0.03mol B、0.04mol C、0.05mol D、0.06mol
三、非选择题
-
19. 六氯化钨(WCl6)可用作有机合成催化剂,熔点为283℃,沸点为340℃,易溶于CS2 , 极易水解。实验室中,先将三氧化钨(WO3)还原为金属钨(W)再制备WCl6 , 装置如图所示(夹持装置略)。回答下列问题:
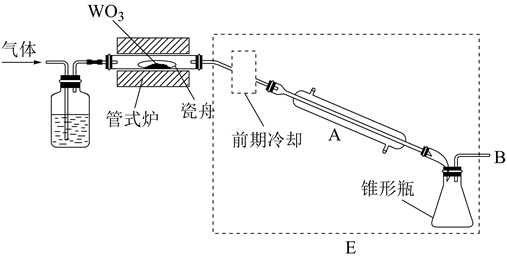 (1)、检查装置气密性并加入WO3。先通N2 , 其目的是;一段时间后,加热管式炉,改通H2 , 对B处逸出的H2进行后续处理。仪器A的名称为 , 证明WO3已被完全还原的现象是。(2)、WO3完全还原后,进行的操作为:①冷却,停止通H2;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通Cl2;⑥……。碱石灰的作用是;操作④是 , 目的是。(3)、利用碘量法测定WCl6产品纯度,实验如下:
(1)、检查装置气密性并加入WO3。先通N2 , 其目的是;一段时间后,加热管式炉,改通H2 , 对B处逸出的H2进行后续处理。仪器A的名称为 , 证明WO3已被完全还原的现象是。(2)、WO3完全还原后,进行的操作为:①冷却,停止通H2;②以干燥的接收装置替换E;③在B处加装盛有碱石灰的干燥管;④……;⑤加热,通Cl2;⑥……。碱石灰的作用是;操作④是 , 目的是。(3)、利用碘量法测定WCl6产品纯度,实验如下:①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1g;开盖并计时1分钟,盖紧称重为m2g;再开盖加入待测样品并计时1分钟,盖紧称重为m3g,则样品质量为g(不考虑空气中水蒸气的干扰)。
②滴定:先将WCl6转化为可溶的Na2WO4 , 通过IO 离子交换柱发生反应:WO +Ba(IO3)2=BaWO4+2IO ;交换结束后,向所得含IO 的溶液中加入适量酸化的KI溶液,发生反应:IO +5I-+6H+=3I2+3H2O;反应完全后,用Na2S2O3标准溶液滴定,发生反应:I2+2S2O =2I-+S4O 。滴定达终点时消耗cmol•L-1的Na2S2O3溶液VmL,则样品中WCl6(摩尔质量为Mg•mol-1)的质量分数为。称量时,若加入待测样品后,开盖时间超过1分钟,则滴定时消耗Na2S2O3溶液的体积将(填“偏大”“偏小”或“不变”),样品中WCl6质量分数的测定值将(填“偏大”“偏小”或“不变”)。
20. 苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下: +KMnO4→
+KMnO4→ 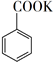 + MnO2
+ MnO2  +HCl→
+HCl→  +KCl
+KCl名称
相对分
子质量
熔点/℃
沸点/℃
密度/(g·mL−1)
溶解性
甲苯
92
−95
110.6
0.867
不溶于水,易溶于乙醇
苯甲酸
122
122.4(100℃左右开始升华)
248
——
微溶于冷水,易溶于乙醇、热水
实验步骤:①在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
②停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
③纯度测定:称取0. 122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25. 00 mL溶液,用0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗21. 50 mL的KOH标准溶液。
回答下列问题:
(1)、根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。A、100 mL B、250 mL C、500 mL D、1000 mL(2)、在反应装置中应选用冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是。(3)、加入适量饱和亚硫酸氢钠溶液的目的是;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理。(4)、“用少量热水洗涤滤渣”一步中滤渣的主要成分是。(5)、干燥苯甲酸晶体时,若温度过高,可能出现的结果是。(6)、本实验制备的苯甲酸的纯度为;据此估算本实验中苯甲酸的产率最接近于(填标号)。A.70% B.60% C.50% D.40%
(7)、若要得到纯度更高的苯甲酸,可通过在水中的方法提纯。21. NiS难溶于水,易溶于稀酸,可用于除去镍电解液中的铜离子,NiS在潮湿的空气中可转化为碱式硫化高镍[Ni(OH)S],从而降低除铜离子能力。实验室模拟制取NiS装置如图(加热、夹持装置略去),先通氮气排尽装置内空气后,同时通入硫化氢气体和氨气,制得NiS沉淀。回答下列问题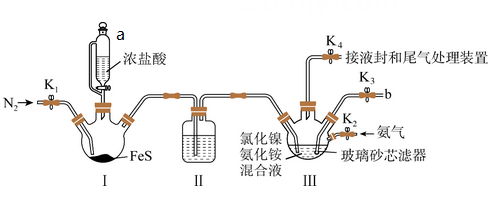 (1)、装置图中,仪器a的名称是 , 装置 Ⅱ中的试剂为。(2)、装置Ⅲ中反应的离子方程式为。(3)、反应结束后关闭K1、K4 , 在b、c处分别连接下图两个装置,打开K2、K3进行抽滤洗涤。装置Ⅳ接在(填“b”或“c”) 处。
(1)、装置图中,仪器a的名称是 , 装置 Ⅱ中的试剂为。(2)、装置Ⅲ中反应的离子方程式为。(3)、反应结束后关闭K1、K4 , 在b、c处分别连接下图两个装置,打开K2、K3进行抽滤洗涤。装置Ⅳ接在(填“b”或“c”) 处。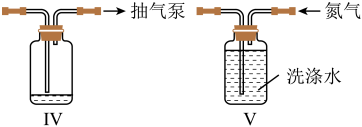 (4)、用NiS除去镍电解液中铜离子时,NiS陈化时间对除铜离子效果的影响如图所示(陈化时间:沉淀完全后,让生成的沉淀与母液一起放置的时间)。图中曲线变化原因是 (以化学方程式表示)。
(4)、用NiS除去镍电解液中铜离子时,NiS陈化时间对除铜离子效果的影响如图所示(陈化时间:沉淀完全后,让生成的沉淀与母液一起放置的时间)。图中曲线变化原因是 (以化学方程式表示)。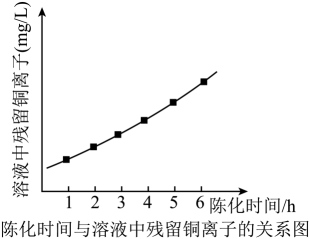 (5)、测定某NiS样品的纯度
(5)、测定某NiS样品的纯度称取试样(杂质中不含Ni) mg置于锥形瓶中,用稀酸溶解后加入掩蔽剂掩蔽其他离子,加pH≈10的氨性缓冲溶液5mL紫脲酸铵指示剂少许。用0.0200mol/L EDTA (Na2H2Y)标准溶液滴定,发生反应: Ni2++H2Y2- NiY2-+ 2H+。滴定达终点时消耗EDTA标准溶液VmL。
①样品的纯度为。
②滴定过程中,若氨性缓冲溶液pH值过低,导致测得的产品纯度 (填“偏低”、 “偏高”或“不影响”)。
22. 硫酸亚铁晶体(FeSO4•7H2O)可用于生产聚合硫酸铁。以钕铁硼二次废渣(主要含Fe2O3、Fe3O4等)为原料制备硫酸亚铁晶体的实验流程如图: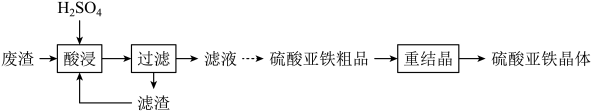 (1)、“酸浸”时,Fe3O4发生反应的离子方程式为。(2)、将“滤渣”返回“酸浸”工序,其目的是。(3)、与普通过滤相比,使用图1装置进行过滤的优点是。
(1)、“酸浸”时,Fe3O4发生反应的离子方程式为。(2)、将“滤渣”返回“酸浸”工序,其目的是。(3)、与普通过滤相比,使用图1装置进行过滤的优点是。 (4)、固定其他条件不变,反应温度、反应时间、铁粉过量系数[]分别对“滤液”中Fe3+还原率的影响如图2、图3、图4所示。
(4)、固定其他条件不变,反应温度、反应时间、铁粉过量系数[]分别对“滤液”中Fe3+还原率的影响如图2、图3、图4所示。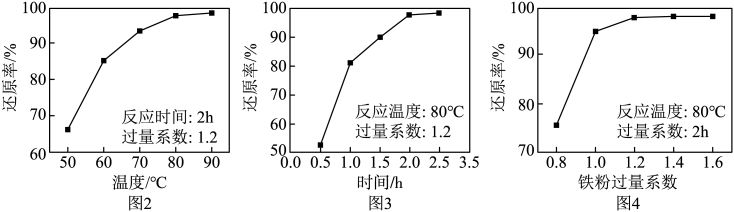
设计由100mL“滤液”[其中c(Fe3+)=0.8mol•L-1]制备硫酸亚铁粗品的实验方案:。(须使用的试剂和仪器:铁粉、冰水、真空蒸发仪)
(5)、通过下列实验测定硫酸亚铁晶体样品的纯度。准确称取1.2000g样品置于锥形瓶中,用50mL蒸馏水完全溶解,加一定量硫酸和磷酸溶液;用0.02000mol•L-1KMnO4标准溶液滴定至终点(MnO转化为Mn2+),平行滴定3次,平均消耗KMnO4标准溶液42.90mL。计算硫酸亚铁晶体样品中FeSO4•7H2O的质量分数。(写出计算过程)23. 铼(Re)是具有重要战略意义的金属。NH4ReO4是制备高纯度Re的重要中间体。Ⅰ.NH4ReO4的纯度测定
称取w g NH4ReO4样品,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1mol·L-1的盐酸标准溶液吸收,蒸氨结束后取下接收瓶。取吸收液用c2mol·L-1NaOH标准溶液滴定过剩的HCl, 达到终点时消耗V2mLNaOH溶液。
 (1)、仪器a是(填名称)。(2)、冰盐水的作用是。(3)、实验所用的NaOH标准溶液,通常采用间接法配制,即配成近似浓度的溶液,再用基准物标定。不能采用直接法配制的原因是。(4)、根据下表,滴定操作时宜选用(填一种指示剂名称);滴定终点的现象是。
(1)、仪器a是(填名称)。(2)、冰盐水的作用是。(3)、实验所用的NaOH标准溶液,通常采用间接法配制,即配成近似浓度的溶液,再用基准物标定。不能采用直接法配制的原因是。(4)、根据下表,滴定操作时宜选用(填一种指示剂名称);滴定终点的现象是。部分指示剂变色的pH范围如下表:
指示剂名称
变色的pH范围
酸色.
中性色
碱色
甲基橙
3.1--4.4
红
橙
黄
甲基红
4.4一6. 2
红
橙
黄
溴百里酚蓝
6.0-7.6
黄
绿
蓝
酚酞
8.2-10.0
无
浅红
红
(5)、样品中NH4ReO4的质量分数为(填表达式)。(6)、Ⅱ.高纯度铼的制取高温下用H2还原NH4ReO4可制得金属铼,装置如下图所示:
[已知:NH4ReO4 受热分解生成Re2O7]
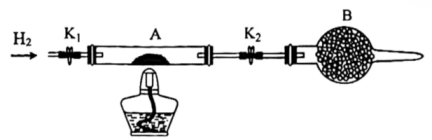
② 装置B中盛放的试剂为(填名称)。
②判断A中NH4ReO4已经反应完全的方法是。
③玻璃管内发生反应的化学方程式为。
24. 青蒿素是高效的抗疟药,为无色针状晶体,易溶于有机溶剂,难溶于水,熔点为 , 温度超过完全失去药效(已知:乙醚沸点为)。从青蒿中提取青蒿素的一种工艺如下:
索氏提取装置如图所示.实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至装置a,冷凝后滴入滤纸套筒1中,与青蒿粉末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对青蒿粉末的连续萃取。回答下列问题:
 (1)、装置a的名称为。(2)、索氏提取的青蒿素位于(填“圆底烧瓶”或“索氏提取器”)中;与常规的萃取相比,索氏提取的优点是。(3)、提取液蒸馏过程中选用下列哪种装置更好(填字母),原因是。
(1)、装置a的名称为。(2)、索氏提取的青蒿素位于(填“圆底烧瓶”或“索氏提取器”)中;与常规的萃取相比,索氏提取的优点是。(3)、提取液蒸馏过程中选用下列哪种装置更好(填字母),原因是。 (4)、粗品提纯的过程可能是(填字母)。
(4)、粗品提纯的过程可能是(填字母)。a.加水溶解、蒸发浓缩、冷却结晶
b.加70%的乙醇溶解、水浴加热、冷却结晶、过滤
c.加入乙醚进行萃取分液
(5)、青蒿素(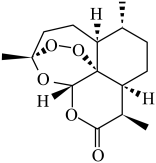 )中含有过氧键,与碘化钠反应生成碘单质。为测定产品中青蒿素的纯度,取样品配制成溶液,取加入锥形瓶中,再加入足量的溶液和几滴淀粉溶液,用标准液滴定。(已知: , M(青蒿素))
)中含有过氧键,与碘化钠反应生成碘单质。为测定产品中青蒿素的纯度,取样品配制成溶液,取加入锥形瓶中,再加入足量的溶液和几滴淀粉溶液,用标准液滴定。(已知: , M(青蒿素))①滴定终点的现象为;
②三次滴定数据记录如下:
滴定次数
待测液体()
标准液读数()
滴定前读数
滴定后读数
第一次
25.00
1.50
41.52
第二次
25.00
3.00
42.98
第三次
25.00
4.50
41.60
青蒿素的纯度为。
25. 气体中微量的H2S,对工业生产和环境都有危害。通过以下实验装置利用20%脱硫剂三嗪( )水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
)水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
回答下列问题:
(1)、仪器1的名称是。装置甲制取CO2 , 实验室制取CO2的离子方程式为。(2)、仪器2盛装0.001 mol·L-1H2S水溶液,三颈烧瓶丙中盛装溶液是。(3)、操作步骤:①打开开关A、C,放入酸溶液产生CO2 , 目的是;
②一段时间后,关小开关C的出气量,打开压缩机开关,同时打开活塞放入H2S水溶液;逐渐减缓仪器1中酸溶液滴入速率并控制气压。使用CO2压缩机的作用是。
(4)、通入二氧化碳所形成的混合气体中,经测量含H2S的量为1000 ×10-6mg·m-3 , 则该混合气体中c(H2S)计算式为mol·L-1。(5)、三嗪( )水溶液吸收H2S,生成
)水溶液吸收H2S,生成 和
和 化学方程式为。CuSO4溶液没有出现 (填现象), 证明三嗪吸收H2S的化学反应具有、等特征,20%三嗪水溶液是很好的脱硫剂。 26. 镁条投入盐酸时,快速溶解并产生大量气泡;投入热水时,其表面会附着微量气泡。受此启发,某兴趣小组对Mg与NaHCO3溶液的反应进行了如下探究:
化学方程式为。CuSO4溶液没有出现 (填现象), 证明三嗪吸收H2S的化学反应具有、等特征,20%三嗪水溶液是很好的脱硫剂。 26. 镁条投入盐酸时,快速溶解并产生大量气泡;投入热水时,其表面会附着微量气泡。受此启发,某兴趣小组对Mg与NaHCO3溶液的反应进行了如下探究:实验序号
实验操作
实验现象
1
向7.5 mL1mol·L-1NaHCO3溶液中加入长3cm的镁条
持续快速产生大量气泡,溶液略显浑浊
(1)、I.探究反应产生的气体成分。经检验反应产生的气体有H2 , 实验室检验H2的方法为。
(2)、小组成员认为反应产生的气体中可能有CO2 , 并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):实验序号
实验操作
2
分别称取两份6.0 mL 1 mol·L-1NaHCO3溶液于两个相同塑料瓶中(其中一个加入0.1g镁条),塞紧CO2气体传感器,采集数据,各重复实验1次,得到图1所示曲线
3
分别称取两份30.0 mL 1 mol·L-1NaHCO3溶液于两个相同烧杯中(其中一个加入1.1g镁条),插入pH传感器,搅拌并采集数据,得到图2所示曲线
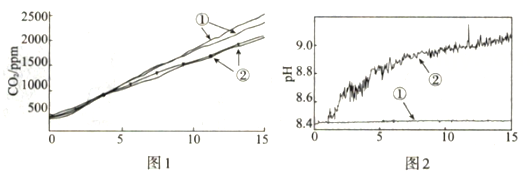
图1中曲线②对应的CO2含量逐渐增大的原因为 (用化学方程式表示);结合实验3解释,随着时间推移,图1中曲线②的数值低于曲线①的原因为。
(3)、II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。小组成员推测可能是溶液中的Na+或HCO加快了该反应的发生,对比实验1设计实验如下:
结合实验1和4,可知溶液中的HCO加快了反应的发生。实验序号
实验操作
实验现象
4
向 溶液中加入长3 cm的镁条
持续快速产生大量气泡,溶液略显浑浊
①实验4中横线处内容为。
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO能加快该反应的原因为。
(4)、III.探究固体浑浊物的组成。文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
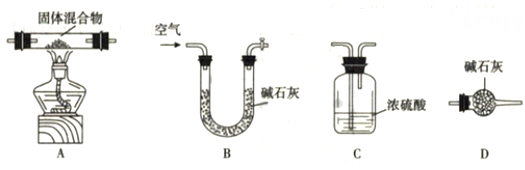
甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为(填字母编号)。
 (5)、乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=。27. 过-硫酸氢钾复合盐(K2SO4·KHSO4·2KHSO5 , M=614 g·mol-1)是白色粉末状固体,具有强氧化性,易溶于水,当溶液pH大于3.0时分解。实验室制取该物质的实验步骤如下:
(5)、乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=。27. 过-硫酸氢钾复合盐(K2SO4·KHSO4·2KHSO5 , M=614 g·mol-1)是白色粉末状固体,具有强氧化性,易溶于水,当溶液pH大于3.0时分解。实验室制取该物质的实验步骤如下:①制取过-硫酸(H2SO5) :先在三颈烧瓶中加入吸附型双氧水稳定剂,然后加入冷的双氧水和过量的浓硫酸,pH控制在2. 0~2.5,反应30 min(反应装置如图所示);
②过-硫酸氢钾复合盐的制备:向①中反应后的溶液中加入碳酸钾溶液,边加边搅拌,碳酸钾溶液滴加完毕后,反应30min,将反应后的混合液转移至烧杯中,在-10℃条件下冷却结晶后,将混合液转移到抽滤瓶中抽滤,得到滤饼,将滤饼置于电热鼓风干燥箱中烘干,得到产品过-硫酸氢钾复合盐。

回答下列问题:
(1)、装置a的名称是 , 用冷的双氧水的原因是。向三颈烧瓶中加入双氧水和浓硫酸的操作:。(2)、写出加入碳酸钾溶液时发生反应生成复合盐和KHSO4的化学方程式:。(3)、步骤②中加入碳酸钾溶液时,应控制加入速度,边加边搅拌的目的是。(4)、一种简单鉴别市售过-硫酸氢钾复合盐是否合格的方法:把一片过-硫酸氢钾片剂放入装有适量稀盐酸的烧杯中,若很快就可以明显闻到有刺激性气味且持续一定时间,可以证明产品的氧化性很好,从而证明这是合格的过-硫酸氢钾复合盐产品。这种方法的原理是(用离子方程式表示)。(5)、间接碘量法测定产品活性氧(一个活性氧可得到2e-)含量。检测原理:2KHSO5 =K2SO4+H2SO4+O2↑
4I-+4H+ +O2=2I2+2H2O
I2+2S2O=S4O+2I-
量取75 mL蒸馏水于碘量瓶中,加入适量的稀硫酸和过量的碘化钾溶液,称取a g产品于碘量瓶中摇匀。暗处放置5 min后,用c mol·L-1的标准硫代硫酸钠溶液滴定,终点时消耗的体积为V mL,则样品中活性氧的质量分数是。
28. “消洗灵”(Na10P3O13 Cl·5H2O)是一种高效低毒的消毒洗涤剂,其消毒原理与“84消毒液”相似,实验室中制备的反应方程式为: , 反应装置如图所示(夹持装置略)。
已知:Cl2与NaOH溶液在加热的条件下反应生成NaClO3和NaCl;
回答下列问题:
(1)、仪器a的名称是 , 实验中用仪器a加浓盐酸的优点是;装置A中反应的离子方程式为。(2)、装置B中盛装的试剂为;装置C中采用多孔球泡的目的是。(3)、打开仪器a的活塞及活塞K,制备NaClO碱性溶液;关闭仪器a的活塞及活塞K,打开装置C中分液漏斗活塞;一段时间后,装置C中溶液经“系列操作”,得到粗产品。①装置C如果采用热水浴会使“消洗灵”(Na10 P3O13 Cl·5H2O)的产率(填“升高”或“降低”)。
②“系列操作”包括、、过滤、洗涤、低温干燥。
(4)、利用滴定法测定产品的纯度(Na10 P3O13 Cl·5H2O) 的摩尔质量为656.5g·mol−1 , 实验方案如下:Ⅰ.取1.500g产品试样溶于蒸馏水中配成100mL溶液;
Ⅱ.量取25.00mL待测液于锥形瓶中,加入 10mL2mol·L−1硫酸溶液、25mL0.1mol·L−1KI溶液(过量),暗处静置5min;
Ⅲ.滴加2~3滴淀粉溶液,用 0.05mol·L−1Na2S2O3标准溶液滴定,发生反应:。平行滴定三次,平均消耗20.00mL标准溶液,则产品的纯度为(保留三位有效数字)。Na2S2O3标准液应放在(填“碱”或“酸”)式滴定管中。
29. 以MnO2粉(含少量Fe3O4、CaO、MgO等杂质)和MnS(溶于酸,不溶于水)为原料制备MnSO4·H2O的过程如下:(1)、反应:将一定量MnO2粉和稀硫酸加入到如图所示实验装置的三颈烧瓶中,加热到90℃后开始加入MnS,并不断搅拌,充分反应。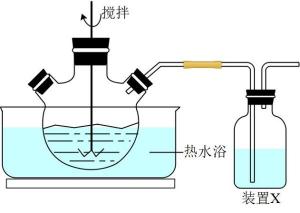
①三颈烧瓶中MnO2与MnS反应转化为Mn2+和S的离子方程式为。
②装置X中是NaOH溶液,作用是。
(2)、除杂。查阅资料可知:Ⅰ.常温下Ka(HF)=7.4×10-4。
Ⅱ.常温下Ksp(CaF2)=2.7×10−11 , Ksp(MgF2)=6.5×10−9。
Ⅲ.有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物
Fe(OH)2
Fe(OH)3
Mn(OH)2
开始沉淀pH
7.6
1.5
8.3
沉淀完全pH
9.7
3.2
9.8
①将三颈烧瓶中的混合物过滤,加入MnF2将滤液中的Ca2+、Mg2+转化为沉淀除去。在Ca2+、Mg2+浓度相同的条件下,pH变化对钙镁去除率的影响如图所示。

Mg2+去除率曲线为(填写“甲”或“乙”)。随pH减小,钙镁去除率下降的原因是。
②以除去Ca2+、Mg2+所得的滤液为原料,制备MnSO4·H2O的实验方案: , 控制温度在80~90℃之间蒸发结晶至有大量晶体出现,趁热过滤,用80~90℃的蒸馏水洗涤2~3次,干燥。(可选用的试剂:H2O2溶液、MnCO3固体、Na2CO3固体、蒸馏水等)。
(3)、测定。准确称取0.3850 g MnSO4·H2O样品置于锥形瓶中,加入H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+ , 用0.1000 mol·L-1硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗标准溶液20.00 mL。计算MnSO4·H2O样品的纯度(请写出计算过程)。30. 某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2 2CuO+TeO2。
(1)、煅烧时,Cr2O3发生反应的化学方程式为。(2)、为提高酸浸速率,可采用的措施是 (任写一条)。(3)、浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有 (写化学式)。(4)、在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。①已知含铬酸性废水中存在着Cr2O和CrO相互转化的平衡,请用离子方程式表示它们之间的转化反应。
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为。(写化学式)。
(5)、测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2O被还原为Cr3+)①氧化还原滴定过程中的离子方程式为。
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中K2Cr2O7的纯度为%。[已知M(K2Cr2O7)=294g·mol-1 , 计算结果保留三位有效数字]
(6)、上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=3×10-5 mol·L-1 , 则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全?(填“是”或“否”)。{已知:Ksp[Fe(OH)3]=4.0×10-38 , Ksp[Cr(OH)3]=6.0×10-31}31. 二氯异氰尿酸钠(C3N3O3Cl2Na)为白色固体,难溶于冷水,是氧化性消毒剂中最为广谱、高效、安全的消毒剂。实验室用如图所示装置(夹持装置已略去)制备二氯异氰尿酸钠。请回答下列问题:
已知:实验原理为。
(1)、仪器X的名称为。(2)、完成上述实验选择合适的装置,按气流从左至右,导管连接顺序为(填字母)。(3)、装置D中发生反应的离子方程式为。(4)、当装置A内出现的现象时,打开装置A中分液漏斗的活塞,加入氰尿酸(C3H3N3O3)溶液,在反应过程中仍不断通入Cl2的目的是。(5)、实验过程中装置A的温度必须保持在7℃~12℃,pH控制在6.5~8.5,则该实验适宜的受热方式是(填“冷水浴”或“热水浴”)。(6)、测定粗产品中二氯异氰尿酸钠的纯度。将m g粗产品溶于无氧蒸馏水中配制成100 mL溶液,取20.00 mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5 min。用的标准溶液进行滴定,加入指示剂,滴定至终点时,消耗标准溶液。(杂质不与反应,涉及的反应为、)
①加入的指示剂是(填名称)。
②C3N3O3Cl2Na的百分含量为(用含m、c、V的代数式表示)%。
③下列操作会导致粗产品中二氯异氰尿酸钠的纯度偏低的是(填标号)。
a.盛装Na2S2O3标准溶液的滴定管未润洗
b.滴定管在滴定前有气泡,滴定后无气泡
c.碘量瓶中加入的稀硫酸偏少
32. 用粗铜精炼工业中产生的铜阳极泥(主要含Cu2Se、Ag2Se、金和铂等)为原料,回收并制备硝酸铜和硒的工艺流程如图: (1)、“烧结”时发生如下反应,请完善该反应方程式:。
(1)、“烧结”时发生如下反应,请完善该反应方程式:。_____
工业上,采用通入高压氧气使铜阳极泥处于“沸腾”状态,其目的是。
(2)、在实验室,操作X的名称为。(3)、滤渣Y的成分有Ag2O、(填化学式,下同);已知萃取与反萃取原理为:2RH+Cu2+→R2Cu+2H+ , 则“反萃取”时反萃取剂最好选用溶液。(4)、FeSO4的作用是“还原”Na2SeO4制备Na2SeO3 , 每摩尔Na2SeO4消耗FeSO4的物质的量为mol;常温下,H2SeO3的Ka1=1.0x10-3 , Ka2=1.0x10-7;当常温下溶液的pH=4.4时,Na2SeO3溶液中最主要的含Se粒子是。(5)、“控电位还原”是指在一定电压下,电位高的氧化剂优先被还原,电位低的氧化剂保留在溶液中,以达到硒与杂质金属的分离;下表为一些氧化剂的电位(A/B:A代表氧化剂,B代表还原产物)。名称
电位/V
0.345
0.770
0.740
则SeO、Fe3+和Cu2+的氧化性由强到弱的顺序为 , 在0.740V时Fe3+优先被还原,其还原反应(半反应)式为。
33. 五氧化二钒()广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂(含有、、、、、等)中回收钒,既能避免对环境的污染,又能节约宝贵的资源,回收工艺流程如下:
已知:
①“酸浸”时和与稀硫酸反应分别生成和。
②溶液中与可相互转化: , 且为沉淀。
(1)、“酸浸”前,需对废钒催化剂进行粉碎预处理,其目的是。(2)、“还原转化”中加入的目的是将转化为 , 写出反应的离子方程式:。(3)、加入的目的是将过量的转化为。“氧化1”后,溶液中含有的金属阳离子主要有、、 , 调节使离子沉淀,若溶液中 , 则调节溶液的最小值为可使沉淀完全(离子浓度≤时沉淀完全),此时(填“有”或“无”)沉淀生成。{假设溶液体积不变, , , }(4)、“氧化2”过程中发生反应的离子方程式为。(5)、“沉钒”时,通入氨气的作用是。(6)、若该废钒催化剂中的含量为10%(原料中所有的钒已换算成)。取100g待处理样品,按照上述流程进行实验。当加入溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的回收率是%(假设与反应后的操作步骤中钒元素无损失)。34. 乙酸酐在有机合成工业中有广泛的应用。实验室利用如下方法制备少量乙酸酐。实验原理(反应1、反应2已配平):反应1:CH3COOH+SOCl2→CH3COCl+X↑+Y↑ ΔH<0
反应2:CH3COCl+CH3COOH→(CH3CO)2O+HCl↑ ΔH<0
已知:有关物质的部分信息如下。
物质
沸点/℃
相对分子质量
理化性质
乙酸(CH3COOH)
118
60
易溶于水和有机溶剂
二氯亚砜(SOCl2)
79
119
遇水水解,受热易分解
乙酰氯(CH3COCl)
51
78.5
遇水或乙醇剧烈分解
乙酸酐[(CH3CO)2O]
139.6
102
遇水形成乙酸,易溶于有机溶剂
实验步骤:
I.将21.0g冰醋酸加入到三颈烧瓶中,再分批缓慢加入21.0gSOCl2 , 控制反应温度35℃,搅拌回流2小时。
II.将三颈烧瓶中的混合物转移至另一烧瓶中,提纯,收集到较纯的乙酸酐12.0g(其中乙酸酐占90.0%)。
实验装置如图所示:
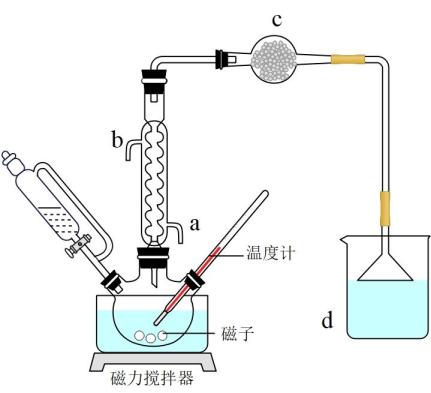
回答下列问题:
(1)、仪器c的名称是 , 冷凝管的进水口是(填字母)。(2)、反应1生成的X和Y均为酸性气体,其化学式为和。(3)、步骤I中,控制反应温度在35℃左右,不宜过高的原因是。(4)、c中盛放无水氯化钙,主要作用是 , d中盛放的试剂是。(5)、步骤II中,从混合物中提纯乙酸酐应采取的操作名称是。(6)、该方法制得乙酸酐的产率是%(保留1位小数)。35. 以废锰酸锂电池为原料,回收、精铜的实验流程如下: (1)、“浸取”在如图所示装置中进行。
(1)、“浸取”在如图所示装置中进行。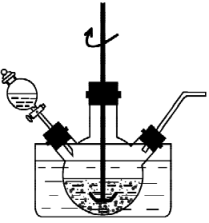
①将一定量“和石墨混合粉末”与溶液、溶液中的一种配成悬浊液,加入到三颈烧瓶中,75℃下通过滴液漏斗缓慢滴加另一种溶液。滴液漏斗中的溶液是。
②转化为的化学方程式为。
③保持温度、反应物和溶剂的量不变,能提高Mn元素浸出率的措施有。
(2)、补充以“铜箔和铝箔”为原料制备精铜的实验方案:;将所得精铜用蒸馏水洗净,干燥。实验中须使用的试剂溶液、不锈钢片、混合溶液,除常用仪器外须使用的仪器:直流电源。
(3)、通过下列方法测定的纯度:准确称取0.4000g样品,加入25.00mL溶液和适量硫酸,加热至完全反应(发生反应为),用标准溶液滴定过量的至终点,消耗标准溶液20.00mL(滴定反应为)。计算样品中的质量分数(写出计算过程)。36. 某兴趣小组用铬铁矿(FeCr2O4 , 含Al、Si氧化物等杂质)为主要原料制备K2Cr2O7晶体,流程如下: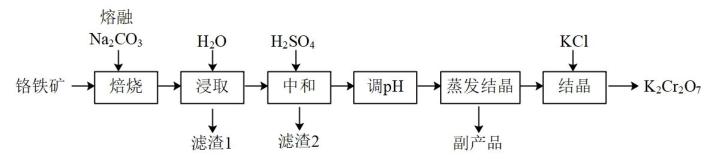 (1)、焙烧的目的是将FeCr2O4转化为Na2CrO4 , 并将Al、Si氧化物转化为可溶性钠盐。焙烧时气体与矿料逆流而行,目的是。该步骤不能使用陶瓷容器,原因是。(2)、滤渣2的主要成分是Al(OH)3和。(3)、流程中调溶液的pH使之变(填“大”或“小”),原因是(用离子方程式表示)。(4)、蒸发结晶所产生的副产品是。(5)、为结晶得到杂质较少的K2Cr2O7粗产品,请结合下图从下列选项中选出合理的操作并排序。
(1)、焙烧的目的是将FeCr2O4转化为Na2CrO4 , 并将Al、Si氧化物转化为可溶性钠盐。焙烧时气体与矿料逆流而行,目的是。该步骤不能使用陶瓷容器,原因是。(2)、滤渣2的主要成分是Al(OH)3和。(3)、流程中调溶液的pH使之变(填“大”或“小”),原因是(用离子方程式表示)。(4)、蒸发结晶所产生的副产品是。(5)、为结晶得到杂质较少的K2Cr2O7粗产品,请结合下图从下列选项中选出合理的操作并排序。
a.50℃蒸发溶剂
b.100℃蒸发溶剂
c.抽滤
d.冷却至室温
e.蒸发至溶液出现晶膜,停止加热
f.蒸发至溶液出现大量晶体,停止加热
(6)、该小组用m1kg铬铁矿(FeCr2O460%)制备K2Cr2O7 , 最终得到产品m2kg,产率为(列出计算式)。