2023-2024 学年 浙教版科学九年级上册 1.6 几种重要的盐 同步练习
试卷更新日期:2023-08-01 类型:同步测试
一、单选题
-
1. 向硫酸铜和稀硫酸的混合溶液中滴加氢氧化钡溶液。生成沉淀质量与滴加的氢氧化钡质量的关系如右图所示。下列说法正确的是( )
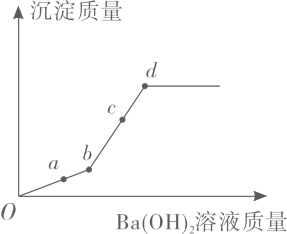 A、若向a点溶液滴加酚酞试剂,溶液变红 B、b点有两种沉淀 C、c点所得溶液中的溶质只有CuSO4 D、d点时烧杯中只有四种物质2. 以太阳能为热源分解Fe,O,经热化学铁氧化合物循环分解水制氢气的过程如图所示,下列叙述正确的是( )
A、若向a点溶液滴加酚酞试剂,溶液变红 B、b点有两种沉淀 C、c点所得溶液中的溶质只有CuSO4 D、d点时烧杯中只有四种物质2. 以太阳能为热源分解Fe,O,经热化学铁氧化合物循环分解水制氢气的过程如图所示,下列叙述正确的是( )
①过程I中能量转化形式是太阳能转化为化学能
②过程II的化学方程式为:3FeO+H2O Fe3O4 + H2↑
③该过程总反应为:2H2OO2↑+2H2↑
④铁氧化合物循环制H2具有节约能源、产物易分离等优点
A、①② B、①②③ C、①②④ D、①②③④3. 小宁分别将不同质量的锌粉加入一定量的Cu(NO3)2和AgNO3混合溶液中,充分反应后过滤,以下是在不同情况下对滤渣或滤液成分的说法,错误的是( )A、若滤液中只含一种溶质,滤渣一定含有Ag、Cu,可能含有Zn B、当滤液含两种溶质时,滤渣一定含有Ag,可能含有Cu,一定不含Zn C、若滤渣中有红色固体,滤液一定含有Zn(NO3)2 , 一定不含Cu(NO3)2 D、若向所得滤液中滴加稀盐酸有白色沉淀生成,滤渣一定只含有Ag4. 人类常利用化学反应得到所需要的物质,如图是X、Y、Z、W四种物质的转化关系(都能通过一步反应实现) ,则X、Y、Z、W依次可能是( ) A、C、CO、CO2、H2CO3 B、H2O2、O2、H2O、H2 C、CaO、Ca(OH)2、CaCl2、CaCO3 D、Cu、CuO、Cu(OH)2、CuSO45. 取稀盐酸与氢氧化钠反应后的溶液进行实验。下列实验能证明两者恰好完全中和的是A、加硝酸银溶液,有白色沉淀生成 B、加氢氧化镁固体,固体全部溶解 C、滴入适量FeCl₃溶液,溶液变黄,但无沉淀生成 D、测得反应后溶液中Na⁺与Cl⁻的个数比为1:16. 合理的实验方案才能达成实验目的,下列有关实验方案设计不合理的是( )
A、C、CO、CO2、H2CO3 B、H2O2、O2、H2O、H2 C、CaO、Ca(OH)2、CaCl2、CaCO3 D、Cu、CuO、Cu(OH)2、CuSO45. 取稀盐酸与氢氧化钠反应后的溶液进行实验。下列实验能证明两者恰好完全中和的是A、加硝酸银溶液,有白色沉淀生成 B、加氢氧化镁固体,固体全部溶解 C、滴入适量FeCl₃溶液,溶液变黄,但无沉淀生成 D、测得反应后溶液中Na⁺与Cl⁻的个数比为1:16. 合理的实验方案才能达成实验目的,下列有关实验方案设计不合理的是( )选项
实验目的
试剂与操作方法
A
分离CaCO3和CaO
加水溶解、过滤
B
鉴别NaOH和NaCl
滴加酚酞试液
C
检验溶液中的Fe3+
滴加NaOH溶液
D
除去KCl中的K2CO3
加过量稀盐酸、蒸发、结晶
A、A B、B C、C D、D7. 有一瓶标签无法辨认的试剂,是碳酸钠溶液或硫酸钠溶液中的一种。仅用下列试剂无法进行鉴别的是( )A、试纸 B、酚酞试液 C、稀硫酸 D、硝酸钡溶液8. 芯片主要以高纯度的单质硅(Si)为原料制成,在半导体硅元件生产中,常用氢氟酸(HF)来清除硅表面的氧化膜,反应原理可表示为SiO2+6HF===H2SiF6+2X,已知硅元素显+4 价。下列说法错误的是( )A、生成物X的化学式是H2O B、H2SiF6中氟元素显-1价 C、该反应是复分解反应 D、地壳中硅元素含量仅次于氧元素9. 右图为氮元素的部分化合价、物质类别二维图。下列说法错误的是( ) A、a点物质在空气中体积分数最高 B、b点物质属于大气污染物 C、c点物质的名称为硝酸 D、d点物质可能是复合肥料10. 用一小块未打磨过的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如图所示。待实验结束后,发现试管底部出现了灰色沉淀。为了初步判断灰色沉淀的成分,往上述试管中继续滴加稀盐酸,观察到沉淀溶解并有气泡生成。下列推理正确的有( )
A、a点物质在空气中体积分数最高 B、b点物质属于大气污染物 C、c点物质的名称为硝酸 D、d点物质可能是复合肥料10. 用一小块未打磨过的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如图所示。待实验结束后,发现试管底部出现了灰色沉淀。为了初步判断灰色沉淀的成分,往上述试管中继续滴加稀盐酸,观察到沉淀溶解并有气泡生成。下列推理正确的有( )
①0~t1阶段,铝的氧化物与稀盐酸反应
②t1~t2阶段,铝和稀盐酸反应生成气体
③t3~t4阶段,稀盐酸过量生成气体量减少
④实验结束后试管底部出现的灰色沉淀是铝
A、①② B、①②④ C、①③④ D、②③④二、实验探究题
-
11. 小宁在课外资料中获悉:在锌和稀硫酸的反应中,加入硫酸铜溶液会影响反应的快慢。为此,他进行了探究。实验装置如图甲所示。

【实验步骤】
①在规格相同的A、B试管中分别放入大小相近、数量相同的锌粒,胶头滴管吸入等量的溶液,如图甲所示。塞紧橡胶塞。
②将两个胶头滴管中的溶液同时挤入试管后,立即开启数据采集器
③约100s后,停止采集数据。电脑显示气压p随时间变化的关系如图乙。
【实验分析】
⑴图甲中“★”处应填。
⑵要确保实验成功,实验前应检查反应装置的。
⑶实验中,锌和稀硫酸反应的快慢通过采集到的试管内值的变化快慢来反映。
【实验结论】
在锌和稀硫酸的反应中,加入硫酸铜溶液可以(填“减慢”或“加快”)反应速度。
12. “鱼浮灵”主要成分是过碳酸钠(xNaCO3·yH2O2),俗称固体双氧水,过碳酸钠具有N2a2CO3和H2O2的双重化学性质。某兴趣小组对其进行以下探究:利用如图装置进行产品中活性氧含量测定和过碳酸钠(xNa2CO3·yH2O2)组成的测定(杂质对测定无影响)。注:活性氧含量是指产品中能转化为O2的氧元素的质量分数。[查阅资料]①"鱼浮灵”中活性氧含量≥13.0%是一等品,≥10.5%是合格品。
②过碳酸钠能与酸反应放出CO2和O2.
 (1)、实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2 , 其目的是。(2)、装置B的作用是。(填序号).
(1)、实验前先缓慢通N2一段时间,加热铜网至红热后,再缓慢滴入过量稀硫酸,直至A中样品完全反应;继续缓慢通N2 , 其目的是。(2)、装置B的作用是。(填序号).①除去气体中的水蒸气 ②便于观察和控制气流速度
(3)、实验测得C装置中铜网质量增加1.2g,D装置质量增加2.2g。该产品中活性氧含量为%;z:y=。三、填空题
-
13. 在配制硝酸钾(KNO3)营养液时,小敏操作过程如图所示,请回答下列问题:

硝酸钾在不同温度时的溶解度
温度/℃
20
30
40
50
溶解度/克
31.6
45.8
63.9
85.5
(1)、硝酸钾能为农作物的生长提供养料,属于(选填”钾”、“氨”或”复合”)肥。(2)、上述溶液中属于饱和溶液的是 (填序号)。(3)、现要配制20%的硝酸钾营养液,需向烧杯③溶液中加水 克。14. 桐屿枇杷果肉细腻,柔软多汁,甜酸适度,深受市场欢迎。为获得优质枇杷果实,须用科学的种植和管理方法。(1)、种植枇杷理想的土壤是通气、透水,同时能保水保肥,水和空气的体积比接近。下列按体积分数构建的土壤组成模型中,符合上述要求的是_______。 A、A B、B C、C(2)、枇杷的果实膨大期应多施钾肥、磷肥,下列复合肥中肥效最佳。(填序号)
A、A B、B C、C(2)、枇杷的果实膨大期应多施钾肥、磷肥,下列复合肥中肥效最佳。(填序号)①硝酸钾[KNO3]②磷酸二氢钾[KH2PO4]③磷酸一铵[NH4H2PO4]
(3)、采摘后减弱果实的呼吸作用可延长贮藏期,请据此写出一种利于贮藏的方法。15. 某白色固体M可能由Na2CO3、Na2SO4、MgCl2、Ba(OH)2中的一种或几种物质组成。为确定其成分,进行如图所示实验。
则:
(1)、白色沉淀E的化学式为。(2)、白色固体M的成分是。16. 某白色固体A,含有K2SO4、NaOH、CaCO3、BaCl2中一种或几种,取少量白色固体A进行如下实验。 (1)、白色固体A中一定有含有的物质是(写名称)。(2)、请写出沉淀完全溶解的化学方程式。17. 如图为实验室中常见的盛放硝酸银溶液的试剂瓶,瓶身为棕色,是因为硝酸银具有的化学性质;滴管滴加了硝酸银溶液后,插回到滴瓶前(填“需要”或“不需要”用水清洗)。
(1)、白色固体A中一定有含有的物质是(写名称)。(2)、请写出沉淀完全溶解的化学方程式。17. 如图为实验室中常见的盛放硝酸银溶液的试剂瓶,瓶身为棕色,是因为硝酸银具有的化学性质;滴管滴加了硝酸银溶液后,插回到滴瓶前(填“需要”或“不需要”用水清洗)。
四、解答题
-
18. 食用碱的主要成分是Na2CO3(含有少量NaCI),研究小组为测定市售食用碱中Na2CO3的含量,设计了如图所示实验装置。

取12克食用破样品放人锥形瓶进行实验。按定量测定实验的正确步骤,进行规范操作,并用电子天平对某一装置进行连续称重,直至该装置质量不再改变时停止实验,此时该装置质量增加了4.4克。(假设每步吸收都完全,ACDE装置中试剂均过量)
回答下列问题:
(1)、装置A的作用是;(2)、根据某装置质量不再改变时,作为停止实验的依据,则该装置应该是;(3)、计算食用碱中Na2CO3的质量分数。(要求根据化学方程式计算)19. 九年级某班利用稀硫酸与氧化铜粉末反应完成“探究酸的化学性质”实验,实验后废液集中在一个废液缸中。为了探究废液的成分,同学们又进行如下实验:取上层废液于烧杯,加入一定溶质质量分数的氢氧化钠溶液。下表为生成沉淀总质量与所加的氢氧化钠-溶液总质量关系。氢氧化钠溶液总质量/g
20
40
60
80
100
120
沉淀总质量/g
0.49
2.94
5.39
m
n
9.8
(1)、表中n= 。(2)、所取的废液中溶质是。(3)、所用氢氧化钠溶液的溶质的质量分数是多少?五、综合说理题
-
20. 小明在实验室里做:“氧化铜与盐酸反应”的实验,观察到溶液逐渐变成绿色,向这绿色溶液中加水,则溶液为蓝色。为解释这种现象,他查阅以下资料:
资料一:氯化铜溶液中的Cu2+会与H2O、Cl-相结合,分别形成呈蓝色物质1和呈黄色物质2。Cu2+与H2O、Cl-相结合的数量会随着氯化铜溶液浓度的改变而发生变化,从而使呈蓝色物质1和黄色物质2的数量发生变化。
资料二:根据光学原理,颜色可调。例如:蓝色+黄色=绿色。
请解释原因: