2023-2024 学年 浙教版科学九年级上册 1.5 酸和碱之间发生的反应 同步练习
试卷更新日期:2023-08-01 类型:同步测试
一、单选题
-
1. 土壤中存在多种离子,如 Ca2+、K+、H+、CO32-、PO43- 等。人们经常使用熟石灰来降低土壤的酸性,熟石灰能降低土壤的酸性,本质上是由于( )A、OH-与H+结合 B、OH-与K+结合 C、Ca2+与CO32-结合 D、Ca2+与PO43-结合2. 如图甲某同学将稀盐酸滴入氢氧化钠溶液中发生反应,图乙是该反应的微观粒子示意图。下列关于酸和碱反应的说法中,合理的是( )
 A、图中酸碱反应结束后,溶液pH=0 B、酸碱反应的实质是H++OH﹣=H2O C、酸和碱的质量需相等才能发生反应 D、酸碱反应的实质是Na++Cl﹣=NaCl3. “松花蛋”(又称“变蛋”)是大家很喜欢的一种食品,因其在制作过程中使用了碱性的物质而带有苦涩味。为减少苦涩味,在吃“松花蛋”时,最好蘸点下列哪种物质( )A、白酒 B、食醋 C、食盐 D、白糖4. 如图表示稀盐酸和氢氧化钠溶液发生反应时,烧杯中溶液的pH随滴入液体体积的变化曲线及相关的实验操作。下列说法正确的是( )
A、图中酸碱反应结束后,溶液pH=0 B、酸碱反应的实质是H++OH﹣=H2O C、酸和碱的质量需相等才能发生反应 D、酸碱反应的实质是Na++Cl﹣=NaCl3. “松花蛋”(又称“变蛋”)是大家很喜欢的一种食品,因其在制作过程中使用了碱性的物质而带有苦涩味。为减少苦涩味,在吃“松花蛋”时,最好蘸点下列哪种物质( )A、白酒 B、食醋 C、食盐 D、白糖4. 如图表示稀盐酸和氢氧化钠溶液发生反应时,烧杯中溶液的pH随滴入液体体积的变化曲线及相关的实验操作。下列说法正确的是( ) A、当滴入液体体积为7mL时,盐酸和氢氧化钠恰好完全反应 B、当滴入液体体积为5mL时,所得溶液呈酸性 C、当滴入液体体积为9mL时,所得溶液中的溶质只有NaCl D、该实验是将氢氧化钠溶液滴入盛有稀盐酸的烧杯中5. 某校兴趣小组在利用稀硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化,其图像如图所示,下列说法正确的是( )
A、当滴入液体体积为7mL时,盐酸和氢氧化钠恰好完全反应 B、当滴入液体体积为5mL时,所得溶液呈酸性 C、当滴入液体体积为9mL时,所得溶液中的溶质只有NaCl D、该实验是将氢氧化钠溶液滴入盛有稀盐酸的烧杯中5. 某校兴趣小组在利用稀硫酸和氢氧化钠溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化,其图像如图所示,下列说法正确的是( ) A、图中c点所示溶液能使酚酞试液变红 B、图中b点所示溶液中,含有的微粒是Na+、SO42﹣ C、该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中 D、由a点到c点的pH变化过程证明酸和碱发生了化学反应6. 稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,下列操作及实验现象(或结果),不能证明反应发生的是( )
A、图中c点所示溶液能使酚酞试液变红 B、图中b点所示溶液中,含有的微粒是Na+、SO42﹣ C、该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中 D、由a点到c点的pH变化过程证明酸和碱发生了化学反应6. 稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,下列操作及实验现象(或结果),不能证明反应发生的是( ) A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH=77. 等质量的氢氧化钠溶液和稀盐酸混合后,若所得溶液pH=7,则( )A、所用氢氧化钠溶液和稀盐酸的溶质质量分数相同 B、混合前后水分子总数不变 C、混合前后阳离子总数不变 D、混合溶液中钠离子和氯离子个数相等8. 从微观视角看物质的变化是化学特有的思维方式。如右图描述了NaOH溶液与盐酸反应的微观实质,C处应填入的物质化学式是( )
A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH=77. 等质量的氢氧化钠溶液和稀盐酸混合后,若所得溶液pH=7,则( )A、所用氢氧化钠溶液和稀盐酸的溶质质量分数相同 B、混合前后水分子总数不变 C、混合前后阳离子总数不变 D、混合溶液中钠离子和氯离子个数相等8. 从微观视角看物质的变化是化学特有的思维方式。如右图描述了NaOH溶液与盐酸反应的微观实质,C处应填入的物质化学式是( ) A、NaCl B、NaOH C、HCl D、H2O9. 某研究性学习小组为了探究氢氧化钠溶液与稀硫酸是否恰好完全反应,分别取少量反应后的溶液于试管中,用下表中的不同试剂进行实验。下列选项错误的是( )
A、NaCl B、NaOH C、HCl D、H2O9. 某研究性学习小组为了探究氢氧化钠溶液与稀硫酸是否恰好完全反应,分别取少量反应后的溶液于试管中,用下表中的不同试剂进行实验。下列选项错误的是( )选项
所用试剂
现象和结论
A
硫酸铜溶液
出现蓝色沉淀,则氢氧化钠过量
B
石蕊溶液
呈紫色,则恰好完全反应
C
锌粒
有气泡产生,则硫酸过量
D
氯化钡溶液
出现白色沉淀,则硫酸过量
A、A B、B C、C D、D10. 氢氧化钠滴入硫酸来进行酸与碱的反应,反应后的溶液中酸是否有剩余?为了验证这个问题,下列对反应后的溶液进行的操作不可行的是( )A、用pH试纸测量溶液的pH B、加入铁看是否冒气泡 C、滴入氯化钡看是否产生白色沉淀 D、加入氢氧化铜看溶液是否变蓝11. 稀NaOH溶液与稀盐酸反应过程中温度和pH的变化如图所示,下列说法正确的是( ) A、该实验是将稀Na0H溶液滴入稀盐酸 B、稀NaOH溶液与稀盐酸反应为吸热反应 C、40s时,溶液中溶质为HCl、NaOH和NaCl D、在20s到40s之间某一时刻,两溶液恰好完全反应12. 胃酸可以帮助食物的消化,但是胃酸过多,就会伤及胃、十二指肠黏膜,造成胃溃疡或十二指肠溃疡等疾病。药物治疗可以口服抑酸剂,饮食治疗可以适当食用的食物是( )A、苹果pH=3.4
A、该实验是将稀Na0H溶液滴入稀盐酸 B、稀NaOH溶液与稀盐酸反应为吸热反应 C、40s时,溶液中溶质为HCl、NaOH和NaCl D、在20s到40s之间某一时刻,两溶液恰好完全反应12. 胃酸可以帮助食物的消化,但是胃酸过多,就会伤及胃、十二指肠黏膜,造成胃溃疡或十二指肠溃疡等疾病。药物治疗可以口服抑酸剂,饮食治疗可以适当食用的食物是( )A、苹果pH=3.4 B、萝卜pH=4.6
B、萝卜pH=4.6  C、土豆pH=5.4
C、土豆pH=5.4  D、板栗pH=8.8
D、板栗pH=8.8  13. 小陈用稀盐酸和氢氧化钠溶液进行“酸碱中和”实验,并用酚酞作为指示剂,实验测得溶液的pH变化如图所示,由此作出的判断正确的是( )
13. 小陈用稀盐酸和氢氧化钠溶液进行“酸碱中和”实验,并用酚酞作为指示剂,实验测得溶液的pH变化如图所示,由此作出的判断正确的是( )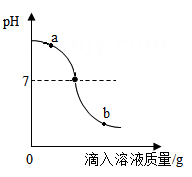 A、是将氢氧化钠溶液滴入稀盐酸中 B、点a所示溶液中含两种阴离子 C、实验过程中溶液共呈现三种颜色 D、若将点b所示溶液与碳酸钠混合不会产生气泡14. 取稀盐酸与氢氧化钠反应后的溶液进行实验。下列能说明稀盐酸、氢氧化钠恰好都完全反应的是( )A、加硝酸银溶液,有白色沉淀生成 B、加氢氧化镁固体,固体全部溶解 C、加酚酞试液,溶液显红色 D、测定溶液的pH,刚好显中性15. 稀HCl和NaOH溶液混合后发生反应但无明显现象,下列操作及实验现象(或结果),不能证明反应发生的是( )
A、是将氢氧化钠溶液滴入稀盐酸中 B、点a所示溶液中含两种阴离子 C、实验过程中溶液共呈现三种颜色 D、若将点b所示溶液与碳酸钠混合不会产生气泡14. 取稀盐酸与氢氧化钠反应后的溶液进行实验。下列能说明稀盐酸、氢氧化钠恰好都完全反应的是( )A、加硝酸银溶液,有白色沉淀生成 B、加氢氧化镁固体,固体全部溶解 C、加酚酞试液,溶液显红色 D、测定溶液的pH,刚好显中性15. 稀HCl和NaOH溶液混合后发生反应但无明显现象,下列操作及实验现象(或结果),不能证明反应发生的是( ) A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH等于7
A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH等于7二、填空题
-
16. 某科学兴趣小组同学对氢氧化钾溶液与稀硫酸发生中和反应进行探究,设计了如下实验:同学们把两种无色溶液分别贴上P、Q标签,向烧杯中倒入一定量的P溶液并测定其pH,再向溶液中逐滴加入Q溶液,并不断振荡,同时测定混合液的pH、温度与Q溶液质量的变化曲线:
 (1)、写出该反应的化学方程式:。(2)、由图甲分析可知:写出c点时杯内溶液中的离子有(填离子符号)。(3)、分析图乙中BC段温度变化的原因是。17. 在化学实验中,有时药品的滴加顺序不同会导致实验现象不同。某同学使用图甲所示实验装置进行实验,集气瓶内气球的体积变化与滴加药品体积的关系如图乙所示,其中A点表示开始滴加某种药品,B点表示开始滴加另一种药品 (不考虑由于滴入液体的体积及反应导致的温度变化对集气瓶内气压的影响)。据图回答:
(1)、写出该反应的化学方程式:。(2)、由图甲分析可知:写出c点时杯内溶液中的离子有(填离子符号)。(3)、分析图乙中BC段温度变化的原因是。17. 在化学实验中,有时药品的滴加顺序不同会导致实验现象不同。某同学使用图甲所示实验装置进行实验,集气瓶内气球的体积变化与滴加药品体积的关系如图乙所示,其中A点表示开始滴加某种药品,B点表示开始滴加另一种药品 (不考虑由于滴入液体的体积及反应导致的温度变化对集气瓶内气压的影响)。据图回答: (1)、实验中首先加入的试剂是。(2)、BC段气球体积不变的原因(请用化学方程式表示)。(3)、CD段气球体积增大的原因是。18. 某研究性学习小组的同学对酸和碱之间的反应进行了如下探究: 实验 1:证明酸和碱发生了反应。
(1)、实验中首先加入的试剂是。(2)、BC段气球体积不变的原因(请用化学方程式表示)。(3)、CD段气球体积增大的原因是。18. 某研究性学习小组的同学对酸和碱之间的反应进行了如下探究: 实验 1:证明酸和碱发生了反应。 (1)、 在图甲中,判断氢氧化钠溶液和稀盐酸恰好完全反应的实验现象是。(2)、实验 2:测量酸和碱反应过程中温度的变化情况。
(1)、 在图甲中,判断氢氧化钠溶液和稀盐酸恰好完全反应的实验现象是。(2)、实验 2:测量酸和碱反应过程中温度的变化情况。往一定量的稀盐酸中逐滴滴加氢氧化钠溶液,烧杯中溶液温度变化如图乙所示。请判断A点时溶液的酸碱性为性。
(3)、若改为将等量稀盐酸往氢氧化钠固体中滴加,反应过程中最高温度远高于图乙中的最高值。 请做出合理解释。19. 小科所在的实验小组进行了如下实验: (1)、写出B中反应的化学方程式:。(2)、D中沉淀的化学式是:。(3)、B、D试管内的物质在E中混合后得到无色溶液,其中一定含有的溶质是: , 可能含有的溶质是:。20. 兴趣小组研究酸碱反应时利用稀硫酸、氢氧化钠溶液、紫色石蕊指示剂进行实验,实验操作和溶液颜色变化如下图所示。
(1)、写出B中反应的化学方程式:。(2)、D中沉淀的化学式是:。(3)、B、D试管内的物质在E中混合后得到无色溶液,其中一定含有的溶质是: , 可能含有的溶质是:。20. 兴趣小组研究酸碱反应时利用稀硫酸、氢氧化钠溶液、紫色石蕊指示剂进行实验,实验操作和溶液颜色变化如下图所示。
 (1)、从微观角度分析,该反应的实质是。(2)、根据乙图颜色的变化,判断图甲中B溶液是。(填写溶液名称)(3)、图乙中M点时,溶液中除紫色石蕊外还存在的溶质有。21. 小珏同学认为:酸与碱中和反应的结果是酸和碱各自的特性都消失.如图描述的是氢氧化钠与盐酸反应的微观实质,请从微观的角度分析,甲、乙处应填入的化学符号依次是 、.
(1)、从微观角度分析,该反应的实质是。(2)、根据乙图颜色的变化,判断图甲中B溶液是。(填写溶液名称)(3)、图乙中M点时,溶液中除紫色石蕊外还存在的溶质有。21. 小珏同学认为:酸与碱中和反应的结果是酸和碱各自的特性都消失.如图描述的是氢氧化钠与盐酸反应的微观实质,请从微观的角度分析,甲、乙处应填入的化学符号依次是 、. 22. 人体胃酸主要成分是(写出化学式),胃酸过多我们可以利用酸能用碱中和性质,可以服用复方氢氧化铝来中和,中和反应的实质是。23. 观察和实验是学习科学的两种基本方法。请判断下列操作或实验中能观察到的现象:(1)、打开盛有浓盐酸试剂瓶的瓶盖,瓶口会看到 , 这是挥发出来的氯化氢气体与空气中的水蒸气结合形成的盐酸小液滴。(2)、向一只盛有稀盐酸的试管中滴加几滴紫色石蕊试液,发现试液变成 , 说明稀盐酸呈酸性。(3)、将鸡蛋放入盛有稀盐酸的烧杯中,发现蛋壳(主要成分是碳酸钙)表面有。24. 下表是几种家用清洁剂的功能和有效成分。
22. 人体胃酸主要成分是(写出化学式),胃酸过多我们可以利用酸能用碱中和性质,可以服用复方氢氧化铝来中和,中和反应的实质是。23. 观察和实验是学习科学的两种基本方法。请判断下列操作或实验中能观察到的现象:(1)、打开盛有浓盐酸试剂瓶的瓶盖,瓶口会看到 , 这是挥发出来的氯化氢气体与空气中的水蒸气结合形成的盐酸小液滴。(2)、向一只盛有稀盐酸的试管中滴加几滴紫色石蕊试液,发现试液变成 , 说明稀盐酸呈酸性。(3)、将鸡蛋放入盛有稀盐酸的烧杯中,发现蛋壳(主要成分是碳酸钙)表面有。24. 下表是几种家用清洁剂的功能和有效成分。清洁剂



功能
清除污垢,除异味
漂洗衣物,使色彩鲜艳
漂除衣物污渍
有效成分
HCl
H2O2
NaClO
(1)、厕所污垢的主要成分是尿碱,通常用洁厕灵进行清洗,由此可推测尿碱是一种具有(选填“酸性”或“碱性”)的物质。(2)、各取适量三种清洁剂于试管中,加入少许二氧化锰,有大量气泡产生的清洁剂是。25. 有10mL稀盐酸(其中滴有少量紫色石蕊试剂)的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下。请分析并回答下列问题:加入NaOH溶液的体积/mL
0
2
4
6
8
10
12
14
烧杯中溶液的pH
1.1
1.2
1.4
1.6
2.0
7.0
11.0
12.2
(1)、当加入氢氧化钠溶液的体积为 mL时,稀盐酸和氢氧化钠溶液恰好完全反应,该反应的化学方程式是;(2)、当加入氢氧化钠溶液的体积为13mL时,溶液中的溶质有哪些?;(用化学式表示)
三、实验探究题
-
26. 在探究酸和碱的化学性质时,小明在10毫升氢氧化钠溶液中滴入几滴酚酞试液,然后逐滴滴入浓硫酸,温度变化如图所示。
 (1)、AB段反应过程中溶液颜色变化的现象是 。(2)、小明根据温度变化的曲线图,得出酸和碱反应放出热量,老师建议小明再思考一下,还有引起温度变化是 。(3)、为了探究硫酸是否过量,小明分别选取氯化钡溶液、紫色石蕊试液设计实验方案,进行了如表实验:
(1)、AB段反应过程中溶液颜色变化的现象是 。(2)、小明根据温度变化的曲线图,得出酸和碱反应放出热量,老师建议小明再思考一下,还有引起温度变化是 。(3)、为了探究硫酸是否过量,小明分别选取氯化钡溶液、紫色石蕊试液设计实验方案,进行了如表实验:方案
方案一
方案二
实验操作
在反应后的溶液中滴加氯化钡溶液
在反应后的溶液中滴加紫色石蕊试液
实验现象
出现白色沉淀
溶液变红
实验结论
硫酸过量
硫酸过量
小白与同学讨论后,指出小明设计的实验方案中有一个方案不合理,请指出不合理的方案并说明理由:。
27. 化学小组在学习酸和碱的中和反应后,从不同角度开展实验活动,验证氢氧化钠和盐酸能发生反应。 (1)、通过溶液酸碱性的变化进行验证。
(1)、通过溶液酸碱性的变化进行验证。在实验1中,用滴管缓慢滴入稀盐酸,并不断搅拌。观察到烧杯内溶液由红色变为无色,反应后溶液中一定含有的离子是 , 可能含有的离子。
(2)、利用中和反应放热进行验证。在实验2中,将稀盐酸全部注入试管中,立即固定活塞。观察到氢氧化钠固体全部消失,U形管的液面左低右高,部分同学由此认为氢氧化钠和盐酸发生了反应。但有的同学不赞同,理由是(装置气密性良好,稀盐酸挥发忽略不计);他认为仍利用此装置,再补充一个实验才能达成实验2目的,将5mL稀盐酸换为 , 其余试剂及操作与实验2相同,然后比较实验结果。
28. 学习酸碱中和反应时,很多同学对实验产生探究兴趣。 (1)、甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱反应是放热反应的结论。乙同学认为中同学推理不合理,理由是 。(2)、乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出氢氧化钠溶液温度随加入稀硫酸质量的变化如图。由图知,稀硫酸与氢氧化钠溶液发生的反应是(填“放热”,或“吸热”)反应,B点表示的含义是。(3)、丙同学将稀硫酸滴入氢氯化钠溶液中,有气泡产生,他认为氢氧化钠溶液已变质。请你分析变质的原图(用化学方程式表示)。
(1)、甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱反应是放热反应的结论。乙同学认为中同学推理不合理,理由是 。(2)、乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出氢氧化钠溶液温度随加入稀硫酸质量的变化如图。由图知,稀硫酸与氢氧化钠溶液发生的反应是(填“放热”,或“吸热”)反应,B点表示的含义是。(3)、丙同学将稀硫酸滴入氢氯化钠溶液中,有气泡产生,他认为氢氧化钠溶液已变质。请你分析变质的原图(用化学方程式表示)。四、解答题
-
29. 在一定量的氢氧化钠稀溶液中逐渐滴加稀盐酸,反应过程中不断搅拌并及时测量不同时刻溶液的温度与pH,记录数据如下表:
反应时间(秒)
0
25
50
75
100
125
150
175
200
滴入稀盐酸体积(毫升)
0
4
8
12
16
20
24
28
32
pH
13.2
13.0
12.7
12.4
12.1
7.0
2.0
1.6
1.3
温度(℃)
36.9
37.5
38.0
38.5
38.8
39.2
39.0
38.8
38.6
(1)、观察上表发现,当反应时间在秒时开始,溶液中氯化钠的质量不再增加。(2)、完成上述实验,能否用氢氧化钠固体代替,并请说明原因。(3)、结合上表中滴入稀盐酸体积与pH的变化数据,试计算氢氧化钠稀溶液中溶质的质量(稀HCl的密度取1.0g/mL,稀盐酸溶质质量分数为7.3%)30. )在一定量的氢氧化钠稀溶液中, 逐渐滴加溶质质量分数 7.3%的稀盐酸, 反应过程中不断 搅拌, 并利用数字化传感器测量不同时刻溶液的温度与 pH,记录数据如下表:
反应时间(秒)
0
25
50
75
100
125
150
175
200
滴入稀盐酸体积(毫升)
0
4
8
12
16
20
24
28
32
pH
13.2
13.0
12.7
12.4
12.1
7.0
2.0
1.6
1.3
温度(℃)
36.9
37.5
38.0
38.5
38.8
39.2
39.0
38.8
38.6
(1)、观察上表发现,当反应时间在秒时开始, 溶液中 NaCl 的质量不会增加。(2)、在逐渐滴加稀盐酸的过程中,溶液的温度先升高后降低, 请分析其原因。(3)、结合上表中滴入稀盐酸体积与 pH 的变化数据, 请计算氢氧化钠稀溶液中溶质的质量。(稀盐 酸的密度取 1.0 克/毫升)31. 在研究“酸与碱之间发生的反应”过程中,取一洁净的锥形瓶,往其中加入25克氢氧化钠溶液,然后逐滴滴入质量分数为7.3%的稀盐酸。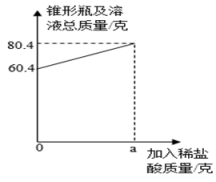 (1)、为了获取酸能与碱反应的证据,滴加稀盐酸前,锥形瓶中还需加入的是 。(2)、酸与碱之间反应的实质是 。(3)、滴加稀盐酸至恰好完全反应,锥形瓶及溶液总质量随加入稀盐酸质量的变化关系如图所示,则a的值是 。(4)、求反应后溶液中溶质的质量分数。
(1)、为了获取酸能与碱反应的证据,滴加稀盐酸前,锥形瓶中还需加入的是 。(2)、酸与碱之间反应的实质是 。(3)、滴加稀盐酸至恰好完全反应,锥形瓶及溶液总质量随加入稀盐酸质量的变化关系如图所示,则a的值是 。(4)、求反应后溶液中溶质的质量分数。五、综合说理题
-
32. 土壤的盐渍化是导致我国耕地减少的一个重大威胁,因为盐渍化之后土壤的 pH 会远高于 7(成为盐碱地),导致大多数植物难以生存。某科技攻关小组已尝试在一盐碱地上种植某种农作物,欲使农作物生长更好须采用多种措施,其中一种措施就是用碳酸水浇灌农作物,请运用所学知识解释采用碳酸水浇灌农作物的道理。