高考二轮复习知识点:有关反应热的计算1
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 一种分解氯化铵实现产物分离的物质转化关系如下,其中代表或中的一种。下列说法正确的是( )
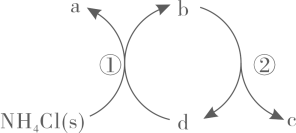 A、、分别是 B、既可以是 , 也可以是 C、已知为副产物,则通入水蒸气可减少的产生 D、等压条件下,反应、的反应热之和,小于氯化铵直接分解的反应热2. 2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法错误的是( )
A、、分别是 B、既可以是 , 也可以是 C、已知为副产物,则通入水蒸气可减少的产生 D、等压条件下,反应、的反应热之和,小于氯化铵直接分解的反应热2. 2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法错误的是( ) A、相同条件下,K(s)的(ΔH2′+ΔH3′)<Na(s)的(ΔH2+ΔH3) B、ΔH4的值数值上和Cl-Cl共价键的键能相等 C、ΔH5<0,在相同条件下,2Br(g)的ΔH5′>ΔH5 D、ΔH7<0,且该过程形成了分子间作用力3. 已知反应2NO(g)+2H2(g) N2(g)+2H2O(g) △H=-752kJ/mol的反应机理如下:
A、相同条件下,K(s)的(ΔH2′+ΔH3′)<Na(s)的(ΔH2+ΔH3) B、ΔH4的值数值上和Cl-Cl共价键的键能相等 C、ΔH5<0,在相同条件下,2Br(g)的ΔH5′>ΔH5 D、ΔH7<0,且该过程形成了分子间作用力3. 已知反应2NO(g)+2H2(g) N2(g)+2H2O(g) △H=-752kJ/mol的反应机理如下:①2NO(g) N2O2(g)(快)
②N2O2(g)+H2(g) N2O(g)+H2O(g)(慢)
③N2O(g)+H2(g) N2(g)+H2O(g)(快)下列有关说法正确的是( )
A、N2O2和N2O是该反应的催化剂 B、②的反应的活化能最小 C、反应速率v(NO)=v(H2)=v(N2) D、总反应中逆反应的活化能比正反应的活化能大4. 中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:
下列说法正确的是( )
A、过程Ⅰ、过程Ⅲ均为放热过程 B、过程Ⅲ生成了具有极性共价键的H2、CO2 C、使用催化剂降低了水煤气变换反应的ΔH D、图示过程中的H2O均参与了反应过程5. 在恒容密闭容器中将CO2与含少量CO的H2混合生成甲醇,反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。下图中是按 分别为①1:4和②1:6两种投料比时,CO2的平衡转化率随温度变化的曲线。
下列有关说法正确的是( )
A、按投料比①时,CO2的平衡转化率随温度变化的曲线对应的是图中的曲线I B、图中a点对应的H2的转化率等于30% C、图中b点对应的平衡常数K的值大于c点 D、 的数值,a点比c点小6. 已知2SO2(g)+O2(g) 2SO3(g)+Q kJ·mol-1(Q>0)。下列说法正确的是( )
A、相同条件下,2molSO2(g)和1molO2(g)所具有的能量小于2molSO3(g)所具有的能量 B、将2molSO2(g)和1molO2(g)充分反应可放出的热量为Q kJ C、增大压强或升高温度,该平衡都向逆反应方向移动 D、若充分反应后放热Q kJ,则此过程中有2molSO2(g)被氧化7. 通过以下反应均可获取O2。下列有关说法不正确的是 ( )①光催化分解水制氧气:2H2O(l)=2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②过氧化氢分解制氧气:2H2O2(l)=2H2O(l) + O2(g) ΔH2=-196.4 kJ·mol-1
③一氧化氮分解制氧气:2NO(g)=N2(g) + O2(g) ΔH3=-180.5 kJ·mol-1
A、反应①是人们获取H2的途径之一 B、反应②、③都是化学能转化为热能 C、反应H2O2(l)=H2O(g)+ O2(g)的ΔH=-285.8kJ·mol-1 D、反应2H2(g)+2NO(g)=N2(g)+2H2O(l)的ΔH=-752.1 kJ·mol-18. 下列有关说法正确的是 ( )A、标准状况下,2.24 L Cl2与足量的NaOH溶液反应,转移的电子数目为0.1NA B、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0 C、工业上需要把BaSO4沉淀转化为BaCO3 沉淀,然后获得Ba2+ , 这是因为Ksp(BaSO4)>Ksp(BaCO3), D、已知I I2+I- , 向盛有KI3溶液的试管中加入适量CCl4 , 振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
9. 已知C(s)+H2O(g)═CO(g)+H2(g)△H=akJ•mol﹣1 2C(s)+O2(g)═2CO(g)△H=﹣220kJ•mol﹣1H﹣H,O=O和O﹣H键的键能分别为436、496和462kJ•mol﹣1 , 则a为( )
I2+I- , 向盛有KI3溶液的试管中加入适量CCl4 , 振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
9. 已知C(s)+H2O(g)═CO(g)+H2(g)△H=akJ•mol﹣1 2C(s)+O2(g)═2CO(g)△H=﹣220kJ•mol﹣1H﹣H,O=O和O﹣H键的键能分别为436、496和462kJ•mol﹣1 , 则a为( )
A、﹣332 B、+130 C、+350 D、﹣13010. SF6是一种优良的绝缘气体,分子结构中存在S﹣F键.已知1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF﹣F.S﹣F键需吸收的能量分别为160kJ、330kJ.则发生反应S(s)+3F2(g)═SF6(g),产生1molSF6反应能量变化为( )A、释放1780KJ B、释放1220kJ C、释放450kJ D、吸收430kJ•mol﹣111. SF6分子结构中只存在S﹣F键,是一种优良的绝缘气体,制备原理:S(s)+3F2(g)→SF6(g)+Q.已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F﹣F、S﹣F键需吸收的能量分别为160kJ、330kJ.则反应热效应Q的值为(单位:kJ)( )A、178 0 B、1220 C、﹣1220 D、﹣1780二、非选择题
-
12. 尿素合成的发展体现了化学科学与技术的不断进步。(1)、十九世纪初,用氰酸银与在一定条件下反应制得 , 实现了由无机物到有机物的合成。该反应的化学方程式是 。(2)、二十世纪初,工业上以和为原料在一定温度和压强下合成尿素。反应分两步:
和生成;
分解生成尿素。

结合反应过程中能量变化示意图,下列说法正确的是填序号。
活化能:反应反应
为放热反应,为吸热反应
(3)、近年研究发现,电催化和含氮物质等在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题。向一定浓度的溶液通至饱和,在电极上反应生成 , 电解原理如图所示。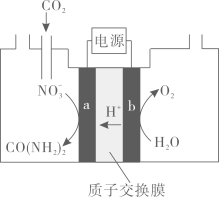
电极是电解池的极。
电解过程中生成尿素的电极反应式是。
(4)、尿素样品含氮量的测定方法如下。已知:溶液中不能直接用溶液准确滴定。

消化液中的含氮粒子是。
步骤中标准溶液的浓度和消耗的体积分别为和 , 计算样品含氮量还需要的实验数据有。
13. 油气开采、石油化工、煤化工等行业废气普遍含有的硫化氢,需要回收处理并加以利用。回答下列问题:(1)、已知下列反应的热化学方程式:①
②
③
计算热分解反应④的。
(2)、较普遍采用的处理方法是克劳斯工艺。即利用反应①和②生成单质硫。另一种方法是:利用反应④高温热分解。相比克劳斯工艺,高温热分解方法的优点是 , 缺点是。(3)、在、反应条件下,将的混合气进行热分解反应。平衡时混合气中与的分压相等,平衡转化率为 , 平衡常数。(4)、在、反应条件下,对于分别为、、、、的混合气,热分解反应过程中转化率随时间的变化如下图所示。
①越小,平衡转化率 , 理由是。
②对应图中曲线 , 计算其在之间,分压的平均变化率为。
14. 氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。方法I:氨热分解法制氢气
相关化学键的键能数据
化学键
键能
946
436.0
390.8
一定温度下,利用催化剂将 分解为 和 。回答下列问题:
(1)、反应 ;(2)、已知该反应的 ,在下列哪些温度下反应能自发进行?_______(填标号)A、25℃ B、125℃ C、225℃ D、325℃(3)、某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。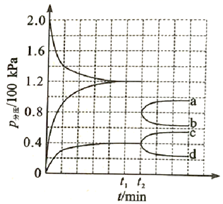
①若保持容器体积不变, 时反应达到平衡,用 的浓度变化表示 时间内的反应速率 (用含 的代数式表示)
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是(用图中a、b、c、d表示),理由是;
③在该温度下,反应的标准平衡常数 。(已知:分压=总压×该组分物质的量分数,对于反应 , ,其中 , 、 、 、 为各组分的平衡分压)。
方法Ⅱ:氨电解法制氢气
利用电解原理,将氮转化为高纯氢气,其装置如图所示。
 (4)、电解过程中 的移动方向为(填“从左往右”或“从右往左”);(5)、阳极的电极反应式为。
(4)、电解过程中 的移动方向为(填“从左往右”或“从右往左”);(5)、阳极的电极反应式为。KOH溶液KOH溶液
15. 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1)、 。(2)、一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为ɑ mol,CO为b mol,此时H2O(g)的浓度为mol﹒L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为。(3)、不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=
CH3OH的平衡产率=
其中纵坐标表示CO2平衡转化率的是图(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为;图乙中T1温度时,三条曲线几乎交于一点的原因是。
(4)、为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为_________(填标号)。A、低温、高压 B、高温、低压 C、低温、低压 D、高温、高压16. 以为原料制备甲醇等能源物质具有较好的发展前景。因此,研发利用技术,降低空气中含量成为研究热点。(1)、在催化剂的作用下,氢气还原的过程中可同时发生反应I、II。(已知活化能:)I.
II.
①则的 , 其中反应I能自发进行的条件是。
②保持温度T不变时,在容积不变的密闭容器中,充入一定量的及 , 起始及达到平衡时,容器内各气体的物质的量及总压强数据如表所示:
/mol
/mol
/mol
/mol
/mol
总压强/kPa
起始
0.5
0.9
0
0
0
平衡
m
0.3
p
若反应I、II均达到平衡, , 则表中m=;反应I的平衡常数(用含p的代数式表示)。
(2)、在kPa下,向恒压反应器中通入3mol、1mol , 的平衡转化率及的平衡产率随温度变化的关系如图。
已知:的产率
①下列说法正确的是(填标号)。
A.反应过程中,容器内压强不再变化,说明反应I达到平衡
B.反应过程中,气体密度保持不变,说明反应I达到平衡
C.反应过程中,气体的平均摩尔质量保持不变,说明反应I达到平衡
②图中500K以后,的平衡转化率随温度升高而增大的原因是。
(3)、工业上常用电解法将合成为羧酸以实现资源化处理。以Pt为电极、质子惰性有机溶剂为电解液的装置,可将转化为草酸(),其阴极的电极反应式为。17. CH4超干重整CO2技术可得到富含CO的化工原料。回答下列问题:(1)、CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H已知上述反应中相关的化学键键能数据如下:
化学键
C-H
C=O
H-H
C
 O(CO)
O(CO)键能/ kJ·mol -1
413
745
436
1075
则该反应的∆H=。
(2)、一定条件下,向体积为VL的密闭容器中通入CH4、CO2各1.0 mol及少量O2和水蒸汽,CH4与CO2催化重整过程中还会发生如下反应:反应①CO2(g)+H2(g) CO(g) + H2O(g) ∆H1= +41.2 kJ·mol-1
反应②CH4(g)+ O2(g) CO(g) +2H2(g) ∆H2= -35.6 kJ·mol-1
测得不同温度下反应平衡时各产物产量如图所示。

图中a和b分别代表产物和 , 当某超高温度,H2O的含量随温度升高而下降的主要原因是。1100K时,CH4与CO2的转化率分别为95%和90%,则CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=(写出计算式)。
(3)、催化重整时会伴随积碳和消碳反应,积炭反应会使催化剂活性降低,相关数据如下表:反应
Ⅰ
Ⅱ
CH4(g) C(s)+2H2(g)
CO2(g) +C(s) 2CO(g)
∆H (kJ·mol -1)
+75
-173
研究发现,如果反应I不发生积碳过程,则反应II也不会发生积碳过程。因此若保持催化剂的活性。应采取的条件是。如果I、II均发生了积碳反应,通入过量水蒸气能有效清除积碳,反应的化学方程式是。
18. 汽车尾气是否为导致空气质量问题的主要原因,由此引发的“汽车限行”争议,是当前备受关注的社会性科学议题。(1)、反应 可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示( 表示过渡态、 表示中间产物)。
三个基元反应中,属于放热反应的是(填标号);图中 。
(2)、探究温度、压强(2 、5 )对反应 的影响,如图所示,表示2 的是(填标号)。 (3)、用 可以消除 污染:
(3)、用 可以消除 污染:①某条件下该反应速率 , ,该反应的平衡常数 ,则 , 。
②一定温度下,在体积为1L的恒容密闭容器中加入4 和6 发生上述反应,测得 和 的物质的量随时间变化如图。

a点的正反应速率c点的逆反应速率(填“大于”、“小于”或“等于”);测得平衡时体系压强为 ),则该反应温度下 。(用含 的式子表示,只列式不用化简)。若在相同时间内测得 的转化率随温度的变化曲线如下图,400℃~900℃之间 的转化率下降由缓到急的原因是。
 19. 二甲醚可用于护发、护肤药品和涂料中作各类气雾推进剂。在制药、染料、农药等工业中有许多独特的用途。(1)、已知:CO(g)、H2(g)、CH3OCH3(g)的燃烧热ΔH分别为-283kJ·mol-1、-285.8kJ·mol-1、-1460kJ·mol-1 , H2O(g)=H2O(l) ΔH1=-44 kJ·mol-1。则2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) ΔH2= , 该反应能否自发进行与有关。(2)、T1 ℃时,在恒容密闭容器中通入CH3OCH3 ,发生反应CH3OCH3(g)⇌CO(g)+H2(g) +CH4(g) ,测得容器内初始压强为50kPa,反应过程中反应时间t与气体总压p总的关系如下表所示。
19. 二甲醚可用于护发、护肤药品和涂料中作各类气雾推进剂。在制药、染料、农药等工业中有许多独特的用途。(1)、已知:CO(g)、H2(g)、CH3OCH3(g)的燃烧热ΔH分别为-283kJ·mol-1、-285.8kJ·mol-1、-1460kJ·mol-1 , H2O(g)=H2O(l) ΔH1=-44 kJ·mol-1。则2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) ΔH2= , 该反应能否自发进行与有关。(2)、T1 ℃时,在恒容密闭容器中通入CH3OCH3 ,发生反应CH3OCH3(g)⇌CO(g)+H2(g) +CH4(g) ,测得容器内初始压强为50kPa,反应过程中反应时间t与气体总压p总的关系如下表所示。反应时间t/s
0
100
350
850
2000
2500
气体总压p总/kPa
50.0
55.0
65.0
83.2
125.0
125.0
①该温度下,反应达到平衡时,CH3OCH3的分解率为;t=350s时,混合气体的平均摩尔质量为(保留三位有效数字)g·mol-1。
②若反应达到平衡后,升高温度,CH3OCH3的浓度增大,则正反应为(填“放热”或“吸热”)反应。
③该温度下,要缩短反应达到平衡所需的时间,可采取的措施是。
(3)、在T2℃、p0kPa(恒温、恒压)下,将等物质的量的CO与H2通入容积为VL的容器内,发生反应:2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g)。反应达到平衡时,测得容器容积为0.6VL,用气体分压[气体分压(p)=气体总压(p总)×体积分数]代替平衡浓度表示的平衡常数Kp=(kPa)-4。反应速率v=v正-v逆=k正p2(CO)·p4(H2)-k逆p(CH3OCH3)p(H2O),k正、k逆分别为正、逆反应速率常数,p为气体的分压。该温度下,当容器体积为0.8VL时, =。20. 研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成多种低碳有机物,如反应类型①:Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.5kJ·mol−1Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+40.9kJ·mol−1
Ⅲ.CO(g)+2H2(g) CH3OH(g) ΔH3
回答下列问题:
(1)、反应III的∆H3为。(2)、在绝热恒容的密闭容器中,将CO2和H2按物质的量之比1∶3投料发生反应I,下列不能说明反应已达平衡的是 (填序号)。A、体系的温度保持不变 B、CO2和H2的转化率相等 C、单位时间内体系中减少3mol H2的同时有1mol H2O增加 D、合成CH3OH的反应限度达到最大(3)、如图为一定比例的CO2+H2、CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。490K时,根据曲线a、c可判断合成甲醇的反应机理是________。(填“A”或“B”) A、CO CO2 CH3OH+H2O B、CO2 CO CH3OH
A、CO CO2 CH3OH+H2O B、CO2 CO CH3OH反应类型②:
Ⅰ.2CO2(g)+2H2O(l) CH2=CH2(g)+3O2(g)
Ⅱ.CH2=CH2(g)+H2O(l)=C2H5OH(l)
Ⅲ.2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g)
(4)、CO2和水反应乙烯的反应中,当反应达到平衡时,若减小压强,则CO2的转化率 (填“增大”“减小”或“不变”)。(5)、反应Ⅲ,在某铁系催化剂催化下,温度、氢碳比[ =x]对CO2平衡转化率的影响以及温度对催化效率影响如图所示。
=x]对CO2平衡转化率的影响以及温度对催化效率影响如图所示。  ①下列有关说法正确的是 (填字母)。
①下列有关说法正确的是 (填字母)。A.反应Ⅲ是一个放热反应
B.增大氢碳比,可以提高H2的平衡转化率
C.温度低于300℃时,随温度升高乙烯的平衡产率增大
D.平衡常数:K(N)<K(M)
②在总压为2.1MPa的恒压条件下,M点时,CO2的平衡转化率为 ,则该条件下用平衡体系中各气体分压表示的平衡常数(Kp)的计算式(只需列式)为Kp= (各气体分压=平衡体系中各气体的体积分数×总压)。
(6)、二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯的选择性,应当 。21. 环氧乙烷常用于一次性口罩生产过程中灭菌和新冠病毒的消杀,工业上常利用乙烯直接氧化法生产环氧乙烷( ),发生的反应如下。
),发生的反应如下。 主反应Ⅰ:2CH2=CH2(g)+O2(g) 2
 (g) =-210kJ·mol-1
(g) =-210kJ·mol-1副反应Ⅱ:CH2=CH2(g)+3O2(g) 2CO2(g)+2H2O)(l) =-1324kJ·mol-1
Ⅲ.2
 (g)+5O2(g) 4CO2(g)+4H2O(g)
(g)+5O2(g) 4CO2(g)+4H2O(g) 已知:环氧乙烷选择性是指乙烯进行反应Ⅰ生成环氧乙烷的优势。
(1)、 =kJ·mol-1。(2)、①图1是乙烯转化率、环氧乙烷选择性与流速关系的图象,图中随进料气的流速加快,乙烯的转化率下降,其可能原因是。

②图2是乙烯转化率、环氧乙烷选择性与压强关系的图象,图中当反应体系的压强高于2.4MPa,环氧乙烷选择性下降,其可能原因是。
(3)、实验测得反应Ⅰ中,v正=K正·x2(CH2=CH2)·x(O2),v逆=K逆·x2( ),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。
),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。 ①若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应,达到平衡时CH2=CH2的转化率为75%,则该反应平衡常数的值为。
②若平衡后仅升高温度,则下列说法正确的是。
a.x(CH2=CH2)增大,x(
 )减小
)减小b.K正与K逆的比值增大
c.v正减小,v逆增大
d.K正与K逆的比值减小
(4)、将乙烯与饱和食盐水的电解产物反应,转化为氯乙醇[CH2(OH)CH2C],氯乙醇进一步反应生成环氧乙烷,其电解简易装置如右图所示。
已知:CH2=CH2+H2O+Cl2→CH2(OH)CH2Cl+HCl
①a电极为(选填“阴极”或“阳极”)。
②b电极区域生成环氧乙烷的化学方程式为。
22. 随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,制取甲胺的反应为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g) ΔH。回答下列问题:(1)、上述反应中所需的甲醇工业上利用水煤气合成,已知①CO(g)+ O2(g)═CO2(g) △H1=-284kJ/mol
②H2(g)+ O2(g)═H2O(g) △H2=-248kJ/mol
③CH3OH(g)+ O2(g)═CO2(g)+2H2O(g) △H3=-651kJ/mol
CO(g)+2H2(g) CH3OH(g)ΔH=。
(2)、在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为。
②X轴上b点的数值比a点(填“大”或“小”)。某同学认为图中Y轴表示温度,你认为他判断的理由是。
(3)、实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2 , 常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1 , 则Ksp(PbI2)=;已知Ksp(PbCl2)=1.6×10-5 , 则转化反应PbI2(s)+2Cl-(aq) PbCl2(s)+2I-(aq)的平衡常数K=。(4)、分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:
①反应H2(g)+I2(g) 2HI(g)的ΔH (填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O 3H++HSO4-+2I- , I2+I- I3- , 图2中曲线a、b分别代表的微粒是、(填微粒符号);由图2知要提高碘的还原率,除控制温度外,还可以采取的措施是。
23. 随着石油资源的日益枯竭,天然气的廾发利用越来越受到重视。CH4/CO2催化重整制备合成气(CO和H2)是温室气体CO2和CH4资源化利用的重要途径之一,并受了国内外研究人员的高度重视。回答下列问题:(1)、已知:①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+205.9 kJ·mol-1②CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CH4/CO2催化重整反应为CH4(g)+CO2(g) 2CO(g)+2H2(g) △H
该催化重整反应的△H=kJ·mol-1。要缩短该反应达到平衡的时间并提高H2的产率可采取的措施为。
(2)、向2L刚性密闭容器中充入2molCH4和2mol CO2进行催化重整反应,不同温度下平衡体系中CH4和CO的体积分数( )随温度变化如下表所示。
)随温度变化如下表所示。 
已知b>a>c,则T1T2(填“>”“<”或“=”)。T1下该反应的平衡常数K=(mol2·L-2)
(3)、实验硏究表明,载体对催化剂性能起着极为重要的作用,在压强0.03MPa,温度750℃条件下,载体对镍基催化剂性能的影响相关数据如下表:
由上表判断,应选择载体为(填化学式),理由是。
(4)、现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均充入2mol CH4(g)和2 molCO2(g)进行反应,三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的情况下,反应均进行到tmin时,CO2的体积分数如图所示,此时I、Ⅱ、Ⅲ个容器中一定处于化学平衡状态的是。 (5)、利用合成气为原料合成甲醇,其反应为CO(g)+2H2(g) CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
(5)、利用合成气为原料合成甲醇,其反应为CO(g)+2H2(g) CH3OH(g),在一定温度下查得该反应的相关数据如下表所示:
该反应速率的通式为ν正=k正cm(CO)·cn(H2)(k正是与温度有关的速率常数)。由表中数据可确定反应速率的通式中n=(取正整数)。若该温度下平衡时组别1的产率为25%,则组别1平衡时的v正=(保留1位小数)。
24. 汽车尾气污染是由汽车排放的废气造成的环境污染。主要污染物为一氧化碳、碳氢化合物、氮氧化合物等,对人类和动、植物危害甚大。解决汽车尾气问题的主要方法是研究高效催化剂促使尾气中的一氧化碳和氮氧化物反应,转化成无污染的氮气和二氧化碳。回答下列问题:
(1)、在Co+的催化作用下,CO(g)还原N2O(g)的反应历程和能量变化如图所示(逸出后物质认为状态下发生变化,在图中略去)。已知总反应的化学方程式为:CO(g)+N2O(g) CO2(g)+N2(g)。
该反应分两步进行:
第一步:Co+(s)+N2O(g) CoO+(s)+N2(g) △H1=+15.9kJ•mol-1;
笫二步:;△H2=;
①填写第二步反应的热化学方程式,并根据反应历程图计算△H2的数值。
②该反应的最高能垒(活化能)为。
(2)、500℃条件下,在容积均为2L的三个密闭容器中,按不同方式投入反应物,发生上述反应,测得相关数据如下表:容器
反应物投入的量
平衡时
n(N2/mol)
达到平衡所需时间/min
平衡时能量变化/kJ
甲
1molCO和1molN2O
n1
t1
放热Q1
乙
2molCO和2molN2O
n2
t2
放热Q2
丙
2molCO2和2molN2
n3
t3
吸热Q3
①Q1+ 358.6(填“>”“=”或“<”下同,t1t2;
②500℃条件下,乙和丙两容器,气体混合物中N2O的物质的量分数x(N2O)与反应时间t的关系如下表:
t/s
0
20
40
60
80
120
乙
x(N2O)
0.5
0.32
0.20
0.12
0.088
0.07
丙
x(N2O)
0
0.030
0.048
0.059
0.065
0.07
根据上述实验结果,计算出乙容器中0~20s时间内的化学反应速率v(CO)=;该反应的平衡常数K数值为:;(保留3位有效数字)
③请推测并在图中画出甲容器中x(N2O)随时间变化的关系图象,标出恰好达到平衡时刻点的位置。
 (3)、若将CO(g)还原N2O(g)的反应设计成如图的原电池装置,则该电池正极的电极反应式为。
(3)、若将CO(g)还原N2O(g)的反应设计成如图的原电池装置,则该电池正极的电极反应式为。 25. 将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。回答下列问题:(1)、如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa和5.0MPa。据图可知,该反应为反应(填“放热”或“吸热")。设CO2的初始浓度为comol•L-1 , 根据5.0MPa时的数据计算该反应的平衡常数K(240k)= (列出计算式即可)。若在4.0MPa时减小投料比,则CO2的平衡转化率曲线可能位于II线的(填“上方”或“下方”)。
25. 将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。回答下列问题:(1)、如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa和5.0MPa。据图可知,该反应为反应(填“放热”或“吸热")。设CO2的初始浓度为comol•L-1 , 根据5.0MPa时的数据计算该反应的平衡常数K(240k)= (列出计算式即可)。若在4.0MPa时减小投料比,则CO2的平衡转化率曲线可能位于II线的(填“上方”或“下方”)。 (2)、利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
(2)、利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g) CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:共价键
C—O
H—O
N—H
C—N
键能/k.J•mol-1
351
463
393
293
则该反应的△H=k.J•mol-1 。
(3)、已知:①CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226kJ•rnol-1②N2(g)+2O2(g) 2NO2(g)△H2=+68kJ•mol-1
③N2(g)+O2(g) 2NO(g) △H3=+183kJ•mol-1
则:2CO(g)+2NO(g) 2CO2(g)+N2(g) △H=kJ•mol-1。
(4)、一定温度下,下列措施一定能加快反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。A、及时移去甲醇 B、改进催化剂 C、提高反应物浓度 D、增大容器压强(5)、甲烷重整可选氧化物NiO- Al2O3作为催化剂,工业上常用Ni(NO3)2、Al(NO3)3混合液加入氨水调节pH=12(常温),然后将浊液高压恒温放置及煅烧等操作制备该催化剂。加入氨水调节pH=12时,c(Ni2+)为。[已知:Ksp[Ni(OH)2]=5×10-16]26. 1,3-丁二烯是重要的化工原料,工业上常用1-丁烯催化脱氢的方法制备。将0.1mol 1-丁烯和0.675mol水蒸气组成的混合气,在80kPa恒压下进行反应:CH3CH2CH=CH2(g) CH2=CHCH=CH2(g)+H2(g)△H。
请回答下列问题:
(1)、已知化学键键能数据如下,由此计算△H=kJ·mol-1。化学键
C-C
C=C
C-H
H-H
键能/kJ·mol-1
348
612
412
436
(2)、下图表示脱氢反应中温度对1-丁烯的平衡转化率的影响,工业生产通常控制反应温度为600℃。
①请解释工业生产控制温度在600℃的原因 。
②此温度下反应进行2.5h后达到平衡,从开始反应到建立平衡,以H2表示的反应速率为v(H2)=kPa·h-1;脱氢反应的平衡常数Kp=kPa(Kp为以分压表示的平衡常数,P分=P总×物质的量分数)。
(3)、在密闭容器中反应达到平衡后,再充入1.575mol 1-丁烯和1.625mol 1,3-丁二烯,化学反应向 (填“正反应”、“逆反应”或“不移动”)方向进行。27. 对甲烷和CO2的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合CO2重整反应有:反应①:
反应②:
(1)、CO燃烧的热化学方程式为 △H=kJ/mol(2)、一定条件下,将CH4与CO2以体积比1:1置于恒温恒容的密闭容器中发生反应 ,下列能说明反应达到平衡状态的有____。A、体系密度保持不变 B、容器中压强保持不变 C、H2和CO的体积比保持不变 D、每消耗1molCH4的同时生成2mol CO(3)、重整反应中存在着副反应产生的积碳问题。加入少量的Na2CO3可不断消除积碳。请用化学方程式表示其反应过程: , 。(4)、已知甲烷临氧藕合CO2重整反应体系中还有反应③: 。在密闭容器中,重整反应①②③在1073K时催化下达到平衡,发现n(H2)/n(CO)<l,请从平衡移动的角度解释原因。如果投料时增加氧气比例,下列预测可能错误的是(填编号)。A.氢气总产量减少 B.反应①的甲烷转化率升高
C.会产生副反应 D.对反应②的平衡无影响
(5)、温度对重整反应体系中反应物平衡转化率,平衡时氢气、一氧化碳和水的物质的量影响如图所示。若CH4与CO2的起始投料相等,则起始时n(CH4)=mol,在1000K时反应③的平衡常数K为 28. 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及部分物质未标出)。
28. 科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及部分物质未标出)。 (1)、已知:CH4 、CO, 、H2的燃烧热分别为890. 3 KJ·mol-1、283. 0 KJ·mol-1、285. 8 KJ·mol-1。则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g)的△H=(2)、工业上可用H2和CO2制备甲醇,其反应方程式为CO2 ( g) + 3H2 (g) CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
(1)、已知:CH4 、CO, 、H2的燃烧热分别为890. 3 KJ·mol-1、283. 0 KJ·mol-1、285. 8 KJ·mol-1。则上述流程中第一步反应2CH4(g)+O2(g)=2CO(g)+4H2(g)的△H=(2)、工业上可用H2和CO2制备甲醇,其反应方程式为CO2 ( g) + 3H2 (g) CH3OH(g)+ H2O(g)。某温度下,将1 mol CO2和3 mol H2充人体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:

①用H2表示的前2h的平均反应速率v(H2)=
②该温度下,CO2的平衡转化率为
(3)、在300℃、8 MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(4)、CO2经催化加氢可合成低碳烯烃:2CO2 ( g)+6H2 (g) C2H4 (g)+4H2 O(g) △H。在0 .1 MPa时,按 (CO2): (H2)=1:3投料,如图所示为不同温度( )下,平衡时四种气态物质的物质的量( )的关系。①该反应的△H0(填“>”或“<”)。
②曲线 表示的物质为(填化学式)。
29. 生石灰是常用的建筑材料,常采用煅烧石灰石来制取。体积为1L的真空密闭容器中加入0.5moL碳酸钙,发生的反应CaCO3(s) CaO(s)+CO2(g)△H ,测得二氧化碳的物质的量浓度随温度变化关系如图所示。
图A表示CO2的平衡浓度随温度变化的关系曲线
图B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线
回答下列相关问题:
(1)、CaCO3(s) CaO(s)+CO2(g) △H 0(填>,<或=)。(2)、在T5℃下,维持温度和容器体积不变,向上述平衡体系再充入0.5moL氮气,则最后的平衡时容器中的碳酸钙质量为克;若在T5℃下,维持温度和总压强不变,向原平衡体系再充入0.5moL氮气,则容器中最后残留的碳酸钙质量为克。(3)、请说明随着温度升高,曲线B向曲线A逼近的原因(4)、以CaO为吸收体,将生物材质(以C计)与水蒸气反应制取H2。相关主要反应如下:
I. C(s) + H2O(g) CO(g) + H2(g) △H = + 131. 6 kJ·mol-1
II. CO(g) + H2O(g) CO2(g) + H2(g) △H = -43 kJ·mol-1
III. CaO(s)+CO2(g) CaCO3(s) △H = -178. 3 kJ·mol-1
①计算反应Ⅳ C(s) + 2H2O(g) + CaO(s) CaCO3(s) + 2H2 (g)的△H =kJ·mol-1。
若K1、K2、K3分别为反应I、II、III的平衡常数,则反应Ⅳ的平衡常数K=
(用含K1、K2、K3的式子表示)。
②对于可逆反应 C(s)+2H2O(g)+CaO(s) CaCO3(s) + 2H2(g),采取以下措施可以提高H2产率的是。(填字母编号)
A. 适当的降低体系的温度
B. 压缩容器的体积
C. 用镧镍合金(LaNi5)吸收氢气
D. 增加CaO的量
(5)、将碳酸钙固体与CO2饱和水溶液充分接触,某温度下CO2饱和水溶液中H2CO3的浓度0.03mol·L-1 , 水的pH约等于6,这种情况下钙离子最大浓度为mol·L-1 。(计算结果保留两位有效数字)(CaCO3的KSP=2.8×10-9 , 碳酸K1=4.3×10-7 K2=4.7×10-11)
30. 回收和利用CO2是环境科学家研究的热点,是减轻温室效应危害的重要途径。(1)、在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为。 (2)、CO2经过催化氢化合成低碳烯烃。合成乙烯的反应为
(2)、CO2经过催化氢化合成低碳烯烃。合成乙烯的反应为2CO2(g)+6H2(g)=CH2=CH2(g)+4H2O(g) △H=akJ/mol
已知:
键
H-H
C=O
C=C
O-H
C-H
键能/kJ/mol
436.0
745.0
615.0
462.8
413.4
则a=。
(3)、T℃时。在恒容密闭容器中充入1molCO2和nmolH2 , 在一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0,混合气体中CH3OH 的体积分数与氢气的物质的量的关系如图所示。图1中A、B、C 三点对应的体系。CO的转化率最大的是(填字母),判断理由是。
 (4)、工业上也用合成气(H2和CO) 合成甲醇,反应为2H2(g)+CO(g) CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。
(4)、工业上也用合成气(H2和CO) 合成甲醇,反应为2H2(g)+CO(g) CH3OH(g) △H<0,在10L的恒容密团容器中充入H2和CO的物质的量分别为2mol和1mol,测得CO的平衡转化率与温度、压强的关系如图2所示。①图2中S代表的物理量是。
②已知300℃时上述反应达到平衡时,CO 的平衡转化率为60% 若再向该平衡体系中再加入2molCO、2molH2、2molCH3OH 若保持温度和容器体积不变,则平衡会(填“正向移动”“逆向移动”或“不移动”)。
(5)、工业上常用高浓度的K2CO3溶液吸收CO2 , 得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下图所示:
①阳极区产生CO2的原因是(用离子方程式表示)。
②利用平衡移动原理,简述CO32-在阴极区再生的原因。
31. 氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:(1)、直接热分解法制氢某温度下,2H2O(g) 2H2(g) +O2(g),该反应的平衡常数表达式为K=。
(2)、乙醇水蒸气重整制氢反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图1所示。某温度下,图1所示反应每生成1mol H2(g),热量变化是62 kJ,则该反应的热化学方程式为。
 (3)、水煤气法制氢CO(g)+ H2O(g) CO2(g) +H2(g) △H<0
(3)、水煤气法制氢CO(g)+ H2O(g) CO2(g) +H2(g) △H<0在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见图2(图中各点对应的反应温度可能相同,也可能不同)。

①向2 L恒温恒容密闭容器中加入一定量的CO和0.1mol H2O(g),在图中G点对应温度下,反应经5 min 达到平衡,则平均反应速率v(CO)=。
②图中B、E 两点对应的反应温度分别为TB和TE , 则TBTE (填“>”“ <”或“=”)。
③经分析,A、E、G三点对应的反应温度都相同(均为T℃),其原因是A、E、G 三点对应的相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0 mol CO、1.0 mol H2O(g)、1.0 molCO2和x mol H2 , 为使上述反应开始时向正反应方向进行,则x应满足的条件是。
(4)、光电化学分解制氢反应原理如图3,钛酸锶光电极的电极反应式为4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为。
 (5)、Mg2Cu 是一种储氢合金。350℃时,Mg2Cu 与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数约为7.7%)。该反应的化学方程式为。32. 石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。请回答下列问题:(1)、COS的电子式是。(2)、已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362 kJ·mol-1
(5)、Mg2Cu 是一种储氢合金。350℃时,Mg2Cu 与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数约为7.7%)。该反应的化学方程式为。32. 石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。请回答下列问题:(1)、COS的电子式是。(2)、已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362 kJ·mol-1②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为。
(3)、可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3 , 该反应的平衡常数为。(已知H2CO3 的Ka1=4.2×10-7 , Ka2=5.6×10-11;H2S的Ka1=5.6×10-8 , Ka2=1.2×10-15)(4)、在强酸溶液中用H2O2 可将COS氧化为硫酸,这一原理可用于COS 的脱硫。该反应反应的化学方程式为。(5)、COS的水解反应为COS(g)+H2O(g) CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示: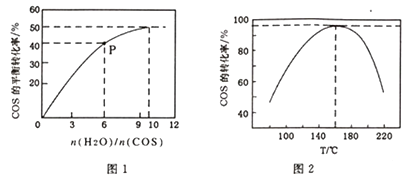
①该反应的最佳条件为:投料比[n(H2O)/n(COS)] , 温度
②P点对应的平衡常数为 。(保留小数点后2 位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是。
33.(1)、I.利用水蒸气或二氧化碳对甲烷进行重整是提高甲烷利用率的重要方式水蒸气重整:CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+205.9 KJ·mol-1 ①
CO(g)+H2O(g) CO2(g)+H2(g) △H 2 =-41.2 KJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H 3 ③
则反应①自发进行的条件是 , △H3 =KJ·mol-1
(2)、Ⅱ.2017年7月10日我国甲烷、二氧化碳重整制合成气装置在山西实现全系统运行,减少了温室气体的排放。某2L恒容密闭容器中,投入2 mol CH4和2 mol CO2 , 不同温度下平衡体系中CH4和CO的物质的量分数 /(y)%随温度变化如右图所示:

①T1温度下该反应的平衡常数是
②2c点CH4的物质的量分数为
③v逆:ab点(填“>”、“<”、“=”、“无法确定”),理由是。
(3)、现有温度相同的I、II、III三个恒压密闭容器,均已充入1 mol CH4(g)和1 mol CO2(g),三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的的情况下,反应进行到tmin时,CO2的体积分数如下图,此时I、II、III三个容器中可能处于化学平衡状态的是。