2023-2024 学年 浙教版科学九年级上册 1.4 常见的碱 同步练习
试卷更新日期:2023-08-01 类型:同步测试
一、单选题
-
1. 我们可以通过建立图像来表示化学反应过程中的量的相互关系。现一烧杯中含有HCl和CuCl2的混合液,将一定质量分数的氢氧化钠溶液加入到混合液中直至过量(CuCl2溶液看成中性),则反应中各个量的图像正确的是( )
 A、甲、乙、丙 B、甲、乙 C、乙、丙 D、甲、丙2. 下列各组物质相互接触,能发生化学反应却无明显现象的是( )A、氢氧化钠溶液与盐酸 B、氢氧化钡溶液与硫酸铜溶液 C、氧化铁与盐酸 D、石灰石与盐酸3. 氢氧化钡(Ba(OH)2)与氢氧化钙的化学性质相似。实验小组为了验证氢氧化钡的某些化学性质,设计如图所示实验,其中不能达到实验目的的是( )
A、甲、乙、丙 B、甲、乙 C、乙、丙 D、甲、丙2. 下列各组物质相互接触,能发生化学反应却无明显现象的是( )A、氢氧化钠溶液与盐酸 B、氢氧化钡溶液与硫酸铜溶液 C、氧化铁与盐酸 D、石灰石与盐酸3. 氢氧化钡(Ba(OH)2)与氢氧化钙的化学性质相似。实验小组为了验证氢氧化钡的某些化学性质,设计如图所示实验,其中不能达到实验目的的是( ) A、利用实验①验证氢氧化钡溶液显碱性 B、利用实验②验证氢氧化钡能与酸反应 C、利用实验③验证氢氧化钡能与某些盐反应 D、利用实验④验证氢氧化钡能与某些非金属氧化物反应4. 物质性质决定其用途,以下叙述不符合这一观点的是( )A、酒精易燃,可做酒精灯燃料 B、苛性钠溶液呈碱性,可改良酸性土壤 C、石墨能导电,可用作电池电极 D、铁易导热,可用于制作炊具5. “物质性质决定用途”是重要的化学观念之一。下列物质的用途与其性质不对应的是( )
A、利用实验①验证氢氧化钡溶液显碱性 B、利用实验②验证氢氧化钡能与酸反应 C、利用实验③验证氢氧化钡能与某些盐反应 D、利用实验④验证氢氧化钡能与某些非金属氧化物反应4. 物质性质决定其用途,以下叙述不符合这一观点的是( )A、酒精易燃,可做酒精灯燃料 B、苛性钠溶液呈碱性,可改良酸性土壤 C、石墨能导电,可用作电池电极 D、铁易导热,可用于制作炊具5. “物质性质决定用途”是重要的化学观念之一。下列物质的用途与其性质不对应的是( )序号
物质
性质
用途
A
稀盐酸
能与金属氧化物反应
金属除锈
B
氢氧化钙
能与二氧化碳反应
改良酸性土壤
C
碳酸钙
形成的岩石质地坚硬
做建筑材料
D
氯化钠
具有杀菌作用
清洗伤口
A、A B、B C、C D、D6. 在①二氧化碳,②酚酞试液,③稀盐酸,④硫酸铜溶液这四种物质中,能和氢氧化钠作用且表现出了“碱的通性”的组合是( )A、①②③④ B、①②③ C、②③④ D、①③④7. 实验室保存氢氧化钠溶液,下列方法不恰当的是( )A、不避光 B、玻璃瓶配玻璃塞 C、塑料瓶盛 D、密封8. 在盛有氢氧化钠溶液的试剂瓶口上出现了一层白色固体物质,它的主要成分是( )A、氢氧化钠 B、硫酸钠 C、碳酸钙 D、碳酸钠9. 向硫酸和硫酸铜的混合稀溶液中,逐滴加入NaOH溶液,下列曲线图正确的是( )A、 B、
B、 C、
C、 D、
D、 10. 如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。无论加入多少量的饱和石灰水,反应后试管内溶液一定呈碱性的是( )
10. 如图所示,分别向四支试管中加入饱和石灰水,使其与试管内溶液充分反应。无论加入多少量的饱和石灰水,反应后试管内溶液一定呈碱性的是( ) A、① B、② C、③ D、④11. 物质的结构决定性质,性质决定用途。下列物质的结构、性质和用途之间匹配正确的是( )
A、① B、② C、③ D、④11. 物质的结构决定性质,性质决定用途。下列物质的结构、性质和用途之间匹配正确的是( )选项
结构
性质
用途
A
稀盐酸中含有氢离子
具有酸性
检验溶液中是否含有银离子
B
稀盐酸中含有氯离子
具有酸性
检验溶液中是否含有银离子
C
氢氧化钠溶液中含有钠离子
具有碱性
吸收二氧化硫气体
D
氢氧化钠溶液中含有氢氧根离子
具有碱性
吸收二氧化硫气体
A、A B、B C、C D、D12. 一瓶存放较长时间的石灰水,瓶内壁附有一层白膜,要洗去这层白膜最好的方法是( )A、用水洗 B、用氢氧化钠溶液洗 C、用盐酸洗 D、先用盐酸,再用水洗13. 一定温度下,向agFeCl3溶液中加入NaOH固体,溶液的质量与加入NaOH固体的质量变化关系如图所示。下列叙述正确的是( ) A、m-n=c-b B、MP段发生的反应为:FeCl3+3NaOH=3NaCl+Fe(OH)3↓ C、P点对应的溶液中溶质的种类有三种 D、生成Fe(OH)3的质量为(n-c+a)g14. 科学推论是科学研究中最常用的科学方法,下列推论正确的是( )A、碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 B、酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应 C、用酚酞试液检验氢氧化钠溶液是否变质 D、碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性15. 某种“即食即热型快餐”适合外出旅行时使用,内层是用铝箔包裹并已加工好的真空包装食品,外层有分别包装的两包化学物质,使用时拉动预留在外的拉线,可使外层两包化学物质发生反应,便可对内层食品进行加热。这两包化学物质的最佳选择是( )A、浓硫酸和水 B、生石灰和水 C、石灰石和水 D、氢氧化钠和水
A、m-n=c-b B、MP段发生的反应为:FeCl3+3NaOH=3NaCl+Fe(OH)3↓ C、P点对应的溶液中溶质的种类有三种 D、生成Fe(OH)3的质量为(n-c+a)g14. 科学推论是科学研究中最常用的科学方法,下列推论正确的是( )A、碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐 B、酸与碱反应生成盐和水,所以生成盐和水的反应一定是酸与碱的反应 C、用酚酞试液检验氢氧化钠溶液是否变质 D、碱性溶液能使石蕊试液变蓝,所以能使石蕊试液变蓝的溶液呈碱性15. 某种“即食即热型快餐”适合外出旅行时使用,内层是用铝箔包裹并已加工好的真空包装食品,外层有分别包装的两包化学物质,使用时拉动预留在外的拉线,可使外层两包化学物质发生反应,便可对内层食品进行加热。这两包化学物质的最佳选择是( )A、浓硫酸和水 B、生石灰和水 C、石灰石和水 D、氢氧化钠和水二、填空题
-
16. 图甲是关于氢氧化钠化学性质的思维导图,请据图回答问题。
 (1)、性质①,将无色酚酞溶液滴入氢氧化钠溶液中,溶液呈色。(2)、性质②,将氢氧化钠溶液滴入稀盐酸中、图2表示该反应过程中溶液pH的变化曲线,n点溶液中的溶质是(填化学式)。(3)、依据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为。17. 将氢氧化钠溶液逐滴滴入盐酸和氯化铜的混合溶液中,并根据观察到的现象绘制了如图曲线,根据图示回答问题:
(1)、性质①,将无色酚酞溶液滴入氢氧化钠溶液中,溶液呈色。(2)、性质②,将氢氧化钠溶液滴入稀盐酸中、图2表示该反应过程中溶液pH的变化曲线,n点溶液中的溶质是(填化学式)。(3)、依据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为。17. 将氢氧化钠溶液逐滴滴入盐酸和氯化铜的混合溶液中,并根据观察到的现象绘制了如图曲线,根据图示回答问题: (1)、请解释OA段的反应是缘故。(2)、请写出AB段发生反应的化学方程式。(3)、C点处溶液的pH7(填“>”、“=”或“<”)。18. 请同学们搭乘“化学地铁”一起畅游物质世界吧!如图所示,列车上的物质可与各站的对应物质发生一步进行的反应,方可驶向下一站,“2﹣5号站”各站的对应物质属于不同类别的纯净物. “碳酸钠溶液”列车抵达“4号站”时,将列车上的物质更换为“稀盐酸”后出发.
(1)、请解释OA段的反应是缘故。(2)、请写出AB段发生反应的化学方程式。(3)、C点处溶液的pH7(填“>”、“=”或“<”)。18. 请同学们搭乘“化学地铁”一起畅游物质世界吧!如图所示,列车上的物质可与各站的对应物质发生一步进行的反应,方可驶向下一站,“2﹣5号站”各站的对应物质属于不同类别的纯净物. “碳酸钠溶液”列车抵达“4号站”时,将列车上的物质更换为“稀盐酸”后出发. (1)、与“碳酸钠溶液”和“稀盐酸”都能反应的“3号站”的对应物质为(写一种);(2)、“稀盐酸”列车途经“1、2、3号站”时,原“碳酸钠溶液”列车途经某站的对应物质必须更换为(写一种物质化学式),“稀盐酸”列车能走完全程.19. 某同学参照生物的二歧分类检索表,对一些化学物质进行区分。现有A、B、C、D四种溶液,它们分别是氢氧化钠溶液、硫酸铜溶液、碳酸钠溶液和氯化钙溶液中的一种。他制作了如图所示的分类检索表,请帮他将图中“”中的内容补充完整,并指明氢氧化钠所处的位置(选填“2”、“ 3”、“ C”、“ D”)
(1)、与“碳酸钠溶液”和“稀盐酸”都能反应的“3号站”的对应物质为(写一种);(2)、“稀盐酸”列车途经“1、2、3号站”时,原“碳酸钠溶液”列车途经某站的对应物质必须更换为(写一种物质化学式),“稀盐酸”列车能走完全程.19. 某同学参照生物的二歧分类检索表,对一些化学物质进行区分。现有A、B、C、D四种溶液,它们分别是氢氧化钠溶液、硫酸铜溶液、碳酸钠溶液和氯化钙溶液中的一种。他制作了如图所示的分类检索表,请帮他将图中“”中的内容补充完整,并指明氢氧化钠所处的位置(选填“2”、“ 3”、“ C”、“ D”) 20. 如图是关于氢氧化钠化学性质的思维导图,请据图回答
20. 如图是关于氢氧化钠化学性质的思维导图,请据图回答 (1)、依据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为。(2)、性质④,将氢氧化钠固体和某种盐混合研磨,能放出有刺激性气味的气体。推测这种盐的组成中含有。(写出原子团的符号)21. 结合NaOH、Ca(OH)2的相关知识,回答下列问题(1)、可用来改变良酸性土壤的碱是;(2)、从微观角度看,它们的溶液具有相似化学性质的原因是;22. 某溶液M可能含有盐酸、硫酸、氯化钠、硝酸镁中的一种或几种,为了探究其组成,向一定质量的溶液M中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。分析图像可知:
(1)、依据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为。(2)、性质④,将氢氧化钠固体和某种盐混合研磨,能放出有刺激性气味的气体。推测这种盐的组成中含有。(写出原子团的符号)21. 结合NaOH、Ca(OH)2的相关知识,回答下列问题(1)、可用来改变良酸性土壤的碱是;(2)、从微观角度看,它们的溶液具有相似化学性质的原因是;22. 某溶液M可能含有盐酸、硫酸、氯化钠、硝酸镁中的一种或几种,为了探究其组成,向一定质量的溶液M中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示。分析图像可知: (1)、溶液 M 中一定含有的物质是(2)、b 点时消耗氢氧化钡的质量34.2g(填大于、 等于、 小于)23. 学习酸碱中和反应时,很多同学对其产生探究兴趣。(1)、甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱中和反应是放热反应的结论。乙同学认为甲同学的推理是不合理,理由是 。(2)、乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,氢氧化钠溶液的温度随着加入的稀硫酸质量的变化曲线如下图所示:
(1)、溶液 M 中一定含有的物质是(2)、b 点时消耗氢氧化钡的质量34.2g(填大于、 等于、 小于)23. 学习酸碱中和反应时,很多同学对其产生探究兴趣。(1)、甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱中和反应是放热反应的结论。乙同学认为甲同学的推理是不合理,理由是 。(2)、乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,氢氧化钠溶液的温度随着加入的稀硫酸质量的变化曲线如下图所示:
①由该图知,稀硫酸与氢氧化钠溶液发生的反应是(填“放热”或“吸热”)反应,B点表示的含义是;
②A→B,烧杯中溶液的pH逐渐。
(3)、丙同学认为氢氧化钠溶液与稀硫酸混合没有明显现象,于是他想借助下列溶液来验证反应是否真的发生,不可行的是__________。A、无色酚酞试液 B、FeCl3 C、BaCl2 D、KNO324. 用下列物质的序号填空:①食醋 ②熟石灰 ③稀盐酸 ④浓硫酸(1)、工业上通常用来除铁锈的是;(2)、可用于干燥部分气体的是;(3)、农业上可用来改良酸性土壤的是 ;(4)、日常生活中一种重要的调味品是 。25. 小桐同学研究碱的性质时,进行如图实验,观察到有蓝色絮状沉淀产生。一段时间后,发现试管中的沉淀有些小组部分变黑,小庐同学仍为蓝色。 (1)、反应生成的蓝色絮状沉淀物质是;(2)、根据质量守恒定律,推测黑色物质可能是___________。A、铁 B、碳 C、二氧化锰 D、氧化铜
(1)、反应生成的蓝色絮状沉淀物质是;(2)、根据质量守恒定律,推测黑色物质可能是___________。A、铁 B、碳 C、二氧化锰 D、氧化铜三、实验探究题
-
26. 为验证稀HCl的化学性质,小科做了如图所示实验。
 (1)、能产生气泡的试管是(填字母,可多选)。(2)、为了检验试管D中变成无色的溶液中是否含有HCl,可以往试管中再加入适量的_____(填字母,可多选)检验。A、AgNO3溶液 B、Ca(OH)2溶液 C、CaCO3 D、CO2(3)、五个实验完成后,小科又进行了如下实验:在上述五支反应后的试管中,抽取两支试管内的溶液进行混合,后出现白色沉淀;将混合后的物质过滤,向滤液X滴加无色酚酞试液,发现溶液不变色,溶质可能为(除酚酞外)_________(填字母,可多选)。A、NaCl B、NaCl、HCl C、NaCl、CaCl2 D、NaCl、HCl、CaCl227. 学习了酸雨及酸的性质后,同学们知道了煤(含有C、H、O、S等元素)燃烧产生的二氧化硫是形成酸雨的主要原因之一。同学们在老师指导下制作了“酸雨形成及危害的模型”来研究酸雨形成的原因及危害,并设计了评价表。图1是小科制作的模型。
(1)、能产生气泡的试管是(填字母,可多选)。(2)、为了检验试管D中变成无色的溶液中是否含有HCl,可以往试管中再加入适量的_____(填字母,可多选)检验。A、AgNO3溶液 B、Ca(OH)2溶液 C、CaCO3 D、CO2(3)、五个实验完成后,小科又进行了如下实验:在上述五支反应后的试管中,抽取两支试管内的溶液进行混合,后出现白色沉淀;将混合后的物质过滤,向滤液X滴加无色酚酞试液,发现溶液不变色,溶质可能为(除酚酞外)_________(填字母,可多选)。A、NaCl B、NaCl、HCl C、NaCl、CaCl2 D、NaCl、HCl、CaCl227. 学习了酸雨及酸的性质后,同学们知道了煤(含有C、H、O、S等元素)燃烧产生的二氧化硫是形成酸雨的主要原因之一。同学们在老师指导下制作了“酸雨形成及危害的模型”来研究酸雨形成的原因及危害,并设计了评价表。图1是小科制作的模型。
评价表:
评价指标
优秀
合格
待改进
指标一
密封性好,能除去大部分污染气体
密封性好,能除去小部分污染气体
密封性不好,不能除去污染气体
指标二
能通过实验现象说明煤燃烧产生的气体是SO2
有实验现象,但不能说明煤燃烧产生SO2
没有明显实验现象
指标三
能通过多个实验现象显示酸雨的危害
能通过一个实验现象显示酸雨的危害
不能通过实验现象显示酸雨的危害
(1)、根据评价表,该模型的指标一可被评为优秀。因为该装置可以除去大部分污染气体,原因是氢氧化钠溶液具有 的性质。(2)、该模型的指标二被评为合格的原因是,煤燃烧还能产生 气体,也能使浸有紫色石蕊试液的棉花变红。(3)、该模型的指标三被评为待改进,于是小科设计了图2、图3两种模型。这两种改进模型中,图 的模型能被评为合格。28. 氢氧化钠与稀硫酸反应是否放出热量?三位同学为探究此问题按如图进行了实验: (1)、甲同学按图实验:在烧杯中先加入一定量的稀硫酸溶液,然后再加入适量的氢氧化钠固体,观察到温度计示数变大,于是得到“反应放出热量”的结论。你认为是否正确并说明理由 ;(2)、乙同学用乙图实验,可以根据 现象证明该反应放出热量。(3)、丙同学是将稀硫酸不断的滴入氢氧化钠溶液中,并用数字化仪器测量的数据。由图可知,当反应进行到20s时溶液中的溶质是 。29. 小柠借鉴网上资料腌制松花蛋。先将纯碱和食盐加入容器中,然后用沸水溶解,接着慢慢加入生石灰充分反应,冷却后得到料液,最后将鸭蛋放入其中浸渍一段时间。回答问题:(1)、生石灰加入沸水中,水能持续保持沸腾,其原因是。(2)、小柠对冷却后得到的料液产生了浓厚的兴趣;于是取了适量料液(上层清液),对其中的溶质进行探究。
(1)、甲同学按图实验:在烧杯中先加入一定量的稀硫酸溶液,然后再加入适量的氢氧化钠固体,观察到温度计示数变大,于是得到“反应放出热量”的结论。你认为是否正确并说明理由 ;(2)、乙同学用乙图实验,可以根据 现象证明该反应放出热量。(3)、丙同学是将稀硫酸不断的滴入氢氧化钠溶液中,并用数字化仪器测量的数据。由图可知,当反应进行到20s时溶液中的溶质是 。29. 小柠借鉴网上资料腌制松花蛋。先将纯碱和食盐加入容器中,然后用沸水溶解,接着慢慢加入生石灰充分反应,冷却后得到料液,最后将鸭蛋放入其中浸渍一段时间。回答问题:(1)、生石灰加入沸水中,水能持续保持沸腾,其原因是。(2)、小柠对冷却后得到的料液产生了浓厚的兴趣;于是取了适量料液(上层清液),对其中的溶质进行探究。①小柠认为,料液中一定存在NaCl和NaOH,料液中一定有NaOH的原因是(用化学方程式表示)。
②小柠猜想,料液中还有可能存在Ca(OH)2或Na2CO3 , 于是进行了如下实验:
实验1:取少量上层清液放入试管中,滴加少量Na2CO3溶液,有白色沉淀。
实验2:取少量上层清液放入试管中,滴加过量稀盐酸,没有明显现象。
由此可以得出,该料液中除NaOH与NaCl外,还含有(填写化学式)
四、解答题
-
30. 化学小组参与“铅蓄废电池中硫酸回收”的研究项目,回收时需要测定电池废液中硫酸的质量分数。向装有50g废液的锥形瓶中加入质量分数为20%的氢氧化钠溶液,并充分搅拌,利用温度传感器等设备采集信息并绘制成下图,请据图回答问题。(杂可溶但不参加反应)
 (1)、该反应是(填“吸热”或“放热”)反应。(2)、恰好完全反应时,溶液的温度为℃。(填“t1”、“t2”或“t3”)。(3)、计算废液中硫酸的质量分数。(写出计算过程)(4)、配制上述实验所用的氢氧化钠溶液。
(1)、该反应是(填“吸热”或“放热”)反应。(2)、恰好完全反应时,溶液的温度为℃。(填“t1”、“t2”或“t3”)。(3)、计算废液中硫酸的质量分数。(写出计算过程)(4)、配制上述实验所用的氢氧化钠溶液。①氢氧化钠固体应放在玻璃器皿中称量的原因是;
②用量筒量水时仰视读数,会导致测定废液中硫酸的质量分数结果(填“偏大”、“偏小”或“不变”)。
31. 某锥形瓶内盛有盐酸和氯化铜的混合溶液100g ,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形 瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。请回答: (1)、反应至A点时,溶液中的溶质有。(2)、反应至B点时,所加入的NaOH溶液的质量是克。(3)、求C点时,锥形瓶内溶液中NaCl的质量。32. 含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为10%NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,据图回答:(结果保留0.1%)
(1)、反应至A点时,溶液中的溶质有。(2)、反应至B点时,所加入的NaOH溶液的质量是克。(3)、求C点时,锥形瓶内溶液中NaCl的质量。32. 含CuCl2和HCl的100g混合溶液中,逐滴加入溶质质量分数为10%NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,据图回答:(结果保留0.1%) (1)、写出PM段所观察到现象。(2)、P点时溶液中的溶质是。(3)、求M点溶液中溶质的质量。(4)、求出m1的值33. 向100g稀硫酸溶液中加入一定量的镁粉,待固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀的质量与加入NaOH溶液的质量关系如图所示,请回答下列问题:
(1)、写出PM段所观察到现象。(2)、P点时溶液中的溶质是。(3)、求M点溶液中溶质的质量。(4)、求出m1的值33. 向100g稀硫酸溶液中加入一定量的镁粉,待固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀的质量与加入NaOH溶液的质量关系如图所示,请回答下列问题: (1)、根据图像分析,当加入NaOH溶液至A点时,烧杯内溶液中含有的溶质是;(2)、加入镁粉的质量为多少克?(3)、求加入80gNaOH溶液时,充分反应后的溶液(不饱和溶液)中溶质的质量分数?
(1)、根据图像分析,当加入NaOH溶液至A点时,烧杯内溶液中含有的溶质是;(2)、加入镁粉的质量为多少克?(3)、求加入80gNaOH溶液时,充分反应后的溶液(不饱和溶液)中溶质的质量分数?五、综合说理题
-
34. 如图所示,关闭阀门K2 , 缓缓打开阀门K1 , 氢氧化钠溶液流入平底烧瓶,轻轻振荡,发现溶液仍显红色;然后,关闭K1 , 缓缓打开K2 , 发现C中溶液沿导管慢慢流入平底烧瓶,观察到立即有气泡产生,且溶液红色逐渐褪去。请解释产生上述现象的原因。
 35. 图甲是目前流行的某品牌“自热火锅”,图乙是自热火锅结构示意图。某兴趣小组对这种不用火不用电,只要加水就能食用的火锅产生了兴趣。于是他们查阅了相关资料如下:
35. 图甲是目前流行的某品牌“自热火锅”,图乙是自热火锅结构示意图。某兴趣小组对这种不用火不用电,只要加水就能食用的火锅产生了兴趣。于是他们查阅了相关资料如下:自热火锅使用方法
1.下层底盒中倒入适量冷水,打开加热包塑料膜,将加热包放入凉水中。
2.放上上层食材盒,倒入一定食用冷水,盖上盖子,15分钟后,即可开盖食用。
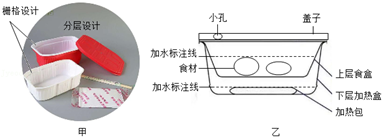
①材料:外盒是采用具有良好耐热性、保温性能的聚丙烯材料制成,餐盒为航空铝箔材料,无污染可再生。带有小孔的盒盖内扣设计,具有良好的密闭功能。
②栅格设计:内外盒之间采用栅格设计,有利于空气流动。
③加热包内含有铁粉、铝粉、焦炭粉、生石灰等物质,其中的金属粉末与碳粉在热水中能发生氧化并缓慢放热。
请结合上述材料和学过的科学知识解释:
(1)、“自热火锅”能快速加热食材并保温的工作原理。(2)、为什么要设置带小孔的盒盖?