高考二轮复习知识点:物质的量与其浓度和气体摩尔体积的综合应用
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 下列说法正确的是( )A、 (标准状况)与水充分反应转移 电子 B、 和 均可通过化合反应得到 C、将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生 D、 与 溶液反应:2. 以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是( )A、放电过程中,K+均向负极移动 B、放电过程中,KOH物质的量均减小 C、消耗等质量燃料,(CH3)2NNH2—O2燃料电池的理论放电量最大 D、消耗1molO2时,理论上N2H4—O2燃料电池气体产物的体积在标准状况下为11.2L3. NA是阿伏加德罗常数的值。下列说法正确的是( )A、22.4 L(标准状况)氮气中含有7NA个中子 B、1 mol重水比1 mol水多NA个质子 C、12 g石墨烯和12 g金刚石均含有NA个碳原子 D、1 L 1 mol·L−1 NaCl溶液含有28NA个电子4. NA代表阿伏加德罗常数的值,下列说法正确的是()A、常温常压下,124g P4中所含P-P键数目为4NA B、100mL 1mol·L-1 FeCl3溶液中所含Fe3+的数目为0.1NA C、标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA D、密闭容器中,2mol SO2 和1mol O2催化反应后分子总数为2NA5. 某科研机构研发的NO—空气燃料电池的工作原理如图所示,下列叙述正确的是
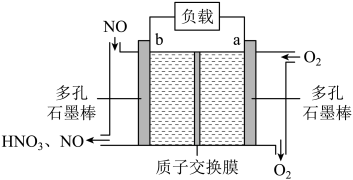 A、a电极为电池负极 B、电池工作时透过质子交换膜从右向左移动 C、b电极的电极反应: D、当外电路中通过电子时,a电极处消耗6. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、0.1mol环氧乙烷(
A、a电极为电池负极 B、电池工作时透过质子交换膜从右向左移动 C、b电极的电极反应: D、当外电路中通过电子时,a电极处消耗6. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、0.1mol环氧乙烷( )中含有共价键的总数为0.3NA
B、1molD2O比1molH2O多NA个质子
C、2.8gN2与CO混合气体中含有分子数为0.1NA
D、16.25g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
7. 下列说法正确的是( )A、标准状况下,的体积为22.4L B、同温同压下,等体积的和CO所含分子数相同 C、丁烷所含碳原子数是相同质量乙烷的2倍 D、的盐酸中, 为8. 室温下过氧化铬()在硝酸酸化的戊醇中会溶解并发生反应:。在5m1的过氧化铬戊醇溶液中滴入一定量的稀硝酸,在不同时刻测得过氧化铬浓度如下表:
)中含有共价键的总数为0.3NA
B、1molD2O比1molH2O多NA个质子
C、2.8gN2与CO混合气体中含有分子数为0.1NA
D、16.25g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA
7. 下列说法正确的是( )A、标准状况下,的体积为22.4L B、同温同压下,等体积的和CO所含分子数相同 C、丁烷所含碳原子数是相同质量乙烷的2倍 D、的盐酸中, 为8. 室温下过氧化铬()在硝酸酸化的戊醇中会溶解并发生反应:。在5m1的过氧化铬戊醇溶液中滴入一定量的稀硝酸,在不同时刻测得过氧化铬浓度如下表:时间/min
4
6
8
10
t
20
25
35
4.230
2.510
1.790
1.350
1.240
1.130
1.110
1.100
下列叙述正确的是( )
A、4~6min内过氧化铬分解的平均速率 B、8~10min内过氧化铬分解释放的体积为0.86mL(标准状况) C、推测表中t的取值范围为:10<15 D、若升高温度后重新实验发现20min时过氧化铬浓度为 , 则证明反应的△H>09. 侯氏制碱法涉及的主要反应为 。 为阿伏加德罗常数的值,下列有关说法错误的是( )A、标准状况下,5.6L 的分子数为0.25 B、1个 晶胞的质量为 C、1L0.1 溶液中NH 数目小于0.1 D、反应消耗0.1 析出 数目为0.110. 常温下,向100mL0.1mol·L-1H2S溶液中缓慢通入SO2气体,可发生反应2H2S+SO2=3S↓+2H2O。下列关于该过程的说法错误的是( )A、pH先增大后减小,最终保持不变 B、恰好完全反应时,反应消耗112mLSO2(标准状况) C、 的值减小 D、0.1mol·L-1H2S溶液中:c(H+)=c(HS-)+2c(S2-)+c(OH-)11. 多伦多大学EdwardSargent教授团队研发了一种将乙烯高效转化为环氧乙烷的电化学合成方法。反应在KCl电解液的流动池中进行,示意图如图。电解结束后,将阴阳极电解液输出混合,便可生成环氧乙烷。下列说法正确的是( ) A、泡沫镍电极连接电源负极 B、铂箔电极附近溶液pH下降 C、该过程的总反应为CH2=CH2+HOCl→
A、泡沫镍电极连接电源负极 B、铂箔电极附近溶液pH下降 C、该过程的总反应为CH2=CH2+HOCl→ +HCl
D、当电路中通过1mol电子时,铂箔电极上会产生11.2L气体(标准状况)
12. 合成氨是催化界的经典反应,数次诺贝尔奖的获得,说明其从工业应用到机理认识都有着重要意义。当前,利用电化学手段进行氨的合成是人类化学控制合成的新目标,一种电化学合成氨的装置(惰性电极)示意图如图所示。下列说法正确的是( )
+HCl
D、当电路中通过1mol电子时,铂箔电极上会产生11.2L气体(标准状况)
12. 合成氨是催化界的经典反应,数次诺贝尔奖的获得,说明其从工业应用到机理认识都有着重要意义。当前,利用电化学手段进行氨的合成是人类化学控制合成的新目标,一种电化学合成氨的装置(惰性电极)示意图如图所示。下列说法正确的是( )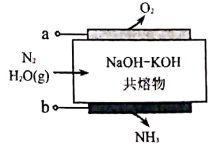 A、 电极连接电源的负极 B、 电极的电极反应式为: C、当有 生成时,理论上产生 D、电流从 极经共熔物到 极,再经电源流回 极13. 二茂铁(
A、 电极连接电源的负极 B、 电极的电极反应式为: C、当有 生成时,理论上产生 D、电流从 极经共熔物到 极,再经电源流回 极13. 二茂铁( )广泛应用于航天化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( )
)广泛应用于航天化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( )  A、Fe与电源的正极相连 B、流程中生成催化剂金属钠,金属钠能与水发生反应,因此DMF溶液不能用水代替 C、该过程中理论上产生11.2 L的H2消耗1 mol环戊二烯 D、二茂铁制备过程中阴极的电极反应为2H++2e-=H2↑14. NA是阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,22.4 L CHCl3中分子数为NA B、常温常压下,28gN2含有的原子数为2NA C、1L0.1mol•L−1CH3COOH的水溶液中含氧原子数为0.2NA D、常温下,28g铁片投入足量浓H2SO4中生成SO2为0.5NA15. 某海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
A、Fe与电源的正极相连 B、流程中生成催化剂金属钠,金属钠能与水发生反应,因此DMF溶液不能用水代替 C、该过程中理论上产生11.2 L的H2消耗1 mol环戊二烯 D、二茂铁制备过程中阴极的电极反应为2H++2e-=H2↑14. NA是阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,22.4 L CHCl3中分子数为NA B、常温常压下,28gN2含有的原子数为2NA C、1L0.1mol•L−1CH3COOH的水溶液中含氧原子数为0.2NA D、常温下,28g铁片投入足量浓H2SO4中生成SO2为0.5NA15. 某海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )离子
含量
9360
83
200
1100
16000
1200
118
 A、甲室的电极反应式为: B、乙室和丁室中部分离子的浓度增大,淡水的出口为b C、当戊室收集到 (标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol D、淡化过程中易在戊室形成水垢16. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )A、常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中阳离子的数目相等 B、标准状况下,22.4LHF所含有的分子数目为NA C、常温常压下,NO2与N2O4的混合气体46g,原子总数为3NA D、0.1mol-NH2(氨基)中所含有的电子数为NA17. 是阿伏加德罗常数的值,下列说法正确的是( )A、23 g Na在氧气中充分燃烧生成 ,转移电子数为2 B、 的NaOH溶液中,含有 的数日为0.01 C、电子数为 的 分子的质量为1.6g D、标准状况下,3.36 L的 中含有氧原子的数目为0.4518. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,1mol -OH中含有9NA个电子 B、在精炼铜的过程中,当阳极有32g铜参加反应时转移电子数为NA C、常温下,0.1mol环氧乙烷(
A、甲室的电极反应式为: B、乙室和丁室中部分离子的浓度增大,淡水的出口为b C、当戊室收集到 (标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol D、淡化过程中易在戊室形成水垢16. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )A、常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中阳离子的数目相等 B、标准状况下,22.4LHF所含有的分子数目为NA C、常温常压下,NO2与N2O4的混合气体46g,原子总数为3NA D、0.1mol-NH2(氨基)中所含有的电子数为NA17. 是阿伏加德罗常数的值,下列说法正确的是( )A、23 g Na在氧气中充分燃烧生成 ,转移电子数为2 B、 的NaOH溶液中,含有 的数日为0.01 C、电子数为 的 分子的质量为1.6g D、标准状况下,3.36 L的 中含有氧原子的数目为0.4518. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,1mol -OH中含有9NA个电子 B、在精炼铜的过程中,当阳极有32g铜参加反应时转移电子数为NA C、常温下,0.1mol环氧乙烷( )中含有的共价键数目为0.3NA
D、1L0.5mol/LpH=7的CH3COONH4溶液中 数目为0.5NA
19. 设NA为阿伏加德罗常数的值,下列说法中正确的是( )A、常温常压下,2.24 L H2O中含有极性共价键的数目为0.2NA B、0.1 mol·L-1NH4Cl溶液中含有NH
)中含有的共价键数目为0.3NA
D、1L0.5mol/LpH=7的CH3COONH4溶液中 数目为0.5NA
19. 设NA为阿伏加德罗常数的值,下列说法中正确的是( )A、常温常压下,2.24 L H2O中含有极性共价键的数目为0.2NA B、0.1 mol·L-1NH4Cl溶液中含有NH 的数目小于0.1NA
C、100 mL 12 mol·L-1的浓HNO3与过量Cu反应转移电子的数目为0.6NA
D、标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA
20. 常温下,将一定量的氯气通入100mL4mol·L-1的氢氧化钠溶液中,发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。充分反应后,下列说法正确的是(NA为阿伏加德罗常数)( )A、当通入的Cl2为2.24L时,反应中电子转移数目为0.1NA B、当电子转移数目为0.2NA时,溶液质量增加14.2g C、当溶液中Na+为0.4NA时,溶液中的Cl-为0.2NA D、当溶液质量增加7.1g时,溶液中ClO-为0.1NA21. NA是阿伏加德罗常数的值。下列说法正确的是( )A、1 mol K2Cr2O7被还原为Cr3+转移的电子数为3N B、0.1 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为0.1 NA C、常温常压下,124 g P4中所含P-P键数目4 NA D、标准状况下,22.4 L丙烷中所含共价键数目为10 NA22. 下列各物质所包含的原子物质的量最多的是(NA表示阿伏加德罗常数)( )A、44gCO2气体 B、标准状况下44.8LH2 C、18g水 D、2NA个NH3分子23. 设NA为阿伏加德罗常数的值。下列关于常温下0.1mol/LNa2S2O3溶液与pH=1的H2SO4溶液的说法正确的是( )A、1LpH=1的H2SO4溶液中,含H+的数目为0.2NA B、98g纯H2SO4中离子数目为3NA C、含0.1molNa2S2O3的水溶液中阴离子数目大于0.1NA D、Na2S2O3与H2SO4溶液混合产生22.4L气体时转移的电子数为2NA24. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )A、30g乙酸和葡萄糖混合物中的氢原子数为2NA B、2molSO2与3molO2反应生成的SO3分子数为2NA C、标准状况下,2.24LC2H6含有的共价键数为0.6NA D、常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12NA25. 设NA为阿伏加德罗常数的数值。下列说法正确的是( )A、标准状况下,22.4L苯中含有的碳氢键数目为6NA B、标准状况下,22.4LNO与11.2L 的O2组成的混合气体中含有的原子数为3NA C、25℃时,pH=1的CH3COOH溶液中含有的H+数目等于0.1NA D、已知反应: Cu2S+O2 2Cu+SO2 , 每生成1molCu转移的电子数为2NA26. 设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4L的H2和22.4L的F2混合后,气体分子数为2NA B、0.3mol二氧化氮与水反应转移电子数为0.2NA C、1L2mol·L-1的 NaHCO3溶液中所含H原子数为2NA D、0.1mol的NO与足量O2的混合物中含有的N原子数为0.2NA27. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,5.6L.Cl2与足量NaOH反应转移的电子数为0.25NA B、室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA C、氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA D、5NH4NO3 2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA28. 设NA为阿伏加德罗常数的值.下列说法正确的是( )A、一定条件下,将1molN2和3molH2混合发生反应,转移的电子总数为6NA B、1L0.1mol•L﹣1的Na2CO3溶液中阴离子的总数大于0.1NA C、向FeI2溶液中通入适量Cl2 , 当有2molFe2+被氧化时,消耗Cl2的分子数为NA D、1mol﹣CH3中所含的电子总数为10NA29. 用NA表示阿伏加德罗常数的值,下列说法正确的是( )A、20 g D2O 含有的质子数为10NA B、1mol Na2O2与足量水反应转移的电子数为NA , 生成的气体在标况下的体积为22.4L C、1L 0.1mol/L HF溶液中含有共价键数目为0.1 NA D、NA个Fe(OH)3胶体粒子的质量为107g
的数目小于0.1NA
C、100 mL 12 mol·L-1的浓HNO3与过量Cu反应转移电子的数目为0.6NA
D、标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA
20. 常温下,将一定量的氯气通入100mL4mol·L-1的氢氧化钠溶液中,发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。充分反应后,下列说法正确的是(NA为阿伏加德罗常数)( )A、当通入的Cl2为2.24L时,反应中电子转移数目为0.1NA B、当电子转移数目为0.2NA时,溶液质量增加14.2g C、当溶液中Na+为0.4NA时,溶液中的Cl-为0.2NA D、当溶液质量增加7.1g时,溶液中ClO-为0.1NA21. NA是阿伏加德罗常数的值。下列说法正确的是( )A、1 mol K2Cr2O7被还原为Cr3+转移的电子数为3N B、0.1 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为0.1 NA C、常温常压下,124 g P4中所含P-P键数目4 NA D、标准状况下,22.4 L丙烷中所含共价键数目为10 NA22. 下列各物质所包含的原子物质的量最多的是(NA表示阿伏加德罗常数)( )A、44gCO2气体 B、标准状况下44.8LH2 C、18g水 D、2NA个NH3分子23. 设NA为阿伏加德罗常数的值。下列关于常温下0.1mol/LNa2S2O3溶液与pH=1的H2SO4溶液的说法正确的是( )A、1LpH=1的H2SO4溶液中,含H+的数目为0.2NA B、98g纯H2SO4中离子数目为3NA C、含0.1molNa2S2O3的水溶液中阴离子数目大于0.1NA D、Na2S2O3与H2SO4溶液混合产生22.4L气体时转移的电子数为2NA24. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )A、30g乙酸和葡萄糖混合物中的氢原子数为2NA B、2molSO2与3molO2反应生成的SO3分子数为2NA C、标准状况下,2.24LC2H6含有的共价键数为0.6NA D、常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12NA25. 设NA为阿伏加德罗常数的数值。下列说法正确的是( )A、标准状况下,22.4L苯中含有的碳氢键数目为6NA B、标准状况下,22.4LNO与11.2L 的O2组成的混合气体中含有的原子数为3NA C、25℃时,pH=1的CH3COOH溶液中含有的H+数目等于0.1NA D、已知反应: Cu2S+O2 2Cu+SO2 , 每生成1molCu转移的电子数为2NA26. 设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4L的H2和22.4L的F2混合后,气体分子数为2NA B、0.3mol二氧化氮与水反应转移电子数为0.2NA C、1L2mol·L-1的 NaHCO3溶液中所含H原子数为2NA D、0.1mol的NO与足量O2的混合物中含有的N原子数为0.2NA27. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,5.6L.Cl2与足量NaOH反应转移的电子数为0.25NA B、室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA C、氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA D、5NH4NO3 2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA28. 设NA为阿伏加德罗常数的值.下列说法正确的是( )A、一定条件下,将1molN2和3molH2混合发生反应,转移的电子总数为6NA B、1L0.1mol•L﹣1的Na2CO3溶液中阴离子的总数大于0.1NA C、向FeI2溶液中通入适量Cl2 , 当有2molFe2+被氧化时,消耗Cl2的分子数为NA D、1mol﹣CH3中所含的电子总数为10NA29. 用NA表示阿伏加德罗常数的值,下列说法正确的是( )A、20 g D2O 含有的质子数为10NA B、1mol Na2O2与足量水反应转移的电子数为NA , 生成的气体在标况下的体积为22.4L C、1L 0.1mol/L HF溶液中含有共价键数目为0.1 NA D、NA个Fe(OH)3胶体粒子的质量为107g二、非选择题
-
30. 化合物X(只含有一种阳离子)由三种短周期元素组成,按照如下流程进行实验。已知固体A为一种单质和一种化合物的混合物,溶液C的焰色反应星黄色。
 (1)、E的化学式为 , 化合物X中阴离子的电子式为。(2)、写出确定气体B的依据:。(3)、上述流程中溶液C生成白色沉淀D的离子方程式为。(4)、化合物X在加热条件下可将CuO还原成Cu,反应化学方程式为。A中的化合物在加热条件下也可以将CuO还原成Cu,取足量A中的化台物与W g CuO(设CuO完全反应)共热,请设计实验证明还原产物的组成。(提示:CuO的还原产物可能为 , 在酸性条件下不稳定,发生反应为)31.(1)、全固态锂离子电池的结构如图所示,放电时电池反应为 2Li+MgH2=Mg+2LiH。放电时,X 极作极。充电时,Y 极反应式为。
(1)、E的化学式为 , 化合物X中阴离子的电子式为。(2)、写出确定气体B的依据:。(3)、上述流程中溶液C生成白色沉淀D的离子方程式为。(4)、化合物X在加热条件下可将CuO还原成Cu,反应化学方程式为。A中的化合物在加热条件下也可以将CuO还原成Cu,取足量A中的化台物与W g CuO(设CuO完全反应)共热,请设计实验证明还原产物的组成。(提示:CuO的还原产物可能为 , 在酸性条件下不稳定,发生反应为)31.(1)、全固态锂离子电池的结构如图所示,放电时电池反应为 2Li+MgH2=Mg+2LiH。放电时,X 极作极。充电时,Y 极反应式为。 (2)、电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
(2)、电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。
①阳极的电极反应式为
②简述浓缩室中得到浓乳酸的原理:
③电解过程中,采取一定的措施可控制阳极室的 pH 约为 6~8,此时进入浓缩室的OH-可忽略不计。400 mL 10 g∙L −1 乳酸溶液通电一段时间后,浓度上升为 145 g∙L −1 (溶液体积变化忽略不计),阴极上产生的 H2 在标准状况下的体积约为L。(乳酸的摩尔质量为90 g•mol-1)
32. 实验室中常用二氧化锰与浓盐酸共热制取氯气。某化学兴趣小组为制取较为纯净、干燥的氯气,设计了如下实验装置。
请按要求回答下列问题:
(1)、仪器X的名称为 , 其中发生反应的化学方程式为。(2)、欲除去中的HCl,装置B中应选用的试剂为(填序号)。a.饱和食盐水 b.饱和氢氧化钠溶液 c.饱和亚硫酸钠溶液
(3)、进入装置B的中含有的杂质,除HCl外还有(填化学式)。欲除去该杂质,装置C中盛放的试剂名称为。(4)、装置D中的一处明显不正确为。(5)、装置E中的试剂为 , 其作用为。(6)、加热150mL12mol/L溶液和3.48g粉末的混合物,若反应充分进行,则理论上可产生的在标准状况下的体积为mL。33. 向含有一定量盐酸和的混合溶液中逐滴滴加溶液,产生沉淀的质量m与加入的物质的量n之间的关系如图所示,按要求填空: (1)、段产生的沉淀为(填写化学式)。(2)、原混合溶液中。34. 化学与人类生活、生产和社会可持续发展密切相关,请回答下列问题。(1)、Ⅰ春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。
(1)、段产生的沉淀为(填写化学式)。(2)、原混合溶液中。34. 化学与人类生活、生产和社会可持续发展密切相关,请回答下列问题。(1)、Ⅰ春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入气体的化学方程式。
(2)、用的溶液吸收 , 所得溶液中和物质的量浓度之比为。(3)、Ⅱ.如图为铁及其化合物的“价一类”二维图。
图中①处填 , ②处填。
(4)、某小组在探究性质的实验(实验1)时,观察到溶液变红,片刻红色褪去,有气体生成。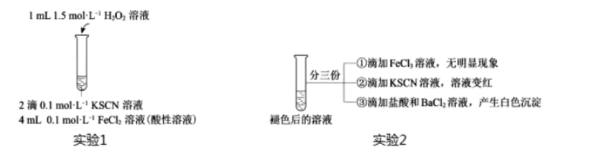
用实验2探究“红色褪去”的原因,则红色褪去的原因是。
35. 固体化合物X由3种元素组成.某学习小组进行了如下实验:
已知:A为二元化合物,其标况下的密度2.86g/L;Z加盐酸得到蓝色溶液:B加硫酸产生白色沉淀。请回答:
(1)、A的分子式。(2)、化合物X含有元素(填元素符号),X的化学式。(3)、实验室常将通过热的固体Z制备氮气,该反应的化学方程式是。36. 完成下列问题。(1)、常温常压下,用等质量的、CO、、四种气体分别吹出四个气球。其中气体为的是____(填序号)。A、 B、
B、 C、
C、 D、
D、 (2)、在标准状况下,2.24L由、组成的混合气体中含有的氮元素的质量约为。(3)、在0.1L由KCl、、形成的植物营养液中, , , , 向混合溶液中滴加足量的溶液后产生沉淀的物质的量为。(4)、在干燥烧瓶中用向下排空气法收集氨气(已知:空气不可能排净,空气的平均相对分子质量为29,瓶内气体对氢气的相对密度为9.5,氨气极易溶于水),将此瓶气体倒置于水槽中,烧瓶内液面上升的体积占烧瓶总体积的。(5)、100mL0.3溶液(密度为 , )和50mL0.2溶液(密度为)的混合,所得密度为的混合溶液中的浓度为(用含d1、d2、d3的式子表示)。
(2)、在标准状况下,2.24L由、组成的混合气体中含有的氮元素的质量约为。(3)、在0.1L由KCl、、形成的植物营养液中, , , , 向混合溶液中滴加足量的溶液后产生沉淀的物质的量为。(4)、在干燥烧瓶中用向下排空气法收集氨气(已知:空气不可能排净,空气的平均相对分子质量为29,瓶内气体对氢气的相对密度为9.5,氨气极易溶于水),将此瓶气体倒置于水槽中,烧瓶内液面上升的体积占烧瓶总体积的。(5)、100mL0.3溶液(密度为 , )和50mL0.2溶液(密度为)的混合,所得密度为的混合溶液中的浓度为(用含d1、d2、d3的式子表示)。