高考二轮复习知识点:阿伏加德罗常数1
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 为阿伏加德罗常数的值。下列叙述正确的是A、异丁烷分子中共价键的数目为 B、标准状况下,中电子的数目为 C、的溶液中的数目为 D、的溶液中的数目为2. 设为阿伏加德罗常数的值。下列说法正确的是( )A、中含有的中子数为 B、分子中含有的键数目为 C、标准状况下,气体中数目为 D、的溶液中数目为3. 常温常压下,电化学还原制氨气的总反应方程式: , 设为阿伏加德罗常数的值,下列说法正确的是( )A、水中含有的孤电子对数为 B、每产生失去的电子数为 C、氨水中,含有的分子数少于 D、消耗(已折算为标况)时,产生的分子数为4. 工业上用N2和H2合成NH3 , NA代表阿伏加德罗常数的值,下列说法正确的是( )A、消耗14gN2生成NH3分子数为2 NA B、消耗1molH2 , 生成N-H键数为2 NA C、生成标准状况下22.4LNH3 , 电子转移数为2 NA D、氧化1molNH3生成NO,需O2分子数为2 NA5. NA是阿伏加德罗常数的值。下列说法正确的是( )A、3.9gNa2O2与足量水反应,转移电子个数为0.1NA B、1.2gMg在空气中燃烧生成MgO和Mg3N2 , 转移电子个数为0.1NA C、2.7gAl与足量NaOH溶液反应,生成H2的个数为0.1NA D、6.0gSiO2与足量NaOH溶液反应,所得溶液中SiO的个数为0.1NA6. NA表示阿伏加德罗常数,下列有关物质结构说法正确的是( )A、NaH的电子式为:
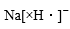 B、78克Na2O2晶体中所含阴阳离子总数为3NA
C、CCl4和PCl5分子中所有原子的最外层都达到了8电子稳定结构
D、浓硫酸溶于水电离出H+和SO并放出大量的热,所以浓硫酸溶于水属于放热反应
7. 设NA为阿伏加德常数的值,下列说法正确的是( )A、1 mol Na2O2固体中含离子总数为4NA B、标准状况下,22.4 L氨水含有NA个NH3分子 C、丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA D、室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA8. 为阿伏加德罗常数的值。下列叙述中正确的是A、中含有的键的数目为 B、标准状况下,和在光照下充分反应后的分子数为 C、固体含有的离子数目为 D、一定条件下,5.6gFe与充分反应,转移的电子数为9. 设NA为阿伏加德罗常数的值,下列说法错误的是A、标准状况下,2.24L丙烯中含有的σ键数目为0.8NA B、6.0gSiO2与足量HF溶液充分反应,生成SiF4的数目为0.1NA C、1.2gNaHSO4晶体中含有的数目为0.01NA D、5.6gFe与3.55g氯气充分反应后转移的电子数目为0.1NA10. 设NA为阿伏加德罗常数的值,下列说法正确的是A、1.0L1mol/LAlCl3溶液中,Al3+的数目为1.0NA B、0.2mol苯含有双键的数目为0.6NA C、电解熔融CuCl2 , 阴极增重3.2g,外电路中通过电子的数目为0.1NA D、标准状况下22.4LSO3的质量为80g11. 表示阿伏加德罗常数的值,下列叙述正确的是A、一定条件下,5.6 g Fe与足量S反应,转移个电子 B、常温下,溶液中阴离子总数等于 C、电解精炼铜时每转移个电子,阳极质量一定减少32 g D、常温常压下,6 g 晶体中所含硅氧键数目为12. 为阿伏加德罗常数的值.下列叙述正确的是A、金刚石中键的数目为 B、与足量水反应,转移电子数为 C、常温下,的溶液中,发生电离的水分子数为 D、含的溶液中含有的氧原子数为13. 科学家发现某些生物酶能将海洋中的转化为 , 该过程的总反应为。设为阿伏加德罗常数的值,下列说法正确的是A、溶液中含离子的数目为 B、标准状况下,中含键的数目为 C、18克中含电子对的数目为 D、完全反应失去电子的数目为14. 已知:。代表阿伏加德罗常数的值,下列说法错误的是A、生成电子转移数为 B、消耗生成CO分子数为 C、生成标准状况下 , 断开C-H键数为 D、消耗所生成的气体完全燃烧,需要分子数为15. 工业合成氨常选择 , 为阿伏加德罗常数的值,下列说法正确的是A、1 mol完全反应,转移的电子数为3 B、混合气中物质的沸点由高到低的顺序为 C、物质的量之比为1∶1的和的混合气体所含原子数目为4 D、反应物断裂个σ键同时生成物断裂个σ键,反应达到平衡状态16. 侯氏制碱法中涉及反应: , 是阿伏加德罗常数的值,下列说法正确的是A、17 g 溶于水所得溶液中和数目之和为 B、1 mol 晶体中所含数目为 C、常温常压下,44 g 所含分子数目为 D、0.1 mol⋅L溶液中所含配位键数目为17. 设NA为阿伏加德罗常数的值,下列说法正确的是A、标准状况下,生成2.24LO2转移的电子数为0.4NA B、2L1mol·L-1的氯化铜溶液中H+数目为4NA C、常温下,5.6g铁与足量稀硝酸反应转移的电子数为0.3NA D、2LpH=5的0.05mol·L-1K2Cr2O7溶液中数目为0.1NA18. 设为阿伏加德罗常数的值,下列说法正确的是A、溶液中所含数目为 B、和充分反应后,所含分子数目小于 C、环氧乙烷(
B、78克Na2O2晶体中所含阴阳离子总数为3NA
C、CCl4和PCl5分子中所有原子的最外层都达到了8电子稳定结构
D、浓硫酸溶于水电离出H+和SO并放出大量的热,所以浓硫酸溶于水属于放热反应
7. 设NA为阿伏加德常数的值,下列说法正确的是( )A、1 mol Na2O2固体中含离子总数为4NA B、标准状况下,22.4 L氨水含有NA个NH3分子 C、丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA D、室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA8. 为阿伏加德罗常数的值。下列叙述中正确的是A、中含有的键的数目为 B、标准状况下,和在光照下充分反应后的分子数为 C、固体含有的离子数目为 D、一定条件下,5.6gFe与充分反应,转移的电子数为9. 设NA为阿伏加德罗常数的值,下列说法错误的是A、标准状况下,2.24L丙烯中含有的σ键数目为0.8NA B、6.0gSiO2与足量HF溶液充分反应,生成SiF4的数目为0.1NA C、1.2gNaHSO4晶体中含有的数目为0.01NA D、5.6gFe与3.55g氯气充分反应后转移的电子数目为0.1NA10. 设NA为阿伏加德罗常数的值,下列说法正确的是A、1.0L1mol/LAlCl3溶液中,Al3+的数目为1.0NA B、0.2mol苯含有双键的数目为0.6NA C、电解熔融CuCl2 , 阴极增重3.2g,外电路中通过电子的数目为0.1NA D、标准状况下22.4LSO3的质量为80g11. 表示阿伏加德罗常数的值,下列叙述正确的是A、一定条件下,5.6 g Fe与足量S反应,转移个电子 B、常温下,溶液中阴离子总数等于 C、电解精炼铜时每转移个电子,阳极质量一定减少32 g D、常温常压下,6 g 晶体中所含硅氧键数目为12. 为阿伏加德罗常数的值.下列叙述正确的是A、金刚石中键的数目为 B、与足量水反应,转移电子数为 C、常温下,的溶液中,发生电离的水分子数为 D、含的溶液中含有的氧原子数为13. 科学家发现某些生物酶能将海洋中的转化为 , 该过程的总反应为。设为阿伏加德罗常数的值,下列说法正确的是A、溶液中含离子的数目为 B、标准状况下,中含键的数目为 C、18克中含电子对的数目为 D、完全反应失去电子的数目为14. 已知:。代表阿伏加德罗常数的值,下列说法错误的是A、生成电子转移数为 B、消耗生成CO分子数为 C、生成标准状况下 , 断开C-H键数为 D、消耗所生成的气体完全燃烧,需要分子数为15. 工业合成氨常选择 , 为阿伏加德罗常数的值,下列说法正确的是A、1 mol完全反应,转移的电子数为3 B、混合气中物质的沸点由高到低的顺序为 C、物质的量之比为1∶1的和的混合气体所含原子数目为4 D、反应物断裂个σ键同时生成物断裂个σ键,反应达到平衡状态16. 侯氏制碱法中涉及反应: , 是阿伏加德罗常数的值,下列说法正确的是A、17 g 溶于水所得溶液中和数目之和为 B、1 mol 晶体中所含数目为 C、常温常压下,44 g 所含分子数目为 D、0.1 mol⋅L溶液中所含配位键数目为17. 设NA为阿伏加德罗常数的值,下列说法正确的是A、标准状况下,生成2.24LO2转移的电子数为0.4NA B、2L1mol·L-1的氯化铜溶液中H+数目为4NA C、常温下,5.6g铁与足量稀硝酸反应转移的电子数为0.3NA D、2LpH=5的0.05mol·L-1K2Cr2O7溶液中数目为0.1NA18. 设为阿伏加德罗常数的值,下列说法正确的是A、溶液中所含数目为 B、和充分反应后,所含分子数目小于 C、环氧乙烷(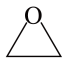 )中所含键数目为
D、常温常压下,乙醇中所含杂化的原子数目为
19. 甲酸甲酯常用作杀菌剂、熏蒸剂和烟草处理剂,可由甲酸和甲醇反应制得。NA为阿伏加德罗常数的值。下列有关说法正确的是A、pH=3的甲酸溶液中氢离子数目为1×10-3NA B、0.5 mol甲酸甲酯中含有sp3杂化的原子数目为NA C、50g质量分数为64%的甲醇水溶液中含有σ键数目为5NA D、甲醇燃料电池中,每消耗22.4L(标准状况)甲醇,转移电子数目为6NA20. 设为阿伏加德罗常数的值,下列说法正确的是A、的溶液中的数目小于 B、中价电子总数为 C、标准状况下,中含有的键数为 D、浓盐酸与反应,产生分子数为21. 为阿伏加德罗常数,下列叙述中正确的是( )A、常温常压下,与混合气体共含个氧原子 B、标准状况下,22.4L乙烯中含有的键数目为 C、密闭容器中,与充分反应生成HI(g),容器内分子数小于 D、常温下与过量稀NaOH溶液反应,转移的电子总数为22. 已知NA为阿伏加德罗常数的值。当反应3Cl2(g)+CS2(g)=CCl4(g)+S2Cl2(g)生成1molS2Cl2(g)时,下列叙述错误的是( )A、反应中断裂的Cl-Cl键数目为3NA B、反应中转移的电子数目为6NA C、生成的CCl4的体积约为11.2L D、反应后气体分子数目减少2NA23. 设是阿伏加德罗常数的值,催化氧化脱硫的工作原理: , 时,。下列说法正确的是( )A、水中含有的氢键数为2 B、每生成 , 失去的电子数为 C、氢氧化铁的悬浊液中,若时,悬浊液中的数目为 D、反应中每产生 , 消耗数目24. 设为阿伏加德罗常数的值,下列说法正确的是( )A、质量分数为46%的乙醇溶液中,含键的数目为 B、晶体含有离子总数为 C、含的浓硫酸与足量的镁反应,转移的电子数为 D、常温下,的溶液中,的数目为25. 设NA表示阿伏加德罗常数值,下列叙述一定正确的是( )A、28g14CO中含有中子数为14NA B、1mol O2与一定量甲烷反应转移电子数目为4NA C、1L浓度为0.1 mol∙L−1Na2CO3溶液中阴离子数目为0.1NA D、28g C2H4和C3H6混合物中含有共用电子对数目6NA26. 设NA为阿伏加德罗常数值,在现实生活中我们常常利用物质的量来为难以用实际数字描述的数量做了定量解释,下列说法正确的是( )A、将0.1mol醋酸钠溶于稀醋酸中使溶液呈中性,溶液中CH3COO-数目小于0.1NA B、将4.6g钠用铝箔包裹并刺小孔,与足量水充分反应生成H2分子数为0.1NA C、1.5mol的液态冰醋酸中含s-pσ键0个 D、1L1mol·L-1NaCl溶液含有28NA个电子27. 利用电催化实现CO2到C2H5OH的转化,反应原理:6H2+2CO2C2H5OH+3H2O。设NA为阿伏加德罗常数的值,下列有关说法正确的是( )A、11.2L CO2中含分子的数目为0.5 NA B、23gC2H5OH中含共价键的数目为4 NA C、生成1 mol C2H5OH转移电子的数目为8 NA D、4gH2与4gD2所含中子的数目相差NA28. 是阿伏加德罗常数的值。下列说法正确的是A、1mol 中含有Si-O键的数目为2 B、25℃、101kPa下,4g 中含有的原子数为2 C、标准状况下,6.72L 与水充分反应转移的电子数目为0.1 D、25℃时,1.0L 的溶液中含有的数目为0.229. 用NA表示阿伏加德罗常数的值。下列说法正确的是A、4gH2中含有的原子数为NA B、0.1mol碳酸钠和碳酸氢钠的混合物含有的氧原子数为0.3NA C、标准状况下,22.4L乙炔中σ键数为NA、π键数为2NA D、1L0.1mol•L-1的AlCl3溶液中含有的Al3+数为3NA30. 汽车尾气中的碳氢化物与臭氧反应是造成城市光化学污染的主要原因,其中常见的反应为 , 已知为阿伏加德罗常数的值,下列有关说法正确的是A、标准状况下,中所含极性共价健数目为 B、和均为只含非极性键的非极性分子 C、和分子中C原子采取杂化和杂化 D、若有参与反应,则反应中转移的电子数目为31. 设为阿伏加德罗常数的值。下列说法正确的是A、28 g 分子中含有的σ键数目为 B、标准状况下,22.4 L HCl气体中数目为 C、的溶液中OH-数目为 D、2.3 g钠与足量氯气反应,电子转移的数目为32. 为阿伏加德罗常数,下列说法正确的是A、1L的溶液中离子数为 B、11.2L乙烷和丙烯的混合气体中所含碳氢键数为 C、0.1L的溶液中,含有的数目可能为 D、常温下,5.6g铁与的硝酸反应,铁失去的电子数为33. 制备的反应:。设为阿伏加德罗常数的值,下列说法正确的是A、溶液中含的数目为 B、(标准状况下)中含电子数目为 C、中含非极性共价键的数目为 D、完全参加反应,转移电子数为
)中所含键数目为
D、常温常压下,乙醇中所含杂化的原子数目为
19. 甲酸甲酯常用作杀菌剂、熏蒸剂和烟草处理剂,可由甲酸和甲醇反应制得。NA为阿伏加德罗常数的值。下列有关说法正确的是A、pH=3的甲酸溶液中氢离子数目为1×10-3NA B、0.5 mol甲酸甲酯中含有sp3杂化的原子数目为NA C、50g质量分数为64%的甲醇水溶液中含有σ键数目为5NA D、甲醇燃料电池中,每消耗22.4L(标准状况)甲醇,转移电子数目为6NA20. 设为阿伏加德罗常数的值,下列说法正确的是A、的溶液中的数目小于 B、中价电子总数为 C、标准状况下,中含有的键数为 D、浓盐酸与反应,产生分子数为21. 为阿伏加德罗常数,下列叙述中正确的是( )A、常温常压下,与混合气体共含个氧原子 B、标准状况下,22.4L乙烯中含有的键数目为 C、密闭容器中,与充分反应生成HI(g),容器内分子数小于 D、常温下与过量稀NaOH溶液反应,转移的电子总数为22. 已知NA为阿伏加德罗常数的值。当反应3Cl2(g)+CS2(g)=CCl4(g)+S2Cl2(g)生成1molS2Cl2(g)时,下列叙述错误的是( )A、反应中断裂的Cl-Cl键数目为3NA B、反应中转移的电子数目为6NA C、生成的CCl4的体积约为11.2L D、反应后气体分子数目减少2NA23. 设是阿伏加德罗常数的值,催化氧化脱硫的工作原理: , 时,。下列说法正确的是( )A、水中含有的氢键数为2 B、每生成 , 失去的电子数为 C、氢氧化铁的悬浊液中,若时,悬浊液中的数目为 D、反应中每产生 , 消耗数目24. 设为阿伏加德罗常数的值,下列说法正确的是( )A、质量分数为46%的乙醇溶液中,含键的数目为 B、晶体含有离子总数为 C、含的浓硫酸与足量的镁反应,转移的电子数为 D、常温下,的溶液中,的数目为25. 设NA表示阿伏加德罗常数值,下列叙述一定正确的是( )A、28g14CO中含有中子数为14NA B、1mol O2与一定量甲烷反应转移电子数目为4NA C、1L浓度为0.1 mol∙L−1Na2CO3溶液中阴离子数目为0.1NA D、28g C2H4和C3H6混合物中含有共用电子对数目6NA26. 设NA为阿伏加德罗常数值,在现实生活中我们常常利用物质的量来为难以用实际数字描述的数量做了定量解释,下列说法正确的是( )A、将0.1mol醋酸钠溶于稀醋酸中使溶液呈中性,溶液中CH3COO-数目小于0.1NA B、将4.6g钠用铝箔包裹并刺小孔,与足量水充分反应生成H2分子数为0.1NA C、1.5mol的液态冰醋酸中含s-pσ键0个 D、1L1mol·L-1NaCl溶液含有28NA个电子27. 利用电催化实现CO2到C2H5OH的转化,反应原理:6H2+2CO2C2H5OH+3H2O。设NA为阿伏加德罗常数的值,下列有关说法正确的是( )A、11.2L CO2中含分子的数目为0.5 NA B、23gC2H5OH中含共价键的数目为4 NA C、生成1 mol C2H5OH转移电子的数目为8 NA D、4gH2与4gD2所含中子的数目相差NA28. 是阿伏加德罗常数的值。下列说法正确的是A、1mol 中含有Si-O键的数目为2 B、25℃、101kPa下,4g 中含有的原子数为2 C、标准状况下,6.72L 与水充分反应转移的电子数目为0.1 D、25℃时,1.0L 的溶液中含有的数目为0.229. 用NA表示阿伏加德罗常数的值。下列说法正确的是A、4gH2中含有的原子数为NA B、0.1mol碳酸钠和碳酸氢钠的混合物含有的氧原子数为0.3NA C、标准状况下,22.4L乙炔中σ键数为NA、π键数为2NA D、1L0.1mol•L-1的AlCl3溶液中含有的Al3+数为3NA30. 汽车尾气中的碳氢化物与臭氧反应是造成城市光化学污染的主要原因,其中常见的反应为 , 已知为阿伏加德罗常数的值,下列有关说法正确的是A、标准状况下,中所含极性共价健数目为 B、和均为只含非极性键的非极性分子 C、和分子中C原子采取杂化和杂化 D、若有参与反应,则反应中转移的电子数目为31. 设为阿伏加德罗常数的值。下列说法正确的是A、28 g 分子中含有的σ键数目为 B、标准状况下,22.4 L HCl气体中数目为 C、的溶液中OH-数目为 D、2.3 g钠与足量氯气反应,电子转移的数目为32. 为阿伏加德罗常数,下列说法正确的是A、1L的溶液中离子数为 B、11.2L乙烷和丙烯的混合气体中所含碳氢键数为 C、0.1L的溶液中,含有的数目可能为 D、常温下,5.6g铁与的硝酸反应,铁失去的电子数为33. 制备的反应:。设为阿伏加德罗常数的值,下列说法正确的是A、溶液中含的数目为 B、(标准状况下)中含电子数目为 C、中含非极性共价键的数目为 D、完全参加反应,转移电子数为二、多选题
-
34. 设NA为阿伏加德罗常教的值,下列叙述正确的是( )A、18g重水(D2O)所含的电子数为10NA B、常温常压下,0.3mol NO2完全与水反应,转移的电子教为0.2NA C、标准状况下,22.4L CCl4中含有NA个CCl4分子 D、常温下,1L 0.1mol/L CH3COONa溶液中Na+离子数为0.1NA35. 已知含铁元素的几种物质间具有如图转化关系。NA为阿伏加德罗常数的值,下列说法正确的是( )
 A、0.1mol·L-1的Fe2(SO4)3溶液中,含有的数目可能为0.3NA B、当反应a中消耗0.2molHCl时,生成的H2分子数为0.05NA C、5.6gFe与足量硝酸溶液发生反应b,转移的电子数为0.3NA D、向沸水中滴加含0.1molFeCl3的饱和溶液,生成0.1NA个Fe(OH)3胶体粒子36. 设NA代表阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,11.2 L水中含有氢原子数为NA B、通常条件下,14g 含有质子数为6NA C、0.5 mol·L-1的FeCl3溶液中含有Cl-数为1. NA D、3.2 g O2和O3的混合气体中含有氧原子总数为0.2 NA
A、0.1mol·L-1的Fe2(SO4)3溶液中,含有的数目可能为0.3NA B、当反应a中消耗0.2molHCl时,生成的H2分子数为0.05NA C、5.6gFe与足量硝酸溶液发生反应b,转移的电子数为0.3NA D、向沸水中滴加含0.1molFeCl3的饱和溶液,生成0.1NA个Fe(OH)3胶体粒子36. 设NA代表阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,11.2 L水中含有氢原子数为NA B、通常条件下,14g 含有质子数为6NA C、0.5 mol·L-1的FeCl3溶液中含有Cl-数为1. NA D、3.2 g O2和O3的混合气体中含有氧原子总数为0.2 NA