高考二轮复习知识点:物质的量的相关计算5
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 下列叙述正确的是A、24 g 镁与27 g铝中,含有相同的质子数 B、同等质量的氧气和臭氧中,电子数相同 C、1 mol重水与1 mol水中,中子数比为2∶1 D、1 mol乙烷和1 mol乙烯中,化学键数相同2. 利用太阳能分解水制氢,若光解0.02mol水,下列说法正确的是( )A、可生成H2的质量为0.02g B、可生成氢的原子数为2.408×1023个 C、可生成H2的体积为0.224L(标准情况) D、生成H2的量理论上等于0.04mol Na与水反应产生H2的量3. 通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓++2HCl。设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、0.1molBaCl2晶体中所含离子总数为0.2NA B、25℃时,pH=1的HCl溶液中含有H+的数目为0.1NA C、17gH2O2中含有非极性键数目为0.5NA D、生成2.33gBaSO4沉淀时, 转移电子数目为0.01NA4. 设 NA 为阿伏加德罗常数的数值,下列说法正确的是( )A、22.4 L 乙烷中所含的极性共价键数目为 7NA B、某温度下,将 1molCl2 通入足量水中转移电子数为 NA C、常温常压下,3.0 g 含葡萄糖的冰醋酸中含有的原子总数为 0.4NA D、室温下,1LpH 为 13 的 NaOH 溶液和 Ba(OH)2 混合溶液中含 OH-个数为 0.01NA5. 设NA为阿伏加德罗常数的值,下列说法正确的是(Na -23 O -16 )( )A、标准状况下,22.4L己烷中含有分子数目为NA B、1mol/LNaOH溶液中含有Na+数目为NA C、7.8gNa2O2中含有的共价键数目为0.1NA D、将0.5molN2O4充入密闭容器中充分反应转化成NO2的数目为NA6. 设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、14g乙烯和丙烯的混合物中极性键数目为2NA B、标准状况下, 与 在光照条件下反应生成HCl分子数为 C、容器中2molNO与1molO2充分反应,产物的分子数为2NA D、电解精炼铜时阳极减轻32 g,电路中转移电子数目一定为NA7. 设NA为阿伏加德罗常数的值。下列叙述正确的是( )A、过氧化氢分解制得标准状况下2.24LO2 , 转移电子的数目为0.4NA B、1L1mol·L-1 Na2CO3溶液中含有的氧原子数目为3NA C、将0.1molFeCl3滴入沸水形成的胶体粒子的数目为0.1NA D、1mol硝基(—NO2)与46g二氧化氮(NO2)所含的电子数均为23NA8. NA代表阿伏加德罗常数的值。下列说法正确的是( )A、H2S的燃烧热是Q kJ/mol。充分燃烧H2S,当有0.5Q kJ热量放出时,转移的电子数为6NA B、25℃时,500mL pH=11的碳酸钠溶液中,由水电离出的OH-数目为0.0005 NA C、pH=2的H3PO4溶液中,H+的数目为0.01NA D、0.10 L 2.0 mol·L-1的NaHCO3溶液中HCO3-和CO32-的离子数之和为0.2NA9. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,2. 24L Hl3CHO含中子数为1.5NA B、7. 1g Cl2通入5L水中反应转移的电子数为0.1NA C、含S2-、HS-共1mol的Na2S溶液中含Na+数目为2NA D、10 g质量分数为17%的H2O2水溶液中含氧原子数目为0.1NA10. 设NA为阿伏加德罗常数值。下列有关叙述错误的是( )A、常温常压下,1 mol氦气中含有的质子数为2NA B、l0g46%乙醇水溶液中所含氧原子数为0.4NA C、1 L1mol/LNa2CO3溶液中,阴离子总数小于NA D、浓硝酸热分解生成NO2、N2O4共23g,转移电子数为0.5NA11. NA为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,0.1 mol Cl2溶于水,转移的电子数目为 0.1 NA B、1 L 0.1 mol/L的 H2SO4溶液中氧原子的总数大于 0.4 NA C、58.5 g氯化钠晶体中含有 NA个氯化钠分子 D、120 g NaHSO4晶体中阳离子和阴离子的总数为 3 NA12. 向含H2S、Fe2+、Br-、I-各0.1 mol的溶液中通入Cl2 , 通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是( )A、
 B、
B、 C、
C、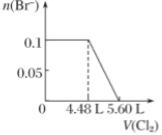 D、
D、 13. 用NA表示阿伏加德罗常数的数值,下列说法中不正确的是( )A、20gD2O含有的电子数为10NA B、标准状况下,22.4LCl2通入足量NaOH溶液中,完全反应时转移的电子数为2NA C、1L0.1mol·L-1NH4NO3溶液中的氮原子数为0.2NA D、25℃时,1.0LpH=12的NaClO溶液中由水电离出的OH-的数目为0.01NA14. NA代表阿伏加德罗常数的值。下列说法正确的是A、14g乙烯和丙烯混合物中含原子数目为2NA( ) B、50gKHCO3和CaCO3混合物含离子数目为2NA C、23gNa与O2完全反应生成Na2O和Na2O2的混合物,转移的电子数目为NA D、铜一锌原电池(电解质为稀硫酸)的电路中每转移2NA个电子,正极生成22.4LH215. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,20g氖气所含有的原子数目为0.5NA B、2.8铁粉与50mL4 mol·L-1盐酸完全反应转移电子的数目为0.1NA C、标准状况下,22.4 LSO2和SO3混合物中含有的硫原子数目为0.1NA D、28g的C2H4和N2混合气体中含有的原子数为2NA16. 用NA表示阿伏加德罗常数,下列叙述中正确的是( )A、0.1 molKI与0.1 molFeCl3在溶液中反应转移的电子数为0.1NA B、镁条在氮气中完全燃烧,生成50g氮化镁时,有1.5NA共用电子对被破坏 C、3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA D、标况时,22.4L二氯甲烷所含有的分子数为NA17. 某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515。10.1g该样品与50mL1mol/L硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为( )A、78 B、140 C、156 D、17218. 用NA表示阿伏加德罗常数。下列叙述正确的是( )A、标准状况下,22.4LH2O含有的分子数为NA B、常温常压下,1.06gNa2CO3含有的Na+数为0.02NA C、通常状况下,NA个CO2分子占有的体积为22.4L D、物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-数为NA19. 在两个容积相同的容器中,一个盛有NH3气体,另一个盛有H2和O2的混合气体。在同温同压下,两容器内的气体不可能具有相同的( )A、原子数 B、分子数 C、质量 D、电子数20. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、足量MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA B、常温下,224 mL H2O中所含氢氧键的数目约为0.02NA C、0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA D、常温下,1 L pH=11的Na2CO3溶液中由水电离出的H+数目为0.001NA21. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、分子总数为NA的CO、C2H4混合气体其体积约为22.4L,质量为28g B、将1molCl2 通入水中,HClO、Cl-、ClO-粒子数之和为2NA C、2.3克金属钠完全燃烧,转移的电子数为0.1NA D、密闭容器中1molH2(g)与1molI2(g)反应制备HI(g),生成2NA个H-I键22. NA代表阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,1.12 L CCl4含有质子数的数目为3.7NA B、常温常压下,3.0 g含葡萄糖的冰醋酸中含有的原子总数为0.4NA C、常温时,56g Fe与足量浓硝酸反应,转移的电子数目为3NA D、晶体B的结构单元如右图
13. 用NA表示阿伏加德罗常数的数值,下列说法中不正确的是( )A、20gD2O含有的电子数为10NA B、标准状况下,22.4LCl2通入足量NaOH溶液中,完全反应时转移的电子数为2NA C、1L0.1mol·L-1NH4NO3溶液中的氮原子数为0.2NA D、25℃时,1.0LpH=12的NaClO溶液中由水电离出的OH-的数目为0.01NA14. NA代表阿伏加德罗常数的值。下列说法正确的是A、14g乙烯和丙烯混合物中含原子数目为2NA( ) B、50gKHCO3和CaCO3混合物含离子数目为2NA C、23gNa与O2完全反应生成Na2O和Na2O2的混合物,转移的电子数目为NA D、铜一锌原电池(电解质为稀硫酸)的电路中每转移2NA个电子,正极生成22.4LH215. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,20g氖气所含有的原子数目为0.5NA B、2.8铁粉与50mL4 mol·L-1盐酸完全反应转移电子的数目为0.1NA C、标准状况下,22.4 LSO2和SO3混合物中含有的硫原子数目为0.1NA D、28g的C2H4和N2混合气体中含有的原子数为2NA16. 用NA表示阿伏加德罗常数,下列叙述中正确的是( )A、0.1 molKI与0.1 molFeCl3在溶液中反应转移的电子数为0.1NA B、镁条在氮气中完全燃烧,生成50g氮化镁时,有1.5NA共用电子对被破坏 C、3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA D、标况时,22.4L二氯甲烷所含有的分子数为NA17. 某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515。10.1g该样品与50mL1mol/L硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为( )A、78 B、140 C、156 D、17218. 用NA表示阿伏加德罗常数。下列叙述正确的是( )A、标准状况下,22.4LH2O含有的分子数为NA B、常温常压下,1.06gNa2CO3含有的Na+数为0.02NA C、通常状况下,NA个CO2分子占有的体积为22.4L D、物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-数为NA19. 在两个容积相同的容器中,一个盛有NH3气体,另一个盛有H2和O2的混合气体。在同温同压下,两容器内的气体不可能具有相同的( )A、原子数 B、分子数 C、质量 D、电子数20. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、足量MnO2与40 mL 10 mol·L-1的浓盐酸充分反应,生成的氯气分子数为0.1NA B、常温下,224 mL H2O中所含氢氧键的数目约为0.02NA C、0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA D、常温下,1 L pH=11的Na2CO3溶液中由水电离出的H+数目为0.001NA21. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、分子总数为NA的CO、C2H4混合气体其体积约为22.4L,质量为28g B、将1molCl2 通入水中,HClO、Cl-、ClO-粒子数之和为2NA C、2.3克金属钠完全燃烧,转移的电子数为0.1NA D、密闭容器中1molH2(g)与1molI2(g)反应制备HI(g),生成2NA个H-I键22. NA代表阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,1.12 L CCl4含有质子数的数目为3.7NA B、常温常压下,3.0 g含葡萄糖的冰醋酸中含有的原子总数为0.4NA C、常温时,56g Fe与足量浓硝酸反应,转移的电子数目为3NA D、晶体B的结构单元如右图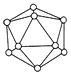 ,则11g晶体B含有0.6NA个三角形(相邻原子构成)
23. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )A、标准状况下,11.2L四氯化碳中含有C-Cl数目为2NA B、常温常压下,4.2g丙烯和环丙烷的混合气体中含有的碳原子数为0.3NA C、常温下,0.5 mol·L-1Fe2(SO4)3溶液中含Fe3+数目为1NA D、1 mol Cl2通入足量水中反应转移的电子数为NA24. 用NA表示阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,22.4LNO与11.2LO2充分反应后得到的气体分子数为NA B、3.6g重水中含有的中子数为2 NA C、常温下,1L1mol·L-1的CH3COOH溶液中,所含溶质分子数小于NA D、一定条件下,6.4g铜与过量的硫反应,转移电子数目为0.2 NA25. 设NA为阿伏加德罗常数的值,下列叙述错误的是( )A、n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA B、17gH2O2所含非极性键数目为0.5NA C、标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA D、56g铁与足量氯气反应,氯气共得到3NA个电子26. 阿伏加德罗常数的值为NA , 下列说法正确的是( )A、0.1molNaHSO4晶体中,含有H+的数目为0.1NA B、28g乙烯和丙烯(CH2=CHCH3)混合气体中含共价单键的数目为4NA C、1L 0.1mol/L的Na2CO3溶液中CO32-和HCO3-离子数目之和为0.1NA D、质量均为22g的T2O与D218O中所含中子数均为12NA27. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA B、标准状况下,2.24LSO3中所含原子数为0.4 NA C、常温常压下,16gO2和O3的混合气体中所含原子数目为NA D、在一定条件下1molN2与3molH2反应生成的NH3分子数为2NA28. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、8.0gCuO和Cu2S的混合物中含有Cu原子数目为0.1NA B、1 mol Na2O和1 mol Na2O2的混合物中,含有离子总数为7NA C、30gC3H8O中所含的极性共价键数目为2.5NA D、在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA29. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、2L0.5 mol·L-1的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目NA B、2.24L (标准状况)己烷在氧气中完全燃烧,得到0.6NACO2分子 C、3gSiO2晶体中含有的Si-O键的数目为0.1 NA D、若1LAlCl3溶液中,含NA个Al3+ , 则Cl-物质的量浓度大于3 mol·L-130. 阿伏加德罗常数的值为NA , 下列说法正确的是( )A、4.6g乙醇分子中含极性键数目为0.6NA B、标准状况下,2.24LSO3含分子数为0.1NA C、Na2S和Na2O2固体混合物7.8g中,含有的阴离子数为0.1NA D、0.2 mol NO和0.1mol O2于密闭容器中充分反应后,其分子数为0.2NA
,则11g晶体B含有0.6NA个三角形(相邻原子构成)
23. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )A、标准状况下,11.2L四氯化碳中含有C-Cl数目为2NA B、常温常压下,4.2g丙烯和环丙烷的混合气体中含有的碳原子数为0.3NA C、常温下,0.5 mol·L-1Fe2(SO4)3溶液中含Fe3+数目为1NA D、1 mol Cl2通入足量水中反应转移的电子数为NA24. 用NA表示阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,22.4LNO与11.2LO2充分反应后得到的气体分子数为NA B、3.6g重水中含有的中子数为2 NA C、常温下,1L1mol·L-1的CH3COOH溶液中,所含溶质分子数小于NA D、一定条件下,6.4g铜与过量的硫反应,转移电子数目为0.2 NA25. 设NA为阿伏加德罗常数的值,下列叙述错误的是( )A、n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA B、17gH2O2所含非极性键数目为0.5NA C、标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA D、56g铁与足量氯气反应,氯气共得到3NA个电子26. 阿伏加德罗常数的值为NA , 下列说法正确的是( )A、0.1molNaHSO4晶体中,含有H+的数目为0.1NA B、28g乙烯和丙烯(CH2=CHCH3)混合气体中含共价单键的数目为4NA C、1L 0.1mol/L的Na2CO3溶液中CO32-和HCO3-离子数目之和为0.1NA D、质量均为22g的T2O与D218O中所含中子数均为12NA27. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA B、标准状况下,2.24LSO3中所含原子数为0.4 NA C、常温常压下,16gO2和O3的混合气体中所含原子数目为NA D、在一定条件下1molN2与3molH2反应生成的NH3分子数为2NA28. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、8.0gCuO和Cu2S的混合物中含有Cu原子数目为0.1NA B、1 mol Na2O和1 mol Na2O2的混合物中,含有离子总数为7NA C、30gC3H8O中所含的极性共价键数目为2.5NA D、在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA29. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、2L0.5 mol·L-1的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目NA B、2.24L (标准状况)己烷在氧气中完全燃烧,得到0.6NACO2分子 C、3gSiO2晶体中含有的Si-O键的数目为0.1 NA D、若1LAlCl3溶液中,含NA个Al3+ , 则Cl-物质的量浓度大于3 mol·L-130. 阿伏加德罗常数的值为NA , 下列说法正确的是( )A、4.6g乙醇分子中含极性键数目为0.6NA B、标准状况下,2.24LSO3含分子数为0.1NA C、Na2S和Na2O2固体混合物7.8g中,含有的阴离子数为0.1NA D、0.2 mol NO和0.1mol O2于密闭容器中充分反应后,其分子数为0.2NA二、多选题
-
31. 已知:①2K2CrO4+H2SO4= K2Cr2O7+ K2SO4+H2O
②Fe2(SO4)3+2HI=2FeSO4+I2+ H2SO4
③K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+ K2SO4+7H2O
下列结论错误的是( )
A、K2CrO4转化为K2Cr2O7属于氧化还原反应 B、氧化性强弱顺序是: K2Cr2O7>Fe2(SO4)3>I2. C、反应②中,每有1molI2生成,转移电子数为2NA D、反应③中氧化产物与还原产物的物质的量之比为1:332. 用 表示阿伏加德罗常数,下列判断正确的是A、0.5 溶液中含有的 的数目是 B、5.6g铁与足量的氯气充分反应,转移电子数目是0.3 C、钠在氧气中燃烧消耗0.5mol氧气时,转移电子数目是2 D、100g98%的浓 中含有氧原子的数目为4三、非选择题
-
33. 化学小组用如下方法测定经处理后的废水中苯酚的含量(废水中不含干扰测定的物质)。
Ⅰ.用已准确称量的 固体配制一定体积的 标准溶液;
Ⅱ.取 L上述溶液,加入过量 ,加 酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入 L废水
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用
 标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗 溶液 L。
标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗 溶液 L。 已知:
和 溶液颜色均为无色
(1)、Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和。(2)、Ⅱ中发生反应的离子方程式是。(3)、Ⅲ中发生反应的化学方程式是。(4)、Ⅳ中加 前,溶液颜色须为黄色,原因是。(5)、 与 物质的量关系为 时, 一定过量,理由是。(6)、V中滴定至终点的现象是。(7)、废水中苯酚的含量为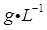 (苯酚摩尔质量:
(苯酚摩尔质量:  ) (8)、由于 具有性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。34. 深入研究碳元素的化合物有重要意义,回答下列问题:(1)、在恒温、恒容密闭容器中加入H2C2O4 , 发生反应:H2C2O4(s) CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。A、压强不再变化 B、CO2(g)的体积分数保持不变 C、混合气体的密度不再变化 D、混合气体的平均摩尔质量保持不变(2)、工业上可以通过反应CO(g)+2H2(g) CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2 , CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的∆H0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)v逆(CH3OH)(填“>”、“<”或“=”)。若在压强p1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2 , 则在压强p2下达到平衡状态B时容器的体积V(B)=L。
) (8)、由于 具有性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。34. 深入研究碳元素的化合物有重要意义,回答下列问题:(1)、在恒温、恒容密闭容器中加入H2C2O4 , 发生反应:H2C2O4(s) CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。A、压强不再变化 B、CO2(g)的体积分数保持不变 C、混合气体的密度不再变化 D、混合气体的平均摩尔质量保持不变(2)、工业上可以通过反应CO(g)+2H2(g) CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2 , CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的∆H0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)v逆(CH3OH)(填“>”、“<”或“=”)。若在压强p1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2 , 则在压强p2下达到平衡状态B时容器的体积V(B)=L。 (3)、从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是(4)、常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=(保留三位有效数字)(已知:Ka1(H2CO3)=4.4×10-7Ka2(H2CO3)=4.7×10-11)(5)、有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe, 则放电时负极反应式为。该电池充电时,当转移2mol电子时,阳极质量的变化量为g。35. 钴酸锂(LiCoO2)是锂离子电池的一种重要正极材料。可利用湿法冶金工艺处理精选后的锂离子电池正极材料(LiCoO2、乙炔黑)重新制备高纯度LiCoO2 , 其流程如下。(已知:LiCoO2难溶于水,Li2CO3微溶于水、难溶于醇,CoCO3难溶于水和醇)
(3)、从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是(4)、常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=(保留三位有效数字)(已知:Ka1(H2CO3)=4.4×10-7Ka2(H2CO3)=4.7×10-11)(5)、有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe, 则放电时负极反应式为。该电池充电时,当转移2mol电子时,阳极质量的变化量为g。35. 钴酸锂(LiCoO2)是锂离子电池的一种重要正极材料。可利用湿法冶金工艺处理精选后的锂离子电池正极材料(LiCoO2、乙炔黑)重新制备高纯度LiCoO2 , 其流程如下。(已知:LiCoO2难溶于水,Li2CO3微溶于水、难溶于醇,CoCO3难溶于水和醇) (1)、H2O2的作用是。(2)、“浸取”时若加入盐酸,Cl-被LiCoO2氧化产生Cl2。请写出该反应的离子方程式 。(3)、向含Co2+、Li+溶液中加入乙醇的作用 , 滤渣b的主要成分是(填化学式)。(4)、在空气中“煅烧”时发生的总化学方程式为 。(5)、可用碘量法来测定产品中钴的含量。取mg样品溶于稀硫酸,加入过量KI,以淀粉为指示剂,用c mol/L Na2S2O3标准溶液进行滴定,达到滴定终点时,消耗Na2S2O3标准溶液VmL,则产品中钴的含量为(以Co2O3计)。有关反应:LiCoO2+4H+=Li++Co3++2H2O,2Co3++2I-=2Co2++I2 , I2+2S2O32-= S4O62-+2I-
(1)、H2O2的作用是。(2)、“浸取”时若加入盐酸,Cl-被LiCoO2氧化产生Cl2。请写出该反应的离子方程式 。(3)、向含Co2+、Li+溶液中加入乙醇的作用 , 滤渣b的主要成分是(填化学式)。(4)、在空气中“煅烧”时发生的总化学方程式为 。(5)、可用碘量法来测定产品中钴的含量。取mg样品溶于稀硫酸,加入过量KI,以淀粉为指示剂,用c mol/L Na2S2O3标准溶液进行滴定,达到滴定终点时,消耗Na2S2O3标准溶液VmL,则产品中钴的含量为(以Co2O3计)。有关反应:LiCoO2+4H+=Li++Co3++2H2O,2Co3++2I-=2Co2++I2 , I2+2S2O32-= S4O62-+2I-