高考二轮复习知识点:物质的量的相关计算4
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 设 为阿伏加德罗常数的值。下列说法正确的是( )A、 含有 键的数目为 B、 的盐酸含有阴离子总数为 C、 与 混合后的分子数目为 D、 与足量 反应生成的 分子数目为2. 已知:在无氧条件下,葡萄糖发生反应C6H12O6 2CH3CH2OH + 2CO2↑。设NA是阿伏加德罗常数的值。下列说法正确的是( )A、0.1 mol葡萄糖(C6H12O6)含羟基(-OH)数目为0.6NA B、常温常压下,46 g CH3CH2OH与足量的钠反应产生氢分子数为0.5NA C、4.48 L CO2和CO的混合气体所含碳原子总数为0.2NA D、2.4 g Mg在足量的CO2中完全燃烧,转移电子数目为0.4NA3. 设 为阿伏加德罗常数的值。下列说法正确的是( )。A、 与 的混合物,含离子总数为 B、已知 中铬元素的化合价为 价,则 分子中存在的过氧键数目为 C、 溶液完全反应,转移电子数目一定为 D、常温时, 的盐酸中水电离的 数目为4. 设 为阿伏加德罗常数的值。化工厂常用浓氨水来检验氯气管道是否发生泄漏,其原理是: 。下列说法正确的是( )A、如果氯气管道漏气,则会看到有大量白雾生成 B、反应中每形成 键,转移电子数为 C、 的 溶液中, 的数目小于 D、该反应中,氧化剂与还原剂的物质的量之比为5. 已知NA是阿伏加德罗常数的值,下列说法正确的是( )A、72gCaO2中阴离子数目为2NA B、将0.1molCl2通入1L水中,转移的电子数为0.1NA C、标准状况下,11.2LO2和22.4LNO在密闭容器中充分混合后,气体分子总数小于NA D、室温下1LpH=13的NaOH溶液中,水电离出的OH-的数目为0.1NA6. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、同温同压同体积的12C18O和14N2均含有14NA个电子 B、100mL0.1mol·L-1的氨水溶液中含有0.01NA个NH4+ C、14gC2H4和C3H4的混合物含有2NA个共用电子对 D、11.5gNa与一定量的氧气完全反应,一定失去0.5NA个电子7. 称取(NH4)2SO4和NH4HSO4混合物样品7.24 g,加入含0.1 mol NaOH的溶液,完全反应,生成NH31792 mL(标准状况),则(NH4)2SO4和NH4HSO4的物质的量比为( )A、1:1 B、1:2 C、1.87:1 D、3.65:18. 医用酒精(75%乙醇)和84消毒液(主要成分是次氯酸钠)均能用于消毒。设NA为阿伏加德罗常数的值,下列说法正确的是( )A、74.5g次氯酸钠中含有的分子数目为NA B、1mol次氯酸钠与足量盐酸反应转移的电子数为2 NA C、46g医用酒精中含有碳碳键的数目为0.75 NA D、1mol乙醇和1mol乙烯分别完全燃烧,消耗氧气的分子数均为3 NA9. 由一种阳离子与两种酸根阴离子组成的盐称为混盐,CaOCl2是一种常见的混盐。下列说法错误的是( )A、CaOCl2有较强的氧化性 B、CaOCl2水溶液呈碱性 C、由氯气为原料,每生成1molCaOCl2 , 转移的电子为2mol D、CaOCl2的溶液中加入足量浓硫酸,可有黄绿色的气体产生10. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、一定条件下,合成氨反应中有0.5molN2发生反应,则反应中转移电子数为3NA B、10克环己烷与2-丙醇的混合液中,碳元素的质量分数为72%,则其中所含的氧原子数目为 NA C、过量铜与含0.4molHNO3的浓硝酸反应,则反应中电子转移数为0.2NA D、常温常压下有28g单晶硅晶体,则其中所含的Si—Si键数目为2NA11. NA为阿伏加德罗常数的值。下列说法正确的是( )A、50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA B、含NA个Na+的Na2O溶解于1L水中,所得溶液中Na+的物质的量浓度为1mol·L-1 C、在 反应中,每生成32g氧气,则转移2NA个电子 D、常温下,1L0.50mol·L-1NH4Cl溶液与2L0.25mol·L-1NH4Cl溶液所含 物质的量相同12. 设[aX+bY]为 a 个 X 微粒和 b 个 Y 微粒组成的一个微粒集合体,N(z)为微粒 z 的数量,NA 为阿伏加德罗常数的值。下列说法一定错误的是( )A、C(石墨)+O2(g) = CO2(g) ΔH=-390 kJ·mol−1 , 则每 1 mol [ C(石墨)+ O2(g)]完全燃烧放热 130 kJ B、Cu 与 1mol/L 的硝酸溶液充分反应,若生成 22.4 L 气体,则转移电子数为 3NA C、标准状况下 1.6g 氧气含分子数为 0.05NA , 且平均每个 O2 分子的体积约为 L D、1 mol Cl2 与稀 NaOH 溶液完全反应,则反应后的溶液中 N(ClO−)+N(HClO)=1NA13. 洁厕灵和84消毒液混合使用会发生反应: ,生成有毒的氯气。NA代表阿伏加德罗常数的值,下列说法正确的是( )A、每生成 氯气,转移的电子数为2NA B、 含有的电子数为28NA C、 溶液中含有的次氯酸根离子数为0.2NA D、将分子总数为NA的 和 的混合气体置于标准状况下,其体积约为14. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,11.2LCHCl3含极性共价键数目为2NA B、0.1L1.0mol/LNaHS溶液中S2−和HS−总数为0.1NA C、常温常压下,1.8g甲基(﹣12C2H3)中含有的中子数为0.9NA D、1molCl2与足量铜铁合金反应,转移电子数的范围在2NA和3NA之间15. 下列各项比较中,一定相等的是( )A、相同物质的量Cu分别与足量浓硝酸和稀硝酸反应,生成气体的物质的量 B、相同物质的量的Na2O和Na2O2中所含阴离子的数目 C、相同质量的Fe分别与足量Cl2、S充分反应,转移的电子数 D、相同物质的量浓度的NH4Cl和NH4HCO3溶液中的c(NH4+)16. 下列说法正确的是( )A、1 mol O2的体积为22.4 L B、5.6 g Fe与足量Cl2反应,转移电子的物质的量为0.3 mol C、0.1 mol/L AlCl3溶液中Cl-的物质的量为0.3 mol D、28g丁烯所含碳原子数是28 g乙烯所含碳原子数的2倍17. 下列各项比较中,一定相等的是( )A、等物质的量的OH-和-OH中所含电子数 B、等质量的氧气和臭氧中含有的氧原子数目 C、1molNa2O2固体中阳离子与阴离子的数目 D、等物质的量的Cu与Fe分别与足量的稀硝酸反应时转移的电子数18. 工业制备硝酸的反应之一为:3NO2 + H2O = 2HNO3 + NO。用NA表示阿伏加德罗常数,下列说法正确的是( )A、室温下,22.4 L NO2 中所含原子总数为3 NA B、36 g H2O中含有共价键的总数为2NA C、上述反应,生成1 mol HNO3转移电子的数目为NA D、标准状况下,11.2 L NO中所含电子总数为5 NA19. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、1.8 g NH4+含有的电子数为NA B、1 L 1 mol·L-1的NaAlO2水溶液中含有的氧原子数为2NA C、标况下,22.4 L NO与11.2 L O2充分反应后,生成物的分子总数为NA D、50 mL 18 mol·L-1的浓硫酸与足量的铜片共热,生成SO2的分子数为0.45NA20. 用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )A、1L0.1mol/L的Na2CO3溶液中含阴离子总数为0.1 NA个 B、0.1mol的2H35Cl分子的中子数是2NA C、1mol Na2O2与足量CO2充分反应转移的电子数目为2NA D、加热条件下,含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1NA21. NA代表阿伏加德罗常数的值。下列说法错误的是( )A、密闭容器中,2molSO2和1molO2催化反应后分子总数大于2NA B、1LpH=2的H2SO3溶液中含H+的数目为0.01NA C、5.6g铁与稀硝酸反应生成0.08molNO,转移电子数为0.3NA D、6.4 g S2和S8的混合物中所含硫原子数为0.2 NA22. 以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线。制备CH3OH的反应转化关系如图所示。设NA为阿伏加德罗常数的值,下列说法正确的是( )
 A、用1 mol CH4理论上能生产标准状况下CH3OH 22.4 L B、等物质的量的CH3OH和CH4 , CH3OH的质子数比CH4多8NA C、44 g CO2气体和44 g CH4与CO的混合气体,所含C原子数均为NA D、用CH4制备合成气的反应中,若生成1 mol CO,反应转移电子数为3NA23. 捕获二氧化碳生成甲酸过程如图所示。NA为阿伏加德罗常数的值,下列说法正确的是( )
A、用1 mol CH4理论上能生产标准状况下CH3OH 22.4 L B、等物质的量的CH3OH和CH4 , CH3OH的质子数比CH4多8NA C、44 g CO2气体和44 g CH4与CO的混合气体,所含C原子数均为NA D、用CH4制备合成气的反应中,若生成1 mol CO,反应转移电子数为3NA23. 捕获二氧化碳生成甲酸过程如图所示。NA为阿伏加德罗常数的值,下列说法正确的是( ) A、10.1gN(C2H5)3可溶于一定量盐酸形成盐,其中[N(C2H5)3H]+的数目为0.1NA B、30g甲酸分子中,电子对数目为5 NA C、在捕获过程中,若有22.4L CO2(标准状况)参与反应,则在反应过程中CO2分子只拆开了NA对电子对 D、该反应是氧化还原反应,每生成1mol甲酸,转移的电子数为2NA24. NA 代表阿伏加德罗常数的值,下列叙述正确的是( )A、88.0 g14CO2与14N2O的混合物中所含中子数为 44 NA B、1 mol CH3COONa与少量 CH3COOH溶于水所得的中性溶液中,CH3COO-数目为NA C、17.4 g MnO2与40 mL10 mol/L浓盐酸反应,转移电子的数目为0.2 NA D、常温下pH=4的醋酸溶液中由水电离出的 H+的数目为 10-10 NA25. 设NA为阿伏加德罗常数的值,下列说法不正确的是( )A、标准状况下,11.2L三氯甲烷中含有分子数为0.5NA B、常温常压下,2gD2O中含有电子数为NA C、46gNO2和N2O4混合气体中含有原子数为3NA D、1 mol Na完全与O2反应生成Na2O和Na2O2 , 转移电子数为NA26. 已知 NA是阿伏加德罗常数的值,下列说法正确的是( )A、32gS8与 S6(
A、10.1gN(C2H5)3可溶于一定量盐酸形成盐,其中[N(C2H5)3H]+的数目为0.1NA B、30g甲酸分子中,电子对数目为5 NA C、在捕获过程中,若有22.4L CO2(标准状况)参与反应,则在反应过程中CO2分子只拆开了NA对电子对 D、该反应是氧化还原反应,每生成1mol甲酸,转移的电子数为2NA24. NA 代表阿伏加德罗常数的值,下列叙述正确的是( )A、88.0 g14CO2与14N2O的混合物中所含中子数为 44 NA B、1 mol CH3COONa与少量 CH3COOH溶于水所得的中性溶液中,CH3COO-数目为NA C、17.4 g MnO2与40 mL10 mol/L浓盐酸反应,转移电子的数目为0.2 NA D、常温下pH=4的醋酸溶液中由水电离出的 H+的数目为 10-10 NA25. 设NA为阿伏加德罗常数的值,下列说法不正确的是( )A、标准状况下,11.2L三氯甲烷中含有分子数为0.5NA B、常温常压下,2gD2O中含有电子数为NA C、46gNO2和N2O4混合气体中含有原子数为3NA D、1 mol Na完全与O2反应生成Na2O和Na2O2 , 转移电子数为NA26. 已知 NA是阿伏加德罗常数的值,下列说法正确的是( )A、32gS8与 S6( )的混合物中所含共价键数目为NA
B、1L0.1mol• L-1H2C2O4溶液中含 C2O42- 离子数为 0.1NA
C、2molNO与 2monO2在密闭容器中充分反应,转移的电子数为 8NA
D、标准状况下 22.4L氯气与甲烷的混合气体,光照时充分反应生成 HCl分子数为NA
27. NA 为阿伏加德罗常数的值。下列说法正确的是( )A、1mol新戊烷中所含共价键数目为16 NA B、标准状况下,1.12LSO3的分子数目为0.05 NA C、1molNa2O2与足量 CO2充分反应,转移电子数目为2 NA D、密闭容器中,2molSO2和1molO2催化反应后分子总数为2 NA
)的混合物中所含共价键数目为NA
B、1L0.1mol• L-1H2C2O4溶液中含 C2O42- 离子数为 0.1NA
C、2molNO与 2monO2在密闭容器中充分反应,转移的电子数为 8NA
D、标准状况下 22.4L氯气与甲烷的混合气体,光照时充分反应生成 HCl分子数为NA
27. NA 为阿伏加德罗常数的值。下列说法正确的是( )A、1mol新戊烷中所含共价键数目为16 NA B、标准状况下,1.12LSO3的分子数目为0.05 NA C、1molNa2O2与足量 CO2充分反应,转移电子数目为2 NA D、密闭容器中,2molSO2和1molO2催化反应后分子总数为2 NA二、多选题
-
28. 某同学将钾投入溶液中待其充分反应。下列叙述错误的是( )A、反应后的溶液中的数目约为 B、反应过程中没有白色沉淀生成 C、反应后的溶液中,溶质只有 D、生成标准状况下
三、非选择题
-
29. 碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量,过程如下:
步骤I. 的制备
 步骤Ⅱ.产品中 含量测定
步骤Ⅱ.产品中 含量测定①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸 ;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 ;
④平行测定三次, 平均值为22.45, 平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
(ii)相关盐在不同温度下的溶解度表
温度/
0
10
20
30
40
50
60
35.7
35.8
36.0
36.3
36.6
37.0
37.3
11.9
15.8
21.0
27.0
6.9
8.2
9.6
11.1
12.7
14.5
16.4
29.4
33.3
37.2
41.4
45.8
50.4
55.2
回答下列问题:
(1)、步骤I中晶体A的化学式为 , 晶体A能够析出的原因是;(2)、步骤I中“300℃加热”所选用的仪器是_______(填标号);A、 B、
B、 C、
C、 D、
D、 (3)、指示剂N为 , 描述第二滴定终点前后颜色变化;(4)、产品中 的质量分数为(保留三位有效数字);(5)、第一滴定终点时,某同学俯视读数,其他操作均正确,则 质量分数的计算结果(填“偏大”“偏小”或“无影响”)。30. 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3 , 进一步处理得到产品Na2CO3和NH4Cl,实验流程如图:
(3)、指示剂N为 , 描述第二滴定终点前后颜色变化;(4)、产品中 的质量分数为(保留三位有效数字);(5)、第一滴定终点时,某同学俯视读数,其他操作均正确,则 质量分数的计算结果(填“偏大”“偏小”或“无影响”)。30. 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3 , 进一步处理得到产品Na2CO3和NH4Cl,实验流程如图: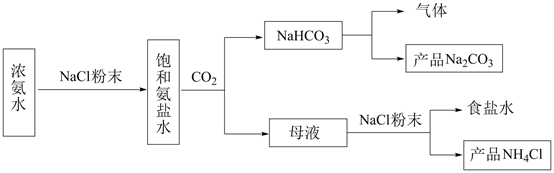
回答下列问题:
(1)、从A~E中选择合适的仪器制备NaHCO3 , 正确的连接顺序是(按气流方向,用小写字母表示)。为使A中分液漏斗内的稀盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或。A.
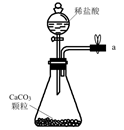 B.
B. 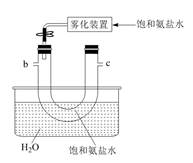 C.
C.  D.
D. 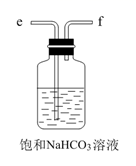 E.
E. 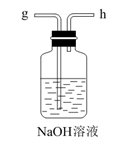 (2)、B中使用雾化装置的优点是 。(3)、生成NaHCO3的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
(2)、B中使用雾化装置的优点是 。(3)、生成NaHCO3的总反应的化学方程式为。(4)、反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2 , Na2O2增重0.14g,则固体NaHCO3的质量为g。
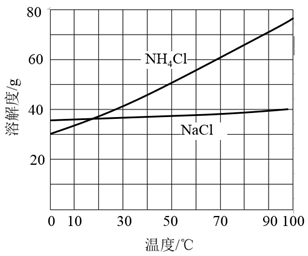
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)→NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为、、洗涤、干燥。
 (5)、无水NaHCO3可作为基准物质标定盐酸浓度.称量前,若无水NaHCO3保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果___(填标号)。A、偏高 B、偏低 不变31. 玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,发生如下反应:
(5)、无水NaHCO3可作为基准物质标定盐酸浓度.称量前,若无水NaHCO3保存不当,吸收了一定量水分,用其标定盐酸浓度时,会使结果___(填标号)。A、偏高 B、偏低 不变31. 玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,发生如下反应:3S+6KOH 2K2S+K2SO3+3H2O
(x-1)S+K2S K2Sx(x=2~6)
S+ K2SO3 K2S2O3
请计算:
(1)、0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3 , 则V=。(2)、2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3 , 则x=。(写出计算过程)32. 聚合氯化铁[Fe2(OH)nCl6-n]m简称PFC,是一种新型高效的无机高分子净水剂。以FeCl2·4H2O为原料,溶于稀盐酸并加入少量的NaNO2 , 经氧化、水解、聚合等步骤,可制备PFC。(1)、在稀盐酸中,NaNO2会与Fe2+反应生成一种无色气体M,气体M对该反应有催化作用,其催化原理如图所示。 M的化学式为; Fe2+在酸性条件下被O2氧化的离子方程式为。 (2)、盐基度[B= × 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响。(填“越大”、“越小”或“无影响”)(3)、PFC样品中盐基度(B)的测定:
(2)、盐基度[B= × 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响。(填“越大”、“越小”或“无影响”)(3)、PFC样品中盐基度(B)的测定:已知:PFC样品的密度ρ = 1.40 g·mL−1 , 样品中铁的质量分数ω(Fe) = 16%
步骤1:准确量取1.00 mL PFC样品置于锥形瓶中。
步骤2:加入一定体积0.05000 mol·L−1的盐酸标准溶液,室温静置后,加入一定体积的氟化钾溶液(与Fe3+反应,消除Fe3+对实验的干扰),滴加数滴酚酞作指示剂,立即用0.05000 mol·L−1氢氧化钠标准溶液滴定至终点,消耗氢氧化钠标准溶液13.00 mL。
步骤3:准确量取1.00 mL蒸馏水样品置于锥形瓶中,重复步骤2操作,消耗氢氧化钠标准溶液49.00 mL。
根据以上实验数据计算PFC样品的盐基度(B)(写出计算过程)。
33. 有一稀硫酸和硝酸铁的混合溶液,向其中加入铁粉,溶液中的Fe2+浓度如图所示(不考虑溶液体积的变化): (1)、溶液中H2SO4与Fe(NO3)3的物质的量之比为(2)、请写出详细的计算过程。
(1)、溶液中H2SO4与Fe(NO3)3的物质的量之比为(2)、请写出详细的计算过程。四、题目
-
34. 镁铁水滑石(镁、铁的碱式碳酸盐)是具有层状结构的无机功能材料,可由Mg(NO3)2·6H2O、Fe(NO3)3·9H2O及CO(NH2)2等按一定比例在温度高于90℃时反应制得。(1)、其他条件不变时,n[CO(NH2)2]/n(Fe3+)对镁铁水滑石产率和溶液pH的变化关系如图所示:

① <3,反应液中产生少量气体,测氨仪未检出NH3 , 说明逸出的气体主要是(填化学式)。
②n[CO(NH2)2]/n(Fe3+)>12,溶液的pH处于稳定状态,这是因为
(2)、镁铁水滑石表示为:[FexMgy(OH)z](CO3)w·pH2O(摩尔质量为660g·mol-1),可通过下列实验和文献数据确定其化学式,步骤如下:I.取镁铁水滑石3.300g加入足量稀硫酸充分反应,收集到气体112mL(标准状况)。
II.文献查得镁铁水滑石热分解TG-DSC图:303~473K,失去层间水(结晶水)失重为10.9%;473~773K时,CO32-和OH-分解为CO2和H2O;773K以上产物为MgO、Fe2O3。
Ⅲ.称取0.4000g热分解残渣(773K以上)置于碘量瓶中,加入稍过量盐酸使其完全溶解,加入适量水和稍过量的KI溶液,在暗处放置片刻,用0.1000mol·L-1Na2S2O3标准溶液滴定到溶液呈淡黄色,加入3mL淀粉溶液,继续滴定到溶液蓝色消失。(2Na2S2O3+I2=2NaI+Na2S4O6),消耗Na2S2O3溶液20.00mL。通过计算确定镁铁水滑石的化学式(写出计算过程)。
35. 化学需氧量(chemical oxygen demand,简称COD)表示在强酸性条件下重铬酸钾氧化 1 L 污水中有机物所需的氧化剂的量,并换算成以氧气为氧化剂时,1 L水样所消耗O2的质量(mg·L-1)计算。COD小,水质好。某湖面出现赤潮,某化学兴趣小组为测定其污染程度,用 1.176 g K2Cr2O7固体配制成 100 mL溶液,现取水样20.00 mL,加入10.00 mL K2Cr2O7溶液,并加入适量酸和催化剂,加热反应2 h。多余的K2Cr2O7用0.100 0 mol·L-1Fe(NH4)2(SO4)2溶液进行滴定,消耗Fe(NH4)2(SO4)2溶液的体积如下表所示。此时,发生的反应是CrO72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。(已知K2Cr2O7和有机物反应时被还原为 Cr3+ , K2Cr2O7的相对分子质量为294)序号
起始读数/mL
终点读数/mL
1
0.00
12.10
2
1.26
13.16
3
1.54
14.64
(1)、K2Cr2O7溶液的物质的量浓度为mol·L-1。(2)、求该湖水的COD为mg·L-1。
-