高考二轮复习知识点:物质的量的相关计算3
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 代表阿伏加德罗常数的值。下列说法正确的是( )A、 中含有的电子数为1.3 B、 中含有的共价键的数目为0.1 C、 肼 含有的孤电子对数为0.2 D、 ,生成 乙烷时断裂的共价键总数为2. X、Y均为短周期金属元素,同温同压下,0.1molX的单质与足量稀盐酸反应,生成H2体积为V1L;0.1molY的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是( )A、X、Y生成H2的物质的量之比一定为 B、X、Y消耗酸的物质的量之比一定为 C、产物中X、Y化合价之比一定为 D、由 一定能确定产物中X、Y的化合价3. 设 表示阿伏加德罗常数的值,下列叙述正确的是( )A、10g质量分数为46%的乙醇水溶液中所含氧原子数为0.4 B、100mL1mol·L-1的硅酸钠溶液中含有的 数为0.1 C、将2.24L 通入足量溴水中充分反应,生成 的数目为0.4 D、12g 在熔融时的离子总数为0.34. 下列说法正确的是( )A、标准状况下, 含有的分子数约为 B、 含有的中子数约为 C、 和 的混合物中含有的氮原子数共约为 D、 与足量的 反应转移的电子数约为5. 下列各项比较中,相等的是( )A、相同物质的量浓度的CH3COOH和CH3COONa溶液中的c(CH3COO-) B、相同质量的乙炔和苯中所含的氢原子数 C、相同物质的量的Cl2分别与足量的Fe、Ca(OH)2充分反应转移电子数 D、标准状况下,相同体积的NO和NO2所含氧原子数6. 下列叙述正确的是( )A、0.5 mol/L CuCl2溶液中含有3.01×1023个Cu2+ B、常温常压下28gCO与22.4 LO2所含分子数相等 C、相同状况下的12Cl8O和14N2 , 若体积相等,则密度相等 D、等物质的量的-CH3与-OH所含电子数相等7. 下列指定量一定相等的是( )A、等质量的NO2与N2O4的物质的量 B、等体积等物质的量浓度的H2SO4溶液与HCl溶液中的H+数 C、等物质的量的Fe与Cu分别与足量Cl2反应时转移的电子数 D、标准状况下,等物质的量的O2与O3的体积8. 设 为阿伏加德罗常数的值,下列说法中正确的是( )A、 正离子所含的电子总数为 B、 与 混合气体中所含原子总数为 C、常温常压下, 和 混合气体中含有 个氧原子 D、电解 溶液共得到 气体(标准状况),理论上转移了 个电子9. 世界某著名学术刊物介绍了一种新型中温全瓷铁-空气电池,其结构如图所示。下列有关该电池放电时的说法正确的是( )
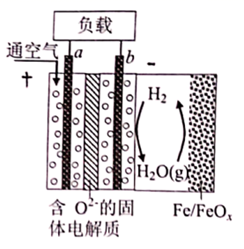 A、a极为原电池的负极 B、正极的电极反应式为 C、放电时电子从b极经固体电解质流向a极 D、消耗掉 铁时,理论上要消耗 标准状况的10. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、2H2S+SO2=3S↓+2H2O反应中,每生成1mol氧化产物时转移电子数为NA B、物质的量相等的重水与水相差2NA个中子 C、乙烯和丙烯组成的28g 混合气体中含氢原子数为4NA D、pH=13的1LBa(OH)2 溶液中所含有OH-数目为0.2NA11. 用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图所示,质子膜允许H+和H2O通过。有关说法正确的是( )
A、a极为原电池的负极 B、正极的电极反应式为 C、放电时电子从b极经固体电解质流向a极 D、消耗掉 铁时,理论上要消耗 标准状况的10. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、2H2S+SO2=3S↓+2H2O反应中,每生成1mol氧化产物时转移电子数为NA B、物质的量相等的重水与水相差2NA个中子 C、乙烯和丙烯组成的28g 混合气体中含氢原子数为4NA D、pH=13的1LBa(OH)2 溶液中所含有OH-数目为0.2NA11. 用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图所示,质子膜允许H+和H2O通过。有关说法正确的是( )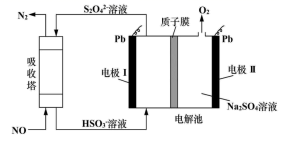 A、电极Ⅰ为电解池的负极,吸收塔反应为2NO+2S2O +2H2O=N2 +4HSO B、电解池中的质子运动方向是:左室→质子膜→右室 C、电极Ⅱ发生的反应为:4OH--4e-=O2↑+2H2O- D、吸收塔中每处理1molNO则右室会生成11.2L的O212. NA为阿伏加德罗常数的值。下列说法正确的是( )A、9g18O2含有的中子数为4NA B、1mol氯气和水充分反应,转移的电子数为2NA C、25℃、101 kPa时,22.4L的N2和CO的混合气体中,原子数为NA D、1L1 mol•L-1 CH3COONa溶液中所含CH3COO-、CH3COOH的总数为NA13. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA B、常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA C、50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA D、某密闭容器盛有0.1molN2和0.3molH2 , 在一定条件下充分反应,转移电子的数目为0.6NA14. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、0.1 mol•L-1NH4NO3溶液中含有的氮原子总数为0.2NA B、12g石墨和金刚石的混合物含有4NA个碳原子 C、1molCl2与足量铁充分反应,转移的电子数为2NA D、2.8gCO 和C2H4的混合气体中含有的质子数为1.4NA15. NA代表阿伏加德罗常数的值,下列说法正确的是( )A、10 g CaCO3和KHCO3的固体混合物所含阳离子大于0.1NA B、30 g二氧化硅中含有化学键的数目为NA C、1 mol Na被完全氧化生成Na2O,失去NA个电子 D、1 L 1 mol/LCH3COONa溶液中含有CH3COO-的数目为NA16. 为实现随处可上网,中国发射了“中星16号”卫星。NH4ClO4是其运载火箭的固体燃料,发生反应为2NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O↑,下列有 关该反应的说法正确的是( )A、上述条件下,氧化性:O2>NH4ClO4 B、该反应中,还原产物与氧化产物的物质的量之比为1:3 C、产生6.4 gO2时,反应转移的电子物质的量为0.8 mol D、0.5 mol NH4ClO4分解产生气体的体积为44.8 L17. 蓝天保卫战—持续三年的大气治理之战,其中低成本、高效率处理SO2、NO2等大气污染物一直是化学研究的重点课题,研究它们的性质、制备在工业生产和环境保护中有着重要意义。一种处理SO2、NO2的研究成果,其反应原理为( )SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH1=-41.8kJ·mol-1 , 标准状况下,SO2(g)+NO2(g)=SO3(s)+NO(g) ΔH2.下列有关说法错误的是A、该反应的ΔS>0 B、ΔH2<-41.8kJ·mol-1 C、SO2的生成速率和NO2的消耗速率相等说明该反应达到平衡状态 D、标准状况下,该反应中每生成22.4L NO转移电子的数目约等于2×6.02×102318. 设 NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、常温下,78g Na2O2中含有离子数为 4NA B、0.5mol/L 的 AlCl3溶液中所含 Al3+的数目小于 0.5NA C、1mol Cl2与过量 H2O 反应,转移的电子数目为NA D、标准状况下,11.2L N2和 NO 混合气体中的原子数为NA19. 我国“金牌火箭”长征二号用 N2H4做燃料,发生反应:2N2H4+ 2NO2 3N2+4H2O。设 NA 为阿伏加德罗常数的值,下列有关说法正确的是( )A、标准状况下,22.4L H2O 中质子数目为 10 NA B、16g N2H4中含有极性共价键数目为 2.5 NA C、反应生成 1.5molN2时转移的电子数目为 4 NA D、密闭容器中 2molNO 和 1molO2充分反应生成 NO2 , 其分子数目为 2 NA20. 设 NA为阿伏加德罗常数的值. 下列说法正确的是( )A、标准状况下,11.2L的 CH4和C2H4的混合气体含 C-H 数目为2NA B、100mL0.1mol/L 酸性 KMnO4溶液与足量草酸反应转移电子数为0.03N A C、含 NaClO7.45g的某新冠消毒片溶于足量水中,所得溶液含阴阳离子总数为0.2NA D、0.5molCO2溶于水,溶液中的 H2CO3、HCO3- 、CO23- 微粒数总和为0.5NA21. 下列说法错误的是( )A、常温常压下,3.2 g O2和O3的混合气体中含有氧原子的数目约为0.2×6.02×1023 B、1 L 0.5 mol·L−1 CH3COONa溶液中含有CH3COOH和CH3COO−的总数约为0.5×6.02×1023 C、标准状况下,1.12 L HCl气体中含有电子的数目约为0.9×6.02×1023 D、0.1mol环氧乙烷(
A、电极Ⅰ为电解池的负极,吸收塔反应为2NO+2S2O +2H2O=N2 +4HSO B、电解池中的质子运动方向是:左室→质子膜→右室 C、电极Ⅱ发生的反应为:4OH--4e-=O2↑+2H2O- D、吸收塔中每处理1molNO则右室会生成11.2L的O212. NA为阿伏加德罗常数的值。下列说法正确的是( )A、9g18O2含有的中子数为4NA B、1mol氯气和水充分反应,转移的电子数为2NA C、25℃、101 kPa时,22.4L的N2和CO的混合气体中,原子数为NA D、1L1 mol•L-1 CH3COONa溶液中所含CH3COO-、CH3COOH的总数为NA13. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA B、常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA C、50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA D、某密闭容器盛有0.1molN2和0.3molH2 , 在一定条件下充分反应,转移电子的数目为0.6NA14. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、0.1 mol•L-1NH4NO3溶液中含有的氮原子总数为0.2NA B、12g石墨和金刚石的混合物含有4NA个碳原子 C、1molCl2与足量铁充分反应,转移的电子数为2NA D、2.8gCO 和C2H4的混合气体中含有的质子数为1.4NA15. NA代表阿伏加德罗常数的值,下列说法正确的是( )A、10 g CaCO3和KHCO3的固体混合物所含阳离子大于0.1NA B、30 g二氧化硅中含有化学键的数目为NA C、1 mol Na被完全氧化生成Na2O,失去NA个电子 D、1 L 1 mol/LCH3COONa溶液中含有CH3COO-的数目为NA16. 为实现随处可上网,中国发射了“中星16号”卫星。NH4ClO4是其运载火箭的固体燃料,发生反应为2NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O↑,下列有 关该反应的说法正确的是( )A、上述条件下,氧化性:O2>NH4ClO4 B、该反应中,还原产物与氧化产物的物质的量之比为1:3 C、产生6.4 gO2时,反应转移的电子物质的量为0.8 mol D、0.5 mol NH4ClO4分解产生气体的体积为44.8 L17. 蓝天保卫战—持续三年的大气治理之战,其中低成本、高效率处理SO2、NO2等大气污染物一直是化学研究的重点课题,研究它们的性质、制备在工业生产和环境保护中有着重要意义。一种处理SO2、NO2的研究成果,其反应原理为( )SO2(g)+NO2(g)=SO3(g)+NO(g) ΔH1=-41.8kJ·mol-1 , 标准状况下,SO2(g)+NO2(g)=SO3(s)+NO(g) ΔH2.下列有关说法错误的是A、该反应的ΔS>0 B、ΔH2<-41.8kJ·mol-1 C、SO2的生成速率和NO2的消耗速率相等说明该反应达到平衡状态 D、标准状况下,该反应中每生成22.4L NO转移电子的数目约等于2×6.02×102318. 设 NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、常温下,78g Na2O2中含有离子数为 4NA B、0.5mol/L 的 AlCl3溶液中所含 Al3+的数目小于 0.5NA C、1mol Cl2与过量 H2O 反应,转移的电子数目为NA D、标准状况下,11.2L N2和 NO 混合气体中的原子数为NA19. 我国“金牌火箭”长征二号用 N2H4做燃料,发生反应:2N2H4+ 2NO2 3N2+4H2O。设 NA 为阿伏加德罗常数的值,下列有关说法正确的是( )A、标准状况下,22.4L H2O 中质子数目为 10 NA B、16g N2H4中含有极性共价键数目为 2.5 NA C、反应生成 1.5molN2时转移的电子数目为 4 NA D、密闭容器中 2molNO 和 1molO2充分反应生成 NO2 , 其分子数目为 2 NA20. 设 NA为阿伏加德罗常数的值. 下列说法正确的是( )A、标准状况下,11.2L的 CH4和C2H4的混合气体含 C-H 数目为2NA B、100mL0.1mol/L 酸性 KMnO4溶液与足量草酸反应转移电子数为0.03N A C、含 NaClO7.45g的某新冠消毒片溶于足量水中,所得溶液含阴阳离子总数为0.2NA D、0.5molCO2溶于水,溶液中的 H2CO3、HCO3- 、CO23- 微粒数总和为0.5NA21. 下列说法错误的是( )A、常温常压下,3.2 g O2和O3的混合气体中含有氧原子的数目约为0.2×6.02×1023 B、1 L 0.5 mol·L−1 CH3COONa溶液中含有CH3COOH和CH3COO−的总数约为0.5×6.02×1023 C、标准状况下,1.12 L HCl气体中含有电子的数目约为0.9×6.02×1023 D、0.1mol环氧乙烷( )中含有共价键的总数约为0.3×6.02×1023
22. 下列说法正确的是( )A、23gNO2与足量水反应,转移的电子数约为6.02×1023 B、标准状况下,22.4L15NH3含有的质子数约为6.02×1024 C、常温下,1L0.1mo1•L-1NH4NO3溶液中含有的NH4+数约为6.02×1022 D、密闭容器中,1molNO与0.5molO2充分反应后,容器中分子数约为6.02×102323. 用NA代表阿伏加德罗常数的数值。下列说法正确的是( )A、7.8 g Na2O2中含有的离子数为0.3 NA B、1 mol NO2与水完全反应转移的电子数为NA C、标准状况下,22.4 L NH3含有的质子数为5NA D、1 L 0.1mol·L-1 NH4Cl溶液中含有的NH4+数为0.1NA24. 潜艇中氧气来源之一的反应是:2Na2O2+2H2O=4NaOH+O2↑。用NA表示阿伏加德罗常数,下列说法正确的是( )A、22.4LO2含2NA个O原子 B、1.8gH2O含有的质子数为NA C、1molNa2O2含共价键的总数为2NA D、上述反应,每生成1molO2转移4mol电子25. 设N为阿伏加德罗常数的值。下列说法正确的是( )A、密闭容器中 和 催化反应后原子总数小于 B、 的浓盐酸与足量 共热,电子转移的数目为 C、向 溶液中滴加氨水至溶液呈中性混合液中 的数目为 D、在标准状况下, 二氯乙烷( )中含有极性键的数目为26. 用NA表示阿伏加德罗常数的数值,下列说法中错误的是( )A、标准状况下,22.4LCl2通入足量NaOH溶液中,完全反应时转移的电子数为2NA B、20gD2O含有的电子数为10NA C、1L0.1mol•L-1NH4NO3溶液中的氮原子数为0.2NA D、25℃时,1.0LpH=12的NaClO溶液中由水电离出OH-的数目为0.01NA
)中含有共价键的总数约为0.3×6.02×1023
22. 下列说法正确的是( )A、23gNO2与足量水反应,转移的电子数约为6.02×1023 B、标准状况下,22.4L15NH3含有的质子数约为6.02×1024 C、常温下,1L0.1mo1•L-1NH4NO3溶液中含有的NH4+数约为6.02×1022 D、密闭容器中,1molNO与0.5molO2充分反应后,容器中分子数约为6.02×102323. 用NA代表阿伏加德罗常数的数值。下列说法正确的是( )A、7.8 g Na2O2中含有的离子数为0.3 NA B、1 mol NO2与水完全反应转移的电子数为NA C、标准状况下,22.4 L NH3含有的质子数为5NA D、1 L 0.1mol·L-1 NH4Cl溶液中含有的NH4+数为0.1NA24. 潜艇中氧气来源之一的反应是:2Na2O2+2H2O=4NaOH+O2↑。用NA表示阿伏加德罗常数,下列说法正确的是( )A、22.4LO2含2NA个O原子 B、1.8gH2O含有的质子数为NA C、1molNa2O2含共价键的总数为2NA D、上述反应,每生成1molO2转移4mol电子25. 设N为阿伏加德罗常数的值。下列说法正确的是( )A、密闭容器中 和 催化反应后原子总数小于 B、 的浓盐酸与足量 共热,电子转移的数目为 C、向 溶液中滴加氨水至溶液呈中性混合液中 的数目为 D、在标准状况下, 二氯乙烷( )中含有极性键的数目为26. 用NA表示阿伏加德罗常数的数值,下列说法中错误的是( )A、标准状况下,22.4LCl2通入足量NaOH溶液中,完全反应时转移的电子数为2NA B、20gD2O含有的电子数为10NA C、1L0.1mol•L-1NH4NO3溶液中的氮原子数为0.2NA D、25℃时,1.0LpH=12的NaClO溶液中由水电离出OH-的数目为0.01NA二、多选题
-
27. 实验室中利用固体KMnO4进行如图实验,下列说法错误的是( )
 A、G与H均为氧化产物 B、实验中KMnO4只作氧化剂 C、Mn元素至少参与了3个氧化还原反应 D、G与H的物质的量之和可能为0.25mol28. 如图为CaC2O4•xH2O在N2和O2气氛中的热重曲线(样品质量随温度变化的曲线)。下列有关说法错误的是( )
A、G与H均为氧化产物 B、实验中KMnO4只作氧化剂 C、Mn元素至少参与了3个氧化还原反应 D、G与H的物质的量之和可能为0.25mol28. 如图为CaC2O4•xH2O在N2和O2气氛中的热重曲线(样品质量随温度变化的曲线)。下列有关说法错误的是( ) A、x的值为1 B、物质A为CaC2O4 , CaC2O4在隔绝空气条件下,420℃以下热稳定,不会分解 C、800℃-1000℃氮气气氛中的反应为CaC2O4CaCO3+CO↑ D、无论是O2气氛还是N2气氛,当1molCaC2O4•xH2O最终转变为C时,转移电子的物质的量相同
A、x的值为1 B、物质A为CaC2O4 , CaC2O4在隔绝空气条件下,420℃以下热稳定,不会分解 C、800℃-1000℃氮气气氛中的反应为CaC2O4CaCO3+CO↑ D、无论是O2气氛还是N2气氛,当1molCaC2O4•xH2O最终转变为C时,转移电子的物质的量相同三、非选择题
-
29. 将3.00g某有机物(仅含C、H、O元素,相对分子质量为150)样品置于燃烧器中充分燃烧,依次通过吸水剂、CO2吸收剂,燃烧产物被完全吸收。实验数据如下表:
吸水剂
CO2吸收剂
实验前质量/g
20.00
26.48
实验后质量/g
21.08
30.00
请回答:
(1)、燃烧产物中水的物质的量为mol。(2)、该有机物的分子式为(写出计算过程)。30. 2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(ClO2)就是其中一种高效消毒灭菌剂,但其稳定性较差,可转化为较稳定的NaClO2保存。工业上常用吸收法和电解法制备NaClO2 , 其工艺流程示意图如图1。

已知:a.纯ClO2熔点为-59℃,沸点为11℃ ,纯的ClO2受热或遇光易发生爆炸,一般稀释到10%以下。
b.长期放置或高于60℃时,NaClO2易分解生成NaClO3和NaCl。
(1)、步骤1中,生成ClO2的化学方程式是 , 通入空气的作用是 。(2)、方法1中,反应的离子方程式是 , 利用方法1制NaClO2时,温度不能超过35℃,可能的原因是 。(3)、方法2中,NaClO2在生成(选填“阴极”或“阳极”)。(4)、NaClO2的溶解度曲线如图2所示,步骤3从NaClO2溶液中获得NaClO2的操作是:加热温度至略低于60℃、、 , 过滤、洗涤、干燥。(5)、保存液态ClO2的条件是(填字母)。a.常温、密封、不避光 b.低温、密封、避光 c.常温、敞口、避光 d.低温、敞口、不避光
(6)、ClO2 在杀菌的同时,可将剧毒氰化物氧化成无毒气体,ClO2 被还原为Cl-。某工厂污水中含CN- a mg/L,处理10m3这种污水,至少需要ClO2 mol。31. 某兴趣小组探究H2和Cl2反应后的气体与氢氧化钠溶液反应。在标准状况下,H2和Cl2的混合气体共2.24 L,光照充分反应后,用NaOH溶液充分吸收。(1)、消耗NaOH物质的量的最大值为mol。(2)、请在下图中画出NaCl的物质的量随H2的体积分数的变化图像。(横坐标表示原混合气体中H2的体积分数,纵坐标表示充分反应后NaCl的物质的量。)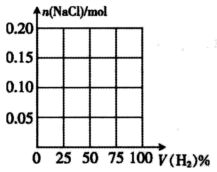 32. 三氯乙醛(CCl3CHO)作为有机原料,常用于生产氯霉素、氯仿等。实验室制备三氯乙醛的装置示意图(加热装置未画出)和有关数据如下:
32. 三氯乙醛(CCl3CHO)作为有机原料,常用于生产氯霉素、氯仿等。实验室制备三氯乙醛的装置示意图(加热装置未画出)和有关数据如下:
反应原理:
相关物质的相对分子质量及部分物理性质:
相对原子质量
熔点/℃
沸点/℃
溶解性
CH3CH2OH
46
-114.1
78.3
与水互溶
CCl3CHO
147.5
-57.5
97.8
可溶于水、乙醇
CCl3COOH
163.5
58
198
可溶于水、乙醇、三氯乙醛
回答下列问题:
(1)、仪器 a 的名称是 ,往 a 中加入盐酸,将其缓慢加入到高锰酸钾中,反应的化学方程式: 。(2)、装置 D 的作用是 ,仪器 F 的作用是 ,E 中冷凝水应从 (填“b”或“c”)口进。(3)、反应过程中若存在次氯酸,CCl3CHO 可能被氧化为 CCl3COOH,写出 CCl3CHO 被次氯酸氧化的化学反应方程式:。(4)、该设计流程存在一处缺陷导致副产物增多,请提出改进的措施: 。(5)、测定产品纯度:称取产品 0.36g 配成待测溶液,加入 0.1000mol·L-1碘标准溶液20.00mL,再加入适量 Na2CO3溶液,反应完全后加盐酸调节溶液的 pH,立即用0.0200mol·L-1 Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗溶液 20.00mL。则产品的纯度为 (计算结果保留三位有效数字)。( ; )33. 陶瓷工业中钴系色釉具有呈色稳定、呈色强度高等优点,利用含钴废料(主要成分为Co3O4 , 还含有少量的铝箔、LiCoO2等杂质)制备碳酸钴的工艺流程如下: (1)、“滤液①”主要成分是: ;“操作①”、“操作②”的分离方法是否相同 (填“是”或“否”)。(2)、“酸溶”中 H2O2的作用是: (选填“氧化剂”或“还原剂”或“既是氧化剂又是还原剂”);若用 Na2S2O3代替 H2O2则有两种硫酸盐生成,写出 Na2S2O3在“酸溶”时发生的化学方程式: 。(3)、已知钴、锂在有机磷萃取剂中的萃取率与 pH 的关系如下图所示,则有机磷萃取时最佳 pH 为 。
(1)、“滤液①”主要成分是: ;“操作①”、“操作②”的分离方法是否相同 (填“是”或“否”)。(2)、“酸溶”中 H2O2的作用是: (选填“氧化剂”或“还原剂”或“既是氧化剂又是还原剂”);若用 Na2S2O3代替 H2O2则有两种硫酸盐生成,写出 Na2S2O3在“酸溶”时发生的化学方程式: 。(3)、已知钴、锂在有机磷萃取剂中的萃取率与 pH 的关系如下图所示,则有机磷萃取时最佳 pH 为 。 (4)、Co2+萃取的反应原理如下:Co2+ + 2HR(有机层) CoR2 + 2H+ ,则从有机相中分离出 CoSO4需向有机溶剂中加入以下哪种试剂 ___________(填选项)。A、H2SO4 B、NaOH C、Co(OH)2 D、HR(5)、“沉钴”时 Na2CO3 的滴速过快或浓度太大,都会导致产品不纯,请分析原因: 。(6)、在空气中煅烧 CoCO3生成钴的氧化物和 CO2 , 测得充分煅烧后固体质量为 24.1g,CO2的体积为 6.72L(标准状况),则该钴氧化物的化学式为 。34. 钼酸钠晶体( )是无公害型冷却水系统的金属级蚀剂,工业上利用钼精矿(主要成分是不溶于水的 ,含少量 等)制备钼酸钠的工艺如图所示。
(4)、Co2+萃取的反应原理如下:Co2+ + 2HR(有机层) CoR2 + 2H+ ,则从有机相中分离出 CoSO4需向有机溶剂中加入以下哪种试剂 ___________(填选项)。A、H2SO4 B、NaOH C、Co(OH)2 D、HR(5)、“沉钴”时 Na2CO3 的滴速过快或浓度太大,都会导致产品不纯,请分析原因: 。(6)、在空气中煅烧 CoCO3生成钴的氧化物和 CO2 , 测得充分煅烧后固体质量为 24.1g,CO2的体积为 6.72L(标准状况),则该钴氧化物的化学式为 。34. 钼酸钠晶体( )是无公害型冷却水系统的金属级蚀剂,工业上利用钼精矿(主要成分是不溶于水的 ,含少量 等)制备钼酸钠的工艺如图所示。
回答下列问题:
(1)、① 中钼元素的化合价是;②在焙烧炉中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是。
(2)、“焙烧”时 转化为 ,写出该反应的化学方程式:。(3)、“碱浸”所得 ,溶液中含 杂质,其中 , ,在结晶前需加入 固体以除去溶液中的 。当 开始沉淀时, 的去除率是。( ,溶液体积变化可忽略)(4)、“除杂”过程中加入的除杂剂是 ,则废渣的化学式为。(5)、钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在不同介质中的腐蚀速率实验结果如下图: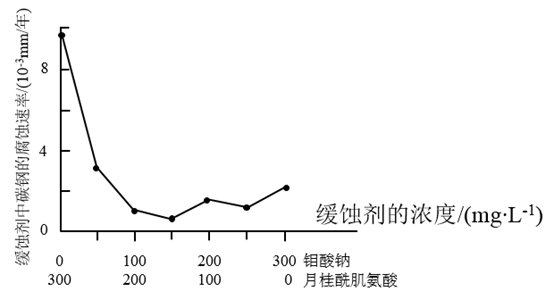
要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为。
(6)、另一种利用钼精矿制备钼酸钠的工艺流程中,直接向粉碎后的钼精矿中加入 溶液和 溶液来得到钼酸钠,则得到钼酸钠溶液的离子方程式为。35. 工业上利用氨氧化获得的高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3 , 工艺流程如下:
已知:Na2CO3+NO+NO2=2NaNO2+CO2
(1)、中和液所含溶质除NaNO2及少量Na2CO3外,还有(填化学式)。(2)、中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是。蒸发Ⅰ产生的蒸气中含有少量的NaNO2等有毒物质,不能直接排放,将其冷凝后用于流程中的(填操作名称)最合理。(3)、母液Ⅰ进行转化时加入稀HNO3的目的是。母液Ⅱ需回收利用,下列处理方法合理的是。a.转入中和液 b.转入结晶Ⅰ操作
c.转入转化液 d.转入结晶Ⅱ操作
(4)、若将NaNO2、NaNO3两种产品的物质的量之比设为2:1,则生产1.38吨NaNO2时,Na2CO3的理论用量为吨(假定Na2CO3恰好完全反应)。