高考二轮复习知识点:物质的量的相关计算2
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 我国科学家进行了如图所示的碳循环研究。下列说法正确的是( )
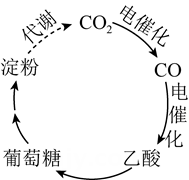 A、淀粉是多糖,在一定条件下能水解成葡萄糖 B、葡萄糖与果糖互为同分异构体,都属于烃类 C、 中含有 个电子 D、 被还原生成2. 下列说法正确的是( )A、 (标准状况)与水充分反应转移 电子 B、 和 均可通过化合反应得到 C、将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生 D、 与 溶液反应:3. 我国科研团队对废旧锂电池进行回收,提取其中有效物质,经处理后合成了LiFe0.6Mn0.4PO4 , 并将其作为正极材料重新应用于锂离子电池中,下列说法正确的是( )
A、淀粉是多糖,在一定条件下能水解成葡萄糖 B、葡萄糖与果糖互为同分异构体,都属于烃类 C、 中含有 个电子 D、 被还原生成2. 下列说法正确的是( )A、 (标准状况)与水充分反应转移 电子 B、 和 均可通过化合反应得到 C、将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生 D、 与 溶液反应:3. 我国科研团队对废旧锂电池进行回收,提取其中有效物质,经处理后合成了LiFe0.6Mn0.4PO4 , 并将其作为正极材料重新应用于锂离子电池中,下列说法正确的是( ) A、废旧锂电池中含有锂、有机电解质等物质,因此应在高温、通风条件下拆解电池,回收其中的锂 B、充电时,Li电极应与外加电源的正极相连 C、放电时,当电路中转移1 mol电子时,正极增重7 g D、充电时,该电池总反应为4. 室温下,等体积0.1mol·L-1的①NaCl ②FeCl3 ③HCl ④Na2CO3四种物质的水溶液中,所含阳离子数目由少到多的顺序是( )A、③①②④ B、③②①④ C、①④③② D、④②①③5. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、12g金刚石和石墨混合物中含有的共价键数目为2NA B、用铜电极电解饱和食盐水,若线路中通过NA个电子,则阳极产生11.2L(标准状况)气体 C、常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA D、6.8g液态KHSO4中含有0.1NA个阳离子6. 设N表示阿伏加德罗常数的值。下列说法正确的是( )A、14 g聚丙烯中含C一H键总数目为2NA B、氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA C、2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间 D、电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA7. 已知 是阿伏加德罗常数的值,下列说法正确的是( )A、 中离子总数为 B、 臭氧含有的质子数为 C、一定条件下, 与 反应生成的 分子数为 D、 溶液中 数为8. 表示阿伏加德罗常数的值,下列说法正确的是( )A、2g氘化锂( )中含中子数为 B、 与 完全反应时转移的电子数为2 C、 固体中含离子数为0.4 D、 晶体含阳离子的数目为0.29. 工业除去电石渣浆[含 ]上层清液中的 ( 浓度为 ),并抽取石膏( )的常用流程如图,其中 常用空气代替。下列说法错误的是( )
A、废旧锂电池中含有锂、有机电解质等物质,因此应在高温、通风条件下拆解电池,回收其中的锂 B、充电时,Li电极应与外加电源的正极相连 C、放电时,当电路中转移1 mol电子时,正极增重7 g D、充电时,该电池总反应为4. 室温下,等体积0.1mol·L-1的①NaCl ②FeCl3 ③HCl ④Na2CO3四种物质的水溶液中,所含阳离子数目由少到多的顺序是( )A、③①②④ B、③②①④ C、①④③② D、④②①③5. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、12g金刚石和石墨混合物中含有的共价键数目为2NA B、用铜电极电解饱和食盐水,若线路中通过NA个电子,则阳极产生11.2L(标准状况)气体 C、常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA D、6.8g液态KHSO4中含有0.1NA个阳离子6. 设N表示阿伏加德罗常数的值。下列说法正确的是( )A、14 g聚丙烯中含C一H键总数目为2NA B、氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA C、2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间 D、电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA7. 已知 是阿伏加德罗常数的值,下列说法正确的是( )A、 中离子总数为 B、 臭氧含有的质子数为 C、一定条件下, 与 反应生成的 分子数为 D、 溶液中 数为8. 表示阿伏加德罗常数的值,下列说法正确的是( )A、2g氘化锂( )中含中子数为 B、 与 完全反应时转移的电子数为2 C、 固体中含离子数为0.4 D、 晶体含阳离子的数目为0.29. 工业除去电石渣浆[含 ]上层清液中的 ( 浓度为 ),并抽取石膏( )的常用流程如图,其中 常用空气代替。下列说法错误的是( )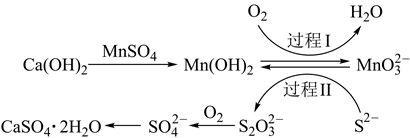 A、在普通硅酸盐水泥中,常添加石膏用来调节水泥的硬化速度 B、过程Ⅰ中,氧化剂与氧化产物的物质的量之比为2∶1 C、将10L上层清液中的 转化为 ,理论上共需标准状况下空气约22.4L D、过程Ⅱ中,反应的离子方程式10. 巴比妥为较早应用的长效类催眠药,有镇静、催眠、抗惊厥、麻醉等不同程度的中枢抑制作用,其优点是作用缓慢,维持时间长。其结构如图所示,下列有关巴比妥的说法正确的是( )
A、在普通硅酸盐水泥中,常添加石膏用来调节水泥的硬化速度 B、过程Ⅰ中,氧化剂与氧化产物的物质的量之比为2∶1 C、将10L上层清液中的 转化为 ,理论上共需标准状况下空气约22.4L D、过程Ⅱ中,反应的离子方程式10. 巴比妥为较早应用的长效类催眠药,有镇静、催眠、抗惊厥、麻醉等不同程度的中枢抑制作用,其优点是作用缓慢,维持时间长。其结构如图所示,下列有关巴比妥的说法正确的是( ) A、巴比妥是一种人工合成的多肽 B、巴比妥能够发生水解,且无论酸、碱性条件下水解均有可能生成气体 C、巴比妥含有两种官能团 D、1 mol巴比妥与足量NaOH溶液反应,可消耗2 mol NaOH11. NA是阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,2g氖气含有0.1NA个氖原子 B、常温常压下,18g重水(D2O)含有的电子数为10NA C、标准状况下,22.4LCl2与足量的铁反应,转移的电子数为NA D、一定条件下,1molN2与足量的H2充分反应,生成2NA个NH3分子12. NA代表阿伏加德罗常数的值。下列说法正确的是( )A、常温下,pH=9的 溶液中,水电离出的H+数目为10-5NA B、1molK2Cr2O7被还原为Cr3+转移的电子数目为6NA C、常温下2.24LN2中共用电子对数目为0.3NA D、1L0.1mol·L-1NH4Cl溶液中,NH 的数目为0.1NA13. 用NA表示阿伏加德罗常数,下列说法正确的是( )A、2.4g镁在空气中燃烧生成MgO和Mg3N2 , 转移电子数无法计算 B、密闭容器中,2mol SO2和1mol O2催化反应后分子总数大于2NA C、1 mol羟基中含有的电子数为10NA D、标准状况下,22.4LHCl溶于水后溶液中有NA个HCl分子14. NA为阿伏加德罗常数的值,则下列叙述正确的是( )A、1 mol
A、巴比妥是一种人工合成的多肽 B、巴比妥能够发生水解,且无论酸、碱性条件下水解均有可能生成气体 C、巴比妥含有两种官能团 D、1 mol巴比妥与足量NaOH溶液反应,可消耗2 mol NaOH11. NA是阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,2g氖气含有0.1NA个氖原子 B、常温常压下,18g重水(D2O)含有的电子数为10NA C、标准状况下,22.4LCl2与足量的铁反应,转移的电子数为NA D、一定条件下,1molN2与足量的H2充分反应,生成2NA个NH3分子12. NA代表阿伏加德罗常数的值。下列说法正确的是( )A、常温下,pH=9的 溶液中,水电离出的H+数目为10-5NA B、1molK2Cr2O7被还原为Cr3+转移的电子数目为6NA C、常温下2.24LN2中共用电子对数目为0.3NA D、1L0.1mol·L-1NH4Cl溶液中,NH 的数目为0.1NA13. 用NA表示阿伏加德罗常数,下列说法正确的是( )A、2.4g镁在空气中燃烧生成MgO和Mg3N2 , 转移电子数无法计算 B、密闭容器中,2mol SO2和1mol O2催化反应后分子总数大于2NA C、1 mol羟基中含有的电子数为10NA D、标准状况下,22.4LHCl溶于水后溶液中有NA个HCl分子14. NA为阿伏加德罗常数的值,则下列叙述正确的是( )A、1 mol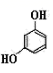 中位于同一平面的原子数目最多为14 NA
B、巯基(-SH)的电子式为
中位于同一平面的原子数目最多为14 NA
B、巯基(-SH)的电子式为 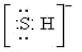 C、N2H4的结构式:
C、N2H4的结构式:  D、常温下,1L 0.2mol/L AlCl3溶液中含Al3+数为0.2NA
15. 设NA为阿伏加德罗常数的值。下列说法错误的是( )A、常温常压下,1.0molFe和足量浓硝酸混合反应,转移电子数为3NA B、等质量的乙烯和丙烯中含有的共用电子对数相等 C、常温下,1.0LpH=13的Ba(OH)2溶液中含OH-的数目为0.1NA D、0.1mol的11B中,含有0.6NA个中子16. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、3.2gN2H4与足量O2反应,完全转化为N2时转移的电子数为0.4 NA B、 由氖气与甲烷组成的混合气体中含有的电子总数为0.1 NA C、含 的浓硝酸与足量 充分反应,生成 的数目为0.1 NA D、 与含 的浓盐酸充分反应,生成 的数目为0.1 NA17. 近日,王方军研究员团队,与中科院武汉病毒研究所胡杨波研究员团队多学科交叉合作设计出了一种电化学氧化灭活新冠病毒(SARS—CoV—2)的新途径,利用电解水过程中阳极产生的活性氧物种,在实验室中实现了对新冠病毒的彻底灭活。下列说法正确的是( )
D、常温下,1L 0.2mol/L AlCl3溶液中含Al3+数为0.2NA
15. 设NA为阿伏加德罗常数的值。下列说法错误的是( )A、常温常压下,1.0molFe和足量浓硝酸混合反应,转移电子数为3NA B、等质量的乙烯和丙烯中含有的共用电子对数相等 C、常温下,1.0LpH=13的Ba(OH)2溶液中含OH-的数目为0.1NA D、0.1mol的11B中,含有0.6NA个中子16. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、3.2gN2H4与足量O2反应,完全转化为N2时转移的电子数为0.4 NA B、 由氖气与甲烷组成的混合气体中含有的电子总数为0.1 NA C、含 的浓硝酸与足量 充分反应,生成 的数目为0.1 NA D、 与含 的浓盐酸充分反应,生成 的数目为0.1 NA17. 近日,王方军研究员团队,与中科院武汉病毒研究所胡杨波研究员团队多学科交叉合作设计出了一种电化学氧化灭活新冠病毒(SARS—CoV—2)的新途径,利用电解水过程中阳极产生的活性氧物种,在实验室中实现了对新冠病毒的彻底灭活。下列说法正确的是( ) A、新冠病毒主要是被碱性溶液灭活的 B、NaCl代替Na2CO3更绿色更高效 C、a电极电势比b电极电势低 D、转移4mole-时,可以收集到标况下22.4LO218. 已知NA为阿伏加德罗常数的值,下列叙述正确的是( )A、12 g石墨烯(单层石墨)中含有六元环的个数为2NA B、100g质量分数为46%的乙醇水溶液中含有的氧原子数为NA C、在0.1mol/L的Na2CO3溶液中,阴离子总数一定大于0.1NA D、常温下,1L 0.1mol·L-1醋酸钠溶液中加入醋酸至溶液为中性,则溶液含醋酸根离子数0.1NA19. 将体积为 的某一元强酸溶液与体积为 的某一元碱溶液混合,恰好完全反应。则以上两溶液中一定相等的是( )A、溶质物质的量 B、溶液质量 C、 和 的物质的量 D、物质的量浓度20. NA为阿伏加德罗常数的值,下列说法错误的是( )A、1mol月球表面的氦 含有的质子数为2NA B、15g乙酸与甲酸甲酯的混合物中含氧原子总数为0.5NA C、2mol 和1mol 催化反应后分子总数为2NA D、物质的量均为1mol的 和 中所含阴离子数均为NA21. NA表示阿伏加德罗常数的值。下列叙述正确的是( )A、足量Cl2分别与含有0.1molFeI2的溶液、含0.1molNa2SO3的溶液反应,转移电子数均为0.2NA B、1molAl分别与足量NaOH溶液、足量稀H2SO4溶液反应,产生氢气的分子数均为1.5NA个 C、22.4LCH4与22.4LCH2=CH2混合得到的气体中含H原子数为8NA D、1mol2H37Cl比1mol3H37Cl少NA个质子22. 常温下,HN3的Ka=1.9×10-5 , 可视为一元弱酸。 设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、1 mol HN3含电子总数为16NA B、1 mol NaN3含有阴离子总数为3NA C、2LpH=3的HN3与足量Zn反应产生H2的分子数为0.001NA D、1 L0.1mol•L-1NaOH溶液中滴入HN3溶液至呈中性,溶液中N 数目为0.1NA23. 设 为阿伏加德罗常数的值。下列说法正确的是( )A、常温常压下,1L 中含有的H+数为 B、密闭容器中,2 和1 催化反应后分子总数为2 C、18g 中含有的质子数为10 D、过氧化钠与水反应时,0.1 完全反应转移电子数为0.224. NA为阿伏加德罗常数,下列叙述正确的是( )A、在常温下,1 m3 pH=4的溶液中由水电离出的H+数目一定为0.1NA B、1 L 1 mol·L-1 CH3COONH4溶液中CH3COO-与NH 数目均等于NA C、1 mol IBr与H2O完全反应生成溴化氢和次碘酸,转移的电子数为NA D、含有NA个Fe(OH)3胶粒的氢氧化铁胶体中,铁元素的质量大于56 g25. 已知 是阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4 L 和 混合气中含4 个原子 B、过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2 C、100 mL 0.1 溶液中含有的 数目为0.01 D、将0.1 mol 通入到足量的水中,溶液中 、HClO、ClO微粒总数为0.226. 代表阿伏加德罗常数的值。下列说法错误的是( )A、标准状况下, 中含有的中子数为 B、 与足量 反应时,转移的电子总数为 C、 与 充分反应后得到的气体分子数小于 D、常温下, 的 溶液中发生电离的水分子数为
A、新冠病毒主要是被碱性溶液灭活的 B、NaCl代替Na2CO3更绿色更高效 C、a电极电势比b电极电势低 D、转移4mole-时,可以收集到标况下22.4LO218. 已知NA为阿伏加德罗常数的值,下列叙述正确的是( )A、12 g石墨烯(单层石墨)中含有六元环的个数为2NA B、100g质量分数为46%的乙醇水溶液中含有的氧原子数为NA C、在0.1mol/L的Na2CO3溶液中,阴离子总数一定大于0.1NA D、常温下,1L 0.1mol·L-1醋酸钠溶液中加入醋酸至溶液为中性,则溶液含醋酸根离子数0.1NA19. 将体积为 的某一元强酸溶液与体积为 的某一元碱溶液混合,恰好完全反应。则以上两溶液中一定相等的是( )A、溶质物质的量 B、溶液质量 C、 和 的物质的量 D、物质的量浓度20. NA为阿伏加德罗常数的值,下列说法错误的是( )A、1mol月球表面的氦 含有的质子数为2NA B、15g乙酸与甲酸甲酯的混合物中含氧原子总数为0.5NA C、2mol 和1mol 催化反应后分子总数为2NA D、物质的量均为1mol的 和 中所含阴离子数均为NA21. NA表示阿伏加德罗常数的值。下列叙述正确的是( )A、足量Cl2分别与含有0.1molFeI2的溶液、含0.1molNa2SO3的溶液反应,转移电子数均为0.2NA B、1molAl分别与足量NaOH溶液、足量稀H2SO4溶液反应,产生氢气的分子数均为1.5NA个 C、22.4LCH4与22.4LCH2=CH2混合得到的气体中含H原子数为8NA D、1mol2H37Cl比1mol3H37Cl少NA个质子22. 常温下,HN3的Ka=1.9×10-5 , 可视为一元弱酸。 设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、1 mol HN3含电子总数为16NA B、1 mol NaN3含有阴离子总数为3NA C、2LpH=3的HN3与足量Zn反应产生H2的分子数为0.001NA D、1 L0.1mol•L-1NaOH溶液中滴入HN3溶液至呈中性,溶液中N 数目为0.1NA23. 设 为阿伏加德罗常数的值。下列说法正确的是( )A、常温常压下,1L 中含有的H+数为 B、密闭容器中,2 和1 催化反应后分子总数为2 C、18g 中含有的质子数为10 D、过氧化钠与水反应时,0.1 完全反应转移电子数为0.224. NA为阿伏加德罗常数,下列叙述正确的是( )A、在常温下,1 m3 pH=4的溶液中由水电离出的H+数目一定为0.1NA B、1 L 1 mol·L-1 CH3COONH4溶液中CH3COO-与NH 数目均等于NA C、1 mol IBr与H2O完全反应生成溴化氢和次碘酸,转移的电子数为NA D、含有NA个Fe(OH)3胶粒的氢氧化铁胶体中,铁元素的质量大于56 g25. 已知 是阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4 L 和 混合气中含4 个原子 B、过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2 C、100 mL 0.1 溶液中含有的 数目为0.01 D、将0.1 mol 通入到足量的水中,溶液中 、HClO、ClO微粒总数为0.226. 代表阿伏加德罗常数的值。下列说法错误的是( )A、标准状况下, 中含有的中子数为 B、 与足量 反应时,转移的电子总数为 C、 与 充分反应后得到的气体分子数小于 D、常温下, 的 溶液中发生电离的水分子数为二、多选题
-
27. 铁与不同浓度硝酸反应时,各种还原产物的相对含量与硝酸溶液浓度的关系如图,下列说法错误的是( )
 A、硝酸的浓度越大,其还原产物中高价态的成分越多 B、Fe与反应分别生成等物质的量的和时,转移电子的数目之比为1∶2 C、少量铁粉与足量的浓度为12.2mol/L硝酸反应时,反应的化学方程式为: D、用一定量的铁粉与足量的溶液反应得到标准状况下气体2.24L,则参加反应的硝酸的物质的量为0.200mol
A、硝酸的浓度越大,其还原产物中高价态的成分越多 B、Fe与反应分别生成等物质的量的和时,转移电子的数目之比为1∶2 C、少量铁粉与足量的浓度为12.2mol/L硝酸反应时,反应的化学方程式为: D、用一定量的铁粉与足量的溶液反应得到标准状况下气体2.24L,则参加反应的硝酸的物质的量为0.200mol三、非选择题
-
28. 化合物X由三种元素组成,某实验小组按如下流程进行相关实验:

化合物X在空气中加热到 , 不发生反应。
请回答:
(1)、组成X的三种元素为;X的化学式为。(2)、溶液C的溶质组成为(用化学式表示)。(3)、①写出由X到A的化学方程式。②X难溶于水,但可溶于氨水中,写出该反应的离子方程式。
(4)、设计实验,检验尾气中相对活泼的2种气体。29. 某同学设计实验确定Al(NO3)3·xH2O的结晶水数目。称取样品7.50g,经热分解测得气体产物中有NO2、O2、HNO3、H2O,其中H2O的质量为3.06g;残留的固体产物是Al2O3 , 质量为1.02g。计算:(1)、x=(写出计算过程)。(2)、气体产物中n(O2)mol。30. 燃煤废气中含有多种能回收利用的原料气,如CO2、SO2及氮氧化物等,需对其综合利用以改善环境质量。请回答下列问题:(1)、我国科学家成功实现由CO2人工合成淀粉,其中包含以下反应:由H2O分解产生H2 , 由CO2与H2合成CH3OH。已知:用处于标准状况下的各元素最稳定单质生成标准状况下1mol某纯物质的热效应称为该物质的标准摩尔生成焓(ΔfH )。由表中数据推测,H2O(1)的ΔfH (填“>”“<”或“=”)-241.8kJ·mol-1;CO2(g)与H2(g)反应生成CH3OH(g)和H2O(g)的热化学方程式为。物质
CO2(g)
H2O(g)
CH3OH(g)
ΔfH
-393.5
-241.8
-205.0
(2)、废气中的SO2经富集后与空气混合,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196kJ·mol-1。已知该反应的v正=k正·p2(SO2)·p(O2)、v逆=k逆·p2(SO3)(k正、k逆为速率常数,只与温度有关,气体分压单位为MPa),如图中曲线①表示的是(填“k正”或“k逆”),判断的理由是。
在868K、0.1MPa和催化剂作用下,混合气(体积含量:SO28.0%、O211.8%,其余气体不反应)在一恒压密闭容器内开始反应。10min后达到平衡,混合气中O2含量为10.0%,则SO2的转化率为 , 该条件下的压强平衡常数K=;工业生产中通常使用比868K低的温度,其主要考虑的因素有(填字母)。
a.反应速率 b.催化剂活性 c.原料转化率 d.生产设备
(3)、烟气中氮氧化物主要以NO形式存在,利用人工制备的O3可将其转变为能被水吸收的N2O5。该过程由以下三步基元反应组成,则生成1molN2O5需消耗O3mol。O3+NO=NO2+O2、O3+NO2=NO3+O2、NO3+NO2=N2O5
31. 三氯化氮(NCl3)是一种强氧化剂,工业上可用于漂白和消毒,实验室可由氯气通入碳酸铵溶液中制得。某化学小组利用此原理进行实验室制备三氯化氮。
回答下列问题:
(1)、装置A中仪器X的名称是 , 盛放的试剂是 , 装置A中发生反应的离子方程式为。(2)、整个装置的导管连接顺序为a→→→→→ 。(3)、装置B中发生反应的化学方程式为。(4)、装置C的作用为;装置D的作用为。(5)、三氯化氮浓度的测定:准确量取20 mL装置B中反应后的溶液,置于100 mL容量瓶中,用水稀释至刻度,摇匀,吸取25.0 mL于烧杯中,加入足量V1 mL c1 mol·L-1亚硫酸钠溶液,充分反应后,向烧杯中加入足量V2 mLc2 mol·L-1 盐酸酸化的氯化钡溶液,得沉淀mg。已知:i.Na2SO3+NCl3 +
 =Na2SO4+ HCl+NH4Cl;
=Na2SO4+ HCl+NH4Cl;ⅱ.BaCl2+Na2SO4=BaSO4↓十2HCl。
①请完成反应i的化学方程式(横线填数字,方框中填化学式):
ⅰ Na2SO3+NCl3+
 =Na2SO4+ HCl+NH4Cl
=Na2SO4+ HCl+NH4Cl②装置B反应后的溶液中三氯化氮的浓度为mol·L-1。
32. 氮化铬(CrN)是一种耐磨性良好的新型材料,难溶于水。探究小组同学用下图所示装置(夹持装置略去)在实验室中制取氮化铬并测定所得氮化铬的纯度。
已知:实验室中常用 溶液与 溶液反应制取 ; 能溶于水和乙醇。
回答下列问题:
(1)、实验准备就绪后,应先加热(填装置代号)装置,此时 所处的状态是。(2)、实验中 的作用是。(3)、改变 的状态,加热E装置。试剂a的名称是 , 写出装置E中发生反应的化学方程式。(4)、实验过程中需间歇性微热b处导管的目的是。(5)、向 所得 中加入足量 溶液,然后通入水蒸气将 全部蒸出,将 用 溶液完全吸收,剩余的 用 溶液恰好中和,则所得产品中 的质量分数为。33. 某兴趣小组探究钠与水、盐酸、醋酸和乙醇反应的快慢。(1)、兴趣小组成员根据已有认知模型提出以下猜测:猜测1:钠分别与水、盐酸反应,由于 , 钠与盐酸反应更快。
猜测2:钠分别与乙醇、醋酸反应,由于醋酸 , 钠与醋酸反应更快。
(2)、设计实验进行“证实与证伪”实验I配制一定浓度的HCl
①用12.00mol·L-1HCl配制0.50mol·L-1HCl和5.00mol·L-1HCl时,除用到烧杯、胶头滴管、玻璃棒外,还必须用到下列仪器中的(写对应字母)。

②配制0.50mol·L-1HCl250mL,需要取用12.00mol·L-1浓盐酸的体积为。
实验II相同温度下,比较钠与水、0.50mol·L-1HCl、5.00mol·L-1HCl反应的快慢
序号
钠块(形状几乎相同)
反应液体(50mL)
钠块消失时间
Ⅰ
0.15g
水
Ⅱ<Ⅰ<Ⅲ
Ⅱ
0.15g
0.50mol·L-1HCl
Ⅲ
0.15g
5.00mol·L-1HCl
该小组查阅资料知,相同温度下,影响钠与盐酸反应速率的主要因素是c(H+)和钠表面的c(Na+)。
③钠与5.00mol·L-1HCl反应,速率最慢的原因可能是。
实验II相同温度下,比较钠与乙醇、醋酸反应的快慢
序号
钠块(形状几乎相同)
反应液体(50mL)
反应现象
钠块消失时间
ⅳ
0.15g
乙醇
钠沉在烧杯底部,产生气泡较快
ⅳ<ⅴ
ⅴ
0.15g
冰醋酸
钠浮在液体表面,产生气泡较慢
④该小组某同学提出,依据化学实验的控制变量思想,该实验设计存在缺陷,该缺陷是。
⑤请你帮助该小组设计新的方案,对上述实验进行改进。
实验结论:
⑥通过实验探究,该小组同学认为钠与醋酸反应比钠与乙醇反应慢,原因可能是。
A.冰醋酸是无水乙酸,无水情况下难以电离出氢离子
B.乙醇钠在乙醇中的溶解度大于乙酸钠在乙酸中的溶解度
C.乙酸羧基中的氢原子比乙醇羟基中的氢原子更难电离出氢离子
34. 二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸。一种新型实验室制备方法的装置如图所示:
分液漏斗及2号气瓶中盛放浓度为150g·L-1的NaClO2溶液,1号气瓶中盛放6mol·L-1的H2SO4溶液,3号、4号、5号、6号气瓶中盛放冰水。回答下列问题:
(1)、配制500mLNaClO2溶液,需NaClO2固体g。(2)、按图连接好各仪器, , 加注相应试剂,并抽真空。(3)、打开分液漏斗活塞,让NaClO2溶液缓慢滴入1号气瓶,生成ClO2和一种气体单质。该反应的化学方程式为。(4)、2号气瓶可吸收1号气瓶中产生的气体单质并继续产生ClO2 , 发生反应的离子方程式为 , 检验还原产物离子的试剂是。(5)、此制备方法不需要设置尾气处理装置,原因是。(6)、制取完毕后,利用滴定法测定所得溶液中ClO2浓度,滴定20.00mLClO2溶液消耗0.1000mol·L-1Na2S2O3溶液25.00mL,则ClO2含量为g·L-1。35. 三氧化钨(WO3)可用于制造钨丝、高熔点合金、硬质合金和防火材料等。一种利用黑钨矿(主要含FeWO4、MnWO4及硅、磷、砷、钼等杂质)制备WO3的工艺流程如图所示。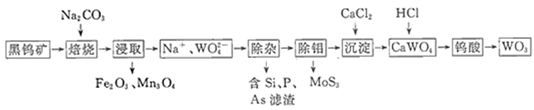
回答下列问题:
(1)、写出两种对提高“焙烧”和“浸取”阶段转化率均有效的措施、。(2)、写出FeWO4在“焙烧”阶段时反应的化学方程式 , 该反应的氧化产物用途有、。(3)、“除钼”阶段中,仲钼酸铵[(NH4)6Mo7O24]与(NH4)2S在溶液中反应生成硫代钼酸铵[(NH4)2MoS4],试写出该反应的化学方程式。(4)、“沉淀”阶段中,要使 浓度降至1×10-3mol·L-1以下,CaCl2在溶液中的浓度应不低于 [Ksp(CaWO4)=2.5×10-3],滤液经稀释后应返回阶段循环利用。(5)、有一种蓝钨WO3-x , 钨的化合价为+5和+6,若x=0.15,则该化合物中+5和+6的钨原子物质的量之比为。
-