高考二轮复习知识点:物质结构中的化学键数目计算2
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 下列叙述正确的是A、24 g 镁与27 g铝中,含有相同的质子数 B、同等质量的氧气和臭氧中,电子数相同 C、1 mol重水与1 mol水中,中子数比为2∶1 D、1 mol乙烷和1 mol乙烯中,化学键数相同2. NA为阿伏加德罗常数的值.下列说法正确的是( )A、0.1 mol 的11B中,含有0.6NA个中子 B、pH=1的H3PO4溶液中,含有0.1NA个H+ C、2.24L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子 D、密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加2NA个P﹣Cl键3. 为阿伏加德罗常数的值。下列叙述正确的是( )A、18g 中含有的质子数目为10 B、32g 中含有共价键的数目为5 C、1mol·L-1的硝酸中含有 的数目为 D、标准状况下,11.2L苯中含有碳原子的数目为34. NA为阿伏加德罗常数的值,下列说法正确的是( )A、一定条件下,1mol N2与足量 H2反应可生成NH3的数目为2NA B、34 g
 中含有的极性键数目为2NA
C、在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3mol Cl2转移的电子数为6NA
D、25℃时,1 L pH=13的Ba(OH)2溶液中Ba2+数目为0.05 NA
5. 设NA表示阿伏加德罗常数的值。下列说法正确的是( )A、铜与浓硝酸充分反应生成22.4L气体时转移电子数为NA B、4.6gNa完全与水反应,生成共价键0.1NA C、Al3++4OH-=[Al(OH)4]- , 说明1molAl(OH)3电离出H+数为NA D、101kPa、120℃时,7.8gC6H6燃烧所得气体分子数一定为0.9NA6. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、6.0g正丙醇中含有共价键的总数为NA B、0.1molCu与足量硫单质充分反应,转移的电子数为0.2NA C、0.1mol/L的NaCl溶液中含有的阴、阳离子总数共有0.2NA D、标准状况下,11.2L由甲烷和乙烯组成的混合气体中所含氢原子数为2NA7. 下列各项比较中,一定相等的是( )A、相同物质的量浓度的氨水和NH4Cl溶液中的 的物质的量浓度 B、相同物质的量的Na分别完全转化为Na2O和Na2O2时转移电子的数目 C、相同物质的量的正丁烷和2-甲基丁烷中含有的C―H键的数目 D、标准状况下,相同体积的乙炔和水中含有的H原子的数目8. 设阿伏加德罗常数的值为NA。下列说法正确的是( )A、pH=13的Ba(OH)3溶液中Ba2+数目为0.1NA B、标准状况下,1.12L苯含有C-H键的个数为3NA C、7.8gNa2S与7.8gNa2O2中含有的阴离子数目均为0.1NA D、1molCl2和Fe在一定条件下充分反应,转移电子数为3NA9. 用 表示阿伏加德罗常数的值,下列说法正确的是( )A、22.4L氮气中含有7 个中子 B、 比 多 个质子 C、48g正丁烷和10g异丁烷的混合物中共价键数目为13 D、1L0.1mol/L醋酸钠溶液含有的 的数目为0.110. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、2L0.5mol/LCH3COOH溶液中含有H+的数目为NA B、23gNa与足量H2O反应完全后生成H2的体积为11.2L C、密闭容器中2molSO2与1molO2充分反应,产物的分子数为2NA D、物质的量相同的
中含有的极性键数目为2NA
C、在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3mol Cl2转移的电子数为6NA
D、25℃时,1 L pH=13的Ba(OH)2溶液中Ba2+数目为0.05 NA
5. 设NA表示阿伏加德罗常数的值。下列说法正确的是( )A、铜与浓硝酸充分反应生成22.4L气体时转移电子数为NA B、4.6gNa完全与水反应,生成共价键0.1NA C、Al3++4OH-=[Al(OH)4]- , 说明1molAl(OH)3电离出H+数为NA D、101kPa、120℃时,7.8gC6H6燃烧所得气体分子数一定为0.9NA6. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、6.0g正丙醇中含有共价键的总数为NA B、0.1molCu与足量硫单质充分反应,转移的电子数为0.2NA C、0.1mol/L的NaCl溶液中含有的阴、阳离子总数共有0.2NA D、标准状况下,11.2L由甲烷和乙烯组成的混合气体中所含氢原子数为2NA7. 下列各项比较中,一定相等的是( )A、相同物质的量浓度的氨水和NH4Cl溶液中的 的物质的量浓度 B、相同物质的量的Na分别完全转化为Na2O和Na2O2时转移电子的数目 C、相同物质的量的正丁烷和2-甲基丁烷中含有的C―H键的数目 D、标准状况下,相同体积的乙炔和水中含有的H原子的数目8. 设阿伏加德罗常数的值为NA。下列说法正确的是( )A、pH=13的Ba(OH)3溶液中Ba2+数目为0.1NA B、标准状况下,1.12L苯含有C-H键的个数为3NA C、7.8gNa2S与7.8gNa2O2中含有的阴离子数目均为0.1NA D、1molCl2和Fe在一定条件下充分反应,转移电子数为3NA9. 用 表示阿伏加德罗常数的值,下列说法正确的是( )A、22.4L氮气中含有7 个中子 B、 比 多 个质子 C、48g正丁烷和10g异丁烷的混合物中共价键数目为13 D、1L0.1mol/L醋酸钠溶液含有的 的数目为0.110. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、2L0.5mol/LCH3COOH溶液中含有H+的数目为NA B、23gNa与足量H2O反应完全后生成H2的体积为11.2L C、密闭容器中2molSO2与1molO2充分反应,产物的分子数为2NA D、物质的量相同的 和CH3CHO所含共价键数目相同
11. NA为阿伏加德罗常数的值,下列说法错误的是( )A、标准状况下,5.6L甲烷和乙烯的混合气体中所含碳氢键数为NA B、足量镁与一定体积的浓硫酸反应,产生气体2.24L(标准状况),则转移的电子数为0.2NA C、含7.8gNa2S的溶液中阴离子总数大于0.1NA D、向100mL1mol•L-1稀盐酸中逐滴加入含0.1molNa2CO3的溶液,则混和液中:N(CO32-)+N(HCO3-)+N(H2CO3)=0.1NA12. 设 表示阿伏加德罗常数的值,下列说法错误的是( )A、56g铁在足量氧气中完全燃烧,转移的电子数小于 B、在 反应中,若有212g氯气生成,则反应中电子转移的数目为 C、 和 的混合物中所含中子数为 D、常温下, 溶液的 ,则溶液中 与 的数目均为13. 设NA表示阿伏加德罗常数的值。下列说法正确的是( )A、1 mol I2与4 mol H2反应生成的HI分子数为2NA B、标准状况下,2. 24 L H2O含有的电子数为NA C、1 L 0.1 mol/L的NH4NO3溶液中含有的氮原子数为0.2NA D、7.8 g苯中碳碳双键的数目为0.3NA14. 某离子化物MCl(s)在水中溶解并发生电离,该过程的微观示意图如图。已知NA为阿伏加德罗常数的值。下列相关说法正确的是( )
和CH3CHO所含共价键数目相同
11. NA为阿伏加德罗常数的值,下列说法错误的是( )A、标准状况下,5.6L甲烷和乙烯的混合气体中所含碳氢键数为NA B、足量镁与一定体积的浓硫酸反应,产生气体2.24L(标准状况),则转移的电子数为0.2NA C、含7.8gNa2S的溶液中阴离子总数大于0.1NA D、向100mL1mol•L-1稀盐酸中逐滴加入含0.1molNa2CO3的溶液,则混和液中:N(CO32-)+N(HCO3-)+N(H2CO3)=0.1NA12. 设 表示阿伏加德罗常数的值,下列说法错误的是( )A、56g铁在足量氧气中完全燃烧,转移的电子数小于 B、在 反应中,若有212g氯气生成,则反应中电子转移的数目为 C、 和 的混合物中所含中子数为 D、常温下, 溶液的 ,则溶液中 与 的数目均为13. 设NA表示阿伏加德罗常数的值。下列说法正确的是( )A、1 mol I2与4 mol H2反应生成的HI分子数为2NA B、标准状况下,2. 24 L H2O含有的电子数为NA C、1 L 0.1 mol/L的NH4NO3溶液中含有的氮原子数为0.2NA D、7.8 g苯中碳碳双键的数目为0.3NA14. 某离子化物MCl(s)在水中溶解并发生电离,该过程的微观示意图如图。已知NA为阿伏加德罗常数的值。下列相关说法正确的是( ) A、1molMCl中含有NA对共用电子对 B、MCl为弱电解质,在水中仅部分电离 C、M+和Cl-均与水分子中的氧原子结合形成水合离子 D、MCl在水作用下的溶解和电离过程是物理变化15. 下列各项比较中,一定相等的是( )A、相同物质的量浓度的 CH3COOH 和 CH3COONa 溶液中的 c(CH3COO-) B、相同质量的钠分别完全转化为 Na2O 和 Na2O2 时转移的电子数 C、相同物质的量的丙烷和 2-甲基丙烷中所含 C—H键的数目 D、标准状况下,相同体积的乙炔和苯中所含的H原子数16. 设NA为阿伏加德罗常数的值。下列叙述正确的是( )A、17g H2O2中含有非极性键的数目为NA B、常温常压下,17g甲基(-14CH3)所含的中子数为9NA C、在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA D、13. 8g NO2与足量水反应,转移的电子数为0.2NA17. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、1 mol CH2=CH2分子中含有的共价键数为6NA B、500 mL 0.5 mol·L−1的NaCl溶液中微粒数大于0.5NA C、30 g HCHO与CH3COOH混合物中含C原子数为NA D、2.3 g Na与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间18. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是()A、室温下pH=11的Na2CO3溶液10L,由水电离出的OHˉ数目为0.01NA B、1.0L1.0mo/L的 NaAlO2溶液中含氧原子数为2NA C、标准状况下,22.4L己烷含有共价键数为19NA D、常温下,13.6gNH3和21.3gCl2混合充分反应后,转移电子数为2.4NA19. NA为阿伏加德罗常数的值,下列说法正确的是()A、1molSiO2晶体中,含有Si−O键的数目为2NA B、16.8g铁粉与足量高温水蒸气反应,转移电子数为0.8NA C、1mol·L−AlCl3溶液中,含有Cl−的数目为3NA D、18gD2O和H2O的混合物中,含有的中子数为9NA20. NA为阿伏加德罗常数的值,下列说法正确的是( )A、常温下pH=2的CH3COOH溶液中,H+的数目为0.01NA B、常温常压下,18 gD2O含有的质子数为10NA C、标准状况下,11.2 L乙烯和环丙烷(C3H6)的混合气体中,共用电子对数目为3NA D、0.1 molCu溶于足量稀硝酸中,转移的电子数为0.2 NA21. 设为阿伏加德罗常数的值。下列叙述正确的是( )A、78g苯含有碳碳双键的数目为3 B、46g乙醇中的极性键数目为7 C、晶体中含有数目小于0.5 D、标准状况下,22.4L丙炔含有的π键数目为22. 下列说法正确的是( )
A、1molMCl中含有NA对共用电子对 B、MCl为弱电解质,在水中仅部分电离 C、M+和Cl-均与水分子中的氧原子结合形成水合离子 D、MCl在水作用下的溶解和电离过程是物理变化15. 下列各项比较中,一定相等的是( )A、相同物质的量浓度的 CH3COOH 和 CH3COONa 溶液中的 c(CH3COO-) B、相同质量的钠分别完全转化为 Na2O 和 Na2O2 时转移的电子数 C、相同物质的量的丙烷和 2-甲基丙烷中所含 C—H键的数目 D、标准状况下,相同体积的乙炔和苯中所含的H原子数16. 设NA为阿伏加德罗常数的值。下列叙述正确的是( )A、17g H2O2中含有非极性键的数目为NA B、常温常压下,17g甲基(-14CH3)所含的中子数为9NA C、在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA D、13. 8g NO2与足量水反应,转移的电子数为0.2NA17. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、1 mol CH2=CH2分子中含有的共价键数为6NA B、500 mL 0.5 mol·L−1的NaCl溶液中微粒数大于0.5NA C、30 g HCHO与CH3COOH混合物中含C原子数为NA D、2.3 g Na与O2完全反应,反应中转移的电子数介于0.1NA和0.2NA之间18. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是()A、室温下pH=11的Na2CO3溶液10L,由水电离出的OHˉ数目为0.01NA B、1.0L1.0mo/L的 NaAlO2溶液中含氧原子数为2NA C、标准状况下,22.4L己烷含有共价键数为19NA D、常温下,13.6gNH3和21.3gCl2混合充分反应后,转移电子数为2.4NA19. NA为阿伏加德罗常数的值,下列说法正确的是()A、1molSiO2晶体中,含有Si−O键的数目为2NA B、16.8g铁粉与足量高温水蒸气反应,转移电子数为0.8NA C、1mol·L−AlCl3溶液中,含有Cl−的数目为3NA D、18gD2O和H2O的混合物中,含有的中子数为9NA20. NA为阿伏加德罗常数的值,下列说法正确的是( )A、常温下pH=2的CH3COOH溶液中,H+的数目为0.01NA B、常温常压下,18 gD2O含有的质子数为10NA C、标准状况下,11.2 L乙烯和环丙烷(C3H6)的混合气体中,共用电子对数目为3NA D、0.1 molCu溶于足量稀硝酸中,转移的电子数为0.2 NA21. 设为阿伏加德罗常数的值。下列叙述正确的是( )A、78g苯含有碳碳双键的数目为3 B、46g乙醇中的极性键数目为7 C、晶体中含有数目小于0.5 D、标准状况下,22.4L丙炔含有的π键数目为22. 下列说法正确的是( )A
B
C
D




一个NaCl晶胞中含有6个Na+和6个Cl-
CaF2晶胞中F-配位数为8,Ca2+配位数为4
二氧化硅晶体中,硅原子与硅氧键个数比为1:2
石墨晶体是层状结构,图中7个六元环完全占有的碳原子数为14
A、A B、B C、C D、D23. 以和为原料制备高纯度次氯酸的机理如图,V为元素钒,其最高化合价为+5价,、分别为两种不同氨基酸,下列说法正确的是( ) A、该机理中化合物A是中间产物 B、反应过程中,钒的成键数目不变 C、该催化循环过程中有氢氧键的断裂和形成 D、该过程的总反应为:24. 代表阿伏加德罗常数的值。下列说法正确的是( )A、溶液中,所含的数目为0.2 B、23g与足量反应完全后可生成个分子 C、在氧气中点燃并充分反应,失去3个电子 D、已知 , 若反应放出242热量,则形成2个共价键25. 设NA为阿伏加德罗常数的值。下列说法不正确的是( )A、标准状况下,2.24L氖气含有的质子数为NA B、常温常压下,0.1mol12C18O2含有的中子数为2.6NA , 电子数为2.2NA C、1mol雄黄(As4S4 ,
A、该机理中化合物A是中间产物 B、反应过程中,钒的成键数目不变 C、该催化循环过程中有氢氧键的断裂和形成 D、该过程的总反应为:24. 代表阿伏加德罗常数的值。下列说法正确的是( )A、溶液中,所含的数目为0.2 B、23g与足量反应完全后可生成个分子 C、在氧气中点燃并充分反应,失去3个电子 D、已知 , 若反应放出242热量,则形成2个共价键25. 设NA为阿伏加德罗常数的值。下列说法不正确的是( )A、标准状况下,2.24L氖气含有的质子数为NA B、常温常压下,0.1mol12C18O2含有的中子数为2.6NA , 电子数为2.2NA C、1mol雄黄(As4S4 , )分子中,含有的极性键数为8NA
D、0.1mol(H2与Cl2)的混合气体充分反应后,体系中含有共价键总数为0.2NA
)分子中,含有的极性键数为8NA
D、0.1mol(H2与Cl2)的混合气体充分反应后,体系中含有共价键总数为0.2NA
二、多选题
-
26. 用表示阿伏加德罗常数的值,下列叙述错误的是( )A、在标准状况下,中所含原子总数为 B、中含有非极性共价键的数目为 C、聚乙烯中含有碳碳双键的数目为 D、苯中含有碳碳双键的数目为27. 设 为阿伏加德罗常数的值,下列说法正确的是( )A、 中所含共价键数目为 B、标准状况下, 环己烷中所含碳原子数目为 C、 乙酸乙酯和乙醛的混合物充分燃烧,消耗氧气分子数目为 D、 乙醇溶液与足量 反应生成氢气分子数为
三、非选择题
-
28. 下表是前20号元素中的部分元素的一些数据:
A
B
C
D
E
F
G
H
I
J
原子半径(10-10m)
1.02
2.27
0.74
1.43
0.77
1.10
0.99
1.86
0.75
1.17
最高价态
+6
+1
-
+3
+4
+5
+7
+1
+5
+4
最低价态
-2
-
-2
-
-4
-3
-1
-
-3
-4
试回答下列问题:
(1)、以上10种元素电负性最大的是(填元素符号)。比元素B原子序数大7的元素在元素周期表中的位置:第周期,第族,其基态原子的核外电子排布式是。(2)、H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)。(3)、元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成个σ键,个π键。(4)、I与氢元素形成的10电子分子X的空间构型为;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为 , 其中X与Cu2+之间以键结合。(5)、下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a.。
b.。
(6)、如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为 , 若晶胞边长为a cm,则晶体的密度为(用含a、NA的代数式表示)(g/mL)。 29. 氮元素可以形成多种化合物,回答以下问题;(1)、基态氮原子的轨道表示式是。(2)、肼( )分子可视为 分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。
29. 氮元素可以形成多种化合物,回答以下问题;(1)、基态氮原子的轨道表示式是。(2)、肼( )分子可视为 分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。①写出与 分子互为等电子体的一种离于的化学式。
②肼( )是分子(填极性分子或非极性分子)。
③肼可用作火箭燃料,燃烧时发生的反应是:
若该反应中有4mol N-H键断裂,则形成的 键有mol。
(3)、图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是(填标号)。
a. b. c. d.
30. 碳元素单质及其化合物有多种形式,其在生产生活中有多种用途(1)、如图是碳单质的三种晶体的局部结构图,请按要求填写完善表格
物质
结构图标号
晶体类型
晶体熔化破坏的作用力
碳原子杂化方式
石墨
(2)、金刚石晶体中,24g金刚石中含有的 C—C 键数目为。(3)、硅、碳化硅的结构都与金刚石类似,这三种结构相似晶体的熔点由高到低顺序是请用文字解释原因:。(4)、如图是碳化硅的晶胞结构,已用黑球表示了其中一个硅原子,请在晶胞图中把其它硅原子涂黑。
若碳化硅晶胞边长为apm,阿伏加德罗常数为NA , 则碳化硅晶体的密度为(列出计算式即可)g/cm3。
31. Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。(1)、基态Co原子的价电子排布式为 , Co3+核外3d能级上有对成对电子。
(2)、Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+ 的配位数是 , 1mol 配离子中所含σ键的数目为 , 配位体N3-中心原子杂化类型为。(3)、Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+ ,其原因是。(4)、某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN- , K+位于立方体的某恰当位置上。据此可知该晶体的化学式为 , 立方体中Fe2+间连接起来形成的空间构型是。(5)、NiO的晶体结构如图甲所示,其中离子坐标参数A 为(0,0,0),B为(1,1,0),则C离子坐标参数为。 (6)、一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为g(用含a、NA的代数式表示)。32. 元素周期表是科学界最重要的成就之一。作为一种独特的工具,它使科学家能够预测地球上和宇宙中物质的外观、性质及结构等。(1)、通常制造的农药含元素F、P、S、Cl。四种元素的电负性从大到小的顺序为;第一电离能从大到小的顺序为。(2)、科学家曾利用元素周期表寻找F、Cl的含碳化合物作为制冷剂。已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,若要求制冷剂沸点介于两者之间,则含一个碳原子的该制冷剂可以是(写出其中一种的化学式)。(3)、1963年以来科学家借助射电望远镜,在星际空间已发现NH3、HC≡C-C≡N等近两百种星际分子。与NH3互为等电子体的阳离子为;HC≡C-C≡N分子中 键与 键的数目比n( )∶n( )=。(4)、过渡元素(包括稀土元素)中可寻找各种优良催化剂。Sc的一种氢化物的晶胞结构如图所示,该氢化物的化学式为。
(6)、一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为g(用含a、NA的代数式表示)。32. 元素周期表是科学界最重要的成就之一。作为一种独特的工具,它使科学家能够预测地球上和宇宙中物质的外观、性质及结构等。(1)、通常制造的农药含元素F、P、S、Cl。四种元素的电负性从大到小的顺序为;第一电离能从大到小的顺序为。(2)、科学家曾利用元素周期表寻找F、Cl的含碳化合物作为制冷剂。已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,若要求制冷剂沸点介于两者之间,则含一个碳原子的该制冷剂可以是(写出其中一种的化学式)。(3)、1963年以来科学家借助射电望远镜,在星际空间已发现NH3、HC≡C-C≡N等近两百种星际分子。与NH3互为等电子体的阳离子为;HC≡C-C≡N分子中 键与 键的数目比n( )∶n( )=。(4)、过渡元素(包括稀土元素)中可寻找各种优良催化剂。Sc的一种氢化物的晶胞结构如图所示,该氢化物的化学式为。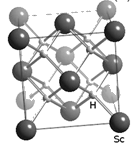 33. 铜的化合物用途非常广泛。已知下列反应:[Cu(NH3)2]++NH3+CO [Cu(NH3)3CO]+ , 2CH3COOH+2CH2=CH2+O2
33. 铜的化合物用途非常广泛。已知下列反应:[Cu(NH3)2]++NH3+CO [Cu(NH3)3CO]+ , 2CH3COOH+2CH2=CH2+O2 2CH3COOCH=CH2+2H2O。 (1)、Cu2+基态核外电子排布式为。(2)、NH3分子空间构型为。(3)、CH3COOCH=CH2分子中碳原子轨道的杂化类型是 , 1molCH3COOCH=CH2中含 键数目为。(4)、CH3COOH可与H2O混溶,除因为它们都是极性分子外,还因为。(5)、配离子[Cu(NH3)3CO]+中NH3及CO中的C与Cu(Ⅰ)形成配位键。不考虑空间构型,[Cu(NH3)3CO]+的结构可用示意图表示为。34. 请用C、H、O、N、S 五种元素回答下列问题(1)、除H 外,其它四种元素中,第一电离能最大的元素基态原子电子排布图为 , 电负性最大的元素基态原子核外电子运动状态共有种。(2)、五种元素中,由其中两种元素构成甲、乙、丙、丁四种分子,所含原子的数目依次为3、4、6、8,都含有18 个电子。甲和乙的主要物理性质比较如下:
2CH3COOCH=CH2+2H2O。 (1)、Cu2+基态核外电子排布式为。(2)、NH3分子空间构型为。(3)、CH3COOCH=CH2分子中碳原子轨道的杂化类型是 , 1molCH3COOCH=CH2中含 键数目为。(4)、CH3COOH可与H2O混溶,除因为它们都是极性分子外,还因为。(5)、配离子[Cu(NH3)3CO]+中NH3及CO中的C与Cu(Ⅰ)形成配位键。不考虑空间构型,[Cu(NH3)3CO]+的结构可用示意图表示为。34. 请用C、H、O、N、S 五种元素回答下列问题(1)、除H 外,其它四种元素中,第一电离能最大的元素基态原子电子排布图为 , 电负性最大的元素基态原子核外电子运动状态共有种。(2)、五种元素中,由其中两种元素构成甲、乙、丙、丁四种分子,所含原子的数目依次为3、4、6、8,都含有18 个电子。甲和乙的主要物理性质比较如下:熔点/K
沸点/ K
标准状况时在水中的溶解度
甲
187
202
2.6
乙
272
423
以任意比互溶
①1mol 乙分子含有个σ键;
②丁分子的中心原子采取杂化方式;甲分子的VSEPR模型为 , 丙分子为 (“极性”或“非极性”) 分子。
35. 我国已经成功研制出了碱金属的球碳盐K3C60。实验测知该物质在熔融状态下可以导电,而且在超临界温度18K时具有超导性。(1)、你猜测一下K3C60中含有什么样的化学键?(2)、1molK3C60含有的离子数目为多少?(3)、K3C60中的C60俗称足球烯,分子结构酷似足球,由12个正五边形与20个正六边形构成,碳碳键长介于碳碳单键与双键之间,你能推测一下其中碳的杂化方式吗?