高考二轮复习知识点:物质结构中的化学键数目计算1
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 代表阿伏加德罗常数的值。下列说法正确的是( )A、 中含有的电子数为1.3 B、 中含有的共价键的数目为0.1 C、 肼 含有的孤电子对数为0.2 D、 ,生成 乙烷时断裂的共价键总数为2. 设 为阿伏加德罗常数的值。下列说法正确的是( )A、 含有 键的数目为 B、 的盐酸含有阴离子总数为 C、 与 混合后的分子数目为 D、 与足量 反应生成的 分子数目为3. 绿矾()分解可制备铁红,同时产生、和。设NA为阿伏加德罗常数的值,下列说法错误的是A、溶液含有的阳离子数大于NA B、0.5mol三聚分子(
 )中含有σ键数目为6 NA
C、绿矾分解生成16g时,转移电子数为0.2 NA
D、22.4L溶于水,溶液中、、的数目总和为NA
4. 设NA表示阿伏加德罗常数的值,下列叙述中正确的是A、含4.8g碳元素的石墨晶体中的共价键数是0.8NA B、标准状况下,甲烷和氧气的混合气体共22.4L,完全燃烧后产物的分子总数可能为NA C、10g的D2O中含有的质子数与中子数分别为5NA和4NA D、常压、500℃、催化条件下,1molSO2和0.5molO2充入一密闭容器内,充分反应后的生成物分子数为NA5. 2021年9月,中国科学院天津工业生物技术研究所在实验室首次颠覆性地实现了从二氧化碳到淀粉分子的全合成,这是中国科学家在人工合成淀粉方面取得的原创性突破。下列有关说法中错误的是( )
)中含有σ键数目为6 NA
C、绿矾分解生成16g时,转移电子数为0.2 NA
D、22.4L溶于水,溶液中、、的数目总和为NA
4. 设NA表示阿伏加德罗常数的值,下列叙述中正确的是A、含4.8g碳元素的石墨晶体中的共价键数是0.8NA B、标准状况下,甲烷和氧气的混合气体共22.4L,完全燃烧后产物的分子总数可能为NA C、10g的D2O中含有的质子数与中子数分别为5NA和4NA D、常压、500℃、催化条件下,1molSO2和0.5molO2充入一密闭容器内,充分反应后的生成物分子数为NA5. 2021年9月,中国科学院天津工业生物技术研究所在实验室首次颠覆性地实现了从二氧化碳到淀粉分子的全合成,这是中国科学家在人工合成淀粉方面取得的原创性突破。下列有关说法中错误的是( ) A、反应①中二氧化碳被还原,氧化剂和还原剂的物质的量之比为3:1 B、该技术要得以推广,所需的大量氢气可以来自光伏电解X C、反应②涉及极性键与非极性键的断裂和生成 D、该技术的开发实现了无机物向有机物的转化,对缓解粮食危机具有重大意义6. 设NA为阿伏加德罗常数的值,下列说法中正确的是( )A、0.1mol·L-1 AlCl3溶液含Cl- 为0.3NA B、92g NO2和92g N2O4都含有4NA个氧原子 C、标准状况下,22.4L CCl4中共价键数目为4NA D、0.1mol氯气通入足量FeBr2溶液中,被氧化的Br-数为0.2NA7. 某实验室开发了如图所示的一种电解装置,可实现电解海水制氢气,同时处理含的碱性工业废水,使在电极上直接放电实现产物无害化。下列说法正确的是( )
A、反应①中二氧化碳被还原,氧化剂和还原剂的物质的量之比为3:1 B、该技术要得以推广,所需的大量氢气可以来自光伏电解X C、反应②涉及极性键与非极性键的断裂和生成 D、该技术的开发实现了无机物向有机物的转化,对缓解粮食危机具有重大意义6. 设NA为阿伏加德罗常数的值,下列说法中正确的是( )A、0.1mol·L-1 AlCl3溶液含Cl- 为0.3NA B、92g NO2和92g N2O4都含有4NA个氧原子 C、标准状况下,22.4L CCl4中共价键数目为4NA D、0.1mol氯气通入足量FeBr2溶液中,被氧化的Br-数为0.2NA7. 某实验室开发了如图所示的一种电解装置,可实现电解海水制氢气,同时处理含的碱性工业废水,使在电极上直接放电实现产物无害化。下列说法正确的是( ) A、中,键和键数目之比为5∶1 B、NiCo@C电极处理时发生的反应为: C、离子交换膜应选用阴离子交换膜 D、该电解池工作时,阴极附近溶液的pH逐渐增大8. 化合物
A、中,键和键数目之比为5∶1 B、NiCo@C电极处理时发生的反应为: C、离子交换膜应选用阴离子交换膜 D、该电解池工作时,阴极附近溶液的pH逐渐增大8. 化合物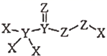 是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z为原子序数依次增大的短周期元素。下列叙述正确的是( ) A、原子半径:Z>Y>X B、Z的第一电离能比同周期相邻元素都大 C、1mol该化合物分子中含有的非极性键数目为2NA D、该化合物中X、Y、Z都满足8电子稳定结构9. 用NA表示阿伏加德罗常数的值,下列叙述错误的是( )A、0.1 mol苯乙烯中碳碳双键的数目为0.1NA B、常温下,46 g由NO2和甲硫醛( H2CS)组成的混合物中含有的分子数为NA C、标准状况下,2.24 LNH3中含有的共价键数目为0.3NA D、100 mL0.1 mol/LNa3AsO4溶液中阴离子总数大于0.01NA10. 已知NA为阿伏加德罗常数的值。下列说法正确的是( )A、1molNH4F晶体中含有共价键数目为4NA B、1L0.1mol/L磷酸钠溶液含有的 数目与0.1L1mol/L磷酸钠溶液含有的 数目相等 C、标况下,3.36LHF中含有的质子数为1.5NA D、60gSiO2晶体中含有的Si-O键数目为2NA11. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、7.8g苯中含碳碳双键的数目为3NA B、16.25gFeCl3水解形成的氢氧化铁胶体粒子数为0.1NA C、1molCH4与1molCl2在光照下充分反应,生成CH3Cl的分子数为NA D、3g3He含有的中子数为NA12. 设NA为阿伏加德罗常数的值,下列有关说法正确的是( )A、14g乙烯和环丙烷的混合物中含C-H键数目为2NA B、标准状况下,2.24L环己烷的分子数为0.1NA C、常温常压下,1mol氨基(-NH2)含有的电子数为10NA D、36g由35Cl和37Cl组成的氯气中所含质子数一定为17NA13. 设NA表示阿伏加德罗常数的值。下列叙述错误的是( )A、标准状况下,1 mol Fe在22.4 L Cl2中完全燃烧时转移电子数为3NA B、6.5gNaN3中含有的阴离子数目为0.1NA C、常温下,0.1 mol环丙烷中含有的共价键数为0.9NA D、1 L 0.1 mol·L-1 Na2S溶液中S2-数目与HS-数目之和小于0.1NA14. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4LSO3中含有的分子数约为1NA B、1mol白磷P4固体所含共价键数目为4NA C、78gNa2O2晶体所含离子的微粒数为3NA D、常温常压下,22.4L氯气溶于水,转移电子数为1NA15. NA是阿伏加德罗常数的值。下列说法正确的是( )A、32gO2中所含的质子数为32NA B、25℃时,pH=12的NaOH溶液中OH-数目为0.01NA C、100g3.4%的H2O2溶液中所含的极性键数目为0.2NA D、标准状况下,H2和CO的混合气体22.4L完全燃烧,转移的电子数为2NA16. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、30gC2H6中含有极性共价键的数目为7NA B、标准状况下,11.2LHF中含有质子的数目为5NA C、5.6gFe与足量稀硝酸反应,转移电子的数目为0.2NA D、7.8gNa2S和Na2O2的混合物中,含有阴离子的数目为0.1NA17. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、1mol乙醇分子中含C—H键的数目为6NA B、标准状况下,22.4L的12C18O中含有中子的数目为16NA C、密闭容器中1molPCl3与1molCl2反应制备PCl5(g),增加了2NA个P—Cl键 D、常温下,1L0.1mol·L-1的醋酸溶液中H+数目为0.1NA18. NA为阿伏加德罗常数的值。下列说法错误的是( )A、常温常压下,3.2g N2H4所含共价键的数目为 0.5NA B、7g乙烯与7g环丙烷组成的混合物中所含氢原子数为2 NA C、0.5mol SO2与足量O2在适宜条件下充分反应转移电子数小于NA D、1L0.1mol/L的NaHSO3溶液中HSO 和SO 的粒子数之和为0.1NA19. NA是阿伏加德罗常数的值,下列说法正确的是( )A、20gD216O含中子数目为9NA B、1molN2H4含极性键数目为4NA C、50mL2mol/LCH3COONa溶液中,阴离子的数目小于0.1NA D、2.24LCl2与足量NaOH溶液反应,转移电子的数目为0.2NA20. NA为阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,2.24LHCl气体中H+数目为0.1NA B、标准状况下,2.24LD2中所含中子数目为0.4NA C、常温常压下,6.2gP4中所含P-P键数目为0.3NA D、0.2molSO2和0.1molO2在密闭容器中充分反应后的分子总数为0.2NA21. 设NA表示阿伏加德罗常数的值。下列说法正确的是( )A、14 g聚丙烯中含C-H键总数目为NA B、氢氧燃料电池正极消耗22. 4 L(标准状况)气体时,电路中通过的电子数目为2NA C、2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0. 2NA之间 D、电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA22. NA是阿伏加德罗常数的值。下列说法正确的是( )A、1 mol SiO2中含有2 mol硅氧键 B、1 mol T2O比1 mol H2O多4 NA个中子 C、1 L 0.1 mol/LNa2CO3溶液中含有的阴离子的总数为0.1 NA D、标准状况下,1 mol O2和O3的混合物中有5NA个氧原子23. NA是阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,2.24L四氯化碳含共价键总数为0.4NA B、由H218O与D216O组成的4.0g混合物含中子数为2NA C、由NO2与N2O4组成的4.6g混合气体含氮原子数为0.5NA D、标准状况下,溶有6.72LSO2的水中HSO 与SO 的微粒数目之和为0.3NA24. NA为阿伏加德罗常数的值,下列说法正确的是( )A、12g C所含的原子数为阿伏加德罗常数 B、O2的相对分子质量为32,所以O2的摩尔质量也为32。 C、标准状况下,1molNO 与11.2L O2充分反应后分子总数为NA D、P4为正四面体形分子,则1 mol P4分子中含有6NA个共价键25. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、34gH2O2中含有18NA个中子 B、1L0.1mol·L-1NH4Cl溶液中,阴离子数大于0.1NA C、标准状况下,22.4LCH4和C2H4的混合气体中含有C—H键的数目为4NA D、足量Fe与1molCl2完全反应,转移的电子数目为2NA26. 设阿伏加德罗常数的值为 。下列说法正确的是( )A、17g羟基(-OH)所含电子总数为 B、标准状况下,1.12L苯含有 键的个数为 C、 和足量 反应,产生的气体的分子数为 D、0.5mol乙酸乙酯在酸性条件下水解,生成乙醇的分子数为27. 肼 是火箭常用的高能燃料,其球棍模型如图所示。肼能与双氧水发生反应: 。用 表示阿伏加德罗常数的值,下列说法中正确的是( )
是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于目前新冠病毒疫情下的生活消毒。其中X、Y、Z为原子序数依次增大的短周期元素。下列叙述正确的是( ) A、原子半径:Z>Y>X B、Z的第一电离能比同周期相邻元素都大 C、1mol该化合物分子中含有的非极性键数目为2NA D、该化合物中X、Y、Z都满足8电子稳定结构9. 用NA表示阿伏加德罗常数的值,下列叙述错误的是( )A、0.1 mol苯乙烯中碳碳双键的数目为0.1NA B、常温下,46 g由NO2和甲硫醛( H2CS)组成的混合物中含有的分子数为NA C、标准状况下,2.24 LNH3中含有的共价键数目为0.3NA D、100 mL0.1 mol/LNa3AsO4溶液中阴离子总数大于0.01NA10. 已知NA为阿伏加德罗常数的值。下列说法正确的是( )A、1molNH4F晶体中含有共价键数目为4NA B、1L0.1mol/L磷酸钠溶液含有的 数目与0.1L1mol/L磷酸钠溶液含有的 数目相等 C、标况下,3.36LHF中含有的质子数为1.5NA D、60gSiO2晶体中含有的Si-O键数目为2NA11. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、7.8g苯中含碳碳双键的数目为3NA B、16.25gFeCl3水解形成的氢氧化铁胶体粒子数为0.1NA C、1molCH4与1molCl2在光照下充分反应,生成CH3Cl的分子数为NA D、3g3He含有的中子数为NA12. 设NA为阿伏加德罗常数的值,下列有关说法正确的是( )A、14g乙烯和环丙烷的混合物中含C-H键数目为2NA B、标准状况下,2.24L环己烷的分子数为0.1NA C、常温常压下,1mol氨基(-NH2)含有的电子数为10NA D、36g由35Cl和37Cl组成的氯气中所含质子数一定为17NA13. 设NA表示阿伏加德罗常数的值。下列叙述错误的是( )A、标准状况下,1 mol Fe在22.4 L Cl2中完全燃烧时转移电子数为3NA B、6.5gNaN3中含有的阴离子数目为0.1NA C、常温下,0.1 mol环丙烷中含有的共价键数为0.9NA D、1 L 0.1 mol·L-1 Na2S溶液中S2-数目与HS-数目之和小于0.1NA14. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4LSO3中含有的分子数约为1NA B、1mol白磷P4固体所含共价键数目为4NA C、78gNa2O2晶体所含离子的微粒数为3NA D、常温常压下,22.4L氯气溶于水,转移电子数为1NA15. NA是阿伏加德罗常数的值。下列说法正确的是( )A、32gO2中所含的质子数为32NA B、25℃时,pH=12的NaOH溶液中OH-数目为0.01NA C、100g3.4%的H2O2溶液中所含的极性键数目为0.2NA D、标准状况下,H2和CO的混合气体22.4L完全燃烧,转移的电子数为2NA16. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、30gC2H6中含有极性共价键的数目为7NA B、标准状况下,11.2LHF中含有质子的数目为5NA C、5.6gFe与足量稀硝酸反应,转移电子的数目为0.2NA D、7.8gNa2S和Na2O2的混合物中,含有阴离子的数目为0.1NA17. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、1mol乙醇分子中含C—H键的数目为6NA B、标准状况下,22.4L的12C18O中含有中子的数目为16NA C、密闭容器中1molPCl3与1molCl2反应制备PCl5(g),增加了2NA个P—Cl键 D、常温下,1L0.1mol·L-1的醋酸溶液中H+数目为0.1NA18. NA为阿伏加德罗常数的值。下列说法错误的是( )A、常温常压下,3.2g N2H4所含共价键的数目为 0.5NA B、7g乙烯与7g环丙烷组成的混合物中所含氢原子数为2 NA C、0.5mol SO2与足量O2在适宜条件下充分反应转移电子数小于NA D、1L0.1mol/L的NaHSO3溶液中HSO 和SO 的粒子数之和为0.1NA19. NA是阿伏加德罗常数的值,下列说法正确的是( )A、20gD216O含中子数目为9NA B、1molN2H4含极性键数目为4NA C、50mL2mol/LCH3COONa溶液中,阴离子的数目小于0.1NA D、2.24LCl2与足量NaOH溶液反应,转移电子的数目为0.2NA20. NA为阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,2.24LHCl气体中H+数目为0.1NA B、标准状况下,2.24LD2中所含中子数目为0.4NA C、常温常压下,6.2gP4中所含P-P键数目为0.3NA D、0.2molSO2和0.1molO2在密闭容器中充分反应后的分子总数为0.2NA21. 设NA表示阿伏加德罗常数的值。下列说法正确的是( )A、14 g聚丙烯中含C-H键总数目为NA B、氢氧燃料电池正极消耗22. 4 L(标准状况)气体时,电路中通过的电子数目为2NA C、2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0. 2NA之间 D、电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA22. NA是阿伏加德罗常数的值。下列说法正确的是( )A、1 mol SiO2中含有2 mol硅氧键 B、1 mol T2O比1 mol H2O多4 NA个中子 C、1 L 0.1 mol/LNa2CO3溶液中含有的阴离子的总数为0.1 NA D、标准状况下,1 mol O2和O3的混合物中有5NA个氧原子23. NA是阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,2.24L四氯化碳含共价键总数为0.4NA B、由H218O与D216O组成的4.0g混合物含中子数为2NA C、由NO2与N2O4组成的4.6g混合气体含氮原子数为0.5NA D、标准状况下,溶有6.72LSO2的水中HSO 与SO 的微粒数目之和为0.3NA24. NA为阿伏加德罗常数的值,下列说法正确的是( )A、12g C所含的原子数为阿伏加德罗常数 B、O2的相对分子质量为32,所以O2的摩尔质量也为32。 C、标准状况下,1molNO 与11.2L O2充分反应后分子总数为NA D、P4为正四面体形分子,则1 mol P4分子中含有6NA个共价键25. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、34gH2O2中含有18NA个中子 B、1L0.1mol·L-1NH4Cl溶液中,阴离子数大于0.1NA C、标准状况下,22.4LCH4和C2H4的混合气体中含有C—H键的数目为4NA D、足量Fe与1molCl2完全反应,转移的电子数目为2NA26. 设阿伏加德罗常数的值为 。下列说法正确的是( )A、17g羟基(-OH)所含电子总数为 B、标准状况下,1.12L苯含有 键的个数为 C、 和足量 反应,产生的气体的分子数为 D、0.5mol乙酸乙酯在酸性条件下水解,生成乙醇的分子数为27. 肼 是火箭常用的高能燃料,其球棍模型如图所示。肼能与双氧水发生反应: 。用 表示阿伏加德罗常数的值,下列说法中正确的是( ) A、标准状况下, 中所含电子总数为 B、标准状况下, 中所含原子总数为 C、标准状况下, 中含有共价键的总数为 D、若生成 ,则上述反应转移电子的数目为28. 用NA代表阿伏加德罗常数的数值。下列说法正确的是( )A、4 6 gC2H6O中含有碳氢共价键的数目为0.5 NA B、1.8g H2O和D2O混合物中含有的中子数为0.8NA C、MnO2与浓盐酸反应产生22.4LCl2(标准状况)时转移电子数为2NA D、1LpH=1的CH3COOH溶液中CH3COO-、CH3COOH数目之和为0.1 NA29. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,11.2 L苯中所含C—H键数目为3NA B、7.8 g Na2S和Na2O2组成的混合物,所含阴离子总数为0.1NA C、1 mol Cl2发生反应时,转移的电子数一定为2NA D、常温下,pH=2的H2SO4溶液中所含H+数目为0.01NA30. 设 为阿伏加德罗常数的值。捕获 生成甲酸的过程如图所示。下列说法错误的是( )
A、标准状况下, 中所含电子总数为 B、标准状况下, 中所含原子总数为 C、标准状况下, 中含有共价键的总数为 D、若生成 ,则上述反应转移电子的数目为28. 用NA代表阿伏加德罗常数的数值。下列说法正确的是( )A、4 6 gC2H6O中含有碳氢共价键的数目为0.5 NA B、1.8g H2O和D2O混合物中含有的中子数为0.8NA C、MnO2与浓盐酸反应产生22.4LCl2(标准状况)时转移电子数为2NA D、1LpH=1的CH3COOH溶液中CH3COO-、CH3COOH数目之和为0.1 NA29. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,11.2 L苯中所含C—H键数目为3NA B、7.8 g Na2S和Na2O2组成的混合物,所含阴离子总数为0.1NA C、1 mol Cl2发生反应时,转移的电子数一定为2NA D、常温下,pH=2的H2SO4溶液中所含H+数目为0.01NA30. 设 为阿伏加德罗常数的值。捕获 生成甲酸的过程如图所示。下列说法错误的是( ) A、 中所含的共价键数目为 B、标准状况下, 中所含的质子数目为 C、 乙基所含的电子总数为 D、 的甲酸水溶液中所含的氧原子数目为31. 代表阿伏加德罗常数的值。下列说法正确的是( )A、将0.1 溶于足量水,转移的电子总数为0.1 B、常温常压下,36g 中所含的中子数为18 C、2.24L(标准状况)乙烯被溴的四氯化碳溶液完全吸收,断裂的共价键总数为0.1 D、7.8g 与 的混合物中,离子总数为0.332. NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、60gSiO2晶体中含有的Si—O键数目为2NA B、pH=1的H3PO4溶液中所含H+的数目为0.1NA C、用含0.1molFeCl3的饱和溶液制备Fe(OH)3胶体,所得胶体粒子数目最多为0.1NA D、1molNa与足量O2反应,生成Na2O和Na2O2的混合物,Na失去NA个电子
A、 中所含的共价键数目为 B、标准状况下, 中所含的质子数目为 C、 乙基所含的电子总数为 D、 的甲酸水溶液中所含的氧原子数目为31. 代表阿伏加德罗常数的值。下列说法正确的是( )A、将0.1 溶于足量水,转移的电子总数为0.1 B、常温常压下,36g 中所含的中子数为18 C、2.24L(标准状况)乙烯被溴的四氯化碳溶液完全吸收,断裂的共价键总数为0.1 D、7.8g 与 的混合物中,离子总数为0.332. NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、60gSiO2晶体中含有的Si—O键数目为2NA B、pH=1的H3PO4溶液中所含H+的数目为0.1NA C、用含0.1molFeCl3的饱和溶液制备Fe(OH)3胶体,所得胶体粒子数目最多为0.1NA D、1molNa与足量O2反应,生成Na2O和Na2O2的混合物,Na失去NA个电子二、非选择题
-
33. 金矿提金采用氰化工艺,产生的含氰废水需处理后才能排放。(1)、氰化工艺中,金溶解于NaCN溶液生成 。
①1000℃时,CH4、NH3和O2在催化剂作用下可转化为HCN,HCN与NaOH反应可制得NaCN。生成HCN的化学方程式为。
②1mol 含有σ键的数目为。
(2)、用H2O2溶液处理含氰废水,使有毒的 转化为 、 等。①该反应的离子方程式为。
②Cu2+可作为上述反应的催化剂。其他条件相同时,总氰化物( 、HCN等)去除率随溶液初始pH变化如图1所示。当溶液初始pH>10时,总氰化物去除率下降的原因可能是。
 (3)、用焦亚硫酸钠(Na2S2O5)/空气法处理含氰废水的部分机理如下,其中[O]代表活性氧原子: 、 、 。其他条件相同时,总氰化物去除事随Na2S2O5 , 初始浓度 变化如图2所示。当 时,总氰化物去除率下降的原因可能是。
(3)、用焦亚硫酸钠(Na2S2O5)/空气法处理含氰废水的部分机理如下,其中[O]代表活性氧原子: 、 、 。其他条件相同时,总氰化物去除事随Na2S2O5 , 初始浓度 变化如图2所示。当 时,总氰化物去除率下降的原因可能是。 34. 铁及其化合物在生产生活中有着广泛的应用。回答下列问题:(1)、基态Fe原子的外围电子排布图为 , 基态Fe2+中,核外电子占据最高能层的符号是 , Fe2+和Fe3+是铁的两种常见离子,Fe3+的稳定性强于Fe2+ , 原因是。(2)、Fe3+可以与SCN—形成一系列不同配位数的红色配合物,所以常用KSCN溶液检验Fe3+的存在,KSCN中四种元素的电负性由小到大的顺序为 , SCN—的几何构型为 , 中心原子的杂化类型为。(3)、实验中常用K3[Fe(CN)6]检验Fe2+ , K3[Fe(CN)6]晶体中的化学键有(填写选项字母)
34. 铁及其化合物在生产生活中有着广泛的应用。回答下列问题:(1)、基态Fe原子的外围电子排布图为 , 基态Fe2+中,核外电子占据最高能层的符号是 , Fe2+和Fe3+是铁的两种常见离子,Fe3+的稳定性强于Fe2+ , 原因是。(2)、Fe3+可以与SCN—形成一系列不同配位数的红色配合物,所以常用KSCN溶液检验Fe3+的存在,KSCN中四种元素的电负性由小到大的顺序为 , SCN—的几何构型为 , 中心原子的杂化类型为。(3)、实验中常用K3[Fe(CN)6]检验Fe2+ , K3[Fe(CN)6]晶体中的化学键有(填写选项字母)a.离子键. b.共价键 c,氢键 d .配位键 e.金属键
1mol K3[Fe(CN)6]中含有σ键与π键的数目比为。
(4)、FexO为氯化钠型结构,在实际晶体中,由于存在缺陷,x<1。 测得Fe0.92O晶体的晶胞参数a=428.0pm,则该晶体的密度ρ=g/cm3 (列出计算式),晶体中最近的两个铁离子间的距离为pm。35. 铝试剂:(NH4)3C19H8(OH)3(COO)3 , 其商品名为阿罗明拿,可用来鉴定溶液中的铝离子。请回答下列问题:(1)、碳原子价层电子的电子排布图。(2)、第二周期部分元素的第一电离能变化趋势如图1所示,其中除氮元素外,其他元素的第一电离能自左而右依次增大的原因是;氮元素的第一电离能呈现异常的原因是。 (3)、经X射线衍射测得阿罗明拿的晶体结构,其局部结构如图2所示。
(3)、经X射线衍射测得阿罗明拿的晶体结构,其局部结构如图2所示。①从结构角度分析,阿罗明拿中的NH4+与氨分子的相同之处为 , 不同之处为。(填标号)
A 中心原子的杂化轨道类型
B 中心原子的价层电子对数
C 立体结构
②阿罗明拿中1个(NH4)3C19H8(OH)3(COO)3单元的C—Oσ键总数为个。分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则阿罗明拿中苯环的大π键应表示为。
③图2中虚线代表氢键,其表示式为(NH4+)N-H---O(COO-)、、。
(4)、阿罗明拿的晶体密度为d g·cm-3 , 其立方晶胞参数为a nm,晶胞中含有y个(NH4)3C19H8(OH)3(COO)3单元,该单元的相对质量为M,则y的计算表达式为(NA表示阿伏加德罗常数的值)。36. [化学——选修3:物质结构与性质]碳及其化合物广泛存在于自然界中,回答下列问题:
(1)、处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在基态原子中,核外存在 对自旋相反的电子。(2)、碳在形成化合物时,其键型以共价键为主,原因是 。(3)、CS2分子中,共价键的类型有 ,C原子的杂化轨道类型是 ,写出两个与CS2具有相同空间构型和键合形式的分子或离子 。(4)、CO能与金属Fe形成Fe(CO)5 , 该化合物的熔点为253K,沸点为376K,其固体属于 晶体。(5)、碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个C原子连接 个六元环,每个六元环占有 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。