高考二轮复习知识点:氧化还原反应的电子转移数目计算3
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 关于反应K2H3IO6+9HI=2KI+4I2+6H2O,下列说法正确的是( )A、K2H3IO6发生氧化反应 B、KI是还原产物 C、生成12.7g I2时,转移0.1mol电子 D、还原剂与氧化剂的物质的量之比为7:12. 常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为 。下列说法错误的是( )A、产生22.4L(标准状况) 时,反应中转移 B、反应中氧化剂和还原剂的物质的量之比为11:6 C、可用石灰乳吸收反应产生的 制备漂白粉 D、可用酸化的淀粉碘化钾溶液检验食盐中 的存在3. 关于反应8NH3+6NO2=7N2+12H2O,下列说法正确的是( )A、NH3中H元素被氧化 B、NO2在反应过程中失去电子 C、还原剂与氧化剂的物质的量之比为3:4 D、氧化产物与还原产物的质量之比为4:34. 一种流体电解海水提锂的工作原理如下图所示,中间室辅助电极材料 具有选择性电化学吸附/脱出锂离子功能。工作过程可分为两步,第一步为选择性吸附锂,第二步为释放锂,通过以上两步连续的电解过程,锂离子最终以LiOH的形式被浓缩到阴极室。下列说法中错误的是( )
 A、第一步接通电源1选择性提取锂:第二步接通电源2释放锂 B、释放锂过程中,中间室材料应接电源负极,发生的电极反应式为 C、中间室两侧的离子交换膜选用阳离子交换膜 D、当阴极室得到4.8gLiOH时,理论上阳极室产生1.12L气体(标准状态下)5. 高铁电池作为新型可充电电池,具有放电曲线平坦,高能高容量,原料丰富,绿色无污染等优点。如图为简易的高铁电池的工作装置。已知:放电后,两极都产生红褐色悬浮物。下列说法正确的是( )
A、第一步接通电源1选择性提取锂:第二步接通电源2释放锂 B、释放锂过程中,中间室材料应接电源负极,发生的电极反应式为 C、中间室两侧的离子交换膜选用阳离子交换膜 D、当阴极室得到4.8gLiOH时,理论上阳极室产生1.12L气体(标准状态下)5. 高铁电池作为新型可充电电池,具有放电曲线平坦,高能高容量,原料丰富,绿色无污染等优点。如图为简易的高铁电池的工作装置。已知:放电后,两极都产生红褐色悬浮物。下列说法正确的是( ) A、该电池放电时的总反应为Fe + FeO + 2H+ + 2H2O =2Fe(OH)3 B、放电时,此盐桥中阴离子的运动方向是从右向左 C、该电池充电时阳极反应的电极反应方程式为 FeO + 3e- + 4H2O = 2Fe(OH)3 + 5OH- D、每消耗56 g Fe,转移电子6 mol6. 以
A、该电池放电时的总反应为Fe + FeO + 2H+ + 2H2O =2Fe(OH)3 B、放电时,此盐桥中阴离子的运动方向是从右向左 C、该电池充电时阳极反应的电极反应方程式为 FeO + 3e- + 4H2O = 2Fe(OH)3 + 5OH- D、每消耗56 g Fe,转移电子6 mol6. 以 为原料,采用电解法制取
为原料,采用电解法制取  的装置如图。下列说法中正确的是( )
的装置如图。下列说法中正确的是( )  A、电子由铅合金经溶液流到金属DSA电极 B、每转移1mole-时,阳极电解质溶液的质量减少8g C、阴极主要电极反应式为
A、电子由铅合金经溶液流到金属DSA电极 B、每转移1mole-时,阳极电解质溶液的质量减少8g C、阴极主要电极反应式为 +6e-+6H+→
+6e-+6H+→  +2H2O
D、反应结束后阳极区pH增大
7. 利用石墨电极电解HNO3和HNO2的混合溶液可获得较浓的硝酸。其工作原理如图所示。下列说法正确的是( )
+2H2O
D、反应结束后阳极区pH增大
7. 利用石墨电极电解HNO3和HNO2的混合溶液可获得较浓的硝酸。其工作原理如图所示。下列说法正确的是( ) A、a为电源的正极 B、电解池中的离子交换膜应为阴离子交换膜 C、阳极的电极反应式为 D、每2mol离子通过离子交换膜,左室产生的气体X的体积为22.4L(标准状况)8. 《Science》杂志报道了王浩天教授团队发明制取 的绿色方法,原理如图所示。已知: , 。下列说法错误的是( )
A、a为电源的正极 B、电解池中的离子交换膜应为阴离子交换膜 C、阳极的电极反应式为 D、每2mol离子通过离子交换膜,左室产生的气体X的体积为22.4L(标准状况)8. 《Science》杂志报道了王浩天教授团队发明制取 的绿色方法,原理如图所示。已知: , 。下列说法错误的是( ) A、该过程中主要的能量转化形式为化学能转化为电能 B、Y膜为选择性阴离子交换膜 C、每生成 ,理论上需消耗标准状况下 D、b极上的电极反应式为9. 设 为阿伏加德罗常数的值,下列叙述正确的是( )A、 溶液中含有 数目为 B、含 的浓盐酸与足量 反应,转移电子数目为 C、标准状况下, 己烷在 中完全燃烧,产生 分子数目为 D、常温下, 与 的混合气体中所含的原子数目为10. 设 为阿伏加德罗常数的值,下列说法正确的是( )A、 与足量 充分反应,转移的电子数为 B、 完全溶于一定量的浓硝酸,生成 的分子数为2 C、将稀氨水滴入含 的溶液至中性,溶液中 数目为 D、标准状况下 三氯甲烷中含共价键数为411. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,2.24 L C3H8分子中的σ键的数目为1.1NA B、5.6 g Fe在7.1 g Cl2中充分燃烧,转移电子数为0.2NA C、0.1 mol NO与0.1 mol O2混合物中质子数为2.3NA D、室温下,pH=9的CH3COONa溶液中,由水电离的H+数目为10-9NA12. 某光电催化反应器如图所示,A电极是Pt/CNT、B电极是TiO2:通过光解水,可由CO2制得异丙醇。下列说法错误的是( )
A、该过程中主要的能量转化形式为化学能转化为电能 B、Y膜为选择性阴离子交换膜 C、每生成 ,理论上需消耗标准状况下 D、b极上的电极反应式为9. 设 为阿伏加德罗常数的值,下列叙述正确的是( )A、 溶液中含有 数目为 B、含 的浓盐酸与足量 反应,转移电子数目为 C、标准状况下, 己烷在 中完全燃烧,产生 分子数目为 D、常温下, 与 的混合气体中所含的原子数目为10. 设 为阿伏加德罗常数的值,下列说法正确的是( )A、 与足量 充分反应,转移的电子数为 B、 完全溶于一定量的浓硝酸,生成 的分子数为2 C、将稀氨水滴入含 的溶液至中性,溶液中 数目为 D、标准状况下 三氯甲烷中含共价键数为411. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,2.24 L C3H8分子中的σ键的数目为1.1NA B、5.6 g Fe在7.1 g Cl2中充分燃烧,转移电子数为0.2NA C、0.1 mol NO与0.1 mol O2混合物中质子数为2.3NA D、室温下,pH=9的CH3COONa溶液中,由水电离的H+数目为10-9NA12. 某光电催化反应器如图所示,A电极是Pt/CNT、B电极是TiO2:通过光解水,可由CO2制得异丙醇。下列说法错误的是( ) A、电子由B极经导线流向A极 B、合成蛋白质纤维膜可以是质子交换膜 C、B极的电极反应为2H2O﹣4e﹣=O2 +4H﹣ D、每生成60g异丙醇电路中通过的电子数目为18NA13. 设NA是阿伏加德罗常数的值,下列说法错误的是( )A、电解精炼铜,当阳极质量减轻32g,电路中转移电子数为NA B、常温常压下,42g乙烯和丁烯的混合物中含3NA个碳原子 C、1.0L0.20mol·L-1FeCl3溶液滴入沸水中,所得Fe(OH)3胶粒数小于0.2NA D、常温下,2.0LpH=9的CH3COONa溶液中,由水电离出的H+数为2.0×10-5NA14. 海洋碳循环是全球碳循环的重要组成部分,是影响全球气候变化的关键控制环节。下图为海洋中碳循环的简单原理图。下列说法错误的是( )
A、电子由B极经导线流向A极 B、合成蛋白质纤维膜可以是质子交换膜 C、B极的电极反应为2H2O﹣4e﹣=O2 +4H﹣ D、每生成60g异丙醇电路中通过的电子数目为18NA13. 设NA是阿伏加德罗常数的值,下列说法错误的是( )A、电解精炼铜,当阳极质量减轻32g,电路中转移电子数为NA B、常温常压下,42g乙烯和丁烯的混合物中含3NA个碳原子 C、1.0L0.20mol·L-1FeCl3溶液滴入沸水中,所得Fe(OH)3胶粒数小于0.2NA D、常温下,2.0LpH=9的CH3COONa溶液中,由水电离出的H+数为2.0×10-5NA14. 海洋碳循环是全球碳循环的重要组成部分,是影响全球气候变化的关键控制环节。下图为海洋中碳循环的简单原理图。下列说法错误的是( ) A、海洋碳循环过程中能将太阳能转化为化学能 B、钙化释放CO2的离子方程式:2HCO +Ca2+=CaCO3↓+CO2↑+H2O C、影响海洋碳循环的因素主要有海水的酸碱性、水温、藻类生物的分布等 D、光合作用,每生成0.1mol(CH2O)x转移电子数为4NA(NA表示阿伏加德罗常数)15. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、2.8g所有的单烯烃含有的C—H个数都为0.4NA B、标准状况下,2.24LNO2气体与水完全反应,转移电子总数为0.1NA C、0.1mol/L的NaHCO3溶液中,n(HCO )<0.1mol D、3.6gH218O中所含电子数为2NA16. 肼(N2H4)是一种常见的还原剂,设其在酸性溶液中以N2H 形式存在。利用如图电解装置,N2H 可将UO 转化为U4+(N2H 转化为N2)。下列说法错误的是( )
A、海洋碳循环过程中能将太阳能转化为化学能 B、钙化释放CO2的离子方程式:2HCO +Ca2+=CaCO3↓+CO2↑+H2O C、影响海洋碳循环的因素主要有海水的酸碱性、水温、藻类生物的分布等 D、光合作用,每生成0.1mol(CH2O)x转移电子数为4NA(NA表示阿伏加德罗常数)15. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、2.8g所有的单烯烃含有的C—H个数都为0.4NA B、标准状况下,2.24LNO2气体与水完全反应,转移电子总数为0.1NA C、0.1mol/L的NaHCO3溶液中,n(HCO )<0.1mol D、3.6gH218O中所含电子数为2NA16. 肼(N2H4)是一种常见的还原剂,设其在酸性溶液中以N2H 形式存在。利用如图电解装置,N2H 可将UO 转化为U4+(N2H 转化为N2)。下列说法错误的是( ) A、镀铂钛网上发生的电极反应式为:N2H -4e-=N2↑+5H+ B、标准状况下,若生成11.2LN2 , 则有2molH+从镀铂钛网通过质子交换膜流向钛板 C、电解一段时间后电解质溶液的pH减小 D、在该电解装置中,N2H 还原性强于H2O17. 一定条件下双氧水与某浓度的硫酸反应过程如图所示,下列说法正确的是
A、镀铂钛网上发生的电极反应式为:N2H -4e-=N2↑+5H+ B、标准状况下,若生成11.2LN2 , 则有2molH+从镀铂钛网通过质子交换膜流向钛板 C、电解一段时间后电解质溶液的pH减小 D、在该电解装置中,N2H 还原性强于H2O17. 一定条件下双氧水与某浓度的硫酸反应过程如图所示,下列说法正确的是HO—OH HO—OSO3H(过一硫酸) HO3SO—OSO3H(过二硫酸)( )
A、生成过硫酸反应过程因硫酸的羟基被取代而呈中性 B、可以用硝酸钡溶液鉴别过一硫酸和过二硫酸 C、过一硫酸与过二硫酸均可做漂白剂,温度越高,漂白性越强 D、等物质的量的过一硫酸与过二硫酸消耗FeSO4的量相等18. NA为阿伏加德罗常数的值。下列说法正确的是( )A、标准状况下,1个N2分子的体积为 B、电解 溶液后,要加入 恢复电解前状态,则电解中转移电子数为0.2NA C、将 溶于稀氨水配成1L溶液,所得溶液呈中性,则溶液中 数目为NA D、合成氨反应中,当2NA个H-H断裂,同时有NA个N-H断裂,则反应达到最大限度19. 设 为阿伏加德罗常数,下列说法正确的是( )A、常温常压下 和 完全燃烧生成 的 B、 晶体中含有离子数为4 C、 通入足量的NaOH溶液中充分反应,转移的电子数0.2 D、将含 的溶液滴入沸水所制得的 胶体粒子数目为20. 设 为阿伏加德罗常数的值,下列说法正确的是( )A、 中,生成0.6molS,转移电子数为0.8 B、3.0g 含有的共用电子对数为0.6 C、质量分数为a%的硝酸稀溶液的物质的量浓度为bmol/L,则溶液密度为 D、质量相等,密度不等的 和CO,含有的分子数不相等21. 二氧化硫测量计工作的反应原理为:SO2+Br2+2H2O=H2SO4+2HBr,设NA为阿伏加德罗常数的值。下列有关说法正确的是( )A、2.24 LSO2参与反应破坏水中氢氧键数目为0.4 NA B、反应生成0.1 mol H2SO4时,溶液中含有阳、阴离子数目为0.3 NA C、在常温常压下16 g液态溴中原子数目为0.2 NA D、反应生成0.2 mol H+ , 转移电子数目为0.2 NA22. 废水中的污染物,可以通过电解原理产生絮凝剂使其沉淀而分离。工作原理如图所示。下列说法错误的是( ) A、b接电源的负极 B、a、b电极的材料均可为铁棒 C、形成絮凝剂时的反应:4Fe2++O2+8OH-+2H2O=4Fe(OH)3 D、外电路中通过3 mol电子,生成1 mol氢氧化铁胶粒23. 我国科学家设计CO2熔盐捕获与转化装置(如图 1),可与太阳能电池装置(如图 2)联合实现绿色转化。下列有关说法错误的是( )
A、b接电源的负极 B、a、b电极的材料均可为铁棒 C、形成絮凝剂时的反应:4Fe2++O2+8OH-+2H2O=4Fe(OH)3 D、外电路中通过3 mol电子,生成1 mol氢氧化铁胶粒23. 我国科学家设计CO2熔盐捕获与转化装置(如图 1),可与太阳能电池装置(如图 2)联合实现绿色转化。下列有关说法错误的是( ) A、N 电极为太阳能电池的负极与图 1 装置 y 极相连 B、CO2与熔盐反应生成 和 C2O C、x 极电极反应式为 2 C2O -4e - ═ 4CO2↑+O2↑ D、y 电极生成 12g 碳时,x 电极生成 22.4L 氧气
A、N 电极为太阳能电池的负极与图 1 装置 y 极相连 B、CO2与熔盐反应生成 和 C2O C、x 极电极反应式为 2 C2O -4e - ═ 4CO2↑+O2↑ D、y 电极生成 12g 碳时,x 电极生成 22.4L 氧气二、多选题
-
24. 每年10月23日上午6∶02到晚上6∶02被誉为“摩尔日”(Mole Day),这个时间的美式写法为6∶0210/23,外观与阿伏加德罗常数6.02×1023相似,下列说法中不正确的是( )A、常温常压下,22.4L Cl2含有的分子数目为NA B、NA个一氧化碳分子和0.5mol甲烷的质量比为7:3 C、由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA D、1mol Na与O2完全反应生成Na2O和Na2O2 , 转移的电子数为NA个25. 工业上冶炼锡的第一步反应原理为 2SnO2+3C 2Sn+a M↑+CO2↑,则下列说法中错误的是( )A、a 的值为 2 B、反应中 SnO2 被还原 C、每生成 1 mol M 转移电子 8 mol D、反应后只有一种氧化产物
三、非选择题
-
26. 对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝( )、钼( )、镍( )等元素的氧化物,一种回收利用工艺的部分流程如下:
 已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。
已知:25℃时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。(1)、“焙烧”中,有 生成,其中 元素的化合价为。(2)、“沉铝”中,生成的沉淀 为。(3)、“沉钼”中, 为7.0。①生成 的离子方程式为。
②若条件控制不当, 也会沉淀。为避免 中混入 沉淀,溶液中 (列出算式)时,应停止加入 溶液。
(4)、①滤液Ⅲ中,主要存在的钠盐有 和 , 为。②往滤液Ⅲ中添加适量 固体后,通入足量(填化学式)气体,再通入足量 ,可析出 。
(5)、高纯 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层 (砷化镓)反应。
①该氧化物为。②已知: 和 同族, 和 同族。在 与上层 的反应中, 元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为。
27. 汽车尾气(主要成分为NOx和CO)已成为主要的空气污染物来源之一,有发生光化学烟雾污染的潜在危险。
(1)、某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是。(填选项序号字母)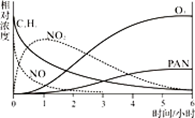
a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
(2)、一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g) 2NO2(g),下列可判断反应达平衡的是。(填选项序号字母)a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2molNO同时生成2molNO2
(3)、高温下N2和O2发生N2(g)+O2(g) 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。①如图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,据此判断反应N2(g)+O2(g) 2NO(g)为(填“吸热”或“放热”)反应。

②2000℃时,向容积为2L的密闭容器中充入10molN2与5molO2 , 达到平衡后NO的物质的量为2mol,则此刻反应的平衡常数K=。该温度下,若开始时向上述容器中充入N2与O2均为1mol,则达到平衡后N2的转化率为。
③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。写出其变化的总化学反应方程式:。
 (4)、为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
(4)、为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16gCH4还原NO2至N2 , 共放出热量867kJ,则ΔH2=。若用标准状况下4.48LCH4还原NO2至N2 , 共转移的电子总数为(阿伏加德罗常数的值用NA表示)。
28. 某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)、方案1:通过置换反应比较向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是 , 说明氧化性Ag+>Cu2+。
(2)、方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较实验
试剂
编号及现象
试管
滴管

1.0 mol/L
KI溶液
1.0 mol/L
AgNO3溶液
Ⅰ.产生黄色沉淀,溶液无色
1.0 mol/L
CuSO4溶液
Ⅱ.产生白色沉淀A,溶液变黄
① 经检验,Ⅰ中溶液不含I2 , 黄色沉淀是。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有(填离子符号)。
b.白色沉淀B是。
c.白色沉淀A与AgNO3溶液反应的离子方程式是 , 说明氧化性Ag+>Cu2+。
(3)、分析方案2中Ag+ 未能氧化I- , 但Cu2+氧化了I-的原因,设计实验如下:编号
实验1
实验2
实验3
实验



现象
无明显变化
a中溶液较快变棕黄色,b中电极
上析出银;电流计指针偏转
c中溶液较慢变浅黄色;
电流计指针偏转
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是(用电极反应式表示)。
②“实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是。
③ 方案2中,Cu2+能氧化I- , 而Ag+未能氧化I-的原因:。
(资料:Ag+ + I- = AgI↓ K1=1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2= 8.7×108)
29. 单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质
SiCl4
BCl3
AlCl3
FeCl3
PCl5
沸点/℃
57.7
12.8
-
315
-
熔点/℃
-70.0
-107.2
-
-
-
升华温度/℃
-
-
180
300
162
请回答下列问题:
(1)、写出装置A中发生反应的离子方程式:。(2)、装置F的名称是;装置C中的试剂是;装置E中的h瓶需要冷却的理由是。(3)、装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是(填写元素符号)。(4)、为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+ , 再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。①滴定前是否要滴加指示剂?(填“是”或“否”)。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol· L-1 KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是
30. 化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
 (1)、根据实验I和Ⅱ,请回答下列问题。
(1)、根据实验I和Ⅱ,请回答下列问题。①由“黄色立即加深”初步判断有I2生成,选择 (填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式 , 该条件下氧化性:Fe2+ I2(选填“>”或“<”)。
③实验Ⅱ的目的是。
(2)、实验Ⅳ中Cu2+与I-反应的离子方程式是 , 甲同学得出氧化性:Cu2+ >I2。(3)、乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有 I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与Cul沉淀有关,故不能确定氧化性:Cu2+>I2 , 并用下图装置进行验证。
K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量 (填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+ I2(选填“>”或“<”)。
(4)、该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++ 2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是。小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
31. 铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3 , 还含少量SiO2等杂质)制备NaBiO3 , 其流程如下:
已知:水解能力:Bi3+>Fe3+。
回答下列问题:
(1)、“浸取”时,为了提高浸取速率,可采取的措施有(任写一条);过滤1的滤渣的主要成分有(填化学式)。(2)、浸取时加入过量浓盐酸的目的是;“母液”中通入气体X后可循环利用,气体X为(填名称)。(3)、写出焙烧时生成铋酸钠的化学方程式;当消耗标准状况下4.48 L O2时,转移电子的数目是。(4)、25℃时,向浓度均为0.04 mol·L-1的Cu2+、Pb2+、Bi3+的混合溶液中滴加(NH4)2S溶液(设溶液体积增加1倍),当c(Pb2+)=10-5 mol·L-1时恰好完全沉淀,所得溶液中c(Cu2+)∶c(Bi3+)=。[已知:Ksp(CuS)=6.0×10-36、Ksp(PbS)=3.0×10-28、Ksp(Bi2S3)=1.6×10-20]
(5)、用双硫腙(H2Dz,二元弱酸)~CCl4络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Cu(HDz)2等],再用CCl4萃取此络合物。下图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
①当调节pH=2.5时,铋(Bi)的存在形式有。
②向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为。
32. 硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
回答下列问题:
(1)、Na2B4O7·10H2O中B的化合价为。(2)、Na2B4O7易溶于水,也易发生水解:B4O72-+7H2O 4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:。(3)、滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式。(4)、加入MgO的目的是。(5)、已知MgSO4、CaSO4的溶解度如下表:温度(℃)
溶解度(g)
40
50
60
70
MgSO4
30.9
33.4
35.6
36.9
CaSO4
0.210
0.207
0.201
0.193
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为。
(6)、硼砂也能在工业上制取NaBH4 , NaBH4被称为有机化学中的“万能还原剂”。①写出NaBH4的电子式:。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为(保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式:。
33. 高锰酸钾常用作消毒杀菌、水质净化剂等。某小组用软锰矿(主要含MnO2 , 还含有少量SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。 (1)、配平焙烧时化学反应: MnO2+ +O2 K2MnO4+H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因。(2)、滤渣II 的成分有(化学式);第一次通CO2不能用稀盐酸代替的原因是。(3)、第二次通入过量CO2生成MnO2的离子方程式为。(4)、将滤液Ⅲ进行一系列操作得KMnO4。
(1)、配平焙烧时化学反应: MnO2+ +O2 K2MnO4+H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因。(2)、滤渣II 的成分有(化学式);第一次通CO2不能用稀盐酸代替的原因是。(3)、第二次通入过量CO2生成MnO2的离子方程式为。(4)、将滤液Ⅲ进行一系列操作得KMnO4。由下图可知,从滤液Ⅲ得到KMnO4需经过、、洗涤等操作。
 (5)、工业上按上述流程连续生产。含MnO2a%的软锰矿1吨,理论上最多可制KMnO4吨。(6)、利用电解法可得到更纯的KMnO4。用惰性电极电解滤液II。
(5)、工业上按上述流程连续生产。含MnO2a%的软锰矿1吨,理论上最多可制KMnO4吨。(6)、利用电解法可得到更纯的KMnO4。用惰性电极电解滤液II。①电解槽阳极反应式为;
②阳极还可能有气体产生,该气体是。
34. 硝酸是重要的氧化剂,铁、铜是生活中常见的金属.(1)、Fe与Cu混合物与65%的硝酸反应会产生大量NO2 , 该反应使用的硝酸的物质的量浓度为 mol/L(已知ρ=1.4g/cm3).(2)、各为0.1mol的Cu与Fe混合物与足量的某浓度的硝酸反应产生4.48L气体(标准状况下),则该反应消耗的硝酸为 mol.(3)、4.4gFe与Cu混合物与过量的硝酸反应,放出的气体与标准状况下的1.12L的氧气混合后通入水中恰好被完全吸收,则其中铜的质量为 g.(4)、Fe与Cu混合物共有a mol,其中铜的物质的量分数为X,将该混合物全部投入b mol的硝酸中使其充分反应,假定硝酸的还原产物仅有NO,①若溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示).
35. 根据所学知识回答问题:(1)、黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2═6SO2+Fe3O4 , 氧化产物为 , 若有3molFeS2参加反应,转移 mol电子.(2)、与明矾相似,硫酸铁也可用作净水剂,其原理为(用离子方程表示)(3)、FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为(4)、在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+ , 并有气体逸出,请写出相应的离子方程式:(5)、铁红是一种红色颜料,其成分是Fe2O3将一定量的铁红溶于160mL5mol•L﹣1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+ , 则参加反应的铁粉的质量为 .36. Na、Cu、Fe、Cl、O、N是常见的6种元素.(1)、Fe位于元素周期表第周期第族;O的基态原子核外有个未成对电子.Cu的基态原子电子排布式为 .(2)、用“>”或“<”填空:第一电离能
原子半径
稳定性
NO
CNa
NH3H2O
(3)、液态N2H4与液态N2O4反应生成气态水,在25℃、101kPa下,已知该反应每消耗1mol N2H4放出519.85kJ的热量,该反应的热化学反应方程式是:(4)、古老的但仍是最有用的制备N2H4的方法是NaClO溶液氧化过量的NH3 , 写出该反应的离子方程式,并标出电子转移的方向和数目 .