高考二轮复习知识点:氧化还原反应的电子转移数目计算2
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 下列说法正确的是( )A、 (标准状况)与水充分反应转移 电子 B、 和 均可通过化合反应得到 C、将蘸有浓氨水和浓硫酸的玻璃棒相互靠近,有白烟产生 D、 与 溶液反应:2. 用电石(主要成分为CaC2 , 含CaS和Ca3P2等)制取乙炔时,常用CuSO4溶液除去乙炔中的杂质。反应为:
①CuSO4+H2S=CuS↓+H2SO4
②11PH3+24CuSO4+12H2O=3H3PO4+24H2SO4+8Cu3P↓
下列分析错误的是( )
A、CaS、Ca3P2发生水解反应的化学方程式:CaS+2H2O=Ca(OH)2+H2S↑、Ca3P2+6H2O=3Ca(OH)2+2PH3↑ B、不能依据反应①比较硫酸与氢硫酸的酸性强弱 C、反应②中每24 mol CuSO4氧化11 mol PH3 D、用酸性KMnO4溶液验证乙炔还原性时,H2S、PH3有干扰3. 《环境科学》刊发了我国科研部门采用零价铁活化过二硫酸钠(Na2S2O8) 去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。下列叙述错误的是( ) A、56gFe参加反应,消耗的S2O大于1 mol B、过二硫酸钠(Na2S2O8) 中S的化合价为+6 C、pH越大,越有利于去除废水中的正五价砷 D、碱性条件下,硫酸根自由基发生反应的方程式为: +H2O= SO++H+4. “西门子法”提纯硅的反应之一为: , 已知氢原子吸引电子的能力介于碳原子和硅原子之间,下列说法不正确的是( )A、是还原产物 B、即是氧化产物,也是还原产物 C、还原剂与氧化剂的物质的量之比为 D、生成时,转移电子5. 用NA表示阿伏加德罗常数的值。溴蒸气与氨气相遇产生“白烟",化学方程式为8NH3+3Br2=N2+6NH4Br。下列说法正确的是( )A、生成14gN2时,反应中还原剂的分子数目为4NA B、标准状况下,11.2LBr2参与反应时转移的电子数为NA C、0.5mol·L-1的NH4Br溶液中含有Br-的数目为0.5NA D、当生成29.4gNH4Br时,消耗NH3分子的数目为0.4NA6. 我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示。下列说法不正确的是( )
A、56gFe参加反应,消耗的S2O大于1 mol B、过二硫酸钠(Na2S2O8) 中S的化合价为+6 C、pH越大,越有利于去除废水中的正五价砷 D、碱性条件下,硫酸根自由基发生反应的方程式为: +H2O= SO++H+4. “西门子法”提纯硅的反应之一为: , 已知氢原子吸引电子的能力介于碳原子和硅原子之间,下列说法不正确的是( )A、是还原产物 B、即是氧化产物,也是还原产物 C、还原剂与氧化剂的物质的量之比为 D、生成时,转移电子5. 用NA表示阿伏加德罗常数的值。溴蒸气与氨气相遇产生“白烟",化学方程式为8NH3+3Br2=N2+6NH4Br。下列说法正确的是( )A、生成14gN2时,反应中还原剂的分子数目为4NA B、标准状况下,11.2LBr2参与反应时转移的电子数为NA C、0.5mol·L-1的NH4Br溶液中含有Br-的数目为0.5NA D、当生成29.4gNH4Br时,消耗NH3分子的数目为0.4NA6. 我国科研团队设计了一种表面锂掺杂的锡纳米粒子催化剂可提高电催化制甲酸盐的产率,同时释放电能,实验原理如图所示。下列说法不正确的是( ) A、充电时,电极周围升高 B、放电时,每生成 , 转移个电子 C、使用催化剂或者均能有效减少副产物的生成 D、使用催化剂,中间产物更不稳定7. 关于反应 , 下列说法错误的是A、HCl是氧化产物 B、既发生还原反应又发生氧化反应 C、被氧化的原子与被还原的原子的个数比2∶1 D、生成1molSi时,转移4mol电子8. 用表示阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,18g含有的中子数、电子数均为 B、甲烷与白磷分子均为正四面体结构,其1mol分子中所含共价键数目均为 C、标准状况下,22.4LHF所含的分子数目为 D、32g由和组成的混合气体中氧原子数目为9. 二氧化氮通入水中,发生下列反应:该反应中,有关下列说法正确的是( )A、H2O作还原剂 B、被氧化与披还原的物质的个数之比为2∶1 C、HNO3是氧化剂 D、HNO3是还原产物10. 汽车尾气常用三效催化剂处理,其表面物质转化关系如图所示,说法正确的是( )
A、充电时,电极周围升高 B、放电时,每生成 , 转移个电子 C、使用催化剂或者均能有效减少副产物的生成 D、使用催化剂,中间产物更不稳定7. 关于反应 , 下列说法错误的是A、HCl是氧化产物 B、既发生还原反应又发生氧化反应 C、被氧化的原子与被还原的原子的个数比2∶1 D、生成1molSi时,转移4mol电子8. 用表示阿伏加德罗常数的值,下列叙述正确的是( )A、常温常压下,18g含有的中子数、电子数均为 B、甲烷与白磷分子均为正四面体结构,其1mol分子中所含共价键数目均为 C、标准状况下,22.4LHF所含的分子数目为 D、32g由和组成的混合气体中氧原子数目为9. 二氧化氮通入水中,发生下列反应:该反应中,有关下列说法正确的是( )A、H2O作还原剂 B、被氧化与披还原的物质的个数之比为2∶1 C、HNO3是氧化剂 D、HNO3是还原产物10. 汽车尾气常用三效催化剂处理,其表面物质转化关系如图所示,说法正确的是( ) A、该过程的催化剂是Ba(NO3)2 B、转化过程中,氮元素均被还原 C、还原过程中生成0.1molN2 , 转移电子数为2NA D、三效催化剂使汽车尾气中污染物转化为无毒物质11. 雄黄(As4S4)具有驱虫解毒功效,雌黄(As2S3)是雄黄的伴生矿物,二者可以相互转化,转化过程如下,下列有关说法错误的是( )
A、该过程的催化剂是Ba(NO3)2 B、转化过程中,氮元素均被还原 C、还原过程中生成0.1molN2 , 转移电子数为2NA D、三效催化剂使汽车尾气中污染物转化为无毒物质11. 雄黄(As4S4)具有驱虫解毒功效,雌黄(As2S3)是雄黄的伴生矿物,二者可以相互转化,转化过程如下,下列有关说法错误的是( ) A、H2O参加了该转化过程 B、若1 mol雄黄发生Ⅱ反应转移28 mol电子,则a为SO3 C、已知亚砷酸具有两性,Ⅳ反应是酸碱中和反应 D、As2O3是砒霜的主要成分,它是亚砷酸(H3AsO3)的酸酐12. 关于反应3LiFePO4+13HNO3=3LiNO3+3Fe(NO3)3+3H3PO4+NO↑+2H2O,下列说法正确的是( )A、LiFePO4中P元素被氧化 B、HNO3反应过程中得到电子 C、生成3.0 g NO时,转移0.1 mol电子 D、还原产物与氧化产物的物质的量之比为3:113. 为阿伏加德罗常数的值。下列有关叙述正确的是( )A、的硫酸溶液中含的数目为 B、含有的质子数和中子数均为 C、通入适量水中,转移的电子数为 D、标准状况下,含有的共价键数为14. 为阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,所含溴原子的数目为 B、与足量的水反应生成 , 转移的电子数为 C、乙醇中含有的键的数目为 D、的溶液中含有的数目小于15. 火法炼铜的原理Cu2S+O2 2Cu+SO2.下列说法正确的是( )A、+1的Cu被O2还原成了Cu单质 B、0.5 mol O2得到的电子,可氧化得到SO2 11.2 L C、每生成64 g Cu电子转移的总数约为3×6.02×1023 D、为了提高铜矿的利用率,O2应过量16. 可闻声波诱导液体振动产生的法拉第波可以调节氧气分子在水中的溶解,从而诱导有差别的时空分布,有的区城呈氧化性,而同时有的区域呈还原性。研究人员选择了如图所示的氧化还原平衡体系。已知:声波频率提高可促进氧气的溶解。
A、H2O参加了该转化过程 B、若1 mol雄黄发生Ⅱ反应转移28 mol电子,则a为SO3 C、已知亚砷酸具有两性,Ⅳ反应是酸碱中和反应 D、As2O3是砒霜的主要成分,它是亚砷酸(H3AsO3)的酸酐12. 关于反应3LiFePO4+13HNO3=3LiNO3+3Fe(NO3)3+3H3PO4+NO↑+2H2O,下列说法正确的是( )A、LiFePO4中P元素被氧化 B、HNO3反应过程中得到电子 C、生成3.0 g NO时,转移0.1 mol电子 D、还原产物与氧化产物的物质的量之比为3:113. 为阿伏加德罗常数的值。下列有关叙述正确的是( )A、的硫酸溶液中含的数目为 B、含有的质子数和中子数均为 C、通入适量水中,转移的电子数为 D、标准状况下,含有的共价键数为14. 为阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,所含溴原子的数目为 B、与足量的水反应生成 , 转移的电子数为 C、乙醇中含有的键的数目为 D、的溶液中含有的数目小于15. 火法炼铜的原理Cu2S+O2 2Cu+SO2.下列说法正确的是( )A、+1的Cu被O2还原成了Cu单质 B、0.5 mol O2得到的电子,可氧化得到SO2 11.2 L C、每生成64 g Cu电子转移的总数约为3×6.02×1023 D、为了提高铜矿的利用率,O2应过量16. 可闻声波诱导液体振动产生的法拉第波可以调节氧气分子在水中的溶解,从而诱导有差别的时空分布,有的区城呈氧化性,而同时有的区域呈还原性。研究人员选择了如图所示的氧化还原平衡体系。已知:声波频率提高可促进氧气的溶解。
下列说法错误的是( )
A、MV2+被 还原形成自由基阳离子MV·+的过程伴随着颜色的改变 B、开启可闻声波能够促进MV2+再生 C、持续补充SDT才能维持蓝色 D、向体系中加入1 mol SDT,转移电子为2 mol17. 设 为阿伏加德罗常数的值,下列说法正确的是( )A、在高温、高压和催化剂的条件下, 与足量 反应,转移的电子数为 B、 溶液中 的浓度为 ,则 该溶液中含有的 的数目大于 C、常温下, 的 溶液中,由水电离出的 的数目为 D、标准状况下, 与 恰好完全反应,生成物中气体分子的数目为18. 《JournalofEnergyChemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是( )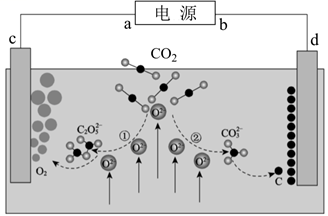 A、由图可知捕获CO2过程的初期发生了氧化还原反应 B、熔盐可用CCl4代替 C、d极电极反应式为 -4e-=C+3O2- D、转移1mol电子该装置最终可捕获CO25.6L(标况下)19. 如图为拟通过甲装置除去污水中的乙酸钠和对氯苯酚,同时利用此装置产生的电能进行粗铜的精炼。下列说法错误的是( )
A、由图可知捕获CO2过程的初期发生了氧化还原反应 B、熔盐可用CCl4代替 C、d极电极反应式为 -4e-=C+3O2- D、转移1mol电子该装置最终可捕获CO25.6L(标况下)19. 如图为拟通过甲装置除去污水中的乙酸钠和对氯苯酚,同时利用此装置产生的电能进行粗铜的精炼。下列说法错误的是( ) A、X极为阴极,发生还原反应 B、当电路中有0.2mol电子通过时,Y极质量可能减少3.2g C、A极的电极反应式:
A、X极为阴极,发生还原反应 B、当电路中有0.2mol电子通过时,Y极质量可能减少3.2g C、A极的电极反应式: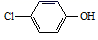 +e-=
+e-= 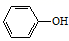 +Cl-
D、工作时,B极附近液体pH值减小
20. 碱性硼化钒(VB2)一空气电池工作时反应为 。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过 电子时,B装置内共收集到 气体(标准状况下),则下列说法错误的是( )
+Cl-
D、工作时,B极附近液体pH值减小
20. 碱性硼化钒(VB2)一空气电池工作时反应为 。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过 电子时,B装置内共收集到 气体(标准状况下),则下列说法错误的是( ) A、VB2电极发生的电极反应为 B、外电路中电流由c电极流向VB2电极 C、电解过程中,b电极表面有气泡产生 D、若B装置内的液体体积为 ,则 溶液的物质的量浓度为21. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、球碳盐K3C60中阴阳离子个数比为1:3 B、标准状况下,46gNO2气体中所含的分子数为 C、32g铜与足量硫单质完全反应,转移电子数为NA D、22.4L Cl2和CO的混合气体中含有的原子数为2NA22. W、X、Y、Z、M五种短周期元素的原子序数依次增大,其中X、Y、Z、M位于同一周期,W、Y位于同一主族,Z原子的最外层电子数是X原子最外层电子数的2倍,Y与Z形成的一种化合物的结构如图所示,下列叙述正确的是( )
A、VB2电极发生的电极反应为 B、外电路中电流由c电极流向VB2电极 C、电解过程中,b电极表面有气泡产生 D、若B装置内的液体体积为 ,则 溶液的物质的量浓度为21. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、球碳盐K3C60中阴阳离子个数比为1:3 B、标准状况下,46gNO2气体中所含的分子数为 C、32g铜与足量硫单质完全反应,转移电子数为NA D、22.4L Cl2和CO的混合气体中含有的原子数为2NA22. W、X、Y、Z、M五种短周期元素的原子序数依次增大,其中X、Y、Z、M位于同一周期,W、Y位于同一主族,Z原子的最外层电子数是X原子最外层电子数的2倍,Y与Z形成的一种化合物的结构如图所示,下列叙述正确的是( ) A、最简单离子的半径: B、氧化物对应水化物的酸性: C、由Y与M两种元素组成的化合物中各原子一定都满足8电子稳定状态 D、 在足量的 中燃烧,转移的电子数为
A、最简单离子的半径: B、氧化物对应水化物的酸性: C、由Y与M两种元素组成的化合物中各原子一定都满足8电子稳定状态 D、 在足量的 中燃烧,转移的电子数为二、多选题
-
23. 把碎纸片b、c、d、e补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是( )
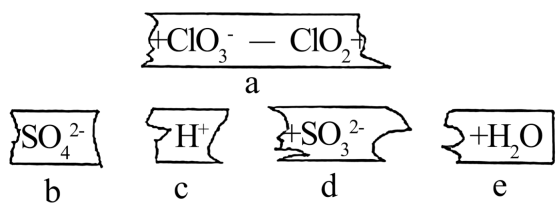 A、纸条排列的顺序可能是:c、d、a、b、e B、通过该反应可知还原性:ClO>SO C、氧化剂与还原剂的物质的量比为2:1 D、每生成1molClO2 , 反应转移的电子数为2NA24. 钒元素在酸性溶液中有多种存在形式,其中VO2+为蓝色,VO 为淡黄色,VO 具有较强的氧化性,浓盐酸能把VO 还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )A、在酸性溶液中氧化性:VO > >Cl2 B、向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色 C、向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol D、浓盐酸还原VO2+的离子方程式为2VO +4H++2Cl-=2VO2++Cl2↑+2H2O
A、纸条排列的顺序可能是:c、d、a、b、e B、通过该反应可知还原性:ClO>SO C、氧化剂与还原剂的物质的量比为2:1 D、每生成1molClO2 , 反应转移的电子数为2NA24. 钒元素在酸性溶液中有多种存在形式,其中VO2+为蓝色,VO 为淡黄色,VO 具有较强的氧化性,浓盐酸能把VO 还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )A、在酸性溶液中氧化性:VO > >Cl2 B、向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色 C、向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol D、浓盐酸还原VO2+的离子方程式为2VO +4H++2Cl-=2VO2++Cl2↑+2H2O三、非选择题
-
25. 稀土(
 )包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下: 
已知:月桂酸 熔点为 ;月桂酸和 均难溶于水。该工艺条件下,稀土离子保持 价不变; 的 ; 开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子
开始沉淀时的pH
8.8
1.5
3.6
6.2~7.4
沉淀完全时的pH
/
3.2
4.7
/
(1)、“氧化调pH”中,化合价有变化的金属离子是。(2)、“过滤1”前,用 溶液调pH至的范围内,该过程中 发生反应的离子方程式为。(3)、“过滤2”后,滤饼中检测不到 元素,滤液2中 浓度为 。为尽可能多地提取 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中 低于 (保留两位有效数字)。(4)、①“加热搅拌”有利于加快 溶出、提高产率,其原因是。②“操作X”的过程为:先 , 再固液分离。
(5)、该工艺中,可再生循环利用的物质有(写化学式)。(6)、稀土元素钇(Y)可用于制备高活性的合金类催化剂 。①还原 和 熔融盐制备 时,生成
 转移 电子。
转移 电子。② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为。
26. 环氧乙烷( ,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如下。
,简称EO)是一种重要的工业原料和消毒剂。由乙烯经电解制备EO的原理示意图如下。  (1)、①阳极室产生Cl2后发生的反应有:、CH2=CH2+HClO→HOCH2CH2Cl。
(1)、①阳极室产生Cl2后发生的反应有:、CH2=CH2+HClO→HOCH2CH2Cl。②结合电极反应式说明生成溶液a的原理。
(2)、一定条件下,反应物按一定流速通过该装置。电解效率η和选择性S的定义:
η(B)= ×100%
S(B)= ×100%
①若η(EO)=100%,则溶液b的溶质为。
②当乙烯完全消耗时,测得η(EO)≈70%,S(EO)≈97%,推测η(EO)≈70%的原因:
I.阳极有H2O放电
II.阳极有乙烯放电
III.阳极室流出液中含有Cl2和HClO
……
i.检验电解产物,推测I不成立。需要检验的物质是。
ii.假设没有生成EO的乙烯全部在阳极放电生成CO2 , η(CO2)≈%。经检验阳极放电产物没有CO2。
iii.实验证实推测III成立,所用试剂及现象是。
可选试剂:AgNO3溶液、KI溶液、淀粉溶液、品红溶液。
27. 二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。完成下列填空:
(1)、将二氧化氯通入品红试液中,看到的现象是;理由是。(2)、请配平下列反应的化学方程式(CH3OH中H为+1价,O为-2价):CH3OH+NaClO3+ → CO2↑+ClO2↑+Na2SO4+
(3)、该反应中,被氧化的元素是。还原产物与氧化产物的物质的量之比是。(4)、根据上述反应可推知。a.氧化性:ClO2>NaClO3 b.氧化性:NaClO3>CH3OH
c.还原性:CH3OH>ClO2 d.还原性:CH3OH>Na2SO4
(5)、若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则反应产生气体(标准状况)为升。(6)、消毒效率常以单位质量的消毒剂得到的电子数表示。ClO2的消毒效率是Cl2的倍。28. 二氧化氯(ClO2)是世界卫生组织(WHO)推荐的Al级广谱、安全、高效消毒剂。以下是ClO2的两种制备方法:方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:H2C2O4 + 2NaClO3 + H2SO4 → Na2SO4 + 2CO2↑ + 2ClO2↑ + 2H2O
完成下列填空:
(1)、在方法一中,当有0.2 mol电子发生转移时,参与反应的还原剂为 mol。(2)、在方法二中,反应物H2C2O4(填序号)。a.仅做氧化剂 b.既被氧化又被还原
c.发生氧化反应 d.既未被氧化也未被还原
(3)、两种方法相比,(填写“方法一”或“方法二”)制备的ClO2更适合用于饮用水的消毒,其主要原因是。(4)、实验室也可用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,其化学反应方程式为 。(5)、氯原子核外共有种不同运动状态的电子,氯离子的最外层电子排布式是。(6)、CCl4分子的空间构型为 , CO2的电子式是。(7)、相同压强下,部分元素氯化物的熔点见表:氯化物
NaCl
KCl
CCl4
熔点/℃
804
773
-22.92
试解释表中氯化物熔点差异的原因:。
29. 烟气的脱硝(除 )技术和脱硫(除 )技术都是目前环境科学研究的热点。(1)、工业上可以采用“质子膜电解槽”对烟气进行脱硫脱硝,其工艺如图甲所示:
① 溶液吸收 主要反应的化学方程式为;
②电解的主要目的是 , 阴极的电极反应式为;
③“高价氮的化合物”中NO2在反应器中发生化合反应的化学方程式为;
(2)、利用活性焦炭的吸附作用,可以对烟气进行脱硫和脱硝。被吸附的 与活性焦炭反应生成 和 ,当生成 时,转移电子的物质的量为 ;(3)、一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入 的 乳浊液中,发生的反应如下: , ,改变 , 的去除率变化情况如图乙所示。
①当 大于1.4时, 去除率升高,但 的去除率却降低。其可能的原因是;
② 和 发生的主要反应为 。保持 的初始浓度不变,改变 ,将反应后的混合气体通入 乳浊液中吸收。为节省 的用量,又能保持 去除效果,则 合适的值约为;
(4)、已知: , ,则 。30. 三氯化钌广泛应用于氯碱工业中金属阳极钌涂层及加氢催化剂。现以固体含Ru废料为原料制备RuCl3晶体,其工艺流程如下:
回答下列问题:
(1)、K2RuO4中Ru的化合价为 , “碱熔”中产生的气体可用于(写一种工业用途)。(2)、“氧化”时欲使2mol K2RuO4氧化为RuO4 , 则需要氧化剂的物质的量为mol。(3)、为了提高“碱熔”效率,可以采取的措施有。(4)、RuO4气体有剧毒,“盐酸吸收”时的化学方程式为。(5)、可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2 = 2Ru+6HCl,所得实验数据记录如下:实验序号
产品质量/g
固体Ru质量/g
①
5.1875
2.0210
②
5.1875
2.0190
③
5.1875
2.0200
④
5.1875
1.6200
则产品的纯度为(用百分数表示)。
(6)、钌及其化合物在合成工业上有广泛用途,根据图示写出合成反应的化学方程式。 31. 用11.92gNaClO配成溶液,向其中加入0.01molNa2SX恰好完全反应,生成Na2SO4和NaCl。则Na2SX 中的 x=(写出简要计算过程)32. 某科研小组利用硫铁矿(主要成分是FeS2 , 含Fe2O3、SiO2、Al2O3等杂质)制备重要的化工原料纳米Fe2O3的工艺流程如图所示。
31. 用11.92gNaClO配成溶液,向其中加入0.01molNa2SX恰好完全反应,生成Na2SO4和NaCl。则Na2SX 中的 x=(写出简要计算过程)32. 某科研小组利用硫铁矿(主要成分是FeS2 , 含Fe2O3、SiO2、Al2O3等杂质)制备重要的化工原料纳米Fe2O3的工艺流程如图所示。
回答下列问题:
(1)、煅烧前硫铁矿粉碎的目的是 , 硫铁矿煅烧得到的气体需回收,该气体在工业上的主要用途是。(2)、用稀硫酸浸取硫铁矿烧渣的主要反应的离子方程式为 , 浸取后过滤得到的滤渣的化学式为。(3)、加入FeS2的主要目的是还原滤液中的Fe3+ , 反应的化学方程式为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4 , 反应中每消耗1molFeS2 , 转移的电子数目为 , 检验Fe3+是否完全被还原,应选择 (填标号)。A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(4)、加FeCO3调溶液pH到5.8左右,其目的为。(5)、加入NH4HCO3生成FeCO3的离子方程式为 , 若煅烧得到160g纳米Fe2O3 , 则消耗的气体和生成的气体的物质的量之比为。33. 高铁酸盐是一种新型绿色净水消毒剂,热稳定性差,在碱性条件下能稳定存在,溶于水发生反应:4FeO42-+10H2O=4Fe(OH)3+3O2↑+8OH-。回答下列问题:(1)、工业上湿法制备高铁酸钾(K2FeO4)的工艺如图:
①Na2FeO4中铁元素的化合价为 , 高铁酸钠用于杀菌消毒时的化学反应类型为 (填“氧化还原反应”、“复分解反应”或“化合反应”)。
②反应2加入饱和KOH溶液可转化析出K2FeO4 , 理由是 。
(2)、化学氧化法生产高铁酸钠(Na2FeO4)是利用Fe(OH)3、过饱和的NaClO溶液和NaOH浓溶液反应,该反应的化学方程式为;理论上每制备0.5mol的Na2FeO4消耗NaClO的质量为(保留小数点后1位)。(3)、采用三室膜电解技术制备Na2FeO4的装置如图甲所示,阳极的电极反应式为。电解后,阴极室得到的A溶液中溶质的主要成分为(填化学式)。 (4)、将一定量的K2FeO4投入一定浓度的Fe2(SO4)3溶液中,测得剩余K2FeO4浓度变化如图乙所示,推测曲线I和曲线Ⅱ产生差异的原因是。34. Fe2O3 在高炉高温下可以发生下列反应:Fe2O3+CO=2FeO+CO2 , 形成的固体混和物(Fe2O3、FeO)中,元素铁和氧质量比用 mFe︰mO 表示 21︰a。(1)、若 mFe︰mO=21︰8,计算 Fe2O3 被 CO 还原的百分率;(2)、Fe2O3 和 CO 的反应分两步进行:Fe2O3→Fe3O4→FeO,当 6<a<8,若 mgFe2O3 参与反应,计算消耗 m(CO)的质量。35. 研究人员将Cu与Cu2O的混合物ag,用足量的稀H2SO4充分反应后,剩余固体质量为bg。
(4)、将一定量的K2FeO4投入一定浓度的Fe2(SO4)3溶液中,测得剩余K2FeO4浓度变化如图乙所示,推测曲线I和曲线Ⅱ产生差异的原因是。34. Fe2O3 在高炉高温下可以发生下列反应:Fe2O3+CO=2FeO+CO2 , 形成的固体混和物(Fe2O3、FeO)中,元素铁和氧质量比用 mFe︰mO 表示 21︰a。(1)、若 mFe︰mO=21︰8,计算 Fe2O3 被 CO 还原的百分率;(2)、Fe2O3 和 CO 的反应分两步进行:Fe2O3→Fe3O4→FeO,当 6<a<8,若 mgFe2O3 参与反应,计算消耗 m(CO)的质量。35. 研究人员将Cu与Cu2O的混合物ag,用足量的稀H2SO4充分反应后,剩余固体质量为bg。已知:Cu2O+2H+═Cu+Cu2++H2O
(1)、混合物中n(Cu2O)=mol(用含a、b的最简式表示)(2)、若将ag混合物在空气中加热生成CuO,则m(CuO)=g(用含a、b的最简式表示)36. 工业上,在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氢气和水,反应方程式可表示为:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)(1)、一定条件下,在容积为2L的容器内进行该反应,20min时达到平衡,生成N2 0.4mol,则平均反应速率v(NO)=。可从混合气体的颜色变化判断上述反应是否达到平衡,其理由是。(2)、工业上也用氨水吸收SO2尾气,最终得到(NH4)2SO4 , (NH4)2SO4溶液中c(NH4+)与c(SO42-)之比2:1(选填“>”、“<”、“=”),用离子方程式解释其原因。(3)、与Cl2相比较,ClO2处理水时被还原成Cl- , 不生成有机氯代物等有害物质。工业上可用亚铝酸钠和稀盐酸为原料制备ClO2 , 反应如下:NaClO2+HCl→ClO2↑+NaCl+(没有配平)(4)、补全方程式并配平,标出电子转移方向和数目 。(5)、该反应中氧化剂和还原剂的物质的量之比是。若生成0.2molClO2 , 转移电子数为个。