高考二轮复习知识点:氧化还原反应的电子转移数目计算1
试卷更新日期:2023-08-01 类型:二轮复习
一、选择题
-
1. 离子化合物和与水的反应分别为;。下列说法正确的是( )A、中均有非极性共价键 B、中水发生氧化反应,中水发生还原反应 C、中阴、阳离子个数比为 , 中阴、阳离子个数比为 D、当反应和中转移的电子数相同时,产生的和的物质的量相同2. 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄褪色的主要原因是发生了以下两种化学反应:

下列说法正确的是
A、和的空间结构都是正四面体形 B、反应Ⅰ和Ⅱ中,元素和S都被氧化 C、反应Ⅰ和Ⅱ中,参加反应的:Ⅰ<Ⅱ D、反应Ⅰ和Ⅱ中,氧化转移的电子数之比为3∶73. 葡萄糖酸钙是一种重要的补钙剂,工业上以葡萄糖、碳酸钙为原料,在溴化钠溶液中采用间接电氧化反应制备葡萄糖酸钙,其阳极区反应过程如下:
下列说法错误的是
A、溴化钠起催化和导电作用 B、每生成葡萄糖酸钙,理论上电路中转移了电子 C、葡萄糖酸能通过分子内反应生成含有六元环状结构的产物 D、葡萄糖能发生氧化、还原、取代、加成和消去反应4. 我国古代四大发明之一黑火药的爆炸反应为:。设为阿伏加德罗常数的值,下列说法正确的是A、含键数目为 B、每生成转移电子数目为 C、晶体中含离子数目为 D、溶液中含数目为5. 设为阿伏加德罗常数的值,下列说法正确的是A、中含有的电子数为 B、溶液中含有的阴离子数目小于 C、标准状况下,乙炔中含有的键数目为 D、与足量的氧气反应转移电子数目为6. SCR是目前较成熟的烟气脱硝技术,它是一种炉后脱硝方法,世界上流行的SCR工艺主要分为氨法SCR和尿素法SCR,尿素法SCR示意图如下图。下列说法错误的是 A、尿素分子中键与键的个数比为 B、该尿素的质量分数约为 C、和的物质的量各为与反应时可完全转化为无毒物质,该过程中转移的电子数目为 D、在70~80℃条件下,尿素也可与烟气中的以物质的量比恰好完全反应,则生成的和的物质的量之比为7. 某化学兴趣小组设计一种从硫矿石(主要成分为硫黄及少量FeS2)中提取硫黄的方法如下:
A、尿素分子中键与键的个数比为 B、该尿素的质量分数约为 C、和的物质的量各为与反应时可完全转化为无毒物质,该过程中转移的电子数目为 D、在70~80℃条件下,尿素也可与烟气中的以物质的量比恰好完全反应,则生成的和的物质的量之比为7. 某化学兴趣小组设计一种从硫矿石(主要成分为硫黄及少量FeS2)中提取硫黄的方法如下:
查阅资料:S的熔点为115.2℃;的沸点为46.2℃。
下列说法错误的是
A、单质硫是分子晶体 B、过程①中可用乙醇代替 C、过程③的目的是使挥发,同时使硫从水中析出 D、将趁热过滤所得滤渣煅烧: , 反应中每生成1 mol , 转移电子的物质的量为5.5 mol8. 向含的废水中加入铁粉和可制备 , 反应如下 , 下列说法正确的是A、的电子式为 B、加入的作用是提供和调节 C、电离方程式: D、反应中每生成转移电子9. 某校化学兴趣小组利用如图装置在实验室制备“84”消毒液,下列说法正确的是 A、装置I中的可以替换成 B、装置Ⅱ可以除去中杂质,还可以防止倒吸 C、装置Ⅲ中消耗(标准状况),转移电子 D、装置Ⅳ的作用是吸收空气中的和水蒸气10. 水热法制备Fe3O4纳米颗粒的反应为: 3Fe2++2S2O32-+O2+xOH-=Fe3O4↓+S4O62-+2H2O,若反应生成1 mol Fe3O4 , 则下列说法正确的是( )A、x=6 B、S2O32-作氧化剂 C、转移电子2 mol D、被Fe2+还原的O2为0.5 mol11. 关于反应2NaNO2+2KI+2H2SO4=2NO↑+I2+Na2SO4+K2SO4+2H2O,下列说法正确的是A、KI发生还原反应 B、H2SO4既不是氧化剂,也不是还原剂 C、氧化产物与还原产物的物质的量之比为2:1 D、消耗0.5molNaNO2时,转移1.0mol电子12. 设为阿伏加德罗常数的值,下列说法正确的是( )A、1.8g含有的中子数为0.1 B、1L氨水中所含的数目为0.1 C、5.6g铁与足量稀盐酸反应、转移的电子数)0.3 D、124g(
A、装置I中的可以替换成 B、装置Ⅱ可以除去中杂质,还可以防止倒吸 C、装置Ⅲ中消耗(标准状况),转移电子 D、装置Ⅳ的作用是吸收空气中的和水蒸气10. 水热法制备Fe3O4纳米颗粒的反应为: 3Fe2++2S2O32-+O2+xOH-=Fe3O4↓+S4O62-+2H2O,若反应生成1 mol Fe3O4 , 则下列说法正确的是( )A、x=6 B、S2O32-作氧化剂 C、转移电子2 mol D、被Fe2+还原的O2为0.5 mol11. 关于反应2NaNO2+2KI+2H2SO4=2NO↑+I2+Na2SO4+K2SO4+2H2O,下列说法正确的是A、KI发生还原反应 B、H2SO4既不是氧化剂,也不是还原剂 C、氧化产物与还原产物的物质的量之比为2:1 D、消耗0.5molNaNO2时,转移1.0mol电子12. 设为阿伏加德罗常数的值,下列说法正确的是( )A、1.8g含有的中子数为0.1 B、1L氨水中所含的数目为0.1 C、5.6g铁与足量稀盐酸反应、转移的电子数)0.3 D、124g( )分子中所含的共价键数目为6
13. 汽车碰撞时,安全气囊中发生反应:。若氧化产物比还原产物多7mol,下列说法错误的是( )A、生成8mol B、1mol被还原 C、转移7mol电子 D、15mol氮原子被氧化14. 下列说法正确的是( )A、室温下,1L0.1mol·L-1盐酸中H+的数目约为6.02×1022 B、标准状况下,5.6LCCl4中所含C—Cl键的数目约为6.02×1023 C、5.6gFe和足量Cl2反应转移电子的物质的量为0.2mol D、室温下,pH相同的盐酸和硫酸中,溶质的物质的量浓度相同15. 据2022年1月统计,我国光伏发电并网装机容量突破3亿千瓦,连续七年稳居全球首位。已知四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],工作原理如图。下列说法正确的是( )
)分子中所含的共价键数目为6
13. 汽车碰撞时,安全气囊中发生反应:。若氧化产物比还原产物多7mol,下列说法错误的是( )A、生成8mol B、1mol被还原 C、转移7mol电子 D、15mol氮原子被氧化14. 下列说法正确的是( )A、室温下,1L0.1mol·L-1盐酸中H+的数目约为6.02×1022 B、标准状况下,5.6LCCl4中所含C—Cl键的数目约为6.02×1023 C、5.6gFe和足量Cl2反应转移电子的物质的量为0.2mol D、室温下,pH相同的盐酸和硫酸中,溶质的物质的量浓度相同15. 据2022年1月统计,我国光伏发电并网装机容量突破3亿千瓦,连续七年稳居全球首位。已知四甲基氢氧化铵[(CH3)4NOH]常用作电子工业清洗剂,以四甲基氯化铵[(CH3)4NCl]为原料,采用电渗析法合成[(CH3)4NOH],工作原理如图。下列说法正确的是( ) A、光伏并网发电装置中N型半导体为正极 B、c为阳离子交换膜,d、e均为阴离子交换膜 C、保持电流恒定,升高温度可加快合成四甲基氢氧化铵的速率 D、制备182g四甲基氢氧化铵,两极共产生33.6L气体(标准状况)16. 一种新型无隔膜可充电电池 , 水系电池以锌箔、石墨毡为集流体,和的混合液作电解质溶液,工作原理如图所示。
A、光伏并网发电装置中N型半导体为正极 B、c为阳离子交换膜,d、e均为阴离子交换膜 C、保持电流恒定,升高温度可加快合成四甲基氢氧化铵的速率 D、制备182g四甲基氢氧化铵,两极共产生33.6L气体(标准状况)16. 一种新型无隔膜可充电电池 , 水系电池以锌箔、石墨毡为集流体,和的混合液作电解质溶液,工作原理如图所示。
下列说法正确的是( )
A、过程I为充电过程,a接电源的正极 B、为增强电池效率,可向电解液中加入硫酸以增强溶液的导电性 C、过程II为放电过程,石墨毡极的电极反应式为 D、放电时,当外电路转移2mol时,两电极质量变化的差值为22g17. 科学家发明了如图所示的新型Zn—CO2水介质电池,电极为金属锌和选择性催化材料,放电时,CO2被转化为储氢物质甲酸等。下列说法正确的是( ) A、放电时,负极反应式为:Zn+2e-+4OH-=Zn(OH) B、放电时,1 mol CO2完全转化为HCOOH,理论上转移4 mol电子 C、充电时,正极溶液中OH−浓度升高 D、充电时,电池总反应为:2Zn(OH)2Zn+O2↑+4OH-+2H2O18. 镓(Ga)位于周期表中第四周期第IIIA族,与强酸、强碱溶液均能反应生成H2 , 是一种应用广泛的金属元素,可用于制造半导体材料氮化镓、砷化镓、磷化镓等。同温同压下, 分别与 浓度均为 的盐酸和氢氧化钠溶液充分反应,生成H2的体积分别为 和 。下列说法错误的是( )A、 B、转移的电子数之比为 C、消耗酸和碱的物质的量之比为 D、反应前后两溶液的质量变化相等19. 水合肼 的性质类似氨水。利用水合肼处理铜氨 废液回收铜粉的实验流程如图:
A、放电时,负极反应式为:Zn+2e-+4OH-=Zn(OH) B、放电时,1 mol CO2完全转化为HCOOH,理论上转移4 mol电子 C、充电时,正极溶液中OH−浓度升高 D、充电时,电池总反应为:2Zn(OH)2Zn+O2↑+4OH-+2H2O18. 镓(Ga)位于周期表中第四周期第IIIA族,与强酸、强碱溶液均能反应生成H2 , 是一种应用广泛的金属元素,可用于制造半导体材料氮化镓、砷化镓、磷化镓等。同温同压下, 分别与 浓度均为 的盐酸和氢氧化钠溶液充分反应,生成H2的体积分别为 和 。下列说法错误的是( )A、 B、转移的电子数之比为 C、消耗酸和碱的物质的量之比为 D、反应前后两溶液的质量变化相等19. 水合肼 的性质类似氨水。利用水合肼处理铜氨 废液回收铜粉的实验流程如图:
下列说法错误的是( )
A、上述三步反应过程均为氧化还原反应 B、反应1的目的是制备 C、合成水合肼的反应中每消耗 转移电子数为 D、反应2完成后要用到过滤操作20. 催化还原氮氧化物是目前应用最广泛的烟气脱硝技术。用活化后的作催化剂,将NO还原成的一种反应历程如图所示:
下列说法正确的是( )
A、增大浓度会影响催化剂对其它气体的吸附 B、总反应的化学方程式为 C、反应过程中催化剂本身未发生价态的变化 D、当消耗标准状况下时,整个过程转移6mol电子21. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、由H218O与D216O组成的4.0 g混合物含中子数为2NA B、100 mL 0.1 mol/LCH3COONa溶液中阴离子数目大于0.01NA C、标准状况下,22.4 L甲醇中含有-OH的数目为NA个 D、某密闭容器中0.1molNa2O2和0.1 mol SO2充分反应,转移电子的数目为0.2NA22. 雄黄()和雌黄()是提取砷的主要矿物原料,二者都难溶于水,在自然界中共生,且可以相互转化。雌黄()能溶于 , 反应如下:。下列说法错误的是( )A、生成 , 则反应中转移电子的物质的量为 B、若将该反应设计成原电池,可选用硝酸作电解质溶液、石墨作负极、作正极 C、反应产生的可用溶液吸收 D、雄黄转化为雌黄过程需要氧化剂23. NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,22.4L CO2中共用电子对数目为2 NA B、标准状况下,46g NO2与N2O4的混合物中所含的原子总数目为3NA C、100g质量分数为49%的硫酸溶液,含有的氧原子数目为2NA D、一定条件下 ,0.2mol SO2与0.1mol O2充分反应后转移电子总数为0.4 NA24. 联氨(N2H4)可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是( ) A、①转化中N2H4是还原剂 B、工业上也可使用Na2SO3处理锅炉水中的溶解氧 C、1mol N2H4可处理水中1.5 molO2 D、③中发生反应后溶液的pH增大
A、①转化中N2H4是还原剂 B、工业上也可使用Na2SO3处理锅炉水中的溶解氧 C、1mol N2H4可处理水中1.5 molO2 D、③中发生反应后溶液的pH增大二、多选题
-
25. “三室法”制备烧碱和硫酸示意图如图,下列说法正确的是( )
 A、电极B为阴极,发生还原反应 B、离子交换膜B为阳离子交换膜 C、稀硫酸从c处进,浓 溶液从b处出,浓 溶液从e处进 D、理论上 迁移数等于导线中通过的电子数, 的迁移数是导线上通过电子数的一半
A、电极B为阴极,发生还原反应 B、离子交换膜B为阳离子交换膜 C、稀硫酸从c处进,浓 溶液从b处出,浓 溶液从e处进 D、理论上 迁移数等于导线中通过的电子数, 的迁移数是导线上通过电子数的一半三、非选择题
-
26. 2020年人类在金星大气中探测到磷化氢( , 也叫膦),也是一种储粮用的熏蒸杀虫剂。(1)、在密闭粮仓放置的磷化钙()片剂,遇水蒸气放出气体。该反应的化学方程式为。(2)、可以采取类似于实验室制取氨气的方法来制取 , 写出PH4I固体和NaOH固体制取的化学方程式:。(3)、工业上,由磷矿制备膦的一种工艺如下:

已知: , 回答下面问题:
①已知白磷在空气中易自燃,将和CO分离得到最经济科学的方法是。
②属于元酸,属于。(填“酸式盐”“正盐”或“碱式盐”)
③白磷和氢氧化钾溶液反应中氧化剂和还原剂物质的量之比是。
④吸入磷化氢会对心脏、呼吸系统、肾、肠胃、神经系统和肝脏造成影响。磷化氢中毒时,可以口服硫酸铜溶液催吐,并解毒:。那么消耗2mol时转移电子mol。
27. 铂钌催化剂是甲醇燃料电池的阳极催化剂。一种以钌矿石[主要含Ru(CO3)2 , 还含少量的FeO、MgO、RuO4、CaO、SiO2]为原料制备钌(Ru)的流程如图。回答下列问题: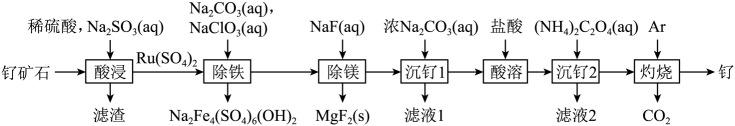 (1)、Na2Fe4(SO4)6(OH)2中Fe的化合价为。(2)、“酸浸”时,Na2SO3的作用。“滤渣”的主要成分有SiO2和(填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是。
(1)、Na2Fe4(SO4)6(OH)2中Fe的化合价为。(2)、“酸浸”时,Na2SO3的作用。“滤渣”的主要成分有SiO2和(填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是。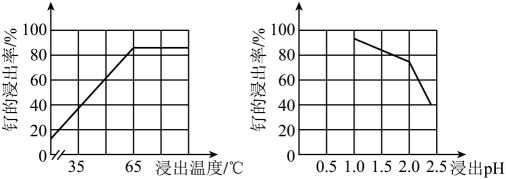 (3)、“除铁”的离子方程式为。(提示:1molNaClO3参与反应,转移6mol电子)(4)、从“滤液2”中可提取一种化肥,其电子式为。(5)、“灼烧”时Ar的作用是。(6)、某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为。(保留三位有效数字)28. 纳米零价铁(ZVI)因其高比表面积、优异的吸附性、较强的还原性和反应活性等优点被广泛应用于污染物的去除。(1)、ZVI可通过FeCl2·4H2O和NaBH4溶液反应制得,同时生成H2、B(OH) , 制备过程中需要不断通入高纯氮气,其目的是。(2)、ZVI电化学腐蚀处理三氯乙烯进行水体修复,H+、O2、等物种的存在会影响效果,水体修复的过程如图所示。有效腐蚀过程中,生成1mol乙烯所转移的电子物质的量为mol,过程④对应的电极反应式为。
(3)、“除铁”的离子方程式为。(提示:1molNaClO3参与反应,转移6mol电子)(4)、从“滤液2”中可提取一种化肥,其电子式为。(5)、“灼烧”时Ar的作用是。(6)、某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为。(保留三位有效数字)28. 纳米零价铁(ZVI)因其高比表面积、优异的吸附性、较强的还原性和反应活性等优点被广泛应用于污染物的去除。(1)、ZVI可通过FeCl2·4H2O和NaBH4溶液反应制得,同时生成H2、B(OH) , 制备过程中需要不断通入高纯氮气,其目的是。(2)、ZVI电化学腐蚀处理三氯乙烯进行水体修复,H+、O2、等物种的存在会影响效果,水体修复的过程如图所示。有效腐蚀过程中,生成1mol乙烯所转移的电子物质的量为mol,过程④对应的电极反应式为。 (3)、ZVI可去除废水中Pb2+ , pH<6时,pH对Pb2+的去除率的影响如图所示。
(3)、ZVI可去除废水中Pb2+ , pH<6时,pH对Pb2+的去除率的影响如图所示。
已知:ⅰ)在水中,ZVI表面的FeOH会因为质子化/去质子化作用而使其表面带正/负电荷,可表示为:FeOH+H+FeOH , FeOHFeO-+H+。pH约为8.1达到等电点,ZVI表面不带电。
ⅱ)pH<6时,ZVI去除Pb2+主要发生表面配位反应和还原反应:
2FeOH+ Pb2+(FeO)2Pb + 4H+
2Fe+ 3Pb2++ 4H2O3Pb+2FeOOH + 6H+
①pH<6时,铁氧化物颗粒不易吸附Pb2+的原因是。
②pH<6时,随着pH增大,Pb2+的去除率会增大至接近100%的原因是。
(4)、催化剂协同ZVI能将水体中的硝酸盐()转化为N2 , 其催化还原反应的过程如图所示。为有效降低水体中氮元素的含量,宜调整水体pH为4.2,当pH<4.2时,随pH减小,N2生成率逐渐降低的原因是。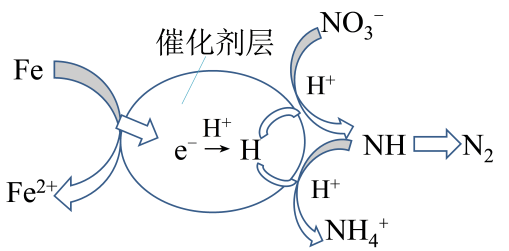 29. NO的排放是造成酸雨及光化学污染的罪魁祸首,采用科学技术减少氮氧化物等物质的排放可促进社会主义生态文明建设。(1)、如图表示了我国某地区在1959~2019年间,空气中NO,含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的统计数据。结合图中数据,判断下列说法正确的是_______。
29. NO的排放是造成酸雨及光化学污染的罪魁祸首,采用科学技术减少氮氧化物等物质的排放可促进社会主义生态文明建设。(1)、如图表示了我国某地区在1959~2019年间,空气中NO,含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的统计数据。结合图中数据,判断下列说法正确的是_______。 A、在交通运输中排放的NOx与燃料的不充分燃烧有关 B、1mol氮氧化物(NOx)形成硝酸型酸雨时转移电子(5-2x)mol C、N2转化为NO的过程不属于氮的固定 D、随着汽车工业的发展,交通运输的NO,排放量所占比重呈增大趋势(2)、用CH4催化还原氮氧化物的相关热化学方程式如下:
A、在交通运输中排放的NOx与燃料的不充分燃烧有关 B、1mol氮氧化物(NOx)形成硝酸型酸雨时转移电子(5-2x)mol C、N2转化为NO的过程不属于氮的固定 D、随着汽车工业的发展,交通运输的NO,排放量所占比重呈增大趋势(2)、用CH4催化还原氮氧化物的相关热化学方程式如下:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(1) ΔH=-662 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(1) ΔH=-1248 kJ/mol
反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(1) ΔH=kJ/mol
(3)、工业上可采用碱液来吸收NOx , 有关的化学反应:①NO+NO2+2NaOH=2NaNO2+H2O
②2NO2+2NaOH=NaNO2+NaNO3+H2O
现有一定条件下a mol NO2和b mol NO的混合气体恰好被一定体积NaOH溶液完全吸收,则a、b应满足的关系为。
(4)、利用某分子筛作催化剂,可脱除工厂废气中的NO、NO2 , 反应机理如图所示。请写出在此反应机理中脱去NO的离子反应方程式。 (5)、在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2
(5)、在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2①NH3与NO2生成N2的反应中,当生成1mol N2时,转移的电子为mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(如图1所示)。反应相同时间NOx的去除率随反应温度的变化曲线如图2所示。下列相关分析正确的是(填序号)

A.在50~150℃范围内随着温度的升高,NOx的去除率迅速上升的原因可能是:催化剂活性随温度升高增大与温度升高共同使NOx去除反应速率迅速增大
B.在150~250℃范围内随着温度的升高,NOx的去除率缓慢上升的原因可能是:温度升高引起的NOx去除反应速率增大
C.反应温度高于380℃时,NOX的去除率迅速下降的原因可能是:催化剂活性下降
D.反应温度高于380℃时,NOx的去除率迅速下降的原因可能是:NH3与O2反应生成了NO
30. 卤族元素的化合物在生活、医药、化工中有着重要的用途。(1)、I.过氧化氢氧化法制备碘酸钾(KIO3)的方法如图:
氧原子核外有种运动状态不同的电子;碘原子最外层电子的排布式为;K2CO3固体中含有的化学键有。
(2)、合成步骤中的化学方程式为。(3)、当合成温度高于70℃,碘酸钾产率会降低,请写出可能的两种原因:。(4)、Ⅱ.ClO2和Cl2都可以用于自来水消毒杀菌,可以通过下列方法制取:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
该反应的氧化产物为 , 若反应过程中有4 mol HCl参与反应,则电子转移的数目为。
(5)、Ⅲ.目前从海水中提溴(Br2)大致有“浓缩”、“氧化”、“提取”等步骤。向浓缩的海水中通入Cl2 , 将海水中的Br-氧化为Br2。“氧化”时先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是。
(6)、用热空气将Br2从上述溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2。吸收1 mol Br2需消耗Na2CO3mol。31. 菱锰矿的主要成分是MnCO3 , 其中含有FeCO3、CaCO3、MgCO3等杂质。工业上采用硫酸铵焙烧菱锰矿法制备高纯MnCO3 , 流程如下图:
已知:
I.金属碳酸盐和硫酸铵混合粉末在加热条件下反应,生成硫酸盐、NH3和CO2。
II.溶液中金属离子沉淀的pH如下表:
金属离子
Fe3+
Fe2+
Mn2+
Mg2+
Ca2+
开始沉淀pH
1.5
6.3
8.2
8.9
11.9
完全沉淀pH
2.8
8.3
10.2
10.9
13.9
(1)、步骤1中MnCO3与(NH4)2SO4反应的化学方程式是。(2)、步骤2和3中加入MnO2固体、调节pH的目的分别是。(3)、上述流程中可以再利用的物质有。a.(NH4)2SO4 b.NH3 c.CO2
(4)、MnCO3可用于制备苯甲醛,流程如下:
已知:甲苯难溶于水,密度小于水,沸点为110.4oC;苯甲醛微溶于水,易溶于甲苯,沸点为179℃。
①MnCO3在空气中加热的化学方程式是。
②操作1是;操作2是。
③该方法制备1.06kg苯甲醛,则理论上消耗Mn2O3kg[M(Mn2O3)=158g/mol;M(苯甲醛)=106g/mol]。
32. 氧族元素(O、S、Se等)及其化合物在生产生活中发挥着巨大作用。(1)、实验室用 溶液和 粉末在常温下反应制备 ,装置如图。
①将虚线框a内的仪器补充完整(夹持装置可省略)。
②b为尾气吸收装置,其中的试剂为。
(2)、生物浸出法可有效回收含硫矿石中的有色金属,某种生物浸出法中主要物质的转化路径如图。
①步骤Ⅰ反应的离子方程式为。
②生物浸出法的总反应的氧化剂是。
(3)、以工业硒为原料制备高纯硒的流程如图。①下列说法正确的是(填字母序号)。
a.过程i到过程ⅲ均为氧化还原反应
b. 既有氧化性,又有还原性
c. 能与NaOH反应生成 和
d.Se与 化合比S与 化合容易
②过程ⅲ中使用的还原剂为 ,对应产物是 。理论上,过程i消耗的 与过程消耗的 的物质的量之比为(工业硒中杂质与 的反应可忽略)。
33. 保险粉(Na2S2O4)是一种白色粉末,在空气中易被氧化,在强酸性环境中不稳定,遇水自身易发生氧化还原反应。可用作还原剂和漂白剂。(1)、I.实验室制法将甲酸钠(易溶于水,微溶于甲醇)、80%甲醇水溶液和NaOH溶液混合,再通入SO2气体,并维持体系弱酸性环境。
补全反应的化学方程式:HCOONa+NaOH+SO2=_+CO2+_,。
(2)、实验中采用80%甲醇水溶液的目的是。(3)、反应一段时间后,装置中有白色固体析出,将固体过滤、洗涤、干燥、收集。干燥保险粉的最佳方法。(选填字母)a.空气中蒸发干燥b.真空干燥c.氯化氢气流中蒸发干燥
(4)、II.工业制法用惰性电极电解NaHSO3溶液制备Na2S2O4 , 装置如图所示。写出a电极的电极反应式。
 (5)、III.制备过程中,产生COD值很高的废水的处理方法
(5)、III.制备过程中,产生COD值很高的废水的处理方法资料:COD为化学需氧量,是表示水中还原性物质多少的一个指标。是指在一定的条件下,采用一定的强氧化剂处理水样时,所消耗的氧化剂量。在Fe2+催化下,H2O2分解为具有强氧化性的氢氧自由基(·OH),可利用其氧化性氧化水体中的还原性物质,以达到处理COD值很高的废水的目的。
用化学用语表示产生氢氧自由基(·OH)的过程。
(6)、当Fe2+投入量超过一定值,会使得还原性物质的脱除率降低,COD无法达到预期指标。可能的原因是。34. 烟气中通常含有高浓度SO2、氮氧化物及粉尘颗粒等有害物质,在排放前必须进行脱硫脱硝处理。(1)、利用甲烷可将氮氧化物还原为氮气除去。已知:2NO(g)+O2(g)=2NO2(g);ΔH=a kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=b kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);ΔH=c kJ·mol-1
反应CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);ΔH= kJ·mol-1。
(2)、H2O2在催化剂αFeOOH的表面上,分解产生·OH。·OH较H2O2和O2更易与烟气中的NO、SO2发生反应。反应后所得产物的离子色谱如图1所示。
①写出·OH氧化NO的化学反应方程式:。
②当H2O2浓度一定时,NO的脱除效率与温度的关系如图2所示。升温至80 ℃以上,大量汽化的H2O2能使NO的脱除效率显著提高的原因是 , 温度高于180 ℃,NO的脱除效率降低的原因是。
(3)、工业可采用亚硫酸钠作吸收液脱除烟气中的二氧化硫。应用双阳离子交换膜电解技术可使该吸收液再生,同时得到高浓度SO2 , 其工作原理如图3所示。① SO2气体在(填“Ⅰ”“Ⅱ”或“Ⅲ”)室生成。
②用离子方程式表示吸收液再生的原理:。
(4)、新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能将烟气中SO2分解除去,若1 mol ZnFe2Ox与足量SO2生成1 mol ZnFe2O4和0.5 mol S,则x=。35. 钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。(1)、CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。①该催化剂中铁元素的化合价为。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是。
(2)、草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定A点剩余固体的化学成分为(填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为。
-