2023-2024 学年 浙教版科学九年级上册 1.2 物质的酸碱性 同步练习
试卷更新日期:2023-08-01 类型:同步测试
一、单选题
-
1. 在以下探究氢氧化钙溶液性质的实验中,还需借助酸碱指示剂证明化学反应发生的是( )A、
 B、
B、 C、
C、 D、
D、 2. 生活中一些常见食物的pH如图所示。下列说法正确的是
2. 生活中一些常见食物的pH如图所示。下列说法正确的是 A、玉米汁显中性 B、上述食物中红豆汁的的酸性最强 C、胃酸过多的人不宜过量饮用苹果汁 D、苹果汁和西瓜汁混合液可能显中性3. 下表是常山地区种植的各种酸甜爽口的水果,其中酸性最强的水果是( )
A、玉米汁显中性 B、上述食物中红豆汁的的酸性最强 C、胃酸过多的人不宜过量饮用苹果汁 D、苹果汁和西瓜汁混合液可能显中性3. 下表是常山地区种植的各种酸甜爽口的水果,其中酸性最强的水果是( )水果名称
蓝莓
杨梅
胡柚
称猴桃
pH
4
2.5
6
4.5
A、蓝莓 B、杨梅 C、胡柚 D、猕猴桃4. 台州湿润多雨,土壤多呈酸性,下列不适合 在台州大面积种植的植物是( )选项
A
B
C
D
植物
茶树
柑橘
水稻
冬枣
适宜生长的pH
5.0-5.5
6.0-6.5
6.0-7.0
8.0-8.5
A、A B、B C、C D、D5. 氢化钙常温下能与水反应生成 , 是野外工作人员便携燃料的来源。其反应化学方程式是 , 下列相关说法正确的是( )A、生成物都属于化合物 B、反应前后元素的化合价不变 C、具有可燃性 D、生成物是常见的盐6. 在探究水的组成实验时,在水电解器中加入少量的稀硫酸以增加水的导电性,下列关于电解水过程所作的图像,其中正确的是( )A、 B、
B、 C、
C、 D、
D、 7. 不同的水果有不同的酸碱性,下表是四种水果汁液的pH,其中酸性最强的是( )
7. 不同的水果有不同的酸碱性,下表是四种水果汁液的pH,其中酸性最强的是( )水果名称
杨梅
蜜桔
文旦
西瓜
汁液的pH
2.5~3.5
4.0~5.0
4.5~5.5
5.5~6.5
A、杨梅 B、蜜桔 C、文旦 D、西瓜8. 如图所示,将充满二氧化碳的试管倒扣在滴有紫色石蕊试液的蒸馏水中,一段时间后,下列实验现象描述正确的是 ( )
①试管内液面上升 ②溶液变红 ③试管内液面不上升 ④溶液变蓝 ⑤溶液不变色
A、①② B、①④ C、②③ D、③⑤9. 小科最近上腹部不适,经常反胃,经检查,原因是胃酸过多。下列数据为一些我市本地水果的近似pH,其中最适宜他吃的是( )A、 翠冠梨pH=6.5
B、
翠冠梨pH=6.5
B、 东魁杨梅pH=2.0
C、
东魁杨梅pH=2.0
C、 桃形李pH=2.5
D、
桃形李pH=2.5
D、 柿子pH=8.5
10. 人体内的一些液体近似的pH如下表,其中碱性最强的是( )
柿子pH=8.5
10. 人体内的一些液体近似的pH如下表,其中碱性最强的是( )液体
胃液
胰液
胆汁
血浆
pH
0.9-1.5
7.5-8.0
7.1-7.3
7.35-7.45
A、胃液 B、胰液 C、胆汁 D、血浆11. 合理的早餐搭配有利于身体健康,下列早餐饮品中对于胃酸过多的人,空腹时最宜食用的是( )种类
苹果汁
牛奶
白开水
豆浆
pH值
2.9-3.3
6.3-6.6
7.0
7.4-7.9
A、苹果汁 B、牛奶 C、白开水 D、豆浆12. 小高利用紫甘蓝制作酸碱指示剂。制取完成后,小高将紫甘蓝汁滴入4种物质中,现象如表所示,下列选项中能证明紫甘蓝汁可以作为酸碱指示剂的最佳组合是( )实验
①
②
③
④
物质
水
食盐水
石灰水
白醋
颜色
紫色
紫色
蓝色
红色
A、①② B、②③ C、①②③ D、①③④13. 小明想研究实验室用石灰石和稀盐酸制取二氧化碳后废液的成分。他取该废液的上层清液,往废液中逐滴加入碳酸钠溶液,实验中先后观察到两种不同的现象。下列图像表示滴加过程中某些量的变化,其中正确的是( )A、 B、
B、 C、
C、 D、
D、 14. 农作物对土壤的酸碱度有一定要求,如图所示是几种植物适宜生长的pH。下列植物中适合在碱性土壤中种植的是( )
14. 农作物对土壤的酸碱度有一定要求,如图所示是几种植物适宜生长的pH。下列植物中适合在碱性土壤中种植的是( ) A、马铃薯 B、菠菜 C、番茄 D、萝卜15. 实验室有一瓶标签破损的试剂,该试剂的溶质为碳酸钠、硫酸钠、氯化钠中的一种,如图所示。则该试剂( )
A、马铃薯 B、菠菜 C、番茄 D、萝卜15. 实验室有一瓶标签破损的试剂,该试剂的溶质为碳酸钠、硫酸钠、氯化钠中的一种,如图所示。则该试剂( ) A、pH一定等于7 B、一定能使紫色石蕊变蓝 C、可用稀盐酸鉴别 D、可用氯化钡溶液鉴别
A、pH一定等于7 B、一定能使紫色石蕊变蓝 C、可用稀盐酸鉴别 D、可用氯化钡溶液鉴别二、填空题
-
16. 氮气是空气中含量最多的气体,实验窒里常用饱和亚硝酸钠(NaNO2 , 水溶液呈碱性)与氯化铵(NH4Cl,水溶液呈酸性)溶液反应制取氮气.(1)、实验室制取氮气的化学方程式:NaNO2+NH4Cl=NaCl+2X+N2↑,则X为。(2)、该反应生成物都是呈中性,测得反应后溶液的pH=8,则反应物过量的是。17. 丽水纳爱斯集团是全球洗涤用品行业前五强企业。其产品之一雕牌超能皂(如图)的主要生产原料是油脂、氢氧化钠和水等。(1)、生产肥皂的主要反应原理: , 则X的化学式为。(2)、该皂液中所含的氢氧化钠常能与氯化铜溶液反应产生沉淀,请写出相关的一个化学方程式:。(3)、如果想要检测该皂液的酸碱性强弱,可以使用pH试纸,请你写出合理的操作过程:18. 《奔跑吧兄弟》是一档热播的娱乐节目,其中涉及到许多科学知识。(1)、其中一期节目,队员用水枪将某无色溶液喷射到对方的“名牌”上,“名牌”立即变红色,若无色溶液为酚酞溶液,则事先浸泡“名牌”的溶液可能是 。A、白酒 B、柠檬酸 C、食盐溶液 D、纯碱溶液(2)、另一期节目,蓝色的“污水”中注入“神秘水”后立即变的澄清透明。无色的“神秘水”的主要成分是草酸,化学式为H2C2O4 , 其中C的化合价为。19. 洗衣机槽清洁剂的主要成分是过碳酸钠(Na2CO4),过碳酸钠是一种白色晶体,溶于水时会与水反应生成碳酸钠和过氧化氢(化学方程式为:Na2CO4+H2O=Na2 CO3+H2O2)。现取少许过碳酸钠晶体,加入水形成溶液。(1)、取少量二氧化锰加入试管中,再加入适量该溶液,观察到有气泡产生,为了检验该气体,可用 。(2)、待不再产生气泡时,得到的溶液呈(选填“酸性”或“中性”或“碱性”)。20. 测得生活中一些液体的pH值如下表:
液体
雨水
糖水
厨房清洁剂
厕所清洁剂
pH
5.6
7
11.8
2
(1)、上述液体中,能使酚酞试液变成红色的是;(2)、用pH试纸测定厨房清洁剂的pH时,先将pH试纸用水润湿,结果会 (选填“偏大”、“偏小”或“无影响”);(3)、厕所清洁剂与厨房清洁剂(选填“能”或“不能”)混合使用。21.(1)、通过实验,我们测得了石灰水、碳酸饮料、食醋及食盐水的pH,图中箭头方向表示pH逐渐增大,表示石灰水的是点 (填字母)。 (2)、在测定碳酸饮料的pH时,若先将试纸用水湿润,则测出的pH值(“偏大"偏小”不变“)22. 洗衣机槽清洁剂的主要成分是过碳酸钠(Na2CO4),过碳酸钠是一种白色晶体,溶于水时会与水反应生成碳酸钠和过氧化氢(化学方程式为:Na2CO4+H2O=Na2CO3+H2O2)。现取少许过碳酸钠晶体,加入水形成溶液。(1)、取少量二氧化锰加入试管中,再加入适量该溶液,观察到有气泡产生,为了检验该气体,可用(2)、待不再产生气泡时,得到的溶液呈(选填“酸性”或“中性”或“碱性”)。(3)、生成的碳酸钠中碳元素的化合价为。23. “奥运五环”(如图)象征五大洲的团结。2022 年北京冬奥会开幕式上,有一个巨大奥运五环“破冰而出”的精彩表演。
(2)、在测定碳酸饮料的pH时,若先将试纸用水湿润,则测出的pH值(“偏大"偏小”不变“)22. 洗衣机槽清洁剂的主要成分是过碳酸钠(Na2CO4),过碳酸钠是一种白色晶体,溶于水时会与水反应生成碳酸钠和过氧化氢(化学方程式为:Na2CO4+H2O=Na2CO3+H2O2)。现取少许过碳酸钠晶体,加入水形成溶液。(1)、取少量二氧化锰加入试管中,再加入适量该溶液,观察到有气泡产生,为了检验该气体,可用(2)、待不再产生气泡时,得到的溶液呈(选填“酸性”或“中性”或“碱性”)。(3)、生成的碳酸钠中碳元素的化合价为。23. “奥运五环”(如图)象征五大洲的团结。2022 年北京冬奥会开幕式上,有一个巨大奥运五环“破冰而出”的精彩表演。 (1)、表演中,要使总重为3×104牛的奥运五环缓缓升起,需要对它施加向上的拉力至少为牛。(2)、奥运五环在40秒的时间内要匀速提升12米,其上升的速度应为米/秒。(3)、小明自制奥运五.环时用化学变化显示颜色,他将酚酞试液滴入装有氨水(pH=10) 的环中,呈现的颜色是。24. 构建知识网络是重要的学习方法。小明在学了物质转化的规律后,构建了如图知识网络。
(1)、表演中,要使总重为3×104牛的奥运五环缓缓升起,需要对它施加向上的拉力至少为牛。(2)、奥运五环在40秒的时间内要匀速提升12米,其上升的速度应为米/秒。(3)、小明自制奥运五.环时用化学变化显示颜色,他将酚酞试液滴入装有氨水(pH=10) 的环中,呈现的颜色是。24. 构建知识网络是重要的学习方法。小明在学了物质转化的规律后,构建了如图知识网络。 (1)、若图中金属是Ca,则图中相应的碱的化学式为。(2)、若图中金属氧化物是 CuO,可以利用 CO 具有性,使它反应发生②号转化。25. 将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入稀盐酸的质量变化曲线如图所示:
(1)、若图中金属是Ca,则图中相应的碱的化学式为。(2)、若图中金属氧化物是 CuO,可以利用 CO 具有性,使它反应发生②号转化。25. 将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入稀盐酸的质量变化曲线如图所示: (1)、在滴加的过程中,烧杯中溶液的 pH 逐渐(填“增大”、“减小”或“不变”)(2)、由图可知,稀盐酸与氢氧化钠溶液发生的反应是(填“放热”或“吸热”) 反应。
(1)、在滴加的过程中,烧杯中溶液的 pH 逐渐(填“增大”、“减小”或“不变”)(2)、由图可知,稀盐酸与氢氧化钠溶液发生的反应是(填“放热”或“吸热”) 反应。三、实验探究题
-
26. 化学兴趣小组将CO2通入NaOH溶液发现无明显现象,为了证明二者发生反应,验证反应
产物,进行了如下实验探究。
指示剂·
紫甘蓝汁
酚酞
酗
紫色
蓝色
深绿
黄绿
黄色
无色
浅红色
深红色·
pH
4-8
8-9
9-11
11-124
>12
<8
8-10
>10
【查阅资料】①已知两种指示剂的pH变色范围如上表:
②饱和碳酸钠溶液的pH=10.5,饱和碳酸氢钠溶液的pH-=8.3, ③碳酸氢钙Ca(HCO3)2易溶于水。
【进行实验】打开分液漏斗瓶塞,旋开活塞,慢慢滴下稀硫酸,向上述滴入紫甘蓝汁、pH=13的氢氧化钠稀溶液中持续通入二氧化碳气体,用pH传感器测得溶液pH随时间变化如下图:
【交流讨论】
 (1)、实验中,溶液颜色由黄色最终变为 , 从而证明二氧化碳与氢氧化钠发生了化学反应。(2)、实验中,选紫甘蓝汁指示反应的进行过程而不选酚酞的原因是。(3)、通过分析,CD段P点溶液中的溶质一定有Na2CO3和 NaHCO3 , 他们取适量P点溶液于试管中,加入足量的氯化钙溶液,发现有白色沉淀产生,(写出后续操作步骤及现象)从而肯定上述结论。27. 将NaOH溶液与稀H2SO4混合,观察不到明显现象,为确定其是否反应,小明设计了口,实验探究方案:(1)、方案一:在装有一定量NaOH溶液的烧杯中滴几滴酚酞试液,用滴管逐滴滴加稀H2SO4并不断振荡。判断两溶液发生了化学反应的现象是。(2)、方案二:向装有一定量稀H2SO4的试管中滴加NaOH溶液,振荡后再滴加Na2CO3溶液,发现有气泡产生,小明据此判定稀H2SO4与NaOH溶液没有发生化学片应。你认为小明的判断是否正确,并说明理由:。(3)、方案三:先用pH试纸测定NaOH溶液的pH,再滴加稀H2SO4 , 振荡后,再测定混合溶液的pH。若测得pH逐渐减小而且小于7,则能判断NaOH浴液与稀H2SO4发生了化学反应。方案中“测得pH小于7”是排除对实验的干扰。28. 项目式作业——论证分子运动实验活动中,小金采用了如图装置进行实验。
(1)、实验中,溶液颜色由黄色最终变为 , 从而证明二氧化碳与氢氧化钠发生了化学反应。(2)、实验中,选紫甘蓝汁指示反应的进行过程而不选酚酞的原因是。(3)、通过分析,CD段P点溶液中的溶质一定有Na2CO3和 NaHCO3 , 他们取适量P点溶液于试管中,加入足量的氯化钙溶液,发现有白色沉淀产生,(写出后续操作步骤及现象)从而肯定上述结论。27. 将NaOH溶液与稀H2SO4混合,观察不到明显现象,为确定其是否反应,小明设计了口,实验探究方案:(1)、方案一:在装有一定量NaOH溶液的烧杯中滴几滴酚酞试液,用滴管逐滴滴加稀H2SO4并不断振荡。判断两溶液发生了化学反应的现象是。(2)、方案二:向装有一定量稀H2SO4的试管中滴加NaOH溶液,振荡后再滴加Na2CO3溶液,发现有气泡产生,小明据此判定稀H2SO4与NaOH溶液没有发生化学片应。你认为小明的判断是否正确,并说明理由:。(3)、方案三:先用pH试纸测定NaOH溶液的pH,再滴加稀H2SO4 , 振荡后,再测定混合溶液的pH。若测得pH逐渐减小而且小于7,则能判断NaOH浴液与稀H2SO4发生了化学反应。方案中“测得pH小于7”是排除对实验的干扰。28. 项目式作业——论证分子运动实验活动中,小金采用了如图装置进行实验。

【查阅资料】浓氨水(氨气的水溶液)可以使无色酚酞试液变为红色
【现象分析】
(1)、氨气是由构成;(2)、将甲、乙两组装置分别放置一段时间,发现甲装置中的B杯液体变成红色,乙装置没有变化,由此可以得出的结论是 ;(3)、【反思交流】这个实验中采用了甲、乙两组装置,目的是;(4)、【改进创新】小金进一步改进实验,设计如图丙实验,往试管口的棉花滴10滴浓氨水,可观察到的现象是。四、解答题
-
29. 实验室有甲乙两瓶久置的氢氧化钠固体,某学习小组为了研究其变质情况,进行了如下实验:(电子秤示数单位为克)
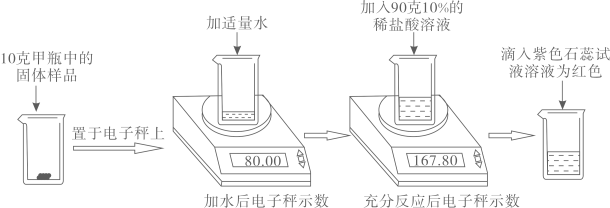 (1)、滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈性。(2)、上述实验中产生的二氧化碳气体质量为克.(3)、计算甲瓶固体样品中碳酸钠的质量分数。(4)、某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加人入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因.30. 某课外活动小组对失去标签的稀硫酸浓度进行测定:取稀硫酸50g于烧杯中,逐滴滴加3.42%的氢氧化钡溶液,烧杯内溶质质量与滴加氢氧化钡溶液质量关系如图1所示。(结果保留两位小数)
(1)、滴入紫色石蕊试液后溶液为红色,说明反应后溶液呈性。(2)、上述实验中产生的二氧化碳气体质量为克.(3)、计算甲瓶固体样品中碳酸钠的质量分数。(4)、某同学另取10克乙瓶中的固体样品,用100克15%的稀硫酸按同样方法进行实验,他认为不管固体样品变质程度如何,稀硫酸加人入后,都不需要使用石蕊试液,请计算说明他做出此判断的原因.30. 某课外活动小组对失去标签的稀硫酸浓度进行测定:取稀硫酸50g于烧杯中,逐滴滴加3.42%的氢氧化钡溶液,烧杯内溶质质量与滴加氢氧化钡溶液质量关系如图1所示。(结果保留两位小数) (1)、当滴加Ba(OH)2溶液50g时,烧杯内溶液的pH7(填“>”“<”或“=”)。(2)、在图2中画出产生沉淀质量与滴加Ba(OH)2溶液的质量关系。(3)、滴加Ba(OH)2溶液至150g时,所得溶液的溶质质量分数为多少?(计算结果保留0.01%)31. 目前不少自来水用液氯(Cl2)作为消毒剂,液氯注入水后发生反应的示意图:
(1)、当滴加Ba(OH)2溶液50g时,烧杯内溶液的pH7(填“>”“<”或“=”)。(2)、在图2中画出产生沉淀质量与滴加Ba(OH)2溶液的质量关系。(3)、滴加Ba(OH)2溶液至150g时,所得溶液的溶质质量分数为多少?(计算结果保留0.01%)31. 目前不少自来水用液氯(Cl2)作为消毒剂,液氯注入水后发生反应的示意图: (1)、次氯酸中氯元素的化合价为。(2)、C物质的水溶液能使紫色的石蕊溶液变成色。(3)、取C物质的水溶液少许,向其中加入稀硝酸和溶液,观察到有白色沉淀产生,利用此法可检验自来水中是否含有Cl-。32. 近两年北仑柴桥的果农兴起种植蓝莓的热潮,每年5、6月是蓝莓丰收的时节,蓝莓中含有丰富的花青素(化学式为C15H11O6)。花青素是一种水溶性色素,颜色与细胞液的酸碱性有关,细胞液酸性时呈红色,碱性时呈蓝色。(1)、在白醋中滴加花青素,溶液变色。(2)、花青素分子中碳、氢、氧原子个数比为。(3)、28.7克花青素中含有克碳元素。33. 向盛有Fe2O3粉末的烧杯中加入过量的稀H2SO4充分搅拌,粉末完全溶解;再向所得溶液中逐滴加入NaOH溶液,生成沉淀与加入NaOH溶液之间的质量关系如图所示。请回答下列问题:
(1)、次氯酸中氯元素的化合价为。(2)、C物质的水溶液能使紫色的石蕊溶液变成色。(3)、取C物质的水溶液少许,向其中加入稀硝酸和溶液,观察到有白色沉淀产生,利用此法可检验自来水中是否含有Cl-。32. 近两年北仑柴桥的果农兴起种植蓝莓的热潮,每年5、6月是蓝莓丰收的时节,蓝莓中含有丰富的花青素(化学式为C15H11O6)。花青素是一种水溶性色素,颜色与细胞液的酸碱性有关,细胞液酸性时呈红色,碱性时呈蓝色。(1)、在白醋中滴加花青素,溶液变色。(2)、花青素分子中碳、氢、氧原子个数比为。(3)、28.7克花青素中含有克碳元素。33. 向盛有Fe2O3粉末的烧杯中加入过量的稀H2SO4充分搅拌,粉末完全溶解;再向所得溶液中逐滴加入NaOH溶液,生成沉淀与加入NaOH溶液之间的质量关系如图所示。请回答下列问题: (1)、往A点所示的溶液中滴入石蕊试液,溶液 。(2)、加入NaOH溶液40g时溶液中存在的溶质是。(写化学式)(3)、计算氢氧化钠溶液中溶质的质量分数。(要求写出计算过程)
(1)、往A点所示的溶液中滴入石蕊试液,溶液 。(2)、加入NaOH溶液40g时溶液中存在的溶质是。(写化学式)(3)、计算氢氧化钠溶液中溶质的质量分数。(要求写出计算过程)五、综合说理题
-
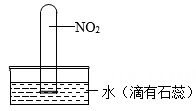
34. 如图所示,将装满NO2气体的试管倒插入滴有石蕊的蒸馏水中,请根据以下信息及所学知识判断实验出现的现象及每个现象产生的原因。
资料Ⅰ:NO2和水会发生反应, 化学方程式为:3NO2+H2O=NO+2HNO3
资料Ⅱ:NO2为有刺激性气味的红棕色气体,NO是一种无色无味难溶于水的气体
资料Ⅲ:同温同压下,两种气体的体积之比等于这两种气体分子个数之比
 35. 自然界的水都是含有多种物质的混合物.生产、生活中需要的纯净水可以通过蒸馏得到。
35. 自然界的水都是含有多种物质的混合物.生产、生活中需要的纯净水可以通过蒸馏得到。(1)将刚刚蒸馏出来的蒸馏水放在敞口的干净容器里,放置几天后,蒸馏水的pH将发生怎样的变化?请你分析引起蒸馏水pH改变的原因。
(2)在电解水的实验中,为了增加水的导电性,常在水中加入一定量的稀硫酸。某次实验时,在一定量的蒸馏水中加入50克16%的稀硫酸进行电解,结束后测得剩余溶液的质量为100克,则剩余溶液中溶质的质量分数为多少?