高考二轮复习知识点:不同晶体的结构微粒及微粒间作用力的区别
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列有关N、P及其化合物的说法错误的是( )A、N的电负性比P的大,可推断NCl3分子的极性比PCl3的大 B、N与N的π键比P与P的强,可推断N≡N的稳定性比P≡P的高 C、NH3的成键电子对间排斥力较大,可推断NH3的键角比PH3的大 D、HNO3的分子间作用力较小,可推断HNO3的熔点比H3PO4的低2. 下列各组物质的熔点均与所含化学键的键能有关的是( )A、CaO与CO2 B、NaCl与HCl C、SiC与SiO2 D、Cl2与I23. 照相底片的定影及银的回收过程如下:
步骤1:将曝光后的照相底片用定影液()浸泡,使未曝光的AgBr转化成配合物溶解,该反应AgBr和的物质的量比为1∶2。
步骤2:在步骤1的废定影液中加使配合物转化为黑色沉淀,并使定影液再生。
步骤3:过滤,将黑色沉淀在空气中灼烧回收银。
下列说法正确的是( )
 A、步骤1中配合物的内外界离子数比为3∶1 B、从步骤2可知和共存时,更易和结合,生成难溶电解质 C、步骤3中灼烧时反应的化学方程式为 D、如图所示为NaBr的晶胞,晶胞边长为a,则Br之间的最短距离为4. 下列“类比”结果正确的是( )A、乙炔的分子构型为直线形,则的分子构型也为直线形 B、单质的熔点 , 则单质的熔点 C、、是酸性氧化物,则也是酸性氧化物 D、通入溶液不产生沉淀,则通入溶液也不产生沉淀5. 两种物质所含化学键种类完全相同,晶体类型也相同的是( )A、NaCl和HCl B、NaOH和Na2O C、C3H8和H2O2 D、SO2和SiO26. 下列关于原子晶体的叙述不正确的是( )A、硬度一定很大 B、熔沸点一定很高 C、一定只含共价键 D、可能含有离子键7. 常温下非固态的物质是( )A、软脂酸(C15H31COOH) B、油酸(C17H33COOH) C、草酸(HOOC﹣COOH) D、氨基酸(H2N﹣CH2COOH)8. 水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( )
A、步骤1中配合物的内外界离子数比为3∶1 B、从步骤2可知和共存时,更易和结合,生成难溶电解质 C、步骤3中灼烧时反应的化学方程式为 D、如图所示为NaBr的晶胞,晶胞边长为a,则Br之间的最短距离为4. 下列“类比”结果正确的是( )A、乙炔的分子构型为直线形,则的分子构型也为直线形 B、单质的熔点 , 则单质的熔点 C、、是酸性氧化物,则也是酸性氧化物 D、通入溶液不产生沉淀,则通入溶液也不产生沉淀5. 两种物质所含化学键种类完全相同,晶体类型也相同的是( )A、NaCl和HCl B、NaOH和Na2O C、C3H8和H2O2 D、SO2和SiO26. 下列关于原子晶体的叙述不正确的是( )A、硬度一定很大 B、熔沸点一定很高 C、一定只含共价键 D、可能含有离子键7. 常温下非固态的物质是( )A、软脂酸(C15H31COOH) B、油酸(C17H33COOH) C、草酸(HOOC﹣COOH) D、氨基酸(H2N﹣CH2COOH)8. 水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图象,模型如图所示,下列关于水的说法正确的是( ) A、水是弱电解质 B、可燃冰是可以燃烧的水 C、氢氧两种元素只能组成水 D、0℃时冰的密度比液态水的密度大9. 氮氧化铝(AlON)是一种空间网状结构,硬度大熔点高的透明材料,描述正确的是( )A、含有离子键 B、属于原子晶体 C、既有离子键又有共价键 D、属于离子晶体10. 化学式为N2H6SO4的某晶体,其晶体类型与硫酸铵相同,则N2H6SO4晶体中不存在( )A、离子键 B、共价键 C、分子间作用力 D、阳离子11. 关于晶体的说法正确的是( )A、若晶体熔融状态下能导电,该晶体一定是离子晶体 B、若晶体熔化时化学键断裂,该晶体一定是原子晶体 C、若晶体中含有非极性分子,该晶体可能有较低的熔沸点 D、若晶体中含有极性共价键,该晶体不可能有很高的熔沸点12. 有关晶体的结构如图所示,下列说法中不正确的是( )A、
A、水是弱电解质 B、可燃冰是可以燃烧的水 C、氢氧两种元素只能组成水 D、0℃时冰的密度比液态水的密度大9. 氮氧化铝(AlON)是一种空间网状结构,硬度大熔点高的透明材料,描述正确的是( )A、含有离子键 B、属于原子晶体 C、既有离子键又有共价键 D、属于离子晶体10. 化学式为N2H6SO4的某晶体,其晶体类型与硫酸铵相同,则N2H6SO4晶体中不存在( )A、离子键 B、共价键 C、分子间作用力 D、阳离子11. 关于晶体的说法正确的是( )A、若晶体熔融状态下能导电,该晶体一定是离子晶体 B、若晶体熔化时化学键断裂,该晶体一定是原子晶体 C、若晶体中含有非极性分子,该晶体可能有较低的熔沸点 D、若晶体中含有极性共价键,该晶体不可能有很高的熔沸点12. 有关晶体的结构如图所示,下列说法中不正确的是( )A、 在NaCl晶体(图甲)中,距Na+最近的Cl-围成正八面体
B、
在NaCl晶体(图甲)中,距Na+最近的Cl-围成正八面体
B、 该气态团簇分子(图乙)的分子式为EF或FE
C、
该气态团簇分子(图乙)的分子式为EF或FE
C、 在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D、
在CO2晶体(图丙)中,一个CO2分子周围有12个CO2分子紧邻
D、 在碘晶体(图丁)中,存在的作用力有非极性键和范德华力
13. 表中数据是对应物质的熔点(℃):
在碘晶体(图丁)中,存在的作用力有非极性键和范德华力
13. 表中数据是对应物质的熔点(℃):干冰
-107
2073
920
801
1291
190
-57
1723
据此做出的下列判断中错误的是( )
A、铝的化合物的晶体中有的是离子晶体 B、表中只有干冰是分子晶体 C、同族元素的氧化物可形成不同类型的晶体 D、不同族元素的氧化物可形成相同类型的晶体14. 某晶体中含有非极性共价键,关于该晶体的判断正确的是( )①可能是共价晶体
②可能是分子晶体
③可能是离子晶体
④不能是金属晶体
⑤熔、沸点可能较低
⑥若熔点很高则硬度很大
⑦不可能具有导电性
⑧可能是化合物
A、全部 B、6项 C、4项 D、3项15. 如图所示晶体的硬度比金刚石大,且原子间以单键结合,则有关该晶体的判断正确的是( ) A、该晶体为片层结构 B、该晶体化学式可表示为Y3X4 C、X的配位数是4 D、X、Y元素分别位于周期表第ⅢA、ⅣA族16. 下列说法错误的是( )
A、该晶体为片层结构 B、该晶体化学式可表示为Y3X4 C、X的配位数是4 D、X、Y元素分别位于周期表第ⅢA、ⅣA族16. 下列说法错误的是( ) A、干冰晶体中,含有晶胞结构单元 B、硅晶体中,最小的环上有6个原子 C、氯化钠晶体中,距最近的有6个 D、石墨晶体中,每个六元环占有2个原子17. 下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )A、Na2O和SiO2熔化 B、碘和干冰升华 C、氯化钠和蔗糖熔化 D、Mg和S熔化18. 下列关于晶体的说法中,错误的是( )
A、干冰晶体中,含有晶胞结构单元 B、硅晶体中,最小的环上有6个原子 C、氯化钠晶体中,距最近的有6个 D、石墨晶体中,每个六元环占有2个原子17. 下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )A、Na2O和SiO2熔化 B、碘和干冰升华 C、氯化钠和蔗糖熔化 D、Mg和S熔化18. 下列关于晶体的说法中,错误的是( )①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性 ②离子晶体是一定含有金属阳离子的晶体 ③共价键可决定分子晶体的熔、沸点 ④干冰晶体中,每个CO2分子周围紧邻12个CO2分子 ⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列 ⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定 ⑦36 g金刚石晶体和36 g石墨晶体含有的C—C键数目相同
A、①②③ B、②③④ C、④⑤⑥ D、②③⑦19. 下列晶体中,①冰 ②石英 ③足球烯(C60) ④食盐 ⑤白磷 ⑥冰醋酸 ⑦晶体氩。晶体中除了存在原子与原子间的共价键外,同时也存在范德华力的有( )A、3种 B、4种 C、5种 D、6种二、多选题
-
20. 对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是( )A、SiX4难水解 B、SiX4是共价化合物 C、NaX易水解 D、NaX的熔点一般高于SiX421. 由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是( )A、NaN3与KN3结构类似,前者晶格能较小 B、第一电离能(I1):N>P>S C、钠晶胞结构属于体心结构,该晶胞分摊含2个钠原子 D、氮气常温下很稳定,是因为氮的电负性小
三、非选择题
-
22. [化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)、Zn原子核外电子排布式为。(2)、黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)Ⅰ1(Cu)(填“大于”或“小于”)。原因是。(3)、ZnF2具有较高的熔点(872 ℃),其化学键类型是;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是。(4)、《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为 , C原子的杂化形式为。(5)、金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA , Zn的密度为g·cm-3(列出计算式)。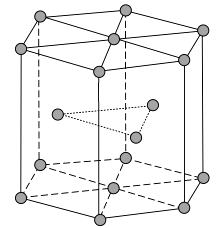 23.(1)、路易斯酸碱电子理论认为,凡是能给出电子对的物质叫做碱;凡是能接受电子对的物质叫做酸。BF3和NH3分别属于是、(酸或者碱)。(2)、金属铯(Cs)位于元素周期表中第6周期第IA族,氯化钠与氯化铯晶体中离子的排列方式如图所示:
23.(1)、路易斯酸碱电子理论认为,凡是能给出电子对的物质叫做碱;凡是能接受电子对的物质叫做酸。BF3和NH3分别属于是、(酸或者碱)。(2)、金属铯(Cs)位于元素周期表中第6周期第IA族,氯化钠与氯化铯晶体中离子的排列方式如图所示:
造成两种化合物晶体结构不同的原因是。
24. 人类对物质结构的探索永无止境。回答下列问题:(1)、碳硼烷酸[化学式为H(CHB11Cl11)是目前世界上已知的最强酸,但腐蚀性很小,可以作为无污染的酸催化剂。现代化学中常利用的特征谱线来鉴定元素。组成碳硼烷酸的4种元素中,基态原子中未成对电子数最多的是(填电子排布式)。(2)、石墨炔是我国科学家在2010年首次制得一种新的碳的同素异形体,其中一种结构如图所示,石墨炔中碳原子的杂化类型为。 (3)、硼元素具有缺电子性。自然界中含硼元素的钠盐是—种天然矿藏,其化学式写作Na2B4O7•10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]•8H2O。其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___(填字母)。
(3)、硼元素具有缺电子性。自然界中含硼元素的钠盐是—种天然矿藏,其化学式写作Na2B4O7•10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]•8H2O。其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___(填字母)。 A、离子键 B、共价键 C、金属键 D、范德华力 E、氢键(4)、镓与硼元素处于同一主族,GaN是制造5G芯片的材料,可发出紫外光。
A、离子键 B、共价键 C、金属键 D、范德华力 E、氢键(4)、镓与硼元素处于同一主族,GaN是制造5G芯片的材料,可发出紫外光。①科学家合成了一种阳离子为“N5n+”其结构是对称的,5个N排成“V”形,每个N原子的最外层都达到8电子稳定结构、且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,N8中阴离子的空间构型为 , 写出一种与其互为等电子体的分子(填化学式)。
②Ga和As两种元素电负性相差不大,能形成化合物GaAs。GaAs的熔点为1238℃,其晶胞结构如图所示。

已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为 , GaAs的熔点(填“高于”或“低于”)GaN,其理由是。若Ga和As的原子半径分别为rGa和rAs , 则GaAs晶胞中原子的体积占晶胞体积的百分率为(列出计算式即可)。
25.(1)、比较结合e-能力的相对强弱:Cl2S(填“>”或“<”);用一个离子方程式说明Cl2和S结合e-能力的相对强弱。(2)、KCN 是离子化合物,各原子均满足8 电子稳定结构。写出 KCN的电子式。(3)、在常压下,CBr4的沸点(190℃)比CCl4的沸点(76.8℃)高。主要原因是 。26.(1)、已知A和B均为第3周期元素,其原子的第一至第四电离能如下表所示:
A通常显价,A的电负性B的电负性(填“>”“<”或“=”)。
(2)、紫外光的光子所具有的能量约为399kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因。
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是。
(3)、实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:

则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有个。
(4)、金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是。(5)、某配合物的分子结构如图所示,其分子内不含有___(填序号)。 A、离子键 B、极性键 C、金属键 D、配位键 E、氢键 F、非极性键(6)、科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2。若有1molCH4生成,则有molσ键和molπ键断裂。27.(1)、I.下列对晶体结构和性质的认识错误的是______A、“雪花→水→水蒸气→氧气和氢气”变化中,被破坏的粒子间的作用力依次是:氢键、氢键、极性键 B、晶体CO2和H2O中,微利间相互作用完全相同,晶体类型也相同 C、SiO2晶体最小的环上,有6个Si原子和6个O原子 D、金刚石和石墨的熔点都较高,是因为二者都为原子晶体 2CuFeS2+O2=Cu2S+2FeS+SO2。(2)、II.黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时发生反应:Fe在周期表中的位置为;Fe、S、O原子的第一电离能由大到小的顺序是。(3)、CuFeS2中Cu元素有个未成对电子,Cu2S中Cu元素基态时电子排布式为。(4)、SO2分子的立体构型为 , SO2可氧化生成SO3 , SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是。
A、离子键 B、极性键 C、金属键 D、配位键 E、氢键 F、非极性键(6)、科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2。若有1molCH4生成,则有molσ键和molπ键断裂。27.(1)、I.下列对晶体结构和性质的认识错误的是______A、“雪花→水→水蒸气→氧气和氢气”变化中,被破坏的粒子间的作用力依次是:氢键、氢键、极性键 B、晶体CO2和H2O中,微利间相互作用完全相同,晶体类型也相同 C、SiO2晶体最小的环上,有6个Si原子和6个O原子 D、金刚石和石墨的熔点都较高,是因为二者都为原子晶体 2CuFeS2+O2=Cu2S+2FeS+SO2。(2)、II.黄铜矿(CuFeS2)是炼铜的最主要矿物,火法炼铜时发生反应:Fe在周期表中的位置为;Fe、S、O原子的第一电离能由大到小的顺序是。(3)、CuFeS2中Cu元素有个未成对电子,Cu2S中Cu元素基态时电子排布式为。(4)、SO2分子的立体构型为 , SO2可氧化生成SO3 , SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是。 (5)、已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS 的原因。
(5)、已知FeO、FeS熔点分别为1369℃、1193℃,解释熔点FeO高于FeS 的原因。 (6)、Cu的晶胞如图所示,晶体密度为ρ g·cm-3。晶胞中等距最近的Cu原子有个,晶胞的边长为(用含ρ和NA的式子表示)。28. 组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等.
(6)、Cu的晶胞如图所示,晶体密度为ρ g·cm-3。晶胞中等距最近的Cu原子有个,晶胞的边长为(用含ρ和NA的式子表示)。28. 组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu等. (1)、N、P、S的第一电离能由小到大的顺序为 .(2)、组成蛋白质的最简单的氨基酸(HOOCCH2NH2)介子中,π键数目为 .(3)、Zn2+、Cu2+能与NH3、H2O、Cl﹣等形成配位数为4的配合物.
(1)、N、P、S的第一电离能由小到大的顺序为 .(2)、组成蛋白质的最简单的氨基酸(HOOCCH2NH2)介子中,π键数目为 .(3)、Zn2+、Cu2+能与NH3、H2O、Cl﹣等形成配位数为4的配合物.①基态Zn2+的价电子(外围电子)排布式为 .
②[Zn(H2O)4]SO4中不存在的化学键类型有 . (填序号).
a.配位键 b.金属键 c.共价键 d.氢键 e.离子键
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl﹣取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 .
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(4)、由上述几种元素组成的6一氨基青霉烷酸的结构如图,其中采用sp3杂化的原子除了S外,还有 .(5)、紫外光的光子所具有的能量约为399kJ•mol﹣根据下表有关蛋白质分子中主要化学键的键能信息,说明人体长时间照射紫外光后皮肤易受伤害的原因是(填序号).共价键
C﹣C
C﹣N
C﹣S
键能/(kJ•mol﹣1)
347
305
259
29.氢能的存储是氢能应用的主要瓶颈,2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子.
 (1)、C60晶体易溶于苯、CS2 , 说明C60是 分子(选填:“极性”、“非极性”);
(1)、C60晶体易溶于苯、CS2 , 说明C60是 分子(选填:“极性”、“非极性”);
(2)、1mol C60分子中,含有σ键数目为 .
(3)、MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度ag•cm﹣3 , 则晶胞的体积为 cm3[用a、NA表示阿伏加德罗常数].
30. 回答下列问题:(1)、下列属于含有极性键的非极性分子的是____A、CS2 B、H2O C、P4 D、CH2Cl2(2)、下列化合物形成的晶体中,属于原子晶体的是____A、干冰 B、氯化钠 C、二氧化硅 D、四氯化硅(3)、某元素基态原子的价电子排布式为3d14s2 , 下列说法正确的是____A、该基态原子中共有3个未成对电子 B、该基态原子最外层有3个电子 C、该基态原子的M层共有8个电子 D、该元素原子核外共有4个电子层(4)、下列有关NH3的说法正确的是____A、比例模型为 (平面三角形)
B、NH3的中心原子上有一对孤对电子
C、NH3晶体属于分子密堆积
D、液氨气化破坏了N—H键
(5)、下列选项正确的是____A、沸点:HI>HBr>HCl>HF B、空间利用率:体心立方堆积>面心立方最密堆积>简单立方堆积 C、硬度:Na>Mg>Al D、熔点:NaCl>NaBr>KBr(6)、元素X、Y、Z在周期表中的相对位置如图所示,已知Y元素基态原子的价层电子排布式为 , 则下列说法错误的是____
(平面三角形)
B、NH3的中心原子上有一对孤对电子
C、NH3晶体属于分子密堆积
D、液氨气化破坏了N—H键
(5)、下列选项正确的是____A、沸点:HI>HBr>HCl>HF B、空间利用率:体心立方堆积>面心立方最密堆积>简单立方堆积 C、硬度:Na>Mg>Al D、熔点:NaCl>NaBr>KBr(6)、元素X、Y、Z在周期表中的相对位置如图所示,已知Y元素基态原子的价层电子排布式为 , 则下列说法错误的是____X
Y
Z
A、非金属性:X>Y>Z B、第一电离能:X>Y>Z C、Y元素位于周期表的第三周期VIIA族 D、Z元素原子的核外电子排布式为(7)、已知P4单质、次磷酸的结构如图,P4在KOH溶液中的变化是: , 下列说法正确的是____ A、PH3分子中所有的原子可能共平面 B、31gP4含有1.5NA个P-P C、元素的电负性大小顺序:P>O>H>K D、KH2PO2属于酸式盐31. 根据要求填空(选填序号):(1)、以下有机物,分子结构呈平面正六边形的是;一定条件下,均能与 、 、 反应的是;可用作果实催熟剂的是。
A、PH3分子中所有的原子可能共平面 B、31gP4含有1.5NA个P-P C、元素的电负性大小顺序:P>O>H>K D、KH2PO2属于酸式盐31. 根据要求填空(选填序号):(1)、以下有机物,分子结构呈平面正六边形的是;一定条件下,均能与 、 、 反应的是;可用作果实催熟剂的是。①甲烷 ②乙烯 ③苯 ④乙醇 ⑤乙酸
(2)、以下有机物,含ⅤA族元素的是;不属于有机高分子化合物的是。①蔗糖 ②纤维素 ③淀粉 ④油脂 ⑤蛋白质
(3)、以下晶体,存在分子间作用力的共价化合物是;存在共价键的离子晶体是。① 晶体 ② 晶体 ③ 晶体 ④干冰 ⑤水晶