广东省惠州市大亚湾区2023年中考一模化学试题
试卷更新日期:2023-07-31 类型:中考模拟
一、单选题
-
1. 下列古代生产工艺中主要体现的物理变化的是( )A、粮食酿酒 B、纺纱织布 C、烧制瓷器 D、冶炼生铁2. 下列标志中与燃烧和爆炸无关的图标是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列物质分类正确的是( )A、合成材料:塑料、合成橡胶、合金 B、盐:小苏打、氯酸钾、纯碱 C、氧化物:臭氧、高锰酸钾、干冰 D、微量元素:碳、硒、碘4. 下列物质中,未计入空气污染指数项目的是( )A、二氧化硫 B、二氧化碳 C、一氧化碳 D、可吸入颗粒物和细颗粒物5. 关于下列符号或图示的说法正确的是( )
3. 下列物质分类正确的是( )A、合成材料:塑料、合成橡胶、合金 B、盐:小苏打、氯酸钾、纯碱 C、氧化物:臭氧、高锰酸钾、干冰 D、微量元素:碳、硒、碘4. 下列物质中,未计入空气污染指数项目的是( )A、二氧化硫 B、二氧化碳 C、一氧化碳 D、可吸入颗粒物和细颗粒物5. 关于下列符号或图示的说法正确的是( )①2N②2Fe2+③
 ④
④ ⑤
⑤ A、①表示2个氮分子 B、②表示2个铁离子 C、③对应离子的符号为 D、由⑤可知铈的相对原子质量为6. 下列做法符合“低碳生活”理念的是( )A、节约使用纸张 B、大量焚烧秸秆 C、使用一次性餐具 D、禁止使用化石燃料7. 《本草纲目》记载:“三七近时始出,南人军中,用为金疮要药,云有奇功”。三七中止血的活性成分主要是田七氨酸(),下列关于田七氨酸的说法正确的是( )A、由四个元素组成 B、相对分子质量为 C、碳元素的质量分数最大 D、碳、氢、氮、氧元素的质量比为8. 如图是一瓶饮用天然水标签的部分内容。下列说法正确的是( )
A、①表示2个氮分子 B、②表示2个铁离子 C、③对应离子的符号为 D、由⑤可知铈的相对原子质量为6. 下列做法符合“低碳生活”理念的是( )A、节约使用纸张 B、大量焚烧秸秆 C、使用一次性餐具 D、禁止使用化石燃料7. 《本草纲目》记载:“三七近时始出,南人军中,用为金疮要药,云有奇功”。三七中止血的活性成分主要是田七氨酸(),下列关于田七氨酸的说法正确的是( )A、由四个元素组成 B、相对分子质量为 C、碳元素的质量分数最大 D、碳、氢、氮、氧元素的质量比为8. 如图是一瓶饮用天然水标签的部分内容。下列说法正确的是( )饮用天然水特征性指标
部分成分含量
钙 镁 钾 钠 偏硅酸
()
A、该饮用天然水属于纯净物 B、该饮用天然水可能呈碱性 C、该饮用天然水中含有钙、镁、钠、钾等单质 D、该饮用天然水中最多含偏硅酸9. 化学史上科学家对人类文明和社会可持续发展作出了重要贡献。下列选项正确的是( )A、门捷列夫创立了原子学说 B、拉瓦锡研究了空气的成分 C、侯德榜为我国相对原子质量的测定作出巨大贡献 D、屠呦呦发明了联合制碱法10. 将溶质质量分数为的浓硫酸稀释为的稀硫酸。下列说法正确的是( )A、实验步骤:计算、称量、溶解、装瓶存放 B、实验仪器:量筒、药匙、胶头滴管、烧杯、玻璃棒、蒸发皿 C、误差分析:若量取水时仰视刻度线,稀释后的溶质质量分数小于 D、溶液稀释:稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌11. 下列实验操作不能达到目的的是( )A、 验证质量守恒定律
B、
验证质量守恒定律
B、 探究铁生锈需要水
C、
探究铁生锈需要水
C、 探究铝、铁、铜的金属活动性顺序
D、
探究铝、铁、铜的金属活动性顺序
D、 证明酸碱发生了中和反应
12. 下列说法正确的是( )A、治疗贫血,可服用葡萄糖酸锌口服液 B、缺乏维生素A,会引起坏血病 C、治疗胃酸过多,可服用含的药物 D、预防佝偻病,可适当摄入氟元素13. 下图是和的溶解度曲线,下列说法正确的是( )
证明酸碱发生了中和反应
12. 下列说法正确的是( )A、治疗贫血,可服用葡萄糖酸锌口服液 B、缺乏维生素A,会引起坏血病 C、治疗胃酸过多,可服用含的药物 D、预防佝偻病,可适当摄入氟元素13. 下图是和的溶解度曲线,下列说法正确的是( ) A、两物质的溶解度只有在时相等 B、时,饱和溶液溶质质量分数约为 C、时,分别将等质量的和溶于水配成饱和溶液,所得溶液的质量前者大于后者 D、若溶液中含有少量 , 可采取蒸发浓缩、控制温度T2℃以上降温结晶、过滤等操作提纯14. 劳动成就梦想。下列劳动项目与所涉及化学知识不相符的是( )
A、两物质的溶解度只有在时相等 B、时,饱和溶液溶质质量分数约为 C、时,分别将等质量的和溶于水配成饱和溶液,所得溶液的质量前者大于后者 D、若溶液中含有少量 , 可采取蒸发浓缩、控制温度T2℃以上降温结晶、过滤等操作提纯14. 劳动成就梦想。下列劳动项目与所涉及化学知识不相符的是( )选项
项目
化学知识
A
将木柴架空燃烧
使木柴与空气充分接触
B
用一氧化碳冶炼金属
一氧化碳能够燃烧
C
用活性炭除去冰箱异味
活性炭具有吸附性
D
洗碗时加入洗洁精
洗洁精能乳化油污
A、A B、B C、C D、D15. 鉴别、除杂是重要的实验技能,下列实验设计不能达到实验目的的是( )选项
实验目的
实验设计
A
除去自来水中的色素和异味
向水中加入明矾
B
检验某化肥中是否含
取该化肥与熟石灰加入研钵中混合研磨,闻气味
C
区分热固性塑料和热塑性塑料
加热,观察外形变化
D
检验甲烷中是否含氢元素
点燃甲烷气体,在火焰上方罩一个干冷的烧杯,观察现象
A、A B、B C、C D、D二、填空题
-
16. 产于顺德的红荔牌红米酒清淡可口、醇厚甘润,是广东的名酒之一。(1)、红荔牌红米酒的原料主要是大米与赤米,这些原料中都富含的营养素是。(2)、红米酒主要成分酒精的学名为 , 从物质分类的角度看,酒精属于(填“无机物”或“有机物”)。(3)、火焰醉鹅,是顺德当地的一道名菜。烹饪时在锅盖加上红米酒,盖煮后点火,锅盖与锅之间的空隙会燎起火焰,写出相关的化学方程式。(4)、“闻酒知香”是因为(从微观解释)。普通红米酒不可以代替酒精消毒,但可以作应急使用。请结合生活常识谈谈使用时的注意事项。17. 化石燃料燃烧会造成环境污染,大力推广新能源刻不容缓。(1)、煤、天然气和合称地球三大化石燃料,它们均属于(填“可再生”或“不可再生”)能源。(2)、氢气作为能源,越来越受到人们的关注。我国科学家研制出一种新型高效催化剂,可使水和一氧化碳在该催化剂作用下转化为氢气,其微观过程如图1所示:

结合过程1、2,写出该反应的化学方程式:。
(3)、从镍氢电池到锂电池,再到钠电池、钾电池,科学家在不断提升电池的性能。如图2为锂、钠、钾三种离子的半径,图3为地壳中元素含量(质量分数)。
①金属失去电子后形成(填“阴”或“阳”)离子,所以常被用作电池材料。
②研究表明,半径越大的离子越容易在电池正、负极之间移动,充电速度越快。根据图2所示锂、钠、钾三种金属的离子半径大小,电池容量相同的这三种电池,充满电时间最短的是电池。
③目前,锂电池使用最广泛,但钠电池具有广阔的应用前景,尽管钠电池的能量密度不如锂电池,但钠电池的优势明显,除了充电时间较短外,结合图3分析其另一个优势是。
三、实验题
-
18. 根据“如图”中的实验装置回答:
 (1)、仪器①的名称是。(2)、实验室只用①、②、④组合制备氧气的化学方程式为 , 该装置在操作上的优点是。(3)、用装置⑦收集氧气,则气体应从(填“a”或“b”)导管口进入。(4)、某化学兴趣小组在实验室利用石灰石与一定浓度的盐酸制备。为了获得平稳的气流,发生装置应选用上图中仪器组合为(填序号),该反应的化学方程式为。(5)、小明将(4)中制取的通入澄清石灰水,观察不到变浑浊的现象,经与小组同学讨论可能是因为混有盐酸中挥发出的气体的缘故。若将该制取的气体通入装置⑧来检验 , 则试剂X可以为(填字母)。
(1)、仪器①的名称是。(2)、实验室只用①、②、④组合制备氧气的化学方程式为 , 该装置在操作上的优点是。(3)、用装置⑦收集氧气,则气体应从(填“a”或“b”)导管口进入。(4)、某化学兴趣小组在实验室利用石灰石与一定浓度的盐酸制备。为了获得平稳的气流,发生装置应选用上图中仪器组合为(填序号),该反应的化学方程式为。(5)、小明将(4)中制取的通入澄清石灰水,观察不到变浑浊的现象,经与小组同学讨论可能是因为混有盐酸中挥发出的气体的缘故。若将该制取的气体通入装置⑧来检验 , 则试剂X可以为(填字母)。a.紫色石蕊试液 b.无色酚酞试液 c.溶液
(6)、若气体的发生装置选择了⑥,对固体反应物的要求是。四、推断题
-
19. A~F为初中化学常见的物质,其中A的浓溶液有吸水性,B的溶液为蓝色,C是目前世界年产量最高的金属,D由两种元素组成,与A属于同类别物质,E的溶液俗称石灰水(图中“⌒”或“—”表示两种物质间能发生反应,“→”表示一种物质能转化为另一种物质,部分反应物、生成物以及反应条件省略)。
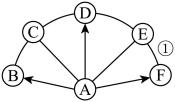
请回答下列问题:
(1)、分别写出B、E物质的化学式。B:E:
(2)、C与A的稀溶液反应时,溶液的颜色由无色变为。(3)、A转化为D的化学方程式为。(4)、C与B的反应属于反应(填基本反应类型)。(5)、若F是造成温室效应加剧的主要气体,反应①的化学方程式为。五、流程题
-
20. 钛()的性质稳定,有良好的耐高温、抗酸碱、高强度、低密度等特性,被称为“21世纪重要的金属”,广泛用于航空航天工业、化工、医疗等领域。工业上常用钛铁矿(主要成分为)制取钛并获得副产品A。工艺流程如下:
 (1)、为了提高“酸溶”的速率,可采取的措施有。操作I的名称是 , 实验室进行这类操作时所需的玻璃仪器有:烧杯、玻璃棒、 , 其中玻璃棒的作用是。(2)、构成金属钛的微粒是(填“分子”“原子”或“离子”):中钛元素的化合价为。(3)、反应②需持续通入氩气,氩气的作用是。(4)、反应③的产物中除红棕色固体A外,还有两种组成元素相同且相对分子质量相差16的气体,则该反应的化学方程式为。(5)、反应①②③中属于分解反应的是(填“①”“②”“③”)。
(1)、为了提高“酸溶”的速率,可采取的措施有。操作I的名称是 , 实验室进行这类操作时所需的玻璃仪器有:烧杯、玻璃棒、 , 其中玻璃棒的作用是。(2)、构成金属钛的微粒是(填“分子”“原子”或“离子”):中钛元素的化合价为。(3)、反应②需持续通入氩气,氩气的作用是。(4)、反应③的产物中除红棕色固体A外,还有两种组成元素相同且相对分子质量相差16的气体,则该反应的化学方程式为。(5)、反应①②③中属于分解反应的是(填“①”“②”“③”)。六、科学探究题
-
21. 同学们在学习“化学反应中的能量变化”时,进行了如“下图”探究实验。
 (1)、实验中,触摸试管外壁,都有发热现象,说明实验甲和实验乙的反应均为(填“吸热”或“放热”)反应。(2)、I.拓展探究
(1)、实验中,触摸试管外壁,都有发热现象,说明实验甲和实验乙的反应均为(填“吸热”或“放热”)反应。(2)、I.拓展探究
【提出问题】实验乙反应后的溶液中溶质成分是什么?
【进行猜想】猜想一:氯化镁猜想二:氯化镁和。
(3)、【实验探究】同学们为验证猜想,设计并进行了如下实验:
【讨论分析】分析反应后溶液中溶质成分时,除要考虑生成物外,还需考虑反应物是否过量。实验操作
实验现象
实验结论
取少量该溶液于试管中,逐滴加入氢氧化钠溶液
猜想二成立
(4)、Ⅱ.定量分析为进一步确定实验乙反应后溶液中各溶质成分含量,同学们又做了如“下图”实验。
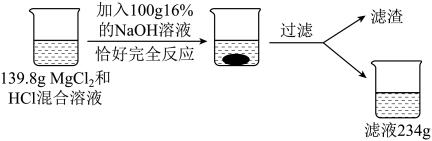
产生沉淀的质量为克。(5)、计算原混合溶液中氯化镁的质量(写出计算过程)。(6)、恰好完全反应时,所得滤液中,含溶质的质量为。
-
-
-