高考二轮复习知识点:氢键的存在对物质性质的影响2
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 短周期主族元素X、Y、Z、W的原子序数依次增大,A是Z的最高价氧化物对应的水化物,常温下0.1mol·L-1A溶液的pH=13,X、Y、W的单质e、f、g在通常状况下均为气态,并有如图所示的转化关系(反应条件略去),甲分子为四核10电子微粒,下列说法正确的是( )
 A、简单离子半径W>Z>Y B、甲易液化与分子内存在氢键有关 C、化合物丙能促进水的电离 D、f分子化学性质较稳定的原因是由于元素Y的非金属性弱2. 下列说法错误的是( )A、沸点: B、HCl的热稳定性比HI差 C、固态NaOH熔化时只破坏离子键,不破坏共价键 D、 中 和 的最-外电子层都形成了8电子稳定结构3. 下列说法错误的是( )A、丁达尔效应可鉴别胶体与溶液 B、红外光谱可区分乙醇与二甲醚 C、碘水可检验淀粉是否发生水解 D、乙醇易溶于水是因为其分子与水分子间形成氢键4. 下列说法正确的是( )A、Na+和Mg2+核外电子排布相同,核外电子能量也相同 B、已知钾在空气中燃烧的产物含有KO2 , KO2中各离子最外层均为8电子稳定结构 C、二甲醚易溶于水,氨基乙酸的熔点较高,主要原因都与氢键有关 D、C60Si60是一种新型的球形分子,经测定结构中包含C60也有Si60 , 则C60被包裹在Si60中5. 苯酚(结构简式如图所示),俗称石炭酸。是一种重要的化工原料,广泛用于制适酚醛树脂、染料、医药、农药等。下列说法错误的是( )
A、简单离子半径W>Z>Y B、甲易液化与分子内存在氢键有关 C、化合物丙能促进水的电离 D、f分子化学性质较稳定的原因是由于元素Y的非金属性弱2. 下列说法错误的是( )A、沸点: B、HCl的热稳定性比HI差 C、固态NaOH熔化时只破坏离子键,不破坏共价键 D、 中 和 的最-外电子层都形成了8电子稳定结构3. 下列说法错误的是( )A、丁达尔效应可鉴别胶体与溶液 B、红外光谱可区分乙醇与二甲醚 C、碘水可检验淀粉是否发生水解 D、乙醇易溶于水是因为其分子与水分子间形成氢键4. 下列说法正确的是( )A、Na+和Mg2+核外电子排布相同,核外电子能量也相同 B、已知钾在空气中燃烧的产物含有KO2 , KO2中各离子最外层均为8电子稳定结构 C、二甲醚易溶于水,氨基乙酸的熔点较高,主要原因都与氢键有关 D、C60Si60是一种新型的球形分子,经测定结构中包含C60也有Si60 , 则C60被包裹在Si60中5. 苯酚(结构简式如图所示),俗称石炭酸。是一种重要的化工原料,广泛用于制适酚醛树脂、染料、医药、农药等。下列说法错误的是( ) A、分子中所有原子可能共平面 B、固体苯酚分子间可能形成氢键 C、 该分子充分燃烧,会消耗 D、 该分子与足量的氢气加成后,环上的一氯取代物有3种6. 短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,A遇甲的浓溶液发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体,上述物质的转化关系如下图所示,下列说法正确的是( )
A、分子中所有原子可能共平面 B、固体苯酚分子间可能形成氢键 C、 该分子充分燃烧,会消耗 D、 该分子与足量的氢气加成后,环上的一氯取代物有3种6. 短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,A遇甲的浓溶液发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体,上述物质的转化关系如下图所示,下列说法正确的是( ) A、由于丁和戊化学键相同,所以它们都是平面结构 B、简单氢化物的沸点: X>Z C、简单离子半径大小: X<Y D、Y的简单离子与Z的简单离子在水溶液中可大量共存7. 下列对实验事实的理论解释正确的是( )
A、由于丁和戊化学键相同,所以它们都是平面结构 B、简单氢化物的沸点: X>Z C、简单离子半径大小: X<Y D、Y的简单离子与Z的简单离子在水溶液中可大量共存7. 下列对实验事实的理论解释正确的是( )选项
实验事实
理论解释
A
酸性:HClO<H2CO3
非金属:C>Cl
B
NH3溶于水形成的溶液能导电
NH3是电解质
C
氮原子的第一电离能大于氧原子
氮原子2p能级半充满
D
H2O的沸点高于H2S
H-O的键能大于H-S的键能
A、A B、B C、C D、D8. 氢键是强极性键上的氢原子与电负性很大且含孤电子对的原子之间的静电作用力。下列事实与氢键无关的是( )A、相同压强下H2O的沸点高于HF的沸点 B、一定条件下,NH3与BF3可以形成NH3·BF3 C、羊毛制品水洗再晒干后变形 D、H2O和CH3COCH3的结构和极性并不相似,但两者能完全互溶9. 结合下表数据分析,下列有关说法错误的是( )物质
分子式
沸点/℃
溶解性
乙醇
C2H6O
78.5
与水以任意比混溶
乙二醇
C2H6O2
197.3
与水和乙醇以任意比混溶
A、乙醇与乙二醇含有的官能团相同,都能与NaOH发生反应 B、采用蒸馏的方法可以分离乙醇与乙二醇的混合物 C、乙醇、乙二醇都能与羧酸在一定条件下发生取代反应 D、丙三醇的沸点应高于乙醇的沸点10. 铜是重要过渡元素,能形成多种配合物,如Cu+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。下列说法不正确的是( ) A、1mol 乙二胺分子中含有11NA个σ键 B、乙二胺分子中氮原子轨道的杂化类型为 sp3 C、Cu+与乙二胺形成的配离子内部含有极性键、非极性键、配位键和离子键 D、乙二胺和三甲胺[分子式为 N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键11. 下列说法正确的是A、除稀有气体外,第二周期元素随着核电荷数递增,元素的最高正价从+1递增到+7 B、H2O的热稳定性高于H2S是因为水分子间存在氢键 C、共价化合物只含共价键,离子化合物只含离子键 D、共价键的键长等于成键原子之间的核间距12. 下列对物质性质解释合理的是
A、1mol 乙二胺分子中含有11NA个σ键 B、乙二胺分子中氮原子轨道的杂化类型为 sp3 C、Cu+与乙二胺形成的配离子内部含有极性键、非极性键、配位键和离子键 D、乙二胺和三甲胺[分子式为 N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键11. 下列说法正确的是A、除稀有气体外,第二周期元素随着核电荷数递增,元素的最高正价从+1递增到+7 B、H2O的热稳定性高于H2S是因为水分子间存在氢键 C、共价化合物只含共价键,离子化合物只含离子键 D、共价键的键长等于成键原子之间的核间距12. 下列对物质性质解释合理的是选项
性质
解释
A
热稳定性:
中存在氢键
B
熔点:晶体硅<碳化硅
碳化硅中分子间作用力较大
C
酸性:
电负性:
D
熔点:
键较强
A、A B、B C、C D、D13. W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,Y的原子序数是X的2倍,下列说法正确的是 A、Z的氧化物对应水化物的酸性比Y的强 B、Y的单核阴离子还原性比X的弱 C、原子半径:Z>Y>X D、X的简单氢化物的沸点高于Y的简单氢化物的沸点,这与分子间氢键有关14. 化学与生活密切相关。下列叙述正确的是A、冰的密度比水小,是因为水分子内存在氢键 B、洁厕灵(主要成分为HCl)与84消毒液可以混用 C、镀锌铁制品的镀层破损后失去对铁制品的保护作用 D、利用紫外杀菌技术进行消毒,是为了使蛋白质变性15. 我国科学家成功利用和人工合成了淀粉,使淀粉的生产方式从农业种植转为工业制造成为可能,其原理如下图所示。下列说法错误的是
A、Z的氧化物对应水化物的酸性比Y的强 B、Y的单核阴离子还原性比X的弱 C、原子半径:Z>Y>X D、X的简单氢化物的沸点高于Y的简单氢化物的沸点,这与分子间氢键有关14. 化学与生活密切相关。下列叙述正确的是A、冰的密度比水小,是因为水分子内存在氢键 B、洁厕灵(主要成分为HCl)与84消毒液可以混用 C、镀锌铁制品的镀层破损后失去对铁制品的保护作用 D、利用紫外杀菌技术进行消毒,是为了使蛋白质变性15. 我国科学家成功利用和人工合成了淀粉,使淀粉的生产方式从农业种植转为工业制造成为可能,其原理如下图所示。下列说法错误的是 A、分子中键和键个数比为1∶1 B、甲醇沸点高于甲醛,是因为甲醇分子间能形成氢键 C、甲醇分子和二羟基丙酮分子中碳原子的杂化类型均为 D、二羟基丙酮与乳酸(
A、分子中键和键个数比为1∶1 B、甲醇沸点高于甲醛,是因为甲醇分子间能形成氢键 C、甲醇分子和二羟基丙酮分子中碳原子的杂化类型均为 D、二羟基丙酮与乳酸( )互为同分异构体
)互为同分异构体
二、多选题
-
16. 硼酸()是一种片层状结构的白色晶体,层内的分子通过氢键相连(如图所示)。下列有关说法正确的是( )
 A、在分子中各原子最外层均满足8电子稳定结构 B、分子的稳定性与氢键有关 C、1mol的晶体中有6mol极性共价键 D、1mol的晶体中有3mol氢键17. 下列有关物质(元素)的表述所得结论正确的是( )
A、在分子中各原子最外层均满足8电子稳定结构 B、分子的稳定性与氢键有关 C、1mol的晶体中有6mol极性共价键 D、1mol的晶体中有3mol氢键17. 下列有关物质(元素)的表述所得结论正确的是( )表述
结论
A
单质硫为非极性分子,难溶于水,微溶于酒精,易溶于
分子极性:
B
CCl2F2无同分异构体
碳原子采取杂化
C
熔点:
分子间形成的氢键强度:
D
电负性:
键角:
A、A B、B C、C D、D18. 图中每条折线表示周期表ⅣA~ⅦA中的某一族元素简单氢化物的沸点变化,每个小黑点代表一种氢化物。下列说法正确的是( ) A、d代表的是CH4 B、沸点的高低顺序是HF>H2O>NH3 C、NH3的沸点是第ⅤA元素形成的氢化物中沸点最高的 D、根据NH3·H2O NH +OH- , 氨分子和水分子之间最主要存在的氢键形式O—H…N19. 下列说法错误的是( )A、水稳定是因为水中含有大量的氢键 B、邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 C、可燃冰(CH4·8H2O)的形成是由于甲烷分子与水分子之间存在氢键 D、氨气极易溶于水,原因之一是氨分子与水分子之间形成了氢键20. 原子序数依次递增的4种短周期元素可形成简单离子W2-、X+、Y3+、Z- , 下列说法正确的是( )A、沸点:H2W>HZ B、工业上常采用电解YZ3冶炼Y单质 C、离子半径由大到小Z->X+>Y3+>W2- D、W、X形成的常见化合物中阴、阳离子个数比是1:2
A、d代表的是CH4 B、沸点的高低顺序是HF>H2O>NH3 C、NH3的沸点是第ⅤA元素形成的氢化物中沸点最高的 D、根据NH3·H2O NH +OH- , 氨分子和水分子之间最主要存在的氢键形式O—H…N19. 下列说法错误的是( )A、水稳定是因为水中含有大量的氢键 B、邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 C、可燃冰(CH4·8H2O)的形成是由于甲烷分子与水分子之间存在氢键 D、氨气极易溶于水,原因之一是氨分子与水分子之间形成了氢键20. 原子序数依次递增的4种短周期元素可形成简单离子W2-、X+、Y3+、Z- , 下列说法正确的是( )A、沸点:H2W>HZ B、工业上常采用电解YZ3冶炼Y单质 C、离子半径由大到小Z->X+>Y3+>W2- D、W、X形成的常见化合物中阴、阳离子个数比是1:2三、非选择题
-
21.(1)、乙醇的挥发性比水的强,原因是。(2)、金属氢化物是应用广泛的还原剂。的还原性比的强,原因是。22. 回答下列问题:(1)、两种有机物的相关数据如表:
物质
HCON(CH3)2
HCONH2
相对分子质量
73
45
沸点/℃
153
220
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是。
(2)、四种晶体的熔点数据如表:物质
CF4
SiF4
BF3
AlF3
熔点/℃
-183
-90
-127
>1000
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是。
23. [化学——选修3:物质结构与性质]过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用,回答下列问题:
(1)、对于基态Cr原子,下列叙述正确的是(填标号)。A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar] 3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)、三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 , 中心离子的配位数为。(3)、[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如下图所示。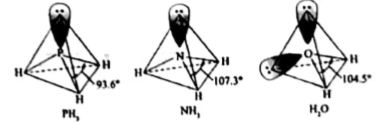
PH3中P的杂化类型是 , NH3的沸点比PH3的 , 原因是。H2O的键角小于NH3的,分析原因。
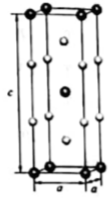
(4)、在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是原子。设Cr和Al原子半径分别为 和 ,则金属原子空间占有率为%(列出计算表达式)。24.(1)、气态氢化物热稳定性 大于 的主要原因是。(2)、 是离子化合物,各原子均满足8电子稳定结构, 的电子式是。(3)、常温下,在水中的溶解度乙醇大于氯乙烷,原因是。25. 氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:(1)、H、B、N中,原子半径最大的是。根据对角线规则,B的一些化学性质与元素的相似。(2)、NH3BH3分子中,N—B化学键称为键,其电子对由提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH3+ +9H2 , 的结构如图所示:
在该反应中,B原子的杂化轨道类型由变为。
(3)、NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是。与NH3BH3原子总数相等的等电子体是(写分子式),其熔点比NH3BH3(填“高”或“低”),原因是在NH3BH3分子之间,存在 , 也称“双氢键”。(4)、研究发现,氦硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
氨硼烷晶体的密度ρ=g·cm−3(列出计算式,设NA为阿伏加德罗常数的值)。
26. 我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:(1)、氮原子价层电子对的轨道表达式(电子排布图)为。(2)、元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈现异常的原因是。(3)、经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。①从结构角度分析,R中两种阳离子的相同之处为 , 不同之处为。(填标号)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
②R中阴离子N5-中的σ键总数为个。分子中的大π键可用符号 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为 ),则N5-中的大π键应表示为。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、、。
 (4)、R的晶体密度为d g·cm-3 , 其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M , 则y的计算表达式为。27. C、N、O、Si、P、Ge、As及其化合物在科研和生产中有许多重要用途。请回答下列问题:
(4)、R的晶体密度为d g·cm-3 , 其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M , 则y的计算表达式为。27. C、N、O、Si、P、Ge、As及其化合物在科研和生产中有许多重要用途。请回答下列问题: (1)、基态氮原子核外电子占据的原子轨道数目为。(2)、图1表示碳、硅和磷三种元素的四级电离能变化趋势,其中表示磷的曲线是(填标号)。(3)、NH3的沸点比PH3高,原因是。(4)、根据等电子原理,NO+电子式为。(5)、Na3AsO4 中AsO43-的空间构型为 , As4O6的分子结构如图2所示,则在该化合物中As的杂化方式是。(6)、锗的某种氧化物晶胞结构如图3所示,该物质的化学式为。已知该晶体密度为7.4g/cm3 , 晶胞边长为4.31×10-10m。则锗的相对原子质量为(保留小数点后一位)。(已知:O的相对原子质量为16,4.313=80,NA=6.02×1023mol-1)28. 氨、磷属于同一主族元素,是组成生命体的重要元素,其单质及化合物用途广泛。回答下列问题:(1)、基态P原子的核外电子排布式为 , 磷及其同周期相邻元素第一电离能由大到小的顺序是。(2)、NH3比PH3易液化的原因是。(3)、自然固氨现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3- 解释了民谚“雷雨发庄稼”的原理。
(1)、基态氮原子核外电子占据的原子轨道数目为。(2)、图1表示碳、硅和磷三种元素的四级电离能变化趋势,其中表示磷的曲线是(填标号)。(3)、NH3的沸点比PH3高,原因是。(4)、根据等电子原理,NO+电子式为。(5)、Na3AsO4 中AsO43-的空间构型为 , As4O6的分子结构如图2所示,则在该化合物中As的杂化方式是。(6)、锗的某种氧化物晶胞结构如图3所示,该物质的化学式为。已知该晶体密度为7.4g/cm3 , 晶胞边长为4.31×10-10m。则锗的相对原子质量为(保留小数点后一位)。(已知:O的相对原子质量为16,4.313=80,NA=6.02×1023mol-1)28. 氨、磷属于同一主族元素,是组成生命体的重要元素,其单质及化合物用途广泛。回答下列问题:(1)、基态P原子的核外电子排布式为 , 磷及其同周期相邻元素第一电离能由大到小的顺序是。(2)、NH3比PH3易液化的原因是。(3)、自然固氨现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3- 解释了民谚“雷雨发庄稼”的原理。①N2分子结构中。σ键和π键之比为 , 已知N N的键能为946kJ·mol-1 , 远大于N—N的键能(193 kJ·mol-1) 的三倍,原因是。
②NO3-中N原子采取杂化方式,其空间构型为 , 写出它的一种等电子体的化学式。
③已知酸性: HNO3>HNO2 , 下列相关见解合理的是。
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+ , 酸性强于HNO2
(4)、磷化硬(BP) 是一种超硬耐磨涂层材料,其晶胞结构如图所示,图中a点和b点的原子坐标参数依次为(0,0,0)、( , , ),则c 点的原子坐标参数为。已知该晶体密度为ρg·cm-3 , 则B-P键的键长为pm (阿伏加德罗常数用NA表示,列出计算式即可)。 29. 科学家在研究金属矿物质组分的过程中,发现了Cu﹣Ni﹣Fe等多种金属互化物.(1)、鉴别某种金属互化物是晶体还是非晶体的方法是 .(2)、已知高温下Cu2O比CuO更稳定,试从铜原子核外电子变化角度解释其原因 .(3)、镍能与类卤素(SCN)2反应生成Ni(SCN)2 . (SCN)2分子中硫原子的杂化方式是 , σ键和π键数目之比为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N═C═S)的沸点,其原因是 .(4)、立方FeO晶体的结构如图1所示,设晶胞边长为a cm,密度为b g•cm﹣3 , 则阿伏加德罗常数可表示为(用含a、b的式子表示).人工制备的FeO晶体常存在缺陷(如图2),已知某氧化物样品组成为Fe0.96O,该晶体中Fe3+与Fe2+的离子个数之比为 .
29. 科学家在研究金属矿物质组分的过程中,发现了Cu﹣Ni﹣Fe等多种金属互化物.(1)、鉴别某种金属互化物是晶体还是非晶体的方法是 .(2)、已知高温下Cu2O比CuO更稳定,试从铜原子核外电子变化角度解释其原因 .(3)、镍能与类卤素(SCN)2反应生成Ni(SCN)2 . (SCN)2分子中硫原子的杂化方式是 , σ键和π键数目之比为;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N)的沸点低于异硫氰酸(H﹣N═C═S)的沸点,其原因是 .(4)、立方FeO晶体的结构如图1所示,设晶胞边长为a cm,密度为b g•cm﹣3 , 则阿伏加德罗常数可表示为(用含a、b的式子表示).人工制备的FeO晶体常存在缺陷(如图2),已知某氧化物样品组成为Fe0.96O,该晶体中Fe3+与Fe2+的离子个数之比为 . 30. H、C、N、O、都属于自然界中常见非金属元素.(1)、O、C、N三种元素的第一电离能由小到大顺序是;NH4+中氮原子轨道的杂化类型为 .(2)、CO、N2的结构可表示为:C≡O、N≡N两者的键能数据:(单位kJ/mol)
30. H、C、N、O、都属于自然界中常见非金属元素.(1)、O、C、N三种元素的第一电离能由小到大顺序是;NH4+中氮原子轨道的杂化类型为 .(2)、CO、N2的结构可表示为:C≡O、N≡N两者的键能数据:(单位kJ/mol)A﹣B
A=B
A≡B
CO
357.7
798.9
1071.9
N2
154.8
418.4
941.7
结合数据说明CO比N2活泼的原因 .
(3)、乙二胺(H2N﹣CH2﹣CH2﹣NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 .(4)、C、N元素形成的新材料具有如右图所示结构,该晶体硬度将超过目前世界上最硬的金刚石,成为首屈一指的超硬新材料.该物质的化学式为: . 31. A、B、C、D、E、F是元素周期表前四周期的六种常见元素,原子序数依次增大,它们有如下性质:
31. A、B、C、D、E、F是元素周期表前四周期的六种常见元素,原子序数依次增大,它们有如下性质:元素
性质
A
自然界中有多种同素异形体,其中一种是自然界中最硬的单质
C
地壳中含量最多的元素
D
基态原子核外9个原子轨道上填充了电子且有1个未成对电子
E
常见的金属元素,可形成多种氧化物,其中一种氧化物常用作红色颜料
F
基态原子的M层全充满,N层没有成对电子,只有一个未成对电子
请完成以下问题:
(1)、基态B原子的价层电子排布图为。(2)、A和B的简单氢化物中沸点更高的是(填化学式),理由是。(3)、比较酸性强弱:(填“”或“”),依据是。(4)、B的一种氢化物常用作火箭推进剂的燃料,液态与气体反应生成对环境友好的气态产物,放出热量,写出该反应的热化学方程式。(5)、D元素的一种氧化物常可作杀菌消毒剂和漂白剂,的分子构型为;工业上制取的方法之一是:用D的单质与潮湿的碳酸钠反应,只生成和另外两种含钠的化合物,反应中无其他气体生成,写出该反应的化学方程式。(6)、用一个离子反应证明氧化性。32. 某柔性电极材料由聚吡咯( )、二维层状材料Ti3C2和聚乙烯醇复合而成,其转化过程示意如图。
)、二维层状材料Ti3C2和聚乙烯醇复合而成,其转化过程示意如图。 (1)、二维层状材料Ti3C2中存在金属键、离子键和共价键。Ti3C2能导电的原因是在电场作用下定向移动。(2)、Ti3C2的结构单元如下图,其中
(1)、二维层状材料Ti3C2中存在金属键、离子键和共价键。Ti3C2能导电的原因是在电场作用下定向移动。(2)、Ti3C2的结构单元如下图,其中 代表原子,在顶点处被个结构单元所共用,在棱心处被个结构单元所共用。 (3)、聚乙烯醇的结构简式为 , 其不能由单体通过聚合反应得到的原因是。(4)、吡咯(
代表原子,在顶点处被个结构单元所共用,在棱心处被个结构单元所共用。 (3)、聚乙烯醇的结构简式为 , 其不能由单体通过聚合反应得到的原因是。(4)、吡咯( )呈平面结构。聚吡咯能够增强材料导电性的原因是。 (5)、通过控制HF溶液浓度和反应时间,在Ti3C2表面引入-F和-OH,形成改性Ti3C2。
)呈平面结构。聚吡咯能够增强材料导电性的原因是。 (5)、通过控制HF溶液浓度和反应时间,在Ti3C2表面引入-F和-OH,形成改性Ti3C2。①聚吡咯和改性Ti3C2通过作用分散在聚乙烯醇中。
②制备柔性电极材料过程中,下列能够替代聚乙烯醇的是(填标号)。
 33. 乙酸()是一种有机一元酸,为食醋的酸味及刺激性气味的来源。它与甲酸甲酯()互为同分异构体。(1)、组成乙酸的元素的电负性由大到小的顺序是(用元素符号表示)。(2)、乙酸与甲酸甲酯的熔、沸点如下表:
33. 乙酸()是一种有机一元酸,为食醋的酸味及刺激性气味的来源。它与甲酸甲酯()互为同分异构体。(1)、组成乙酸的元素的电负性由大到小的顺序是(用元素符号表示)。(2)、乙酸与甲酸甲酯的熔、沸点如下表:物质
熔点/℃
沸点/℃
乙酸
16.6
117.9
甲酸甲酯
-99.8
31.5
造成二者相差较大的原因是。
(3)、甲酸甲酯经碱性水解可得到 , 该微粒的空间构型是。(4)、纯的乙酸在低于熔点时会冻结成冰状晶体,所以无水乙酸又称为冰醋酸。①确定固态乙酸是晶体的最可靠的科学方法是。
②已知乙酸的晶胞结构如图所示,其密度是。该晶胞中乙酸的分子数是;若用表示阿伏加德罗常数的值,则该晶胞的体积为(列出计算式)。
