高考二轮复习知识点:氢键的存在对物质性质的影响1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列有关物质结构和性质的说法错误的是A、含有手性碳原子的分子叫做手性分子 B、邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点 C、酰胺在酸或碱存在并加热的条件下可发生水解反应 D、冠醚(18-冠-6)的空穴与K+尺寸适配,两者能通过弱相互作用形成超分子2. 中科院院士研究发现,纤维素可在低温下溶于NaOH溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,为纤维素绿色再生利用提供了新的解决方案。下列说法错误的是
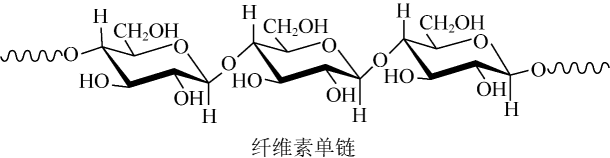 A、纤维素是自然界分布广泛的一种多糖 B、纤维素难溶于水的主要原因是其链间有多个氢键 C、NaOH提供破坏纤维素链之间的氢键 D、低温降低了纤维素在NaOH溶液中的溶解性3. X、Y、Z、W是处于不同周期的前四周期常见元素,原子序数依次递增。Y原子最外层电子数是周期序数的3倍,基态z原子核外s能级与p能级电子数之比为。由上述元素组成的物质转化关系如图所示,其中m、n、q为单质,其它为化合物,甲具有磁性,丙为二元强酸。下列说法错误的是( )
A、纤维素是自然界分布广泛的一种多糖 B、纤维素难溶于水的主要原因是其链间有多个氢键 C、NaOH提供破坏纤维素链之间的氢键 D、低温降低了纤维素在NaOH溶液中的溶解性3. X、Y、Z、W是处于不同周期的前四周期常见元素,原子序数依次递增。Y原子最外层电子数是周期序数的3倍,基态z原子核外s能级与p能级电子数之比为。由上述元素组成的物质转化关系如图所示,其中m、n、q为单质,其它为化合物,甲具有磁性,丙为二元强酸。下列说法错误的是( )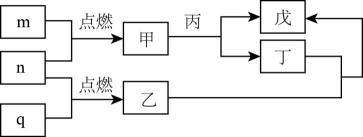 A、乙与丁反应物质的量之比为 B、乙分子构型为Ⅴ型 C、丙分子间可形成氢键 D、向戊中通入n可生成丁4. 2022年2月,第24届冬奥会在北京成功举办。下列有关说法正确的是( )A、为保证食物的口感和安全性,不能在食品中添加任何食品添加剂 B、北京冬奥会上,礼仪服饰采用高科技石墨烯发热材料,石墨烯属于有机高分子材料 C、冰的密度比水小,是因为水分子内存在氢键 D、“绿色奥运”是本届奥运会的理念之一,采用风能和太阳能为奥运服务体现了这一理念5. 下列说法正确的是( )A、次氯酸的结构式为:H-Cl-O B、虚线表示邻烃基苯甲醛的分子间氢键:
A、乙与丁反应物质的量之比为 B、乙分子构型为Ⅴ型 C、丙分子间可形成氢键 D、向戊中通入n可生成丁4. 2022年2月,第24届冬奥会在北京成功举办。下列有关说法正确的是( )A、为保证食物的口感和安全性,不能在食品中添加任何食品添加剂 B、北京冬奥会上,礼仪服饰采用高科技石墨烯发热材料,石墨烯属于有机高分子材料 C、冰的密度比水小,是因为水分子内存在氢键 D、“绿色奥运”是本届奥运会的理念之一,采用风能和太阳能为奥运服务体现了这一理念5. 下列说法正确的是( )A、次氯酸的结构式为:H-Cl-O B、虚线表示邻烃基苯甲醛的分子间氢键: C、醛基的碳氧双键有极性:
C、醛基的碳氧双键有极性: D、组成天然蛋白质的氨基酸可以表示为
D、组成天然蛋白质的氨基酸可以表示为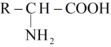 6. 下列说法中正确的是( )A、氢键仅存在于分子间 B、和晶体类型相同 C、的沸点比CO低主要是由于范德华力不同 D、溶于水和干冰升华都只有范德华力改变7. 已知A、B、C、D、E是五种短周期主族元素,其原子半径与原子序数的关系如图1,且A、B、C、D可形成化合物X如图2,C与E同主族。下列说法错误的是( )
6. 下列说法中正确的是( )A、氢键仅存在于分子间 B、和晶体类型相同 C、的沸点比CO低主要是由于范德华力不同 D、溶于水和干冰升华都只有范德华力改变7. 已知A、B、C、D、E是五种短周期主族元素,其原子半径与原子序数的关系如图1,且A、B、C、D可形成化合物X如图2,C与E同主族。下列说法错误的是( ) A、化合物X高温下有较强稳定性 B、A,B,E均可与C形成常见的两种二元化合物 C、简单离子的半径:E>C>D>A D、简单氢化物的沸点:C>E8. 下图是锂离子电池的一种电解质电离出来的阴离子,该阴离子是由同周期元素X、Y、Z、R构成(如图所示),Y是构成物质种类最多的元素,Z的最外层电子数等于Y的核外电子数,四种元素的最外层电子数之和为20。下列说法正确的是( )
A、化合物X高温下有较强稳定性 B、A,B,E均可与C形成常见的两种二元化合物 C、简单离子的半径:E>C>D>A D、简单氢化物的沸点:C>E8. 下图是锂离子电池的一种电解质电离出来的阴离子,该阴离子是由同周期元素X、Y、Z、R构成(如图所示),Y是构成物质种类最多的元素,Z的最外层电子数等于Y的核外电子数,四种元素的最外层电子数之和为20。下列说法正确的是( ) A、Y、Z、R三种元素形成的简单氢化物中,R的氢化物沸点最高 B、Y与Z形成的化合物均有毒 C、原子半径X>Y>Z>R D、R分别与另外三种元素形成的二元化合物,各原子最外层均满足8电子稳定结构9. W、X、Y、Z为原子序数依次增大,且分属于三个不同周期的短周期元素,X、Y同周期。X、Y、Z可形成一种无色剧毒气体(结构如图所示),下列说法错误的是( )
A、Y、Z、R三种元素形成的简单氢化物中,R的氢化物沸点最高 B、Y与Z形成的化合物均有毒 C、原子半径X>Y>Z>R D、R分别与另外三种元素形成的二元化合物,各原子最外层均满足8电子稳定结构9. W、X、Y、Z为原子序数依次增大,且分属于三个不同周期的短周期元素,X、Y同周期。X、Y、Z可形成一种无色剧毒气体(结构如图所示),下列说法错误的是( ) A、X、Y、Z形成的简单氢化物中Y的氢化物熔沸点最高 B、Z元素形成的含氧酸均为强酸 C、W与X、Y均能形成至少2种二元化合物 D、原子半径X大于Y10. X、Y、Z、W四种短周期元素位于三个不同的周期,且原子序数依次增大。它们能形成结构如图所示的分子,下列推断错误的是( )
A、X、Y、Z形成的简单氢化物中Y的氢化物熔沸点最高 B、Z元素形成的含氧酸均为强酸 C、W与X、Y均能形成至少2种二元化合物 D、原子半径X大于Y10. X、Y、Z、W四种短周期元素位于三个不同的周期,且原子序数依次增大。它们能形成结构如图所示的分子,下列推断错误的是( ) A、X、Z原子之间形成的是极性共价键 B、气态氢化物的沸点:W>Z C、右图分子中Y满足最外层8电子稳定结构 D、最高价含氧酸的酸性:W>Y11. 下列有机物相关说法正确的是( )A、氨基酸和蛋白质分子中均含有酰胺键 B、
A、X、Z原子之间形成的是极性共价键 B、气态氢化物的沸点:W>Z C、右图分子中Y满足最外层8电子稳定结构 D、最高价含氧酸的酸性:W>Y11. 下列有机物相关说法正确的是( )A、氨基酸和蛋白质分子中均含有酰胺键 B、 与
与  互为同系物
C、按系统命名法,化合物
互为同系物
C、按系统命名法,化合物  的名称是2,3,3,5,5-五甲基-4-乙基己烷
D、
的名称是2,3,3,5,5-五甲基-4-乙基己烷
D、 比
比  熔沸点低,是因为前者形成分子内氢键
12. 下列关于物质结构与性质的论述错误的是( )A、I 离子的空间构型为V形 B、斜方硫和单斜硫都易溶于CS2 , 是因为这两种物质的分子都属于非极性分子 C、PH3和H2O分子中均含有孤电子对,且PH3提供孤电子对的能力强于H2O D、键能O—H>S—H>Se—H>Te—H,因此水的沸点在同族氢化物中最高13. 某DNA分子的片段如图所示。下列关于该片段的说法错误的是( )
熔沸点低,是因为前者形成分子内氢键
12. 下列关于物质结构与性质的论述错误的是( )A、I 离子的空间构型为V形 B、斜方硫和单斜硫都易溶于CS2 , 是因为这两种物质的分子都属于非极性分子 C、PH3和H2O分子中均含有孤电子对,且PH3提供孤电子对的能力强于H2O D、键能O—H>S—H>Se—H>Te—H,因此水的沸点在同族氢化物中最高13. 某DNA分子的片段如图所示。下列关于该片段的说法错误的是( ) A、氢键的强度:①>② B、该片段中所有参与形成氢键的原子都共平面 C、该片段在一定条件下可发生水解反应 D、胞嘧啶与鸟嘌呤分子中酰胺基的化学活性并不完全相同14. 在电池工业上,碳酸乙烯酯(EC)可作为锂电池电解液的优良溶剂,其结构为
A、氢键的强度:①>② B、该片段中所有参与形成氢键的原子都共平面 C、该片段在一定条件下可发生水解反应 D、胞嘧啶与鸟嘌呤分子中酰胺基的化学活性并不完全相同14. 在电池工业上,碳酸乙烯酯(EC)可作为锂电池电解液的优良溶剂,其结构为 ,熔点为35℃。下列有关说法错误的是( ) A、一个分子中有10个σ键 B、EC分子间能形成氢键 C、分子中至少有4个原子共平面 D、EC由固态变成液态破坏了分子间的作用力15. 据报道,75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活新型冠状病毒。对于上述化学药品的说法错误的是( )A、 能与水互溶 B、 通过氧化灭活病毒 C、过氧乙酸与乙酸是同系物 D、氯仿又叫三氯甲烷16. W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y分别与X形成的化合物均会导致酸雨。下列说法中一定正确的是( )A、简单离子半径中最大的是Z B、简单氢化物中熔沸点最高的是X C、氧化物对应水化物的酸性Z比Y强 D、W的氢化物分子含10个电子17. 某离子[Y2Z4XW2]-的结构如图,且所有原子最外层都达到8电子稳定结构,X、Y、Z、W位于同一短周期,X是其中原子序数最小的元素,W既是同周期也是同主族中原子半径最小的元素。下列说法正确的是( )
,熔点为35℃。下列有关说法错误的是( ) A、一个分子中有10个σ键 B、EC分子间能形成氢键 C、分子中至少有4个原子共平面 D、EC由固态变成液态破坏了分子间的作用力15. 据报道,75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活新型冠状病毒。对于上述化学药品的说法错误的是( )A、 能与水互溶 B、 通过氧化灭活病毒 C、过氧乙酸与乙酸是同系物 D、氯仿又叫三氯甲烷16. W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y分别与X形成的化合物均会导致酸雨。下列说法中一定正确的是( )A、简单离子半径中最大的是Z B、简单氢化物中熔沸点最高的是X C、氧化物对应水化物的酸性Z比Y强 D、W的氢化物分子含10个电子17. 某离子[Y2Z4XW2]-的结构如图,且所有原子最外层都达到8电子稳定结构,X、Y、Z、W位于同一短周期,X是其中原子序数最小的元素,W既是同周期也是同主族中原子半径最小的元素。下列说法正确的是( )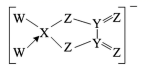 A、该结构中的化学键均为极性共价键 B、Y和Z形成的化合物都是酸性氧化物 C、皮肤上沾有强碱液,用大量水冲洗后,可以涂抹上稀H3XO3溶液 D、Z和W分别与氢元素形成的10电子化合物的沸点:后者高于前者
A、该结构中的化学键均为极性共价键 B、Y和Z形成的化合物都是酸性氧化物 C、皮肤上沾有强碱液,用大量水冲洗后,可以涂抹上稀H3XO3溶液 D、Z和W分别与氢元素形成的10电子化合物的沸点:后者高于前者二、非选择题
-
18. 高技术领域常使用高纯试剂。纯磷酸(熔点为 , 易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于易形成(熔点为),高于则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):

回答下列问题:
(1)、A的名称是。B的进水口为(填“a”或“b”)。(2)、的作用是。(3)、空气流入毛细管的主要作用是防止 , 还具有搅拌和加速水逸出的作用。(4)、升高温度能提高除水速度,实验选用水浴加热的目的是。(5)、磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入促进其结晶。(6)、过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为____(填标号)。A、 B、 C、(7)、磷酸中少量的水极难除去的原因是。19. 以、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)、基态O原子的电子排布式 , 其中未成对电子有个。(2)、Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是。(3)、酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取杂化。邻苯二甲酸酐(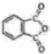 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(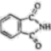 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。 (4)、金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。(5)、ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是。(6)、下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。
(4)、金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。(5)、ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是。(6)、下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。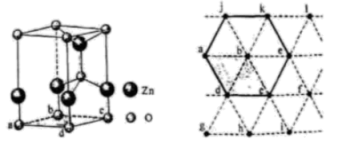 20. 研究笼形包合物结构和性质具有重要意义。化学式为的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为。回答下列问题:
20. 研究笼形包合物结构和性质具有重要意义。化学式为的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为。回答下列问题: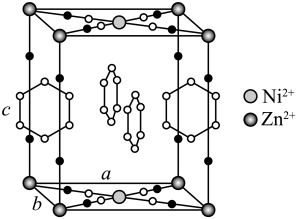 (1)、基态原子的价电子排布式为 , 在元素周期表中位置为。(2)、晶胞中N原子均参与形成配位键,与的配位数之比为;;晶胞中有d轨道参与杂化的金属离子是。(3)、吡啶(
(1)、基态原子的价电子排布式为 , 在元素周期表中位置为。(2)、晶胞中N原子均参与形成配位键,与的配位数之比为;;晶胞中有d轨道参与杂化的金属离子是。(3)、吡啶(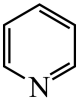 )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大键、则吡啶中N原子的价层孤电子对占据____(填标号)。 A、2s轨道 B、2p轨道 C、sp杂化轨道 D、sp2杂化轨道(4)、在水中的溶解度,吡啶远大于苯,主要原因是① , ②。(5)、
)替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大键、则吡啶中N原子的价层孤电子对占据____(填标号)。 A、2s轨道 B、2p轨道 C、sp杂化轨道 D、sp2杂化轨道(4)、在水中的溶解度,吡啶远大于苯,主要原因是① , ②。(5)、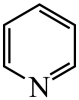 、
、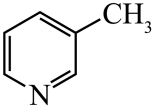 、
、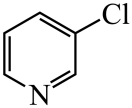 的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 21. 回答下列问题;(1)、①“钡餐”中主要成分的化学式是。
的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 21. 回答下列问题;(1)、①“钡餐”中主要成分的化学式是。②葡萄糖的分子式是。
(2)、焦炭与浓硫酸反应的化学方程式是。(3)、解释接近沸点的水蒸气的相对分子质量测定值比18大的原因。22. 回答下列问题:(1)、四种有机物的相关数据如下表:物质




相对分子质量
72
72
114
114
熔点/℃
- 129.8
- 16.8
- 56.8
97
①总结烷烃同分异构体熔点高低的规律 ;
②根据上述规律预测熔点

 (填“>”或“<”)。(2)、两种无机物的相关数据如下表:
(填“>”或“<”)。(2)、两种无机物的相关数据如下表:物质
(HF)n
冰
氢键形式
F—H…F
O—H…O
氢键键能/kJ·mol-1
28
19
沸点/℃
20
100
(HF)n中氢键键能大于冰,但(HF)n 沸点却低于冰,原因是 。
23. 芯片是国家科技的心脏。在硅及其化合物上进行蚀刻是芯片制造中非常重要的环节。三氟化氮(NF3)、四氟化碳(CF4)是常见的蚀刻剂。(1)、高纯三氟化氮对二氧化硅具有优异的蚀刻速率和选择性。①二氧化硅的晶胞结构如图所示,二氧化硅晶体中硅原子周围最近的硅原子有个。

②工业上常采用F2直接氟化尿素[CO(NH2)2]的方法生产NF3。得到的NF3中常含有少量CF4。常温下,三种物质在水中的溶解性大小顺序为:CF4<NF3<NH3 , 原因是。
(2)、四氟化碳的一种蚀刻机理是:CF4在等离子体的条件下产生活性自由基(▪F),该自由基易与硅及其化合物中的硅原子结合生成SiF4气体从而达到蚀刻目的。用CF4(g)进行蚀刻时常与氧气混合,当混合气体的流速分别为80mL·min-1和100mL·min-1时,蚀刻速率随混合气体中O2和CF4体积之比[V(O2)/V(CF4)]的变化如图所示。
①a点蚀刻速率比b点快的原因是。
②蚀刻速率随V(O2)/V(CF4)先升高后降低的原因是。
(3)、NF3是一种强温室气体,消除大气中的NF3对于环境保护具有重要意义。国内某科研团队研究了利用氢自由基(·H)的脱氟反应实现NF3的降解。降解生成·NF2和HF的两种反应历程如图所示。其中直接抽提反应是降解的主要历程,原因是。 24.(1)、氢键是微粒间的一种常见作用力,如存在于醋酸分子间(
24.(1)、氢键是微粒间的一种常见作用力,如存在于醋酸分子间( )和硝酸分子内(
)和硝酸分子内(  )等。已知邻氨基苯甲醛(
)等。已知邻氨基苯甲醛(  )的熔点为39℃,对氨基苯甲醛(
)的熔点为39℃,对氨基苯甲醛(  )的熔点为71℃,请说明对氨基苯甲醛的熔点比邻氨基苯甲醛高的原因。 (2)、请用一个化学方程式并结合适当的文字说明HClO、H2CO3和HCO 酸性的强弱。25. 、 在电化学和催化领域均有重要地位.回答下列问题:(1)、基态 原子核外占据最高能层电子的电子云轮廓图的形状为; 、 两种基态原子的价层电子数目之比为; 、 、 的第一电离能由大到小的顺序为。(2)、碳有多种同素异形体,其中等质量的石墨与金刚石中共价键的数目之比为。(3)、 、 、 的沸点由高到低的顺序为 , 原因为。(4)、 的酸性弱于 的原因为; 中 的杂化方式为。(5)、 的晶胞结构如图所示。
)的熔点为71℃,请说明对氨基苯甲醛的熔点比邻氨基苯甲醛高的原因。 (2)、请用一个化学方程式并结合适当的文字说明HClO、H2CO3和HCO 酸性的强弱。25. 、 在电化学和催化领域均有重要地位.回答下列问题:(1)、基态 原子核外占据最高能层电子的电子云轮廓图的形状为; 、 两种基态原子的价层电子数目之比为; 、 、 的第一电离能由大到小的顺序为。(2)、碳有多种同素异形体,其中等质量的石墨与金刚石中共价键的数目之比为。(3)、 、 、 的沸点由高到低的顺序为 , 原因为。(4)、 的酸性弱于 的原因为; 中 的杂化方式为。(5)、 的晶胞结构如图所示。
① 晶体中,C周围距离最近且相等的 的数目为。
②若阿伏加德罗常数的值为 ,则 晶体密度 。
26. 2020年诺贝尔化学奖授予开发了“基因剪刀”的两位科学家。利用这一技术,研究人员可以极其精确地改变动物、植物和微生物的DNA。如图是脱氧核糖核酸(DNA)的结构片段。回答下列问题: (1)、构成DNA片段的元素中,N、O、P电负性由大到小的顺序是。(2)、已知N2O为直线形结构,结构式为N=N=O。则N2O是(填“极性”或“非极性”)分子,中间氮原子的杂化轨道类型为杂化。(3)、磷能形成多种含氧酸,某资料认为次磷酸的结构如图所示,则次磷酸分子中σ键与π键数目之比为 , 1mol次磷酸最多能与 molNaOH发生中和反应。
(1)、构成DNA片段的元素中,N、O、P电负性由大到小的顺序是。(2)、已知N2O为直线形结构,结构式为N=N=O。则N2O是(填“极性”或“非极性”)分子,中间氮原子的杂化轨道类型为杂化。(3)、磷能形成多种含氧酸,某资料认为次磷酸的结构如图所示,则次磷酸分子中σ键与π键数目之比为 , 1mol次磷酸最多能与 molNaOH发生中和反应。 (4)、已知下列数据:
(4)、已知下列数据:物质
熔点/K
沸点/K
分解温度/K
NH3
195.3
239.7
1073
PH3
139.2
185.4
713.2
NH3的熔、沸点均高于PH3的原因是;PH3的分解温度高于其沸点,其原因是。
(5)、某磷青铜晶胞结构如图所示。
①其化学式为。
②基态锡原子的价电子排布式为。
该晶体中距离Sn原子最近的Cu原子有个。
③若晶体密度为8.82g·cm-3 , 距离最近的Cu原子核间距为pm(用含NA的代数式表示,设NA表示阿伏加德罗常数的值)。
27. 三氟化氮(NF3)是一种无色、无臭的气体。三氟化氮在一定条件下与水蒸气能发生氧化还原反应,反应产物中生成酸 X、酸 Y 和一种无色气体(遇空气变成红棕色),其中酸 X 是一种弱酸,酸Y 为常见的含氧强酸。(1)、NF3 的空间构型为。(2)、酸X 是弱酸(难电离)的可能原因是。(3)、工业上通过 NH3 和氟气(F2)反应制备 NF3 , 请结合题给信息,判断 NF3 主要表现出来的化学性质是。(4)、NF3 的一种下游产品三聚氟氰(分子式为:C3N3F3),分子结构中显示有环状结构,请从价键理论和物质的相对稳定性角度写出三聚氟氰的结构式 。28. 磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料。 LiFePO4可用FeCl3、NH4H2PO4、LiCl和苯胺( )等作为原料制备。 (1)、Fe2+基态核外电子排布式为 , PO43-的空间构型为(用文字描述)。(2)、NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是(填元素符号)。(3)、1 mol
)等作为原料制备。 (1)、Fe2+基态核外电子排布式为 , PO43-的空间构型为(用文字描述)。(2)、NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是(填元素符号)。(3)、1 mol 含有的σ键数目为 , 苯胺的沸点高于甲苯的主要原因是。 (4)、一个LiCl晶胞(如图)中,Li+数目为。
含有的σ键数目为 , 苯胺的沸点高于甲苯的主要原因是。 (4)、一个LiCl晶胞(如图)中,Li+数目为。 29. 均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原予的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。请回答下列问题:(1)、A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为(用元素符号表示)。(2)、A与HF相比,其熔、沸点较低,原因是。(3)、B分子属于(填“极性”或“非极性”)分子。(4)、D分子中心原子的杂化方式是 , 由该原子组成的单质分子中包含个π键,与该单质分子互为等电子体的常见分子的分子式为。(5)、[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请画出[Fe(NO)(H2O)5]2+结构示意图:。30. 过氧乙酸又名过醋酸 ,是重要化工原料,也是一种绿色生态杀菌剂,其制法为 。(1)、某同学写出了碳原子的4种不同状态的电子排布图:
29. 均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原予的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。请回答下列问题:(1)、A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为(用元素符号表示)。(2)、A与HF相比,其熔、沸点较低,原因是。(3)、B分子属于(填“极性”或“非极性”)分子。(4)、D分子中心原子的杂化方式是 , 由该原子组成的单质分子中包含个π键,与该单质分子互为等电子体的常见分子的分子式为。(5)、[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请画出[Fe(NO)(H2O)5]2+结构示意图:。30. 过氧乙酸又名过醋酸 ,是重要化工原料,也是一种绿色生态杀菌剂,其制法为 。(1)、某同学写出了碳原子的4种不同状态的电子排布图:a.
 b.
b. 
c.
 d.
d. 
其中能量最低的是(填标号),电子由状态C到状态B所得到的光谱为光谱(填“原子发射”或“原子吸收”)。
(2)、过氧乙酸分子中C原子的杂化方式有。(3)、乙酸比乙醇易电离出 的原因。(4)、熔点:乙酸硝酸(填“>”、“<”或“=”),理由。(5)、造纸中,用 与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。①两种硼氢化物的熔点如下表所示:
硼氢化物
熔点/℃
400
-64.5
解释表中两种物质熔点差异的原因。
②硼氢化钠晶胞结构如图所示,该晶体中 的配位数为。已知:硼氢化钠晶体的密度为 , 代表阿伏加德罗常数的值,则a=nm(用含 、 的最简式子表示)。
 31. 补铁剂常用于防治缺铁性贫血,其有效成分般为硫酸亚铁、琥珀酸亚铁、富马酸亚铁和乳酸亚铁等。回答下列问题:(1)、能表示能量最低的亚铁离子的电子排布式是(填标号)。
31. 补铁剂常用于防治缺铁性贫血,其有效成分般为硫酸亚铁、琥珀酸亚铁、富马酸亚铁和乳酸亚铁等。回答下列问题:(1)、能表示能量最低的亚铁离子的电子排布式是(填标号)。a.[Ar]3d54s2 b.[Ar]3d54s1 c.[Ar]3d64s2 d.[Ar]3d6
(2)、琥珀酸即丁二酸(HOOCCH2CH2COOH),在琥珀酸分子中电负性最大的原子是 , 碳原子的杂化方式是;琥珀酸亚铁中存在配位键,在该配位键中配位原子是 , 中心原子是。(3)、富马酸和马来酸互为顺反异构体,其电离常数如下表:物质名称
Ka1
Ka2
富马酸(
 )
)7.94×10-4
2.51×10-5
马来酸(
 )
)1.23×10-2
4.68×10-7
请从氢键的角度解释富马酸两级电离常数差别较小,而马来酸两级电离常数差别较大的原因:。
(4)、β-硫酸亚铁的晶胞结构如图所示,其晶胞参数为a=870pm、b=680pm、c=479pm,α=β=γ=90°,Fe2+占据晶胞顶点、棱心、面心和体心。在该晶胞中,硫酸根离子在空间上有种空间取向,晶胞体内硫酸根离子的个数是 , 铁原子周围最近的氧原子的个数为;设阿伏加德罗常数的值为NA , 则该晶体的密度是g·cm-3(列出计算表达式)。 32. 硫酸铵[(NH4)2SO4]一种优良的氮肥(俗称肥田粉),适用于一般土壤和作物,能使枝叶生长旺盛,提高果实品质和产量,增强作物对灾害的抵抗能力,可作基肥、追肥和种肥,与氢氧化钙在加热的条件下可以生成氨气。根据所学知识回答下列问题:(1)、基态S原子的价电子排布式为 , 能量最高的电子所处的能层的符号为。(2)、SO42-空间构型为 , 中心原子的轨道杂化方式是 , 写出一个与SO42-互为等电子体的分子的化学式。(3)、氨气的沸点(-33.5℃)高于硫化氢的沸点(-60.4℃)的主要原因是:。(4)、O、N、S的第一电离能从大到小的顺序是。(5)、硫酸铜溶液中通入过量的氨气会生成[Cu(NH3)4]SO4 , 1mol的[Cu(NH3)4]2+中σ键的个数为。(6)、以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构如下图所示,这种碳氮化钛化合物的化学式为。若将该晶体的晶胞重新切割,使碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是。
32. 硫酸铵[(NH4)2SO4]一种优良的氮肥(俗称肥田粉),适用于一般土壤和作物,能使枝叶生长旺盛,提高果实品质和产量,增强作物对灾害的抵抗能力,可作基肥、追肥和种肥,与氢氧化钙在加热的条件下可以生成氨气。根据所学知识回答下列问题:(1)、基态S原子的价电子排布式为 , 能量最高的电子所处的能层的符号为。(2)、SO42-空间构型为 , 中心原子的轨道杂化方式是 , 写出一个与SO42-互为等电子体的分子的化学式。(3)、氨气的沸点(-33.5℃)高于硫化氢的沸点(-60.4℃)的主要原因是:。(4)、O、N、S的第一电离能从大到小的顺序是。(5)、硫酸铜溶液中通入过量的氨气会生成[Cu(NH3)4]SO4 , 1mol的[Cu(NH3)4]2+中σ键的个数为。(6)、以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构如下图所示,这种碳氮化钛化合物的化学式为。若将该晶体的晶胞重新切割,使碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是。 33. 铁和钴是两种重要的过渡元素。(1)、钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为。(2)、基态Fe3+的核外电子排布式(3)、铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是 , 分子中σ键与π键的数目之比为。醋酸钠中碳原子的杂化类型。(4)、铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5℃)解释其熔沸点高低的主要原因。(5)、Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为。
33. 铁和钴是两种重要的过渡元素。(1)、钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为。(2)、基态Fe3+的核外电子排布式(3)、铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是 , 分子中σ键与π键的数目之比为。醋酸钠中碳原子的杂化类型。(4)、铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5℃)解释其熔沸点高低的主要原因。(5)、Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为。 (6)、奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为。若品体密度为dg·cm-3 , 则晶胞中最近的两个碳原子的距离为pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
(6)、奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为。若品体密度为dg·cm-3 , 则晶胞中最近的两个碳原子的距离为pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。