高考二轮复习知识点:含有氢键的物质
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 一种可吸附甲醇的材料,其化学式为 , 部分晶体结构如下图所示,其中为平面结构。
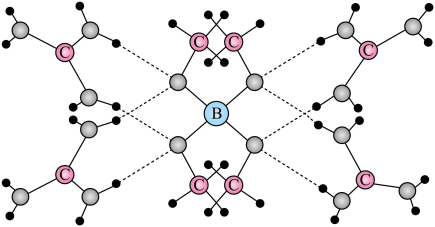
下列说法正确的是
A、该晶体中存在N-H…O氢键 B、基态原子的第一电离能: C、基态原子未成对电子数: D、晶体中B、N和O原子轨道的杂化类型相同2. 2021年诺贝尔化学奖颁给了“在不对称催化方面”做出贡献的两位科学家。脯氨酸(结构如图)可参与诱导不对称催化反应,下列关于脯氨酸的说法错误的是 A、既可以与酸反应,又可以与碱反应 B、饱和碳原子上的一氯代物有3种 C、能形成分子间氢键和分子内氢键 D、与
A、既可以与酸反应,又可以与碱反应 B、饱和碳原子上的一氯代物有3种 C、能形成分子间氢键和分子内氢键 D、与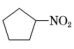 互为同分异构体
3. 含Tp配体的钌(Ru)配合物催化氢化生成甲酸的机理如图所示:
互为同分异构体
3. 含Tp配体的钌(Ru)配合物催化氢化生成甲酸的机理如图所示:
下列叙述错误的是
A、循环中Ru的成键数目未发生变化 B、循环中氮和碳的杂化方式未发生改变 C、循环中物质所含氢键有分子间氢键和分子内氢键 D、循环的总反应为4. 冰的晶胞结构如图所示。下列相关说法错误的是 A、晶胞中z方向上的两个氧原子最短距离为d,则冰晶胞中的氢键的长为d B、冰晶体中,相邻的水分子间皆以氢键结合 C、冰密度比干冰的小,主要是因为冰晶体分子间的氢键存在方向性、饱和性 D、硫化氢晶体结构与冰相似5. 2021年Benjamin List 和Dave MacMillan因不对称有机催化获得诺贝尔化学奖。他们利用有机小分子代替传统的金属催化剂进行不对称合成,脯氨酸是最常见的有机小分子催化剂,下图利用脯氨酸催化Aldol反应的机理如下图所示:
A、晶胞中z方向上的两个氧原子最短距离为d,则冰晶胞中的氢键的长为d B、冰晶体中,相邻的水分子间皆以氢键结合 C、冰密度比干冰的小,主要是因为冰晶体分子间的氢键存在方向性、饱和性 D、硫化氢晶体结构与冰相似5. 2021年Benjamin List 和Dave MacMillan因不对称有机催化获得诺贝尔化学奖。他们利用有机小分子代替传统的金属催化剂进行不对称合成,脯氨酸是最常见的有机小分子催化剂,下图利用脯氨酸催化Aldol反应的机理如下图所示:
下列说法错误的是
A、Aldol反应方程式: B、1→2为消去反应,2→3为加成反应
C、化合物3和4互为同分异构体
D、中间体3中存在氢键
6. 聚氨酯是一种应用广泛的有机材料,可根据需求调节其硬度,其结构片段如图。
B、1→2为消去反应,2→3为加成反应
C、化合物3和4互为同分异构体
D、中间体3中存在氢键
6. 聚氨酯是一种应用广泛的有机材料,可根据需求调节其硬度,其结构片段如图。 (R、R'表示短碳链,
(R、R'表示短碳链, 表示长碳链)
表示长碳链)下列有关聚氨酯的说法错误的是( )
A、聚氨酯在一定条件下能发生水解 B、聚氨酯中只含有酯基 C、聚氨酯链之间可形成氢键,增大材料的硬度 D、的值越大,聚氨酯材料的硬度越大7. 第24届冬奥会在北京、张家口两地举办。国家速滑馆“冰丝带”里屡破奥运会纪录,该冰场是冬奥史上“最快冰面”。冰层表面的结构如图所示。下列有关说法不正确的是( )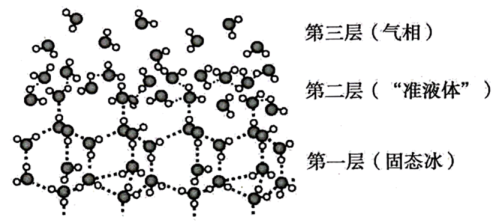 A、冰熔化成水的过程中, , B、第一层固态冰中,水分子间通过氢键形成空间网状结构,密度比液态水小 C、第二层“准液体”中,水分子间形成氢键的数目比固态冰中少 D、当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流动性水分子”,使冰面变滑8. “暖冰”是科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。用“暖冰”做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液呈血红色。则下列说法错误的是( )
A、冰熔化成水的过程中, , B、第一层固态冰中,水分子间通过氢键形成空间网状结构,密度比液态水小 C、第二层“准液体”中,水分子间形成氢键的数目比固态冰中少 D、当高于一定温度时,“准液体”中的水分子与下层冰连接的氢键断裂,产生“流动性水分子”,使冰面变滑8. “暖冰”是科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的。用“暖冰”做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液呈血红色。则下列说法错误的是( ) A、该条件下H2燃烧生成了既具有氧化性又具有还原性的物质 B、水凝固形成20℃时的“暖冰”所发生的变化是化学变化 C、该条件下H2燃烧的产物中可能含有一定量的H2O2 D、在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”9. Cu2O溶于硫酸生成Cu和CuSO4 , CuSO4溶液中加入强碱产生蓝色絮状沉淀,继续加入强碱沉淀溶解生成蓝色[Cu(OH)4]2-。CuSO4·5H2O的晶体结构如图,关于铜的化合物说法错误的是( )
A、该条件下H2燃烧生成了既具有氧化性又具有还原性的物质 B、水凝固形成20℃时的“暖冰”所发生的变化是化学变化 C、该条件下H2燃烧的产物中可能含有一定量的H2O2 D、在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”9. Cu2O溶于硫酸生成Cu和CuSO4 , CuSO4溶液中加入强碱产生蓝色絮状沉淀,继续加入强碱沉淀溶解生成蓝色[Cu(OH)4]2-。CuSO4·5H2O的晶体结构如图,关于铜的化合物说法错误的是( ) A、蛋白质溶液中加入CuSO4发生盐析 B、Cu2O溶于硫酸的离子方程式:Cu2O+2H+=Cu2++Cu+H2O C、Cu(OH)2为两性氢氧化物,可用于鉴别葡萄糖和蔗糖 D、CuSO4·5H2O晶体中 与水分子之间存在氢键10. 如何对肿瘤精准治疗一直是医疗领域需攻克的难题之一,我国科研人员开发出的一种医用亲水凝胶,能使药物的释放更为精确。医用亲水凝胶生产过程中的一种中间体M的结构如图所示。下列有关M的说法正确的是( )
A、蛋白质溶液中加入CuSO4发生盐析 B、Cu2O溶于硫酸的离子方程式:Cu2O+2H+=Cu2++Cu+H2O C、Cu(OH)2为两性氢氧化物,可用于鉴别葡萄糖和蔗糖 D、CuSO4·5H2O晶体中 与水分子之间存在氢键10. 如何对肿瘤精准治疗一直是医疗领域需攻克的难题之一,我国科研人员开发出的一种医用亲水凝胶,能使药物的释放更为精确。医用亲水凝胶生产过程中的一种中间体M的结构如图所示。下列有关M的说法正确的是( ) A、M分子间可通过缩聚反应合成高分子化合物 B、能发生消去反应 C、该分子亲水的原因是能形成分子内氢键 D、分子中所有的碳原子和氮原子可能共平面11. 羟氨(NH2OH)可看作氨分子内的一个氢原子被羟基取代的衍生物。下列说法错误的是( )A、羟氨的水溶液显碱性,可与盐酸发生反应 B、羟氨既有氧化性又有还原性,受热可生成氨气 C、羟氨分子中N原子、O原子与羟基H原子共直线 D、羟氨易溶于水是由于其与水分子形成分子间氢键12. 我国科学家提出用CO2置换可燃冰(mCH4·nH2O) 中CH4的设想,置换过程如图所示,下列说法正确的是( )
A、M分子间可通过缩聚反应合成高分子化合物 B、能发生消去反应 C、该分子亲水的原因是能形成分子内氢键 D、分子中所有的碳原子和氮原子可能共平面11. 羟氨(NH2OH)可看作氨分子内的一个氢原子被羟基取代的衍生物。下列说法错误的是( )A、羟氨的水溶液显碱性,可与盐酸发生反应 B、羟氨既有氧化性又有还原性,受热可生成氨气 C、羟氨分子中N原子、O原子与羟基H原子共直线 D、羟氨易溶于水是由于其与水分子形成分子间氢键12. 我国科学家提出用CO2置换可燃冰(mCH4·nH2O) 中CH4的设想,置换过程如图所示,下列说法正确的是( )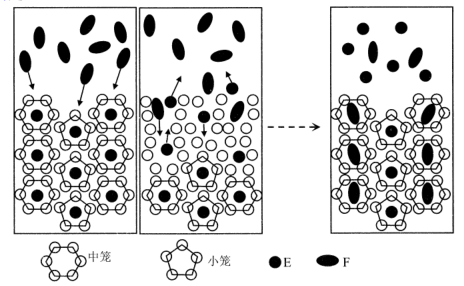 A、E代表CO2 , F代表CH4 B、笼状结构中水分子间主要靠氢键结合 C、CO2置换出CH4的过程是化学变化 D、CO2可置换可燃冰中所有的CH4分子13. 结合下表已知信息,判断下列相关叙述正确的是( )
A、E代表CO2 , F代表CH4 B、笼状结构中水分子间主要靠氢键结合 C、CO2置换出CH4的过程是化学变化 D、CO2可置换可燃冰中所有的CH4分子13. 结合下表已知信息,判断下列相关叙述正确的是( )物质及其编号
分子式
沸点/℃
水溶性
①
甘油
C3H8O3
259
②
1.2-丙二醉
C3H8O2
188
与水以任意比混溶
③
乙醇
C2H6O
197.3
④
丙烷
C3H8
-42.1
难溶于水
A、①、②、③属于一元饱和醇 B、可推测出乙二醇的沸点应低于乙醇的沸点 C、用蒸馏法可将②与③从其混合液中分离出来 D、醇分子之间、醇分子与水分子之间均能形成氢键14. 我国科学家利用高分辨原子力显微镜技术,首次拍摄到质子在水层中的原子级分辨图像,发现两种结构的水合质子,其中一种结构如图所示。下列有关该水合质子的说法正确的是 A、化学式为 B、氢、氧原子都处于同一平面 C、氢、氧原子间均以氢键结合 D、图中所有键角都相同15. 下列说法正确的是( )A、H3O+的空间结构:平面三角形 B、冰中的氢键示意图:
A、化学式为 B、氢、氧原子都处于同一平面 C、氢、氧原子间均以氢键结合 D、图中所有键角都相同15. 下列说法正确的是( )A、H3O+的空间结构:平面三角形 B、冰中的氢键示意图: C、基态氧原子价电子排布图:
C、基态氧原子价电子排布图: D、基态Cr原子电子排布式:[Ar]3d44s2
16. 下列说法错误的是( )A、一定条件下,苯与氯气生成六六六的反应属于加成反应 B、蛋白质的二级结构是因为肽键中的氧原子和氢原子之间存在氢键 C、蒸馏中,冷却水应从冷凝管的下口通入,上口流出 D、灼烧固体时,坩埚放在铁圈或三脚架上直接加热
D、基态Cr原子电子排布式:[Ar]3d44s2
16. 下列说法错误的是( )A、一定条件下,苯与氯气生成六六六的反应属于加成反应 B、蛋白质的二级结构是因为肽键中的氧原子和氢原子之间存在氢键 C、蒸馏中,冷却水应从冷凝管的下口通入,上口流出 D、灼烧固体时,坩埚放在铁圈或三脚架上直接加热二、多选题
-
17. 化合物Z是一种具有广谱抗菌活性的药物,其合成反应如图。下列说法错误的是( )
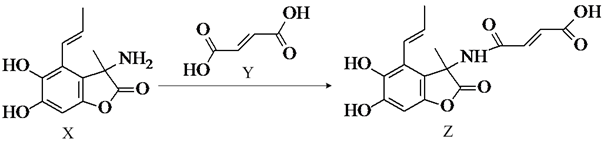 A、X分子间只能形成下列氢键:O-H…O、N-H…N B、1molZ最多能与6molNaOH反应 C、Z分子中含2个手性碳原子 D、X、Y、Z三种分子均存在顺反异构体
A、X分子间只能形成下列氢键:O-H…O、N-H…N B、1molZ最多能与6molNaOH反应 C、Z分子中含2个手性碳原子 D、X、Y、Z三种分子均存在顺反异构体三、非选择题
-
18.(1)、乙醇的挥发性比水的强,原因是。(2)、金属氢化物是应用广泛的还原剂。的还原性比的强,原因是。19. (15分)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表).回答下列问题:(1)、氮原子价层电子对的轨道表达式(电子排布图)为 .(2)、
元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1).第二周期部分元素的E1变化趋势如图(a)所示,
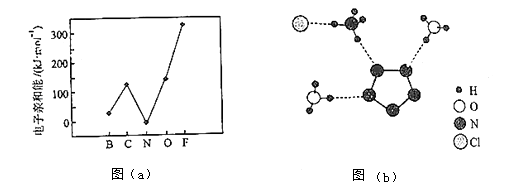
其中除氮元素外,其他元素的E1自左而右依次增大的原因是;氮元素的E1呈现异常的原因是 .
(3)、经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示.①从结构角度分析,R中两种阳离子的相同之处为 , 不同之处为 . (填标号)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
②R中阴离子N5﹣中的σ键总数为个.分子中的大π键可用符号Πmn表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π66),则N5﹣中的大π键应表示为 .
③图(b)中虚线代表氢键,其表示式为(NH4+)N﹣H…Cl、、 .
(4)、R的晶体密度为dg•cm﹣3 , 其立方晶胞参数为anm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为 .20. 氮的相关化合物在材料等方面有重要用途。回答下列问题:(1)、基态N原子的核外电子排布式为 , 第一电离能:I1(N)I1(O)(填“大于”或“小于”)。(2)、N及其同族的P、As均可形成类似的氢化物,NH3、PH3、AsH3的沸点由高到低的顺序为(填化学式)。(3)、[N5]+[AsF6]-是一种全氮阳离子形成的高能物质,其结构如图所示,其中N原子的杂化轨道类型为。 (4)、科学家近期首次合成了具有极性对称性的氮化物钙钛矿材料-LaWN3 , 其立方晶胞结构如图所示,晶胞中La、W、N分别处于顶角、体心、面心位置,晶胞参数为a nm。
(4)、科学家近期首次合成了具有极性对称性的氮化物钙钛矿材料-LaWN3 , 其立方晶胞结构如图所示,晶胞中La、W、N分别处于顶角、体心、面心位置,晶胞参数为a nm。
①La与N间的最短距离为nm,与La紧邻的N个数为。
②在LaWN3晶胞结构的另一种表示中,W处于各顶角位置,则在新的晶胞中,La处于位置,N处于位置。
③设LaWN3的式量为Mr , 阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3(列出计算表达式)。
21. 卤沙唑仑W是一种抗失眠药物,在医药工业中的一种合成方法如下:
已知:(i)

 +HCl
+HCl(ii)

 +H2O
+H2O回答下列问题:
(1)、A的化学名称是。(2)、写出反应③的化学方程式。(3)、D中含O和含N的官能团名称分别是。(4)、下列对有机物D叙述正确的是____(“填字母”)。A、分子式为C13H8BrFON B、分子间能形成氢键 C、既能与盐酸反应,又能与氢氧化钠溶液反应 D、1molD最多能与6molH2 发生加成反应(5)、反应④中Y的结构简式为;反应⑤的反应类型为。(6)、B的同分异构体中,遇到Fe3+显色并能发生银镜反应的化合物共有种。(7)、写出F的结构简式。22. 回答下列问题:(1)、已知固态NH3、H2O、HF中的氢键的键能和结构示意图如表所示:物质及其氢健
HF(s):F—H…F
H2O(s):O—H…O
NH3(s):N—H…N
健能/(kJ·mol-1)
28.1
18.8
5.4

H2O、HF、NH3沸点依次降低的原因是。
(2)、镓的卤化物熔点如表所示:物质
GaF3
GaCl3
GaBr3
GaI3
熔点/℃
1000
78
124
213
各物质的熔点从GaCl3、GaBr3、GaI3到GaF3依次升高,原因是。
23. 铁、钴、镍都属于第Ⅷ族元素,它们的单质、合金及其化合物在催化剂和能源领域用途非常广泛。(1)、基态Fe2+的核外电子排布式为。结合电子排布式分析Fe3+比Co3+氧化性弱的原因:。(2)、BNCP可用于激光起爆器等,BNCP可由N2H4、HClO4、CTCN、NaNT共反应制备。①ClO4-的空间构型为。
②CTCN的化学式为 ,与Co3+形成配位键的原子是。(已知CO32−的结构式为
 )
)③ 可以
 (双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为 ,
(双聚氰胺为原料制备。双聚氰胺中碳原子杂化轨道类型为 ,  中含有σ键的物质的量为。
中含有σ键的物质的量为。④ 是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为。
(3)、一种新型的功能材料的晶胞结构如图所示,Mn在面心和顶点,它的化学式可表示为。 (4)、镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为(列出计算表达式,NA表示阿伏加德罗常数的数值) g∙cm-3。
(4)、镍镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。若该晶体储氢时,H2分子在晶胞的体心和棱的中心位置,距离最近的两个H2分子之间的距离为anm。则镍镁晶体未储氢时的密度为(列出计算表达式,NA表示阿伏加德罗常数的数值) g∙cm-3。 24. 磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:(1)、画出基态P 原子的核外电子排布图。(2)、 NH3比PH3 易液化的原因是。(3)、 P4S3可用于制造火柴,其结构如图1所示。
24. 磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:(1)、画出基态P 原子的核外电子排布图。(2)、 NH3比PH3 易液化的原因是。(3)、 P4S3可用于制造火柴,其结构如图1所示。
①P4S3中硫原子的杂化轨道类型为。
②电负性: 磷硫(填“>”或“<”);第一电离能磷大于硫的原因是。
(4)、NH4BF4是合成氮化硼纳米管的原料之一,1mol NH4BF4中含有mol 配位键。(5)、NF3的键角小于NH3的键角,其原因是。(6)、 磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2 所示。原子坐标参数表示晶胞内部各原子的相对位置,图中a 点和c 点的原子坐标参数依次为(0,0,0)、(1, , ),则b点的原子坐标参数为;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。 25. 铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:(1)、Cu2O中阳离子的基态核外电子排布式为; Cu和Ni在元素周期表中的位置相邻, Ni在周期表中的位置是。(2)、将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 [Cu( NH3)4]SO4·H2O。
25. 铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:(1)、Cu2O中阳离子的基态核外电子排布式为; Cu和Ni在元素周期表中的位置相邻, Ni在周期表中的位置是。(2)、将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 [Cu( NH3)4]SO4·H2O。①乙醇分子中C 原子的轨道杂化类型为 , NH3与H+以配位键形成NH4+ , 则NH4+的空间构型为。
②[Cu( NH3)4]SO4·H2O]中存在的化学键除了极性共价键外,还有。
③NH3极易溶于水的原因主要有两个,一是 , 二是。
(3)、CuSO4溶液中加入过量KCN溶液能生成配离子[Cu(CN)4]2- , 1mol CN-中含有的π键数目为。与CN-互为等电子体的离子有(写出一种即可)。(4)、Cu 与F形成的化合物的晶胞结构如图所示,若晶体密度为a g·cm-3 , 则Cu与F最近距离为pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。 26. 回答下列问题:(1)、固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构。(2)、基态Zn的价层电子排布式 , 金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。(3)、NH3的中心原子的杂化方式为 , NH3中H-N-H键角PH3中H-P-H键角(填“大于”、“小于”或“等于”)。(4)、立方ZnS晶体结构如下图所示,其晶胞边长为a pm,密度为g/cm3 , A位S2-离子与B位置Zn2+离子之间的距离为pm(列式表示)。
26. 回答下列问题:(1)、固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构。(2)、基态Zn的价层电子排布式 , 金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。(3)、NH3的中心原子的杂化方式为 , NH3中H-N-H键角PH3中H-P-H键角(填“大于”、“小于”或“等于”)。(4)、立方ZnS晶体结构如下图所示,其晶胞边长为a pm,密度为g/cm3 , A位S2-离子与B位置Zn2+离子之间的距离为pm(列式表示)。 27. 五氮离子盐、均是高能炸药。回答:(1)、Cl的基态原子电子排布式为。(2)、气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能,N、O、F的第一电离能从小到大的顺序是。(用元素符号表示)。
27. 五氮离子盐、均是高能炸药。回答:(1)、Cl的基态原子电子排布式为。(2)、气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能,N、O、F的第一电离能从小到大的顺序是。(用元素符号表示)。 (3)、经X射线衍射测得的局部结构如上图所示。
(3)、经X射线衍射测得的局部结构如上图所示。①的空间构型是 , 中O原子的杂化方式是。
②中的σ键总数为个,图中a处的氢键可表示为 , 请照此画出b处的氢键。
(4)、下列说法正确的是____A、中含有非极性键 B、两种盐中的五氮离子的结构完全相同 C、两种盐爆炸时均产生气体且大量放热 D、中As显+7价,中As的配位数是6(5)、的晶体密度为 , 立方晶胞边长为anm,设晶胞中含有y个[]单元,该单元的相对质量为M,则y的计算表达式为。28. 一百多年前,李比希首先利用尿素合成了三聚氰胺( ),它可用于阻燃剂、水泥减水剂和高分子合成等领域。请回答: (1)、根据李比希燃烧法,利用如图装置测定三聚氰胺的组成(图中铂小皿用于盛放样品)。
),它可用于阻燃剂、水泥减水剂和高分子合成等领域。请回答: (1)、根据李比希燃烧法,利用如图装置测定三聚氰胺的组成(图中铂小皿用于盛放样品)。
①高氯酸镁的作用是。
②吸收管做成细长型的目的是。
③设计准确测定体积的实验方案。
(2)、一些不法分子往牛奶中加入三聚氰胺,以提高奶制品的含氮量,三聚氰胺在体内可转化为三聚氰酸( )。
)。①三聚氰酸中的C、N、O元素的第一电离能由大到小的顺序是。
②三聚氰酸分子中最多个原子共平面,三聚氰胺与三聚氰酸之间会通过(写出结构表达式)结合,在肾脏内形成结石。
(3)、尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成链状二聚物,其方程式为:
三分子缩合时,还可成环。已知发生缩合反应失去 , 生成二聚物和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算各缩合产物的物质的量之比。
(4)、三聚氰胺与某含氯、氧元素(原子数比1:1)芳香化合物在特定溶剂中混合,迅速反应产生聚酰胺薄膜,部分结构如图所示(不同颜色表示不同的结构;环间的键仅表示连接关系,略去了环间的原子)。参与反应的芳香化合物的结构简式是。 29. 金属冶炼过程中一种用有机化合物从水溶液中提取Cu2+的流程如下所示:(1)、有机化合物W的结构简式为:
29. 金属冶炼过程中一种用有机化合物从水溶液中提取Cu2+的流程如下所示:(1)、有机化合物W的结构简式为:
①该分子中与氮原子相连的氧原子的杂化轨道类型为。
②关于W的说法正确的是。
a.能发生取代、加成、还原反应
b.可与碳酸钠反应产生气体
c.含有氨基官能团
(2)、W可与Cu2+形成化合物Q,其结构如下图所示。
①解释氢键形成的原因。
②氢键对Q在水中溶解性的影响是(填“增大”或“减小”)。
③Cu2+与氮原子之间形成的化学键的类型是。
30. 按要求完成下列问题:(1)、写出硫酸铵的化学式。(2)、写出次氯酸钠中存在的化学键类型。(3)、比较物质沸点:H2OH2S(填“>”、“=”或“<”)。31. A、B、C、D是四种短周期主族元素,其原子序数依次增大。只有B、C位于同一周期且位置相邻,其中C是地壳中含量最多的元素,D是其所处周期中电负性最强的元素。用元素相关化学符号回答下列问题:(1)、①A元素的原子结构示意图为。②B的基态原子电子的空间运动状态有种。
③C的基态原子核外电子排布式为。
④D的基态原子价层电子排布图为。
(2)、B、C两种元素形成的一种化合物B2C曾被用作麻醉剂,推测的空间构型为;写出的一种等电子体的结构式。(3)、B、C两元素分别与A元素形成的两种阳离子中,中心原子的杂化方式都是采用sp3杂化,键角大的是(填离子符号),原因。(4)、如图是A、B、C、D四种元素组成的某化合物的局部晶体结构图,其中虚线表示氢键,氢键之一的表示式可写为 , 请据图任意再写出一种氢键的表示式(用元素符号),阴离子中所含的键数目为(用阿伏加德罗常数的值表示)。 32. 氮原子不但可以形成离子键,还可以形成σ键、π键、大π键和配位键等,成键的多样性使其形成了多种具有独特组成的物质。回答下列问题:(1)、电负性:NO(填“>” 或“<”),基态氮原子价电子排布图不是
32. 氮原子不但可以形成离子键,还可以形成σ键、π键、大π键和配位键等,成键的多样性使其形成了多种具有独特组成的物质。回答下列问题:(1)、电负性:NO(填“>” 或“<”),基态氮原子价电子排布图不是 ,是因为该排布方式违背了。 (2)、肼(H2N-NH2)分子中孤电子对与σ键的数目之比为 , 肼的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是。(3)、正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。
,是因为该排布方式违背了。 (2)、肼(H2N-NH2)分子中孤电子对与σ键的数目之比为 , 肼的相对分子质量与乙烯接近,但沸点远高于乙烯的原因是。(3)、正硝酸钠(Na3NO4)为白色晶体,是一种重要的化工原料。①写出与Na3NO4的阴离子互为等电子体的一种阴离子:(填化学式)。
②在573K条件下,实验室中用NaNO3和Na2O在银皿中反应制得Na3NO4 , Na2O的立方晶胞如图所示。Na2O晶胞的参数为a pm,则晶胞密度为g/cm3(列出计算式即可,NA为阿伏加德罗常数的值)。
 33. 黄铜矿(主要成分二硫化亚铁铜,化学式为CuFeS2)为原料可制备金属铜及其化合物,还可以制得铁红、硫磺等,工艺流程如图:
33. 黄铜矿(主要成分二硫化亚铁铜,化学式为CuFeS2)为原料可制备金属铜及其化合物,还可以制得铁红、硫磺等,工艺流程如图: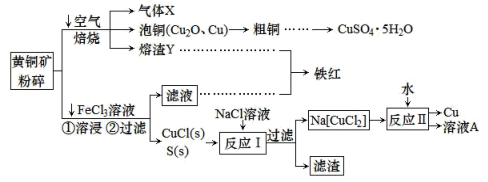
请回答下列问题:
(1)、气体X的名称是。(2)、“铁红”化学式为。向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中H2SO4与HNO3的最佳物质的量之比为。(3)、FeCl3溶液浸取工艺中,溶浸时CuFeS2与FeCl3溶液反应的离子方程式为。(4)、反应I化学方程式为 , 反应II所得“溶液A”成分是(填化学式)。(5)、科学家通过X射线推测胆矾结构示意图如图:
则1mol胆矾有个氢键,写出能反映胆矾结构示意图形式的化学式。
34. 原子序数依次增大的A、B、C、D、E、F、G七种元素。其中A的原子有5种不同运动状态的电子;B的基态原子有3个不同的能级,各能级中的电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;E为它所在周期中原子半径最大的主族元素;F和D位于同一主族,G的原子序数为29。(1)、基态G原子的价电子排布式为。(2)、元素B、C的简单气态氢化物的沸点较高的是 (用化学式表示)。(3)、A晶体熔点为2300℃,则其为晶体。(4)、GD在加热条件下容易转化为G2D,从原子结构的角度解释原因。(5)、G与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸盐,为将生成的两种气体(气体相对分子质量均小于50)完全转化为最高价含氧酸盐,消耗了1molO2和1L2.2mol/LNaOH溶液。则两种气体的分子式及物质的量分别为 , 生成硫酸铜物质的量为。35. 三种常见元素结构信息如下表,试根据信息回答有关问题:元素
A
B
C
结构信息
基态原子核外有两个电子层,最外层有3个未成对电子
基态原子的M层有1对成对的p电子
基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价
(1)、写出B原子的基态电子排布式;(2)、用氢键表示式写出A的氢化物溶液中存在的氢键(任写一种);A的氢化物分子结合一个H+形成阳离子后,其键角(填写“变大”、“变小”、“不变”);(3)、往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 , 简要描述该配合物中化学键的成键情况;(4)、下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键.
在以上分子中,中心原子采用sp3杂化形成化学键是(填写序号);在②的分子中有个σ键和个π键
-