高考二轮复习知识点:化学键和分子间作用力的区别
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 一种钠盐的结晶水合物的阴离子由短周期元素X、Y、Z组成,其结构如图,已知:Z为第二周期元素,三种元素原子序数之和小于20,下列说法正确的是
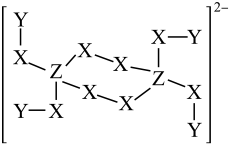 A、X、Y、Z三种元素中原子半径最大的是X B、NaZY4是一种强还原剂,其固体溶于水可产生Y2 C、Z原子的L层上有5个电子 D、X的氢化物中不可能存在非极性共价键2. 在“石蜡 →石蜡油 →石蜡气体→裂化气”的变化过程中,被破坏的作用力依次是A、范德华力、范德华力、范德华力 B、共价键、共价键、共价键 C、范德华力、共价键、共价键 D、范德华力、范德华力、共价键3. 下列变化过程中有化学键被破坏的是( )A、碘升华 B、浓硫酸稀释 C、蔗糖溶于水 D、浓盐酸稀释4. 下列说法错误的是( )A、淀粉和葡萄糖互为同系物 B、氨基酸能与酸、碱反应生成盐 C、乙醛和乙酸可用NaHCO3溶液进行鉴别 D、氢键是一种分子间作用力5. 下列过程只需要破坏共价键的是( )A、晶体硅熔化 B、碘升华 C、熔融Al2O3 D、NaCl溶于水6. 干冰气化过程中发生变化的是( )A、分子间作用力 B、分子内共价键的极性 C、分子内原子间距离 D、分子的空间构型7. 下列说法不正确的是( )A、CO2、SiO2的晶体结构类型不同 B、加热硅、硫晶体使之熔化,克服的作用力不同 C、HCl、NaCl溶于水,破坏的化学键类型相同 D、NaOH,NH4Cl晶体中既有离子键又有共价键8. 科学家将石墨在氟磺酸中“溶解”制得石墨烯(即单层石墨),该溶解克服了石墨层与层之间的( )A、范德华力 B、离子键 C、共价键 D、金属键9. 化学键是非常重要的概念,它与物质变化过程中的能量变化息息相关,下列说法正确的是A、氢键是化学键中的一种,会影响物质的熔沸点 B、活泼金属元素与活泼非金属元素一定形成离子键 C、速滑馆“冰丝带”用干冰作为制冷剂,干冰升华过程中破坏了共价键 D、物理变化也可以有化学键的破坏10. 下列说法正确的是A、HCl比H2S稳定是因为分子间作用力前者强于后者 B、BF3、SiCl4中,每个原子都满足8电子稳定结构 C、CaF2和NaH中的化学键类型完全相同 D、工业上用钠单质与TiCl4溶液反应制取钛单质11. 下列说法不正确的是( )A、HF比H2O稳定性更强,是由于HF分子间作用力较大 B、CCl4和N2分子晶体中各原子最外层都达到8电子稳定结构 C、Na投入到水中,有共价键的断裂与形成 D、离子化合物中一定含有离子键,可能含有共价键12. 下列说法正确的是( )A、CH4、CCl4都是含有极性键的极性分子 B、与NH3、H3O+的空间结构均为三角锥形 C、CS2、H2O、C2H2都是直线形分子 D、分子中共价键的键能越大,分子的熔、沸点越高13. 下列说法正确的是( )A、分子中键与键个数比为1∶1 B、的稳定性高,是因为水分子间存在氢键 C、键长等于成键两原子的半径之和 D、分子之间可能存在化学键14. 下列关于化学键的说法中,不正确的是( )A、化学反应过程包含反应物中化学键断裂和生成物中化学键形成 B、氯化氢气体溶解于水产生氢离子和氯离子的过程中有共价键被破坏 C、化学键是相邻原子或离子间强烈相互作用 D、氢键属于一种化学键15. 关于化学键的叙述中,下列说法正确的是( )A、化学键存在于相邻原子之间,也存在于相邻分子之间 B、NaHSO4固体中含有的阳离子与阴离子的个数比为1∶1 C、阴、阳离子间通过静电引力所形成的化学键是离子键 D、不同元素组成的多原子分子中的化学键一定全是极性键16. 下列变化需克服相同类型作用力的是( )A、碘和干冰的升华 B、硅和冰的熔化 C、氯化氢和氯化钾的溶解 D、溴和汞的气化17. 下列说法正确的是( )A、晶体溶于水时,离子键被破坏,共价键不受影响 B、氢化物稳定性比较:;酸性比较: C、的热稳定性小于 D、易分解是因为分子间作用力弱18. 随着科学技术的不断进步,研究物质的手段和途径越来越多,、、、等己被发现。下列有关说法中,正确的是( )A、与中存在氢键 B、与互为同位素 C、分子中有范德华力 D、1个中含有24个价电子19. 下列说法中正确的是:( )A、分子晶体中一定含有分子间作用力,可能有共价键 B、含有极性键的分子一定是极性分子 C、只要含有金属阳离子的晶体就一定是离子晶体 D、金属晶体的熔点一定比分子晶体的高20. 在下列各组物质中,化学键类型完全相同的是( )A、Cl2 和 CaCl2 B、H2O2 和 Na2O2 C、CO2 和 Ar D、NaCl 和 Na2O21. 下列说法正确的是( )A、由于H—O键比H—S键牢固,所以水的熔沸点比H2S高 B、HF的沸点在同族元素的氢化物中出现反常,是因为HF分子内存在氢键 C、F2、Cl2、Br2、I2熔沸点逐渐升高,是因为它们的组成结构相似,分子间的范德华力增大 D、氢氧化钠固体溶于水破坏了共价键22. 共价键、离子键和分子间作用力是微粒之间的三种作用力,现有晶体:① ;② ;③ ;④白磷(P4);⑤NaCl;⑥金刚石;⑦石墨。其中含有两种作用力的是( )A、①②④⑥ B、①②③⑥ C、②④⑤⑥ D、①③④⑦
A、X、Y、Z三种元素中原子半径最大的是X B、NaZY4是一种强还原剂,其固体溶于水可产生Y2 C、Z原子的L层上有5个电子 D、X的氢化物中不可能存在非极性共价键2. 在“石蜡 →石蜡油 →石蜡气体→裂化气”的变化过程中,被破坏的作用力依次是A、范德华力、范德华力、范德华力 B、共价键、共价键、共价键 C、范德华力、共价键、共价键 D、范德华力、范德华力、共价键3. 下列变化过程中有化学键被破坏的是( )A、碘升华 B、浓硫酸稀释 C、蔗糖溶于水 D、浓盐酸稀释4. 下列说法错误的是( )A、淀粉和葡萄糖互为同系物 B、氨基酸能与酸、碱反应生成盐 C、乙醛和乙酸可用NaHCO3溶液进行鉴别 D、氢键是一种分子间作用力5. 下列过程只需要破坏共价键的是( )A、晶体硅熔化 B、碘升华 C、熔融Al2O3 D、NaCl溶于水6. 干冰气化过程中发生变化的是( )A、分子间作用力 B、分子内共价键的极性 C、分子内原子间距离 D、分子的空间构型7. 下列说法不正确的是( )A、CO2、SiO2的晶体结构类型不同 B、加热硅、硫晶体使之熔化,克服的作用力不同 C、HCl、NaCl溶于水,破坏的化学键类型相同 D、NaOH,NH4Cl晶体中既有离子键又有共价键8. 科学家将石墨在氟磺酸中“溶解”制得石墨烯(即单层石墨),该溶解克服了石墨层与层之间的( )A、范德华力 B、离子键 C、共价键 D、金属键9. 化学键是非常重要的概念,它与物质变化过程中的能量变化息息相关,下列说法正确的是A、氢键是化学键中的一种,会影响物质的熔沸点 B、活泼金属元素与活泼非金属元素一定形成离子键 C、速滑馆“冰丝带”用干冰作为制冷剂,干冰升华过程中破坏了共价键 D、物理变化也可以有化学键的破坏10. 下列说法正确的是A、HCl比H2S稳定是因为分子间作用力前者强于后者 B、BF3、SiCl4中,每个原子都满足8电子稳定结构 C、CaF2和NaH中的化学键类型完全相同 D、工业上用钠单质与TiCl4溶液反应制取钛单质11. 下列说法不正确的是( )A、HF比H2O稳定性更强,是由于HF分子间作用力较大 B、CCl4和N2分子晶体中各原子最外层都达到8电子稳定结构 C、Na投入到水中,有共价键的断裂与形成 D、离子化合物中一定含有离子键,可能含有共价键12. 下列说法正确的是( )A、CH4、CCl4都是含有极性键的极性分子 B、与NH3、H3O+的空间结构均为三角锥形 C、CS2、H2O、C2H2都是直线形分子 D、分子中共价键的键能越大,分子的熔、沸点越高13. 下列说法正确的是( )A、分子中键与键个数比为1∶1 B、的稳定性高,是因为水分子间存在氢键 C、键长等于成键两原子的半径之和 D、分子之间可能存在化学键14. 下列关于化学键的说法中,不正确的是( )A、化学反应过程包含反应物中化学键断裂和生成物中化学键形成 B、氯化氢气体溶解于水产生氢离子和氯离子的过程中有共价键被破坏 C、化学键是相邻原子或离子间强烈相互作用 D、氢键属于一种化学键15. 关于化学键的叙述中,下列说法正确的是( )A、化学键存在于相邻原子之间,也存在于相邻分子之间 B、NaHSO4固体中含有的阳离子与阴离子的个数比为1∶1 C、阴、阳离子间通过静电引力所形成的化学键是离子键 D、不同元素组成的多原子分子中的化学键一定全是极性键16. 下列变化需克服相同类型作用力的是( )A、碘和干冰的升华 B、硅和冰的熔化 C、氯化氢和氯化钾的溶解 D、溴和汞的气化17. 下列说法正确的是( )A、晶体溶于水时,离子键被破坏,共价键不受影响 B、氢化物稳定性比较:;酸性比较: C、的热稳定性小于 D、易分解是因为分子间作用力弱18. 随着科学技术的不断进步,研究物质的手段和途径越来越多,、、、等己被发现。下列有关说法中,正确的是( )A、与中存在氢键 B、与互为同位素 C、分子中有范德华力 D、1个中含有24个价电子19. 下列说法中正确的是:( )A、分子晶体中一定含有分子间作用力,可能有共价键 B、含有极性键的分子一定是极性分子 C、只要含有金属阳离子的晶体就一定是离子晶体 D、金属晶体的熔点一定比分子晶体的高20. 在下列各组物质中,化学键类型完全相同的是( )A、Cl2 和 CaCl2 B、H2O2 和 Na2O2 C、CO2 和 Ar D、NaCl 和 Na2O21. 下列说法正确的是( )A、由于H—O键比H—S键牢固,所以水的熔沸点比H2S高 B、HF的沸点在同族元素的氢化物中出现反常,是因为HF分子内存在氢键 C、F2、Cl2、Br2、I2熔沸点逐渐升高,是因为它们的组成结构相似,分子间的范德华力增大 D、氢氧化钠固体溶于水破坏了共价键22. 共价键、离子键和分子间作用力是微粒之间的三种作用力,现有晶体:① ;② ;③ ;④白磷(P4);⑤NaCl;⑥金刚石;⑦石墨。其中含有两种作用力的是( )A、①②④⑥ B、①②③⑥ C、②④⑤⑥ D、①③④⑦二、非选择题
-
23. 聚合物锂离子电池具有超薄化特征,适用于多种设备,电极材料涵盖、、、等物质。(1)、磷酸为磷的最高价含氧酸,其空间结构如图:

①键角大小比较:(填“大于”“等于”或“小于”)。
②纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是。
(2)、聚合物锂离子电池工作时,沿聚乙二醇分子中的碳氧链迁移,过程如图所示(图中阴离子未画出)。
①迁移过程中与聚乙二醇分子中O原子间的作用力为(填标号)。
a.分子间作用力 b.离子键 c.共价键
②的阴离子的空间构型为;基态As原子的最高能级组轨道排布式为。
(3)、二茂镍 是具有导电性的有机配合物。镍在周期表中的位置是(填写对应周期、族)。x个原子共用y个电子可表示为 , 则环戊二烯离子中的大键可表示为。 (4)、图1为NiO晶胞,与距离最近的有个。
是具有导电性的有机配合物。镍在周期表中的位置是(填写对应周期、族)。x个原子共用y个电子可表示为 , 则环戊二烯离子中的大键可表示为。 (4)、图1为NiO晶胞,与距离最近的有个。
一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为作密置单层排列,填充其中(如图2),该“单分子层”面积密度为 , 则的半径为nm。(用m、表示)
24. 近日,复旦大学、北京大学和上海电力大学等的研究团队共同报道了一种新型NASICON相铁基磷酸盐负极材料Na3Fe2(PO4)P2O7。回答下列问题:(1)、基态Fe2+的价电子排布式为。(2)、Na3Fe2(PO4)P2O7中PO 的空间构型为 , 研究表明,该负极材料发生反应:Na3Fe2(PO4)P2O7-e-=Na2Fe2(PO4)P2O7+Na+ , Na2Fe2(PO4)P2O7-e-=NaFe2(PO4)P2O7+Na+。指出Na2Fe2(PO4)P2O7中Fe2+:Fe3+=。(3)、K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。①铁氰化钾中不存在的作用力有(填标号)。
a.离子键 b.极性键 c.非极性键 d.π键 e.配位键 f.氢键
②1mol[Fe(CN)6]3-中含有的σ键数目为(设NA为阿伏加德罗常数的值)。
(4)、NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的半径分别为6.9×10-2nm和7.8×10-2nm,则熔点:NiO(填“<”、“=”或“>”)FeO,试说明判断理由。(5)、一种铁氮化合物具有高磁导率,密度为ρg·cm-3 , 其结构如图所示:
①该铁氮化合物的化学式为。
②计算Fe(Ⅱ)构成正八面体的体积为cm3。
25. 海洋是元素的摇篮,海水中含有的大量元素在生产、生活、科学研究等多方面具有重要作用。回答下列问题。(1)、写出基态溴原子的价电子排布式 , 氟、氯、溴、氧四种元素中,电负性由大到小的顺序为(填元素符号) 。(2)、Mg、Al的氟化物晶格能分别是2957 kJ•mol-1、5492 kJ•mol-1 , 二者相差很大的原因是。(3)、X射线衍射测定等发现,I3AsF6 中存在I 离子。I 离子的几何构型为 , 中心原子的杂化类型为。(4)、C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上。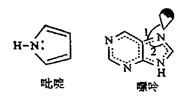
①1mol吡啶分子中含有σ键数目是NA。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因。
③分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为。
(5)、CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示: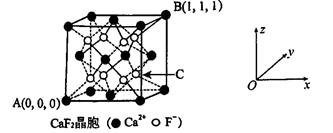
①“ 原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为( , , )
②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA , 则其密度为g•cm-3 (列出计算式即可) 。
26. 【选修三:物质结构与性质】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:(1)、在周期表中,与Li的化学性质最相似的邻族元素是 , 该元素基态原子核外M层电子的自旋状态(填“相同”或“相反”)。(2)、FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为 , 其中Fe的配位数为。(3)、苯胺 )的晶体类型是。苯胺与甲苯(
)的晶体类型是。苯胺与甲苯(  )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是。 (4)、NH4H2PO4中,电负性最高的元素是;P的杂化轨道与O的2p轨道形成键。(5)、NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是。 (4)、NH4H2PO4中,电负性最高的元素是;P的杂化轨道与O的2p轨道形成键。(5)、NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示: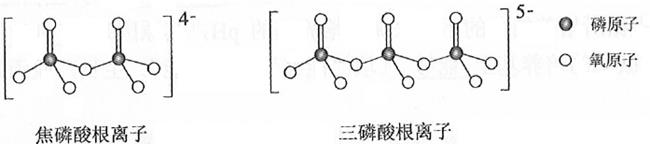
这类磷酸根离子的化学式可用通式表示为(用n代表P原子数)。
27. 【化学———选修 3:物质结构与性质】黑磷是磷的一种稳定的同素异形体,黑磷具有正交晶系的晶体结构(图 A),晶胞参数a=3.310A。b=4.380A。c=10.500A。黑磷烯是二维的单层黑磷(图 B),黑磷烯与石墨烯结构相似,P的配位数为 3。与石墨烯相比,黑磷烯具有半导体性质,更适合于制作电子器件。已知黑磷结构中只有一种等效的三配位 P,所有 P原子的成键环境一样,图 A中编 号为①的 P原子的晶胞内坐标为(0.500,0.090,0.598)。请回答下列问题:
 (1)、写出 P原子的基态电子排布:
(1)、写出 P原子的基态电子排布: (2)、P和 F的电负性大小顺序是 x(P)x(F)。(填 “ <” “ =” 或 “ >” )P和 F形成的分子 PF3和 PF5 , 它们的几何构型分别为、。(3)、①黑磷中 P原子杂化类型是。黑磷中不存在(选填字母序号)。
(2)、P和 F的电负性大小顺序是 x(P)x(F)。(填 “ <” “ =” 或 “ >” )P和 F形成的分子 PF3和 PF5 , 它们的几何构型分别为、。(3)、①黑磷中 P原子杂化类型是。黑磷中不存在(选填字母序号)。A.共价键 B.σ键 C.π键 D.范德华力
②红磷、白磷与黑磷熔点从高到低的顺序为 , 原因是。
(4)、图 A中编号为②的 P原子的晶胞内坐标为 , 黑磷的晶胞中含有个 P原子。28. 选择下列物质填空(填写序号):①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤氯化钙 ⑥过氧化钠⑦石英 ⑧石墨 ⑨氯化铵 ⑩铜晶体(1)、固态时能导电的有(2)、熔化时不破坏化学键的有(3)、含有配位键的有(4)、含有非极性共价键的有29.(1)、CH3COONa溶液呈碱性,用离子方程式表示其原因。(2)、KSCN是离子化合物,各原子都达到8电子稳定结构,则其电子式为。(3)、石英比干冰熔点高的主要原因是。30. 在下列变化中:①I2升华 ②烧碱熔化 ③NaCl溶于水
④HCl溶于水 ⑤O2溶于水...⑥Na2O2溶于水。(1)、未破坏化学键的是(填序号,下同);(2)、仅离子鍵被破坏的是 ;(3)、仅共价键破破坏的是;(4)、离子键和共价键同时被破坏的是。31. 向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。(Ⅰ)在化学实验和科学研究中,水是一种最常用的溶剂。水是生命之源,它与我们的生活密切相关。
(1)、写出与 分子互为等电子体的微粒(填1种)。(2)、水分子在特定条件下容易得到一个 ,形成水合氢离子( )。下列对上述过程的描述不合理的是__________________。A、氧原子的杂化类型发生了改变 B、微粒的形状发生了改变 C、微粒的化学性质发生了改变 D、微粒中的键角发生了改变(3)、 分子内的O-H键、分子间的范德华力和氢键从强到弱依次为(4)、(Ⅱ)胆矾晶体是配制波尔多液的主要原料,波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上。写出铜原子价电子层的电子排布式 , 与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有 (填元素符号)。
(5)、向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;以上过程中发生的离子反应方程式为:;。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有。
(6)、实验过程中加入 后可观察到析出深蓝色 晶体。实验中所加 的作用是32.(1)、如图所示为冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,是图中●、○中的一种。图中●、○分别指代哪种粒子; (2)、H2S和H2O2的主要物理性质比较如下:
(2)、H2S和H2O2的主要物理性质比较如下:熔点/K
沸点/K
标准状况时在水中的溶解度
H2S
187
202
2.6
H2O2
272
423
以任意比互溶
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因。
(3)、向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。与铜同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有(填元素符号)。实验时形成的深蓝色溶液中的阳离子内存在的全部化学键类型有。实验过程中加入C2H5OH后可观察到析出深蓝色Cu(NH3)4SO4H2O晶体。实验中所加C2H5OH的作用是。33.(1)、氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取杂化,NH4+中HNH键角比NH3中HNH键角大,原因是。(2)、Cu3N形成的晶体结构如图所示,N3-的配位数是。 (3)、常温常压下,给水施加一个弱电场便可形成冰,称之为“热冰”,热冰中微粒间存在的作用力有 , 其大小顺序是。(4)、NaF和NaCl属于同一主族的钠盐,但NaF的莫氏硬度比NaCl大,原因是。
(3)、常温常压下,给水施加一个弱电场便可形成冰,称之为“热冰”,热冰中微粒间存在的作用力有 , 其大小顺序是。(4)、NaF和NaCl属于同一主族的钠盐,但NaF的莫氏硬度比NaCl大,原因是。