高考二轮复习知识点:分子间作用力
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 在“石蜡 →石蜡油 →石蜡气体→裂化气”的变化过程中,被破坏的作用力依次是A、范德华力、范德华力、范德华力 B、共价键、共价键、共价键 C、范德华力、共价键、共价键 D、范德华力、范德华力、共价键2. 某小组用温度传感器探究液态物质挥发过程中体系温度变化的大小和快慢。如图a连接装置,将滤纸固定于温度传感器测量端,并插入待测液中使滤纸吸附待测液,待温度示数稳定后,开始采集数据,约10s后取出温度传感器置于空气中放置,采集到的温度变化如图b、图c所示。下列说法错误的是:( )

 A、由图b,分子间作用力越弱,气化速率越快 B、由图c,正丁醇气化温差小于乙醚,是因为正丁醇更稳定 C、由图d,X的相对分子量可能小于Y D、由图d,X、Y可以分别为正己烷、正戊烷3. 一般情况下,前者无法决定后者的是( )A、分子间作用力的大小——分子的稳定性 B、原子的质子数——元素的种类 C、原子核外电子排布——主族元素在周期表中的位置 D、物质内部储存的能量——化学反应的热效应4. 在“ 和 ”的变化过程中,被破坏的作用力依次是()A、范德华力、范德华力 B、范德华力、共价键 C、共价键、离子键 D、共价键、共价键5. 干冰气化过程中发生变化的是( )A、分子间作用力 B、分子内共价键的极性 C、分子内原子间距离 D、分子的空间构型6. 化学键是非常重要的概念,它与物质变化过程中的能量变化息息相关,下列说法正确的是A、氢键是化学键中的一种,会影响物质的熔沸点 B、活泼金属元素与活泼非金属元素一定形成离子键 C、速滑馆“冰丝带”用干冰作为制冷剂,干冰升华过程中破坏了共价键 D、物理变化也可以有化学键的破坏7. 下列说法正确的是A、和都是正四面体分子且键角都为 B、比稳定是由于分子之间存在氢键 C、乙醇分子与水分子之间只存在范德华力 D、氯的各种含氧酸的酸性由弱到强排列为8. 干冰(固态二氧化碳)在-78℃时可直接升华为气体,其晶胞结构如下图所示。下列说法错误的是( )
A、由图b,分子间作用力越弱,气化速率越快 B、由图c,正丁醇气化温差小于乙醚,是因为正丁醇更稳定 C、由图d,X的相对分子量可能小于Y D、由图d,X、Y可以分别为正己烷、正戊烷3. 一般情况下,前者无法决定后者的是( )A、分子间作用力的大小——分子的稳定性 B、原子的质子数——元素的种类 C、原子核外电子排布——主族元素在周期表中的位置 D、物质内部储存的能量——化学反应的热效应4. 在“ 和 ”的变化过程中,被破坏的作用力依次是()A、范德华力、范德华力 B、范德华力、共价键 C、共价键、离子键 D、共价键、共价键5. 干冰气化过程中发生变化的是( )A、分子间作用力 B、分子内共价键的极性 C、分子内原子间距离 D、分子的空间构型6. 化学键是非常重要的概念,它与物质变化过程中的能量变化息息相关,下列说法正确的是A、氢键是化学键中的一种,会影响物质的熔沸点 B、活泼金属元素与活泼非金属元素一定形成离子键 C、速滑馆“冰丝带”用干冰作为制冷剂,干冰升华过程中破坏了共价键 D、物理变化也可以有化学键的破坏7. 下列说法正确的是A、和都是正四面体分子且键角都为 B、比稳定是由于分子之间存在氢键 C、乙醇分子与水分子之间只存在范德华力 D、氯的各种含氧酸的酸性由弱到强排列为8. 干冰(固态二氧化碳)在-78℃时可直接升华为气体,其晶胞结构如下图所示。下列说法错误的是( ) A、二氧化碳晶体是共价晶体 B、每个晶胞中含有4个分子 C、分子的空间结构为直线形 D、干冰升华时需克服分子间作用力9. 下列两组命题中,M组命题能用N组命题加以解释的是( )
A、二氧化碳晶体是共价晶体 B、每个晶胞中含有4个分子 C、分子的空间结构为直线形 D、干冰升华时需克服分子间作用力9. 下列两组命题中,M组命题能用N组命题加以解释的是( )选项
M组
N组
A
酸性强弱:三氟乙酸>三氯乙酸
F的电负性大于Cl的电负性,导致三氟乙酸羧基中的羟基的极性更大
B
 的沸点高于
的沸点高于
因为
 分子间范德华力更大
分子间范德华力更大C
的稳定性大于
的分子间作用力更大
D
HI的沸点比HCl的高
H-I键的键能大于H-Cl键的键能
A、A B、B C、C D、D10. 随着温度的升高,水从固态融化成液态,再蒸发成气态,最终分解成氢气和氧气,如图所示,这个过程中主要克服的作用力依次是( )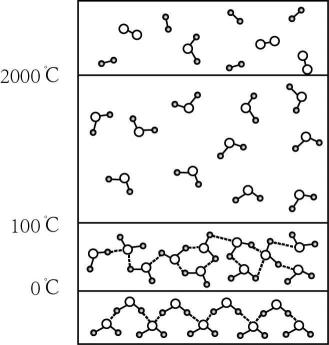 A、分子间作用力 分子间作用力、氢键 极性共价键 B、氢键 氢键、分子间作用力 极性共价键 C、分子间作用力 分子间作用力、氢键 非极性共价键 D、氢键 氢键、分子间作用力 非极性共价键11. 离子键、共价键、和分子间作用力是微粒之间的不同作用力。下列物质中只含有上述一种作用力的是( )A、冰 B、碘单质 C、氢氧化钠 D、氯化钠12. 下列说法正确的是( )A、的相对分子质量比大,分子间作用力也大 B、晶体中所含的化学键只有离子键 C、、、熔沸点依次增大 D、硫酸氢钠溶于水只破坏了离子键13. 下列说法正确的是( )A、冰融化时,分子中有H-O键发生断裂 B、卤化物CX4(X代表卤族元素)中,从F到I,分子间作用力逐渐增大,它们的熔沸点也逐渐升高 C、由于H-O键比H-S键牢固,所以水的熔沸点比H2S高 D、在由分子所构成的物质中,分子间作用力越大,该物质越稳定14. 有关物质结构的下列说法中正确的是( )A、碘升华时破坏了共价键 B、氯化钠固体中的离子键在溶于水时被破坏 C、含极性键共价化合物一定是电解质 D、HF分子间作用力大于HCl,故HF比HCl稳定15. 以下关于分子间作用力的叙述错误的是( )A、是一种较弱的化学键 B、分子间作用力较弱,破坏它所需能量较少 C、分子间作用力对物质的熔、沸点有影响 D、稀有气体原子间存在分子间作用力16. 下列说法正确的是( )A、晶体溶于水时,离子键被破坏,共价键不受影响 B、氢化物稳定性比较:;酸性比较: C、的热稳定性小于 D、易分解是因为分子间作用力弱17. 下列叙述不正确的是( )A、CO2和N2分子中所有原子都满足最外层8电子稳定结构 B、F2、Cl2、Br2、I2的熔点依次升高,与它们的分子间作用力依次增大有关 C、HCl溶于水的过程中克服了共价键 D、CaCl2和Ca(OH)2中化学键类型完全相同18. 下列说法正确的有几句( )
A、分子间作用力 分子间作用力、氢键 极性共价键 B、氢键 氢键、分子间作用力 极性共价键 C、分子间作用力 分子间作用力、氢键 非极性共价键 D、氢键 氢键、分子间作用力 非极性共价键11. 离子键、共价键、和分子间作用力是微粒之间的不同作用力。下列物质中只含有上述一种作用力的是( )A、冰 B、碘单质 C、氢氧化钠 D、氯化钠12. 下列说法正确的是( )A、的相对分子质量比大,分子间作用力也大 B、晶体中所含的化学键只有离子键 C、、、熔沸点依次增大 D、硫酸氢钠溶于水只破坏了离子键13. 下列说法正确的是( )A、冰融化时,分子中有H-O键发生断裂 B、卤化物CX4(X代表卤族元素)中,从F到I,分子间作用力逐渐增大,它们的熔沸点也逐渐升高 C、由于H-O键比H-S键牢固,所以水的熔沸点比H2S高 D、在由分子所构成的物质中,分子间作用力越大,该物质越稳定14. 有关物质结构的下列说法中正确的是( )A、碘升华时破坏了共价键 B、氯化钠固体中的离子键在溶于水时被破坏 C、含极性键共价化合物一定是电解质 D、HF分子间作用力大于HCl,故HF比HCl稳定15. 以下关于分子间作用力的叙述错误的是( )A、是一种较弱的化学键 B、分子间作用力较弱,破坏它所需能量较少 C、分子间作用力对物质的熔、沸点有影响 D、稀有气体原子间存在分子间作用力16. 下列说法正确的是( )A、晶体溶于水时,离子键被破坏,共价键不受影响 B、氢化物稳定性比较:;酸性比较: C、的热稳定性小于 D、易分解是因为分子间作用力弱17. 下列叙述不正确的是( )A、CO2和N2分子中所有原子都满足最外层8电子稳定结构 B、F2、Cl2、Br2、I2的熔点依次升高,与它们的分子间作用力依次增大有关 C、HCl溶于水的过程中克服了共价键 D、CaCl2和Ca(OH)2中化学键类型完全相同18. 下列说法正确的有几句( )①离子键与共价键的本质都是静电作用 ②任何物质中都存在化学键 ③氢键是极弱的化学键 ④离子键就是阴、阳离子之间的静电吸引力 ⑤活泼金属与活泼非金属化合时能形成离子键 ⑥任何共价键中,成键原子成键后均满足稳定结构 ⑦验证化合物是否为离子化合物的实验方法是可以看其熔化状态下能否导电 ⑧两种非金属元素形成的化合物不可能含有离子键 ⑨化学键断裂,一定发生化学变化
A、1 B、2 C、3 D、419. 下列说法正确的是( )A、冰熔化时,分子中化学键发生断裂 B、HF、HCl、HBr、HI的热稳定性依次减弱与氢键无关 C、非极性键不可能存在于离子化合物中,由非金属元素组成的化合物中一定不存在离子键 D、NaCl、HCl两种物质在水溶液中都能电离出两种离子,所以都属于离子化合物20. X、Y、Z、W为原子序数依次增大的四种短周期元素,b、a、d、c为上述四种元素形成的单质,m、n、p为四种元素形成的二元化合物,其转化关系如图所示。W与同周期原子半径最大的元素组成的化合物溶液呈中性,n为一种传递神经信息的“信使分子”。下列说法错误的是( ) A、a的熔点比d的熔点低 B、Y、Z、W的简单离子半径大小顺序为:Y<Z<W C、X、Z组成的分子可能既含有极性键,又含有非极性键 D、在工业上c可大量用于制造有机溶剂和杀菌消毒剂21. 下列说法错误的是( )A、HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关 B、C,Si和Ge的最外层电子数都是4,次外层电子数都是8 C、CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 D、白酒中,乙醇分子和水分子间存在范德华力和氢键22. 下列各组物质发生的变化中,所克服的微粒间的作用力属同种类型的是( )A、蔗糖和食盐溶于水 B、碘和干冰的升华 C、金刚石和冰的熔融 D、石英和生石灰的熔化23. 下列物质①乙烷 ②丙烷 ③乙醇,沸点由高到低的顺序正确的是( )A、①>②>③ B、②>①>③ C、③>②>① D、③>①>②24. 共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体中,含有以上两种作用力的是( )
A、a的熔点比d的熔点低 B、Y、Z、W的简单离子半径大小顺序为:Y<Z<W C、X、Z组成的分子可能既含有极性键,又含有非极性键 D、在工业上c可大量用于制造有机溶剂和杀菌消毒剂21. 下列说法错误的是( )A、HCl、HBr、HI的熔、沸点依次升高与分子间作用力大小有关 B、C,Si和Ge的最外层电子数都是4,次外层电子数都是8 C、CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 D、白酒中,乙醇分子和水分子间存在范德华力和氢键22. 下列各组物质发生的变化中,所克服的微粒间的作用力属同种类型的是( )A、蔗糖和食盐溶于水 B、碘和干冰的升华 C、金刚石和冰的熔融 D、石英和生石灰的熔化23. 下列物质①乙烷 ②丙烷 ③乙醇,沸点由高到低的顺序正确的是( )A、①>②>③ B、②>①>③ C、③>②>① D、③>①>②24. 共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体中,含有以上两种作用力的是( )①氦 ② ③ ④钠 ⑤石墨 ⑥
A、①②③ B、③⑤⑥ C、②③⑤ D、①④⑥25. 的分子结构与 相似,如下图所示。下列有关说法错误的是( ) A、 是极性分子 B、 分子中所有原子均满足8电子稳定结构 C、 分子中既含有极性键又含有非极性键 D、 的相对分子质量比 大,熔、沸点高
A、 是极性分子 B、 分子中所有原子均满足8电子稳定结构 C、 分子中既含有极性键又含有非极性键 D、 的相对分子质量比 大,熔、沸点高二、非选择题
-
26. 将酞菁—钴钛—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:(1)、图1所示的几种碳单质,它们互为 , 其中属于原子晶体的是 , 间的作用力是。
 (2)、酞菁和钴酞菁的分子结构如图2所示。
(2)、酞菁和钴酞菁的分子结构如图2所示。
酞菁分子中所有原子共平面,其中轨道能提供一对电子的原子是(填图2酞菁中原子的标号)。钴酞菁分子中,钴离子的化合价为 , 氮原子提供孤对电子与钴离子形成键。
(3)、气态通常以二聚体的形式存在,其空间结构如图3a所示,二聚体中的轨道杂化类型为。的熔点为 , 远高于的 , 由此可以判断铝氟之间的化学键为键。结构属立方晶系,晶胞如图3b所示,的配位数为。若晶胞参数为 , 晶体密度(列出计算式,阿伏加德罗常数的值为)。 27. 选择下列物质填空(填写序号):①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤氯化钙 ⑥过氧化钠⑦石英 ⑧石墨 ⑨氯化铵 ⑩铜晶体(1)、固态时能导电的有(2)、熔化时不破坏化学键的有(3)、含有配位键的有(4)、含有非极性共价键的有28. 完成下列问题:法匹拉韦是治疗新冠肺炎的一种药物,结构简式如图。
27. 选择下列物质填空(填写序号):①金刚石 ②干冰 ③氩晶体 ④白磷 ⑤氯化钙 ⑥过氧化钠⑦石英 ⑧石墨 ⑨氯化铵 ⑩铜晶体(1)、固态时能导电的有(2)、熔化时不破坏化学键的有(3)、含有配位键的有(4)、含有非极性共价键的有28. 完成下列问题:法匹拉韦是治疗新冠肺炎的一种药物,结构简式如图。 (1)、该药物分子中,电负性最大的元素是。(2)、该分子的所有原子(填“是”或“否”)共平面。(3)、分子中氧原子参与形成键(填“极性”或“非极性”)(4)、C、N、O、F四种元素的简单氢化物中沸点最低的是(填化学式)。29. 三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到。(1)、NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是。(2)、根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:
(1)、该药物分子中,电负性最大的元素是。(2)、该分子的所有原子(填“是”或“否”)共平面。(3)、分子中氧原子参与形成键(填“极性”或“非极性”)(4)、C、N、O、F四种元素的简单氢化物中沸点最低的是(填化学式)。29. 三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129℃;可在铜的催化作用下由F2和过量NH3反应得到。(1)、NF3的沸点比NH3的沸点(-33℃)低得多的主要原因是。(2)、根据下列五种元素的第一至第四电离能数据(单位:kJ·mol-1),回答下面各题:元素代号
I1
I2
I3
I4
Q
2080
4000
6100
9400
R
500
4600
6900
9500
S
740
1500
7700
10500
T
580
1800
2700
11600
U
420
3100
4400
5900
①在周期表中,最可能处于同一族的是。
②T元素最可能是区元素。若T为第二周期元素,F是第三周期元素中原子半径最小的元素,则T、F形成化合物的空间构型为 , 其中心原子的杂化方式为。
30. 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。(1)、认识元素周期表的结构:
①在元素周期表中,第ⅠB、ⅡB元素属于区。
②2017年5月9日我国发布了113号Nh、115号Mc、117号Ts、118号Og四种元素的中文名称,分别为“
 (nǐ)”“镆(mò)”“
(nǐ)”“镆(mò)”“  (tián)”“
(tián)”“  (ào)”,则下列说法正确的是(填字母序号)。
(ào)”,则下列说法正确的是(填字母序号)。a.115号元素在周期表中的位置是第七周期VB族
b.117号元素Ts位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:Nh>Mc
(2)、认识原子结构与元素周期表的关系:见表中元素G的信息,其中“3d64s2”称为该元素原子的 , 该元素M能层上具有种不同运动状态的电子。(3)、认识元素周期律及其应用:①第三周期元素的第一电离能:DE(填“>”“<”或“=”)。
②气态氢化物的沸点:BF(填“>”“<”或“=”),理由是。
31. 已知A、B、C、D、E是原子序数依次增大的前30号元素,A元素形成的一种微粒是最简单的原子,B元素基态原子的核外有3个能级,每个能级上的电子数都相同;D的最外层电子数与能层数之比为3:1;E是第四周期元素,最外层只有一个电子,其余各层电子均充满。回答下列问题(用元素符号或化学式表示):(1)、E在元素周期表中位于区。(2)、B、C、D的原子半径由大到小的顺序为(填元素符号),A分别与B、C、D能形成10电子的化合物,它们的沸点由高到低的顺序是(填分子式)。(3)、C2A4在碱性溶液中能够将ED还原为E2D。C2A4分子中C的杂化方式是 , 由C元素原子组成的单质分子(C2)中含个π键,与单质分子(C2)互为等电子体的分子有。32.(1)、元素的第一电离能:AlSi(填“>”或“<”)。(2)、基态Mn2+的核外电子排布式为。(3)、硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是。 (4)、硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示
(4)、硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示
①在Xm-中,硼原子轨道的杂化类型有;配位键存在于原子之间(填原子的数字标号);m= (填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
33.(1)、元素的第一电离能:AlSi(填“>”或“<”),按电负性由大到小的顺序排列N、O、F。(2)、基态Mn2+的核外电子排布式为。(3)、硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是。 (4)、硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
(4)、硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:
①在Xm-中,硼原子轨道的杂化类型有;配位键存在于原子之间(填原子的数字标号)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力E.氢键