高考二轮复习知识点:原子轨道杂化方式及杂化类型判断5
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 有机物a、b、c的结构如图。下列说法正确的是( )
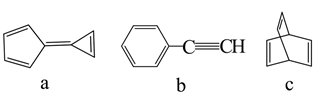 A、a的一氯代物有3种 B、b是
A、a的一氯代物有3种 B、b是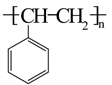 的单体
C、c中碳原子的杂化方式均为
D、a、b、c互为同分异构体
2. 关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( )A、CH3OH为极性分子 B、N2H4空间结构为平面形 C、N2H4的沸点高于(CH3)2NNH2 D、CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同3. 某些醇和羧酸发生酯化反应过程如图,下列说法正确的是( )
的单体
C、c中碳原子的杂化方式均为
D、a、b、c互为同分异构体
2. 关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( )A、CH3OH为极性分子 B、N2H4空间结构为平面形 C、N2H4的沸点高于(CH3)2NNH2 D、CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同3. 某些醇和羧酸发生酯化反应过程如图,下列说法正确的是( ) A、该反应历程中,羧基碳原子存在sp2、sp3杂化方式的转化 B、用同位素标记的C2H518OH与CH3COOH反应,18O同时出现在酯和水中 C、酯化反应中加入浓硫酸,能够改变反应历程,但不能提高反应物转化率 D、选择合适的催化剂,可以使反应物实现100%转化4. 在党的领导下,新中国成立后,我国航天事业从无到有,举世瞩目。以下说法错误的是( )
A、该反应历程中,羧基碳原子存在sp2、sp3杂化方式的转化 B、用同位素标记的C2H518OH与CH3COOH反应,18O同时出现在酯和水中 C、酯化反应中加入浓硫酸,能够改变反应历程,但不能提高反应物转化率 D、选择合适的催化剂,可以使反应物实现100%转化4. 在党的领导下,新中国成立后,我国航天事业从无到有,举世瞩目。以下说法错误的是( ) A、1970年我国发射的第一颗人造地球卫星“东方红一号”采用银锌电池供电,锌做电池的负极 B、2003年“神舟五号”载人飞船遨游太空,飞船燃料偏二甲肼(CH3)2NNH2中C、N原子杂化方式相同 C、2007年“嫦娥一号”探月卫星任务之一是探测月球上3He含量及分布。3He与4He互为同素异形体 D、2021年“天问一号”探测器成功着陆火星,它搭载了新型纳米气凝胶做热控材料,气凝胶的分散剂是气体5. 分子人工光合作用”的光捕获原理如图所示,WOC1是水氧化催化剂WOC在水氧化过程中产生的中间体,HEC1是析氢催化剂HEC在析氢过程中产生的中间体。下列说法错误的是( )
A、1970年我国发射的第一颗人造地球卫星“东方红一号”采用银锌电池供电,锌做电池的负极 B、2003年“神舟五号”载人飞船遨游太空,飞船燃料偏二甲肼(CH3)2NNH2中C、N原子杂化方式相同 C、2007年“嫦娥一号”探月卫星任务之一是探测月球上3He含量及分布。3He与4He互为同素异形体 D、2021年“天问一号”探测器成功着陆火星,它搭载了新型纳米气凝胶做热控材料,气凝胶的分散剂是气体5. 分子人工光合作用”的光捕获原理如图所示,WOC1是水氧化催化剂WOC在水氧化过程中产生的中间体,HEC1是析氢催化剂HEC在析氢过程中产生的中间体。下列说法错误的是( ) A、“分子人工光合作用”将H2O分解为H2和O2 , 将光能以化学能的形式储存在H2、O2中 B、1 mol WOC1中通过螯合作用形成的配位键有8 mol,其中N原子的杂化方式均为sp2 C、水氧化过程的反应为: D、HEC1里面的H…H作用为静电排斥作用6. 近年来,光催化剂的研究是材料领域的热点方向。一种Ru络合物(如图所示)复合光催化剂可将CO2转化为HCOOH。下列说法错误的是( )
A、“分子人工光合作用”将H2O分解为H2和O2 , 将光能以化学能的形式储存在H2、O2中 B、1 mol WOC1中通过螯合作用形成的配位键有8 mol,其中N原子的杂化方式均为sp2 C、水氧化过程的反应为: D、HEC1里面的H…H作用为静电排斥作用6. 近年来,光催化剂的研究是材料领域的热点方向。一种Ru络合物(如图所示)复合光催化剂可将CO2转化为HCOOH。下列说法错误的是( ) A、Ru络合物中第二周期元素的电负性由大到小的顺序为O>N>C B、如图结构的吡啶环(
A、Ru络合物中第二周期元素的电负性由大到小的顺序为O>N>C B、如图结构的吡啶环( )中C,N原子的杂化方式均为sp2
C、吡啶(
)中C,N原子的杂化方式均为sp2
C、吡啶(  )与水可形成氢键,故易溶于水
D、HCOOH的沸点比HCHO高,主要因为HCOOH相对分子质量大于HCHO
7. Cu-ZnO-ZrO2可催化CO2加氢制备甲醇,反应过程如图所示(其中吸附在催化剂表面的物种用*标注)。下列说法错误的是( )
)与水可形成氢键,故易溶于水
D、HCOOH的沸点比HCHO高,主要因为HCOOH相对分子质量大于HCHO
7. Cu-ZnO-ZrO2可催化CO2加氢制备甲醇,反应过程如图所示(其中吸附在催化剂表面的物种用*标注)。下列说法错误的是( ) A、H2O参与了该催化循环 B、存在反应*H3CO-+H2O=CH3OH+*HO- C、CO2与CH3OH分子中碳原子的轨道杂化类型分别为sp2和sp3 D、该催化循环中生成了有毒气体CO8. 下列说法中错误的是( )A、 离子中心原子上的孤电子对数是1,立体构型为平面三角形 B、元素周期表第三周期主族元素中,简单离子半径最小的是 C、金刚石转化为石墨为放热反应,说明相同条件下石墨比金刚石稳定 D、 、 都是非极性分子9. 关于 中的相关微粒,下列化学用语表示正确的是( )A、 的结构示意图:
A、H2O参与了该催化循环 B、存在反应*H3CO-+H2O=CH3OH+*HO- C、CO2与CH3OH分子中碳原子的轨道杂化类型分别为sp2和sp3 D、该催化循环中生成了有毒气体CO8. 下列说法中错误的是( )A、 离子中心原子上的孤电子对数是1,立体构型为平面三角形 B、元素周期表第三周期主族元素中,简单离子半径最小的是 C、金刚石转化为石墨为放热反应,说明相同条件下石墨比金刚石稳定 D、 、 都是非极性分子9. 关于 中的相关微粒,下列化学用语表示正确的是( )A、 的结构示意图: B、HClO的电子式:
C、 的中心原子杂化轨道类型:
D、中子数为20的氯原子:
10. 下列描述中正确的是( )A、BeCl2为V形的极性分子 B、ClO4−的空间构型为正四面体形 C、P4和CH4都是正四面体分子且键角都为109°28′ D、H2O和CO32−的中心原子均为sp3杂化11. 最新发现C3O2是金星大气的成分之一,化学性质与CO相似。C3O2分子中不含环状结构且每个原子均满足8电子稳定结构。下列叙述错误的是( )A、元素的第一电离能:O>C B、3p轨道上有1对成对电子的基态X原子与基态O原子的性质相似 C、C3O2中C原子的杂化方式为sp3 D、C3O2分子中σ键和π键的个数比为1:112. 最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( )
B、HClO的电子式:
C、 的中心原子杂化轨道类型:
D、中子数为20的氯原子:
10. 下列描述中正确的是( )A、BeCl2为V形的极性分子 B、ClO4−的空间构型为正四面体形 C、P4和CH4都是正四面体分子且键角都为109°28′ D、H2O和CO32−的中心原子均为sp3杂化11. 最新发现C3O2是金星大气的成分之一,化学性质与CO相似。C3O2分子中不含环状结构且每个原子均满足8电子稳定结构。下列叙述错误的是( )A、元素的第一电离能:O>C B、3p轨道上有1对成对电子的基态X原子与基态O原子的性质相似 C、C3O2中C原子的杂化方式为sp3 D、C3O2分子中σ键和π键的个数比为1:112. 最近科学家发现都由磷原子构成的黑磷(黑磷的磷原子二维结构如图)是比石墨烯更好的新型二维半导体材料.下列说法正确的是( ) A、石墨烯属于烯烃 B、石墨烯中碳原子采用sp3杂化 C、黑磷与白磷互为同素异形体 D、黑磷高温下在空气中可以稳定存在13. 在抗击新冠病毒肺炎中瑞德西韦是主要药物之一。瑞德西韦的结构如图所示,下列说法正确的是( )
A、石墨烯属于烯烃 B、石墨烯中碳原子采用sp3杂化 C、黑磷与白磷互为同素异形体 D、黑磷高温下在空气中可以稳定存在13. 在抗击新冠病毒肺炎中瑞德西韦是主要药物之一。瑞德西韦的结构如图所示,下列说法正确的是( ) A、瑞德西韦中N、O、P元素的电负性:N>O>P B、瑞德西韦中的N-H键的键能大于O-H键的键能 C、瑞德西韦中所有N都为sp3杂化 D、瑞德西韦结构中存在o键、π键和大π键
A、瑞德西韦中N、O、P元素的电负性:N>O>P B、瑞德西韦中的N-H键的键能大于O-H键的键能 C、瑞德西韦中所有N都为sp3杂化 D、瑞德西韦结构中存在o键、π键和大π键二、非选择题
-
14. 金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。
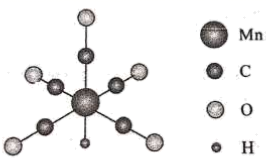
回答问题:
(1)、基态锰原子的价层电子排布式为。(2)、配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为。(3)、第一电离能的大小:CO(填“大于”或“小于”)。(4)、 中碳原子的杂化轨道类型是 , 写出一种与具有相同空间结构的-1价无机酸根离子的化学式。(5)、CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为。(6)、MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是。
以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点硫原子坐标为 ,b点锰原子坐标为 ,则c点锰原子坐标为。
15. 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:(1)、基态F原子核外电子的运动状态有 种。(2)、O、F、Cl电负性由大到小的顺序为;OF2分子的空间构型为;OF2的熔、沸点 (填“高于”或“低于”)Cl2O,原因是。(3)、Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为 , 下列对XeF2中心原子杂化方式推断合理的是(填标号)。A.sp B.sp2 C.sp3 D.sp3d
(4)、XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( , , )。已知Xe—F键长为rpm,则B点原子的分数坐标为;晶胞中A、B间距离d=pm。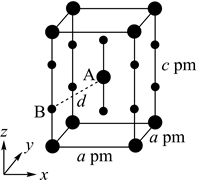 16. [选修3:物质结构与性质]
16. [选修3:物质结构与性质]很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物Ⅱ。
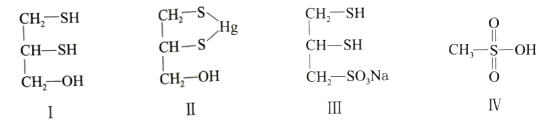 (1)、基态硫原子价电子排布式为。(2)、H2S、CH4、H2O的沸点由高到低顺序为。(3)、汞的原子序数为80,位于元素周期表第周期第ⅡB族。(4)、化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有________。A、在I中S原子采取sp3杂化 B、在Ⅱ中S元素的电负性最大 C、在Ⅲ中C-C-C键角是180° D、在Ⅲ中存在离子键与共价键 E、在Ⅳ中硫氧键的键能均相等(5)、汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是。(6)、理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图9a所示)中部分Ge原子被Hg和Sb取代后形成。
(1)、基态硫原子价电子排布式为。(2)、H2S、CH4、H2O的沸点由高到低顺序为。(3)、汞的原子序数为80,位于元素周期表第周期第ⅡB族。(4)、化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有________。A、在I中S原子采取sp3杂化 B、在Ⅱ中S元素的电负性最大 C、在Ⅲ中C-C-C键角是180° D、在Ⅲ中存在离子键与共价键 E、在Ⅳ中硫氧键的键能均相等(5)、汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是。(6)、理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图9a所示)中部分Ge原子被Hg和Sb取代后形成。
①图9b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是。
②图9c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为;该晶胞中粒子个数比Hg:Ge:Sb = 。
③设X的最简式的式量为Mr , 则X晶体的密度为g/cm3(列出算式)。
17. 在稀土开采技术方面,我国遥遥领先,无论是美国的芒廷帕斯还是澳大利亚的稀土矿山,均为在我国技术的参与下才实现产出。我国科学家最早研究的是稀土—钴化合物的结构。请回答下列问题:(1)、钴原子的价层电子的电子排布式为 , Co4+中存在种不同能级的电子。(2)、Co3+在水中易被还原成 Co2+ , 而在氨水中可稳定存在,其原因为。(3)、一种钴的配合物乙二胺四乙酸合钴的结构为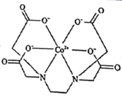 ,1mol 该配合物形成的配位键有mol,配位原子是 , 碳原子的杂化类型有。 (4)、钴蓝晶胞结构如下图所示,该立方晶胞由4个I型和4个型小立方体构成,其化学式为 , 晶体中Al3+占据O2-形成的(填 “四面体空隙”或 “八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为g·cm-3(列计算式;1nm=10-9m)。
,1mol 该配合物形成的配位键有mol,配位原子是 , 碳原子的杂化类型有。 (4)、钴蓝晶胞结构如下图所示,该立方晶胞由4个I型和4个型小立方体构成,其化学式为 , 晶体中Al3+占据O2-形成的(填 “四面体空隙”或 “八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为g·cm-3(列计算式;1nm=10-9m)。 18. 黄铜矿( )是炼铜的最主要矿物,在野外很容易被误认为黄金,故又称愚人金。(1)、基态 原子价层电子排布式为 , 其未成对电子数是。(2)、请判断沸点高低: (填写“>”或“<”)。 沸点低于 的原因是。(3)、S有多种价态的化合物。回答下列问题:
18. 黄铜矿( )是炼铜的最主要矿物,在野外很容易被误认为黄金,故又称愚人金。(1)、基态 原子价层电子排布式为 , 其未成对电子数是。(2)、请判断沸点高低: (填写“>”或“<”)。 沸点低于 的原因是。(3)、S有多种价态的化合物。回答下列问题:①下列关于气态 和 的说法中,正确的是。
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤对电子数目相等 D.都含有极性键
②将纯液态 冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图所示,此固态 中S原子的杂化轨道类型是。
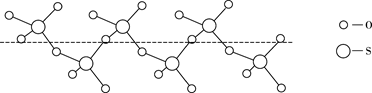
③ 、 中S的化合价均为+6.与 互为等电子体的分子的化学式为 , 中过氧键的数目为。
(4)、 的晶胞如图所示,晶胞参数为a 、b 。 的晶胞中每个 原子与个S原子相连,晶体密度 (列出计算式即可,阿伏加德罗常数的数值为 )。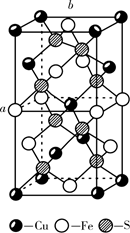 19. 氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:(1)、化合物N2H4的电子式为。(2)、As原子的核外电子排布式为。(3)、P和S是同一周期的两种元素,P的第一电离能比S大,原因是。(4)、NH4+中H-N-H的健角比NH3中H-N-H的键角大,原因是。(5)、Na3AsO4中含有的化学键类型包括;AsO43-空间构型为 , As4O6的分子结构如图所示,则在该化合物中As的杂化方式是。
19. 氮(N)、磷(P)、砷(As)等都是ⅤA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:(1)、化合物N2H4的电子式为。(2)、As原子的核外电子排布式为。(3)、P和S是同一周期的两种元素,P的第一电离能比S大,原因是。(4)、NH4+中H-N-H的健角比NH3中H-N-H的键角大,原因是。(5)、Na3AsO4中含有的化学键类型包括;AsO43-空间构型为 , As4O6的分子结构如图所示,则在该化合物中As的杂化方式是。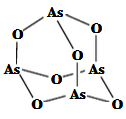 (6)、白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NAmol-1 , 则该晶胞中含有的P原子的个数为 , 该晶体的密度为g·cm-3(用含NA、a的式子表示)。
(6)、白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加德罗常数为NAmol-1 , 则该晶胞中含有的P原子的个数为 , 该晶体的密度为g·cm-3(用含NA、a的式子表示)。 20. 近年来,科学家在超分子、纳米材料等众多领域的研究过程中发现含磷化合物具有重要的应用。(1)、具有超分子结构的化合物 M,其结构如图,回答下列问题:
20. 近年来,科学家在超分子、纳米材料等众多领域的研究过程中发现含磷化合物具有重要的应用。(1)、具有超分子结构的化合物 M,其结构如图,回答下列问题:
①化合物 M 中存在的微粒间的作用力有;
②化合物 M 中碳原子的杂化方式为;
③基态磷原子 价层电子轨道表示式为 , 磷酸根离子的空间构型为 , PH3分子与 NH3 分子相比,的键角更大
(2)、2019年电子科技大学孙旭平教授团队报道了一种磷化硼纳米颗粒作为高选择性 CO2电化学还原为甲醇的非金属电催化剂。磷化硼熔点特别高,处于极高温的空气环境时也具有抗氧化作用。其晶胞结构如图所示:
①氮化硼与磷化硼具有相似的结构,比较 BN 和 BP 的熔点并说明原因:;
②磷化硼晶体中与硼原子距离最近且相等的硼原子数为;
③若图中 A 处磷原子坐标为(0,0,0),D处磷原子坐标为(1,1,0),则E处的硼原子坐标为;
④已知磷化硼晶胞中 A处磷原子与D处磷原子间的距离为a pm,则硼原子与最近磷原子的核间距为pm。
21. 金属在生产、生活中应用广泛,其配合物在治疗癌症方面有重要的运用。回答下列问题:(1)、基态 的价电子排布式为 , 第二电离能 , , 的原因是。(2)、胆矾、SOD酶的活性中心结构分别如图a、b所示:
①胆矾晶体中存在(填标号)。
A.金属键 B.σ键 C.π键 D.非极性键
② 的空间结构是。
③SOD酶中C原子的杂化方式是、。
(3)、一种新型的层状化合物的晶体结构如图所示,已知底边边长为anm,高为cnm。
当晶体Cu和Zn的数目之比为1:1时,该化合物的化学式为。
22. 铁、钴均为第四周期Ⅷ族元素,它们的单质及化合物具有广泛用途. 回答下列问题:(1)、基态Co2+中成单电子数为;Fe和 Co的第三电离能I3(Fe)I3(Co) (填 “>”、“<”或“=”).(2)、化学上可用 EDTA 测定 Fe2+ 和 Co2+ 的含量. EDTA 的结构简式如图所示: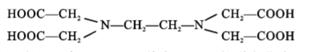
①EDTA 中电负性最大的元素是 , 其中 C原子轨道杂化类型为 ;
②EDTA 存在的化学键有 (填序号).
a. 离子键 b. 共价键 c. 氢键 d.σ键 e.π键 f. 配位键
(3)、将1mol CoCl3·4NH3溶于水中,加入足量 AgNO3溶液生成 1 mol AgCl沉淀. 则CoCl3·4NH3中配离子的化学式为;已知孤电子对与成键电子的排斥作用大于成键电子对与成键电子的排斥作用,试判断 NH3分子与钴离子形成配合物后 H-N-H 键角(填“变大”、“变小”或“不变”).(4)、一种铁氮化合物具有高磁导率,其结构如图所示: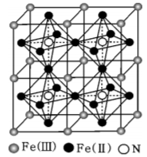
已知晶体的密度为ρg·cm-3 , 阿伏加德罗常数为 NA.
①该结构中单纯分析铁的堆积,其堆积方式为;
②该铁氮化合物的化学式为;
③计算 Fe(Ⅱ)构成正八面体的体积为cm3.
23. 目前我国研制的稀土催化剂催化转化汽车尾气示意图如下: (1)、Zr原子序数为40,价电子排布式为4d25s2 , 它在周期表中的位置是。(2)、图中互为等电子体的两种气体分子是。(3)、C3H8中所有碳原子的杂化方式是。(4)、图中属于非极性的气体分子是。
(1)、Zr原子序数为40,价电子排布式为4d25s2 , 它在周期表中的位置是。(2)、图中互为等电子体的两种气体分子是。(3)、C3H8中所有碳原子的杂化方式是。(4)、图中属于非极性的气体分子是。Fe、Mn元素的部分电离能数据列于下表中
元素
Fe
Mn
电离能(kJ·mol-1)
I1
759
717
I2
1561
1509
I3
2957
3248
(5)、从上表两元素部分电离能数据比较的可知,气态Mn2+再失去一下电子比气态Fe2+再夫去一个电子难,原因是。(6)、CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,镍原子在基态时核外电子排式为 , [Ni(CO)4]的配体是 , 配位原子是。(7)、为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图所示,则与每个Sr2+紧邻的O2-有个。 (8)、与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格,原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA , 试计算晶体铌的密度为g·cm-3(用来a、b、NA表示计算结果)。
(8)、与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格,原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA , 试计算晶体铌的密度为g·cm-3(用来a、b、NA表示计算结果)。 24. 2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。 、 常用作锂离子电池的正极材料,请回答下列问题:(1)、基态锂原子的最高能级的电子云形状是;基态磷原子有个未成对电子;基态铁原子核外电子排布式为。(2)、 中 的配位数为4,配体中N的杂化方式为 , 该配离子中各元素的第一电离能由小到大的顺序为(用元素符号表示)。(3)、 在水中易被还原成 ,而在氨水中可稳定存在,其原因为。(4)、 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
24. 2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。 、 常用作锂离子电池的正极材料,请回答下列问题:(1)、基态锂原子的最高能级的电子云形状是;基态磷原子有个未成对电子;基态铁原子核外电子排布式为。(2)、 中 的配位数为4,配体中N的杂化方式为 , 该配离子中各元素的第一电离能由小到大的顺序为(用元素符号表示)。(3)、 在水中易被还原成 ,而在氨水中可稳定存在,其原因为。(4)、 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
这类磷酸根离子的化学式可用通式表示为(用n代表P原子数)。
(5)、钴蓝晶体结构如下图,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成。晶体中 占据 形成的(填“四面体空隙”或“八面体空隙”);钴蓝晶体的密度为 (列出计算式,用 表示阿伏加德罗常数的值)。 25. 铁、铜及其化合物应用广泛。回答下列问题:(1)、基态铁原子核外最后一个电子填充在(填能级符号),含有个成单电子,具有磁性。(2)、铁氰化钾 是检验 的重要试剂。
25. 铁、铜及其化合物应用广泛。回答下列问题:(1)、基态铁原子核外最后一个电子填充在(填能级符号),含有个成单电子,具有磁性。(2)、铁氰化钾 是检验 的重要试剂。①铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为。
②铁氰化钾中,不存在(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.金属键
(3)、血蓝蛋白是某些节肢动物体内能与氧气可逆结合的一种铜蛋白,其部分结构示意图如图。其中 的化合价为价, 的杂化类型是。 (4)、 合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成 合金的晶体结构图。在这种结构中,同一层的 距离为 。
(4)、 合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成 合金的晶体结构图。在这种结构中,同一层的 距离为 。
① 合金中 。
②同一层中, 原子之间的最短距离是 ,设 为阿伏加德罗常数的值,若要求算 晶体的密度,还需要知道的物理量是(钙、铜元素的相对原子质量为已知量)。
26. Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)、基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式。第三电离能:CaTi(填“大于”或“小于”)。(2)、由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。①Cl2O2的沸点比H2O2低,原因是。
②O3分子的中心原子杂化类型为;与O3互为等电子体的是(任意写一种)。
(3)、Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl 2Na3OCl+H2↑,在该反应中,形成的化学键有 (填标号)。A、金属键 B、离子键 C、配位键 D、极性键 E、非极性键(4)、Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dg•cm3。
①Na3OCl晶胞中,O位于各顶点位置,Cl位于位置。
②用a、d表示阿伏加德罗常数的值NA=(列计算式)。
27. 研究表明,利用FeCl2、NH4H2PO4、Li2CO3和苯胺( )制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。 (1)、Fe2+基态核外电子排布式为。(2)、N、P、O三种元素的电负性由大到小的顺序为。(3)、CO32-中心原子轨道的杂化类型为;与CO32-互为等电子体的一种分子为(填化学式)。(4)、1 mol苯胺分子中含有σ键的数目为;苯胺与甲苯的相对分子质量相近,但苯胺的沸点高于甲苯,其原因是。28. 合成氨工艺的一个重要工序是铜洗,其目的是用铜液(醋酸二氨合铜、氨水)吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应方程式为:Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac (Ac-为CH3COO-的简写)(1)、基态原子中未成对电子数最多的短周期元素X,与上述反应中所有元素均不在同一周期,该基态原子的电子排布式为。(2)、[Cu(NH3)3CO]Ac组成元素中,第一电离能最大的元素是。(填元素符号)。(3)、HAc可通过将CH3CHO氧化得到,比较HAc与乙醛的沸点高低,并说明原因:。(4)、C、N两种原子可形气体分子 (CN)2 , 也可形成有剧毒性的CN-。(CN)2性质与卤素单质类似,判断(CN)2中C原子轨道杂化类型为。与CN-互为等电子体的一种非极性分子的化学式为。(5)、铜晶胞结构如图,铜晶体中每个铜原子周围距离最近的铜原子数目为。
)制备的磷酸亚铁锂(LiFePO4)可用作电池的正极材料。 (1)、Fe2+基态核外电子排布式为。(2)、N、P、O三种元素的电负性由大到小的顺序为。(3)、CO32-中心原子轨道的杂化类型为;与CO32-互为等电子体的一种分子为(填化学式)。(4)、1 mol苯胺分子中含有σ键的数目为;苯胺与甲苯的相对分子质量相近,但苯胺的沸点高于甲苯,其原因是。28. 合成氨工艺的一个重要工序是铜洗,其目的是用铜液(醋酸二氨合铜、氨水)吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应方程式为:Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac (Ac-为CH3COO-的简写)(1)、基态原子中未成对电子数最多的短周期元素X,与上述反应中所有元素均不在同一周期,该基态原子的电子排布式为。(2)、[Cu(NH3)3CO]Ac组成元素中,第一电离能最大的元素是。(填元素符号)。(3)、HAc可通过将CH3CHO氧化得到,比较HAc与乙醛的沸点高低,并说明原因:。(4)、C、N两种原子可形气体分子 (CN)2 , 也可形成有剧毒性的CN-。(CN)2性质与卤素单质类似,判断(CN)2中C原子轨道杂化类型为。与CN-互为等电子体的一种非极性分子的化学式为。(5)、铜晶胞结构如图,铜晶体中每个铜原子周围距离最近的铜原子数目为。 。29. 丁二酮肟可用于镍的检验和测定,其结构式如图:
。29. 丁二酮肟可用于镍的检验和测定,其结构式如图: (1)、Ni元素基态原子价电子排布式为 , C、N、O第一电离能由大到小的顺序是。(2)、1mol丁二酮肟含有的σ键数目是 , 碳原子的杂化方式为。(3)、丁二酮肟镍分子内含有的作用力有(填字母)。
(1)、Ni元素基态原子价电子排布式为 , C、N、O第一电离能由大到小的顺序是。(2)、1mol丁二酮肟含有的σ键数目是 , 碳原子的杂化方式为。(3)、丁二酮肟镍分子内含有的作用力有(填字母)。
a.配位键 b. 离子键 c. 氢键 d. 范德华力
(4)、某镍白铜的晶胞如图所示,其化学式为。 30. 由硝酸锰[Mn(NO3)2]制备的一种含锰催化剂,常温下能去除甲醛、氢氰酸(HCN)等有毒气体。(1)、Mn2+基态核外电子排布式是。NO3-的空间构型为(用文字描述)(2)、甲醛分子中,碳原子的杂化方式为。(3)、HCN分子中σ键与π键的数目比为。H、C、N三种元素的电负性由大到小的顺序为。
30. 由硝酸锰[Mn(NO3)2]制备的一种含锰催化剂,常温下能去除甲醛、氢氰酸(HCN)等有毒气体。(1)、Mn2+基态核外电子排布式是。NO3-的空间构型为(用文字描述)(2)、甲醛分子中,碳原子的杂化方式为。(3)、HCN分子中σ键与π键的数目比为。H、C、N三种元素的电负性由大到小的顺序为。 (4)、硝酸锰受热可分解生成NO2和某种锰的氧化物。该氧化物晶胞结构如右图所示。写出硝酸锰受热分解的化学方程式:。
(4)、硝酸锰受热可分解生成NO2和某种锰的氧化物。该氧化物晶胞结构如右图所示。写出硝酸锰受热分解的化学方程式:。