高考二轮复习知识点:原子轨道杂化方式及杂化类型判断4
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 多巴胺是一种抗休克的药物,其合成路线中的前两步反应如图。下列说法正确的是( )


 A、甲分子中碳原子轨道杂化类型只有sp2 B、乙物质中不存在分子间氢键 C、丙分子中所有的碳原子可能共平面 D、乙、丙分子可用FeCl3溶液鉴别2. 绿原酸的结构简式如图所示,下列有关绿原酸说法正确的是( )
A、甲分子中碳原子轨道杂化类型只有sp2 B、乙物质中不存在分子间氢键 C、丙分子中所有的碳原子可能共平面 D、乙、丙分子可用FeCl3溶液鉴别2. 绿原酸的结构简式如图所示,下列有关绿原酸说法正确的是( ) A、绿原酸分子存在顺反异构 B、绿原酸分子中碳原子均为sp3杂化 C、1mol绿原酸可消耗5molNaOH D、分子中含氧官能团为羟基、羧基和羰基3. 利用西红柿中提取的烟酸为原料可合成降血脂药物灭脂灵,其结构式如图所示。下列有关该化合物的叙述正确的是( )
A、绿原酸分子存在顺反异构 B、绿原酸分子中碳原子均为sp3杂化 C、1mol绿原酸可消耗5molNaOH D、分子中含氧官能团为羟基、羧基和羰基3. 利用西红柿中提取的烟酸为原料可合成降血脂药物灭脂灵,其结构式如图所示。下列有关该化合物的叙述正确的是( ) A、碳原子的杂化方式有3种 B、1mol灭脂灵发生水解可生成3mol
A、碳原子的杂化方式有3种 B、1mol灭脂灵发生水解可生成3mol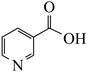 C、含有1个手性碳原子
D、一氯代物有16种(不考虑立体异构)
4. 科学家设计下列装置捕获 ,助力碳中和。下列有关说法错误的是( )
C、含有1个手性碳原子
D、一氯代物有16种(不考虑立体异构)
4. 科学家设计下列装置捕获 ,助力碳中和。下列有关说法错误的是( )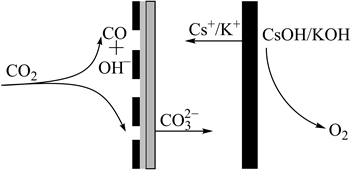 A、 与 中心原子的杂化方式相同 B、 的电子式为 C、阳极电极反应式为 D、 的结构式为5. W、X、Y、Z 是同一短周期的 4 种非金属元素,它们与锂组成的盐是一种新型电池的电解质,其结构如图。下列说法正确的是( )
A、 与 中心原子的杂化方式相同 B、 的电子式为 C、阳极电极反应式为 D、 的结构式为5. W、X、Y、Z 是同一短周期的 4 种非金属元素,它们与锂组成的盐是一种新型电池的电解质,其结构如图。下列说法正确的是( )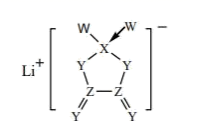 A、原子半径: B、阴离子中 X 的杂化方式: C、最简单氢化物的沸点:W<X D、非金属性:6. 绿原酸可从中药材杜仲和金银花、果蔬土豆和苹果中提取得到,具有抗病毒、降血压、降血脂等药效,其结构简式如图所示。有关该化合物,下列叙述错误的是( )
A、原子半径: B、阴离子中 X 的杂化方式: C、最简单氢化物的沸点:W<X D、非金属性:6. 绿原酸可从中药材杜仲和金银花、果蔬土豆和苹果中提取得到,具有抗病毒、降血压、降血脂等药效,其结构简式如图所示。有关该化合物,下列叙述错误的是( ) A、分子式为C16H18O9 B、分子中所有碳原子不可能共平面 C、能发生水解反应 D、能使酸性高锰酸钾溶液、溴水褪色,且褪色原理相同7. X、Y、Z、W为原子序数依次增大的短周期主族元素,它们形成的某种化合物的结构如图。其中X、Y、Z同周期,Y、W同主族。下列说法错误的是( )
A、分子式为C16H18O9 B、分子中所有碳原子不可能共平面 C、能发生水解反应 D、能使酸性高锰酸钾溶液、溴水褪色,且褪色原理相同7. X、Y、Z、W为原子序数依次增大的短周期主族元素,它们形成的某种化合物的结构如图。其中X、Y、Z同周期,Y、W同主族。下列说法错误的是( ) A、第一电离能:Z>Y>X B、气态氢化物的熔沸点:Y>W C、简单阴离子的还原性:W>Y>Z D、Y与W形成的两种常见化合物,中心原子的杂化方式相同8. CN-能抑制人体组织细胞内酶的活性,不能直接排放到环境中。工业上通过电激发产生HO*和OH- , 可处理废水中的CN- , 机理如图。下列说法错误的是( )
A、第一电离能:Z>Y>X B、气态氢化物的熔沸点:Y>W C、简单阴离子的还原性:W>Y>Z D、Y与W形成的两种常见化合物,中心原子的杂化方式相同8. CN-能抑制人体组织细胞内酶的活性,不能直接排放到环境中。工业上通过电激发产生HO*和OH- , 可处理废水中的CN- , 机理如图。下列说法错误的是( ) A、该电极应该连接直流电源的负极 B、反应I为2CN-+2OH-+10HO*=N2↑+2 +6H2O C、处理1 mol CN- , 反应II理论上生成5 mol O2 D、OH-、HO*和H2O2中氧原子的杂化方式不同9. 如何对肿瘤精准治疗一直是医疗领域需攻克的难题之一、我国科研人员开发出的一种医用亲水凝胶,能使药物的释放更为精确。医用亲水凝胶生产过程中的一种中间体M的结构如图所示,下列有关M的说法正确的是( )
A、该电极应该连接直流电源的负极 B、反应I为2CN-+2OH-+10HO*=N2↑+2 +6H2O C、处理1 mol CN- , 反应II理论上生成5 mol O2 D、OH-、HO*和H2O2中氧原子的杂化方式不同9. 如何对肿瘤精准治疗一直是医疗领域需攻克的难题之一、我国科研人员开发出的一种医用亲水凝胶,能使药物的释放更为精确。医用亲水凝胶生产过程中的一种中间体M的结构如图所示,下列有关M的说法正确的是( ) A、M分子间可通过缩聚反应合成高分子化合物 B、分子中N和O的杂化方式相同 C、该分子亲水的原因是能形成分子内氢键 D、分子中所有的碳原子和氮原子可能共平面10. 下列说法正确的是( )A、基态Mn原子的价电子排布图为
A、M分子间可通过缩聚反应合成高分子化合物 B、分子中N和O的杂化方式相同 C、该分子亲水的原因是能形成分子内氢键 D、分子中所有的碳原子和氮原子可能共平面10. 下列说法正确的是( )A、基态Mn原子的价电子排布图为 B、沸点:CO<N2
C、键角:NH3<H2O
D、S8中S原子的杂化方式为sp3
B、沸点:CO<N2
C、键角:NH3<H2O
D、S8中S原子的杂化方式为sp3
二、非选择题
-
11. 【选修三:物质结构与性质】
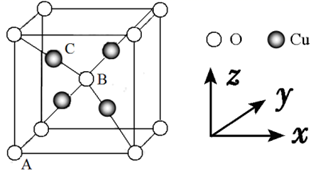
在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
(1)、下列状态的镁中,电离最外层一个电子所需能量最大的是 (填标号)。A、[Ne] B、[Ne]
B、[Ne]  C、[Ne]
C、[Ne]  D、[Ne]
D、[Ne]  (2)、乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是、。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是 , 其中与乙二胺形成的化合物稳定性相对较高的是(填“Mg2+”或“Cu2+”)。(3)、一些氧化物的熔点如下表所示:
(2)、乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是、。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是 , 其中与乙二胺形成的化合物稳定性相对较高的是(填“Mg2+”或“Cu2+”)。(3)、一些氧化物的熔点如下表所示:氧化物
Li2O
MgO
P4O6
SO2
熔点/℃
1570
2800
23.8
−75.5
解释表中氧化物之间熔点差异的原因。
(4)、图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=pm,Mg原子之间最短距离y=pm。设阿伏加德罗常数的值为NA , 则MgCu2的密度是g·cm−3(列出计算表达式)。 12. [选修3——物质结构与性质](1)、下列各组物质性质的比较,结论正确的是( )A、分子的极性: B、物质的硬度: C、物质的沸点: D、在 中的溶解度:(2)、锰单质及其化合物应用十分广泛。回答下列问题:
12. [选修3——物质结构与性质](1)、下列各组物质性质的比较,结论正确的是( )A、分子的极性: B、物质的硬度: C、物质的沸点: D、在 中的溶解度:(2)、锰单质及其化合物应用十分广泛。回答下列问题:位于元素周期表中第四周期族,基态 原子核外未成对电子有个。
(3)、 可与 ,反应生成 ,新生成的化学键为键。,分子的空间构型为 , 其中N原子的杂化轨道类型为。
(4)、金属锰有多种晶型,其中 的结构为体心立方堆积,晶胞参数为 中锰的原子半径为pm。已知阿伏加德罗常数的值为 , 的理论密度 。(列出计算式)(5)、已知锰的某种氧化物的品胞如图所示,其中锰离子的化合价为 , 其配位数为。
 13. 臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为 和 ,NOx也可在其他条件下被还原为N2。(1)、 中心原子轨道的杂化类型为; 的空间构型为(用文字描述)。(2)、Fe2+基态核外电子排布式为。(3)、与O3分子互为等电子体的一种阴离子为(填化学式)。(4)、N2分子中σ键与π键的数目比n(σ)∶n(π)=。(5)、[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。
13. 臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为 和 ,NOx也可在其他条件下被还原为N2。(1)、 中心原子轨道的杂化类型为; 的空间构型为(用文字描述)。(2)、Fe2+基态核外电子排布式为。(3)、与O3分子互为等电子体的一种阴离子为(填化学式)。(4)、N2分子中σ键与π键的数目比n(σ)∶n(π)=。(5)、[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。 14. [化学--选修3:物质结构与性质]东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:(1)、镍元素基态原子的电子排布式为 , 3d能级上的未成对电子数为 .(2)、硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液.
14. [化学--选修3:物质结构与性质]东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:(1)、镍元素基态原子的电子排布式为 , 3d能级上的未成对电子数为 .(2)、硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液.①[Ni(NH3)6]SO4中阴离子的立体构型是 .
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为 , 提供孤电子对的成键原子是 .
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是;氨是分子(填“极性”或“非极性”),中心原子的轨道杂化类型为 .
(3)、单质铜及镍都是由键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958kJ•mol﹣1、INi=1 753kJ•mol﹣1 , ICu>INi的原因是 .(4)、某镍白铜合金的立方晶胞结构如图所示.

①晶胞中铜原子与镍原子的数量比为 .
②若合金的密度为d g•cm﹣3 , 晶胞参数a=nm.
15. 【化学-选修3:物质结构与性质】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)、写出基态As原子的核外电子排布式 .(2)、根据元素周期律,原子半径GaAs,第一电离能GaAs.(填“大于”或“小于”)(3)、AsCl3分子的立体构型为 , 其中As的杂化轨道类型为 .(4)、GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是 .(5)、GaAs的熔点为1238℃,密度为ρ g•cm﹣3 , 其晶胞结构如图所示.
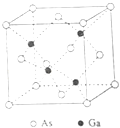
该晶体的类型为 , Ga与As以键键合.Ga和As的摩尔质量分别为MGa g•mol﹣1和MAs g•mol﹣1 , 原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA , 则GaAs晶胞中原子的体积占晶胞体积的百分率为 .
16. 【化学——选修3:物质结构与性质】氮、磷、砷、铁、钛等元素及其化合物在现代农业、科技和国防建设中有着许多独特的用途。
(1)、I.如LiFePO4是新型锂离子电池的电极材料,可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。基态Fe原子的价层电子排布式为 , NH4H2PO4中,除氢元素外,其余三种元素电负性的大小关系是。
(2)、基态Cl原子有种空间运动状态的电子,属于区(填“s”“p”“d”“ds”)(3)、苯胺( )和NH4H2PO4中的N原子杂化方式分别为。 (4)、苯胺和甲苯相对分子质量接近,但苯胺熔点比甲苯的高,原因是。(5)、II.在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,取0.01mol该晶体加入到足量的硝酸银溶液中可得0.02mol白色沉淀,则该晶体中两种配体的物质的量之比为。(6)、III.从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的晶胞如图所示,该磷钇矿的化学式为。
)和NH4H2PO4中的N原子杂化方式分别为。 (4)、苯胺和甲苯相对分子质量接近,但苯胺熔点比甲苯的高,原因是。(5)、II.在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,取0.01mol该晶体加入到足量的硝酸银溶液中可得0.02mol白色沉淀,则该晶体中两种配体的物质的量之比为。(6)、III.从磷钇矿中可提取稀土元素钇(Y),某磷钇矿的晶胞如图所示,该磷钇矿的化学式为。 (7)、已知晶胞参数为a nm和c nm,阿伏加德罗常数的值为NA , 则该磷钇矿的ρ为g·cm−3(列出计算式,用a、c表示)。17. 硼及其化合物在新材料、工农业生产等方面用途广泛。请回答下列问题:(1)、二溴硼基二茂铁(
(7)、已知晶胞参数为a nm和c nm,阿伏加德罗常数的值为NA , 则该磷钇矿的ρ为g·cm−3(列出计算式,用a、c表示)。17. 硼及其化合物在新材料、工农业生产等方面用途广泛。请回答下列问题:(1)、二溴硼基二茂铁( )是硼的有机化合物,写出基态Fe原子的电子排布式 ;基态溴原子的最外层电子排布图 。 (2)、立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是:。(3)、BF3常被用于制取其他硼的化合物,BF3分子中中心原子的杂化轨道类型是 ,SiF4微粒的空间构型是。(4)、NaBH4被认为是有机化学中的“万能还原剂”,其中三种元素的电负性由大到小的顺序是;NaBH4的电子式为。(5)、自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作 ,实际上它的结构单元是由两个 和两个 缩合而成的双六元环,应该写成 ,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___________(填字母)。
)是硼的有机化合物,写出基态Fe原子的电子排布式 ;基态溴原子的最外层电子排布图 。 (2)、立方氮化硼(BN)可利用人工方法在高温高压条件下合成,属于超硬材料,同属原子晶体的氮化硼比晶体硅具有更高的硬度和耐热性的原因是:。(3)、BF3常被用于制取其他硼的化合物,BF3分子中中心原子的杂化轨道类型是 ,SiF4微粒的空间构型是。(4)、NaBH4被认为是有机化学中的“万能还原剂”,其中三种元素的电负性由大到小的顺序是;NaBH4的电子式为。(5)、自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作 ,实际上它的结构单元是由两个 和两个 缩合而成的双六元环,应该写成 ,其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___________(填字母)。 A、离子键 B、共价键 C、氢键 D、金属键18. 铜铟镓硒薄膜太阳能电池(CIGS)是第三代太阳能电池的典型代表。(1)、Cu+价层电子排布式为。(2)、硫酸铜分别和氨水、EDTA[(HOOCCH2)2NCH2-CH2N(CH2COOH)2]配制配合物[Cu(NH3)4(H2O)2]SO4、[Cu(EDTA)]SO4。
A、离子键 B、共价键 C、氢键 D、金属键18. 铜铟镓硒薄膜太阳能电池(CIGS)是第三代太阳能电池的典型代表。(1)、Cu+价层电子排布式为。(2)、硫酸铜分别和氨水、EDTA[(HOOCCH2)2NCH2-CH2N(CH2COOH)2]配制配合物[Cu(NH3)4(H2O)2]SO4、[Cu(EDTA)]SO4。①SO 的空间构型为 , EDTA中碳原子杂化方式为。
②C、N、O、S四种元素中,第一电离能最大的是。
③在[Cu(NH3)4(H2O)2]SO4化合物中,阳离子呈轴向狭长的八面体结构(如图所示)。该阳离子中存在的化学键类型有 , 该化合物加热时首先失去的组分是。
 (3)、某晶体的晶胞结构如图所示,该晶体的化学式为。如果将Se原子看做密堆积,则其堆积模型为。若该晶体中A原子和B原子的坐标分别为(0,0,0)、(0,0, ),则C原子坐标为。已知晶胞参数a=b=0.524nm,c=1.032nm,阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3(列出计算式)。
(3)、某晶体的晶胞结构如图所示,该晶体的化学式为。如果将Se原子看做密堆积,则其堆积模型为。若该晶体中A原子和B原子的坐标分别为(0,0,0)、(0,0, ),则C原子坐标为。已知晶胞参数a=b=0.524nm,c=1.032nm,阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3(列出计算式)。 19. 第四周期某些过渡元素在工业生产中有着极其重要的作用。(1)、Ⅰ.中国锰矿资源较多,分布广泛。
19. 第四周期某些过渡元素在工业生产中有着极其重要的作用。(1)、Ⅰ.中国锰矿资源较多,分布广泛。写出基态锰原子的价电子排布图:。
(2)、 用于 分解制氧气的催化剂, 中氧原子的杂化轨道类型为。(3)、Ⅱ.铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。常作净水剂和补铁剂,SO 的立体构型是。
(4)、铁氰化钾 是检验 的重要试剂。①写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式。
②铁氰化钾中存在的化学键有(填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E。金属键
(5)、Ⅲ.锌在工业中有重要作用,也是人体必需的微量元素。硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图所示。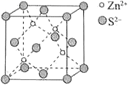
该晶胞中 的配位数为。
(6)、若晶胞参数为 ,则该晶体密度的计算式为 (用 表示阿伏加德罗常数的值,不用化简)。20. 青铜器是我国古代瑰宝。目前,在工业上用磷化铜( )制造磷青铜,磷青铜是含少量钪、锡、磷的铜合金,主要用作耐磨零件和弹性合金原件。(1)、基态 原子的核外电子排布式为;其价电子中未成对电子数与成对电子数之比为。(2)、① 中的P原子的杂化方式是。②P与N同主族,气态氢化物的沸点: (填“>”或“<”),说明理由:。
(3)、磷青铜中的锡、磷两种元素电负性的大小为 P(填“>”“<”或“=”)。(4)、某立方磷青铜晶胞结构如下图所示。
①则其化学式为。
②该晶体中距离 原子最近的 原子有个,在晶胞中由 原子构成的八面体与由 和 原子构成的八面体的个数之比为。
③若晶体密度为 ,最近的 原子核间距为 (用含 、 的代数式表示)。
21. 砷是生命的第七元素,可形成多种重要的化合物。回答下列问题:(1)、基态砷原子N电子层中的成对电子与单电子的数量比为。As的第一电离能(I1)比Se大的原因是。(2)、雄黄(AS4S4)和雌黄(As2S3)在自然界中共生,是提取砷的主要矿物原料,其结构如图所示,1mol雄黄与O2反应生成As2O3 , 转移28mol电子,则另一种产物为。雌黄中As的杂化方式为。 (3)、亚砷酸(H3ASO3)可以用来治疗白血病,为三元弱酸,试推测AsO 的空间构型为。其酸性弱于砷酸(H3AsO4)的原因是。(4)、砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。其晶胞结构如图所示,若沿体对角线方向进行投影则得到如图,请在图中将As原子的位置涂黑。晶体中As原子周围与其距离最近的As原子的个数为 , 若As原子的半径为r1pm,Ga原子的半径为r2pm,则最近的两个As原子的距离为 pm。
(3)、亚砷酸(H3ASO3)可以用来治疗白血病,为三元弱酸,试推测AsO 的空间构型为。其酸性弱于砷酸(H3AsO4)的原因是。(4)、砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料。其晶胞结构如图所示,若沿体对角线方向进行投影则得到如图,请在图中将As原子的位置涂黑。晶体中As原子周围与其距离最近的As原子的个数为 , 若As原子的半径为r1pm,Ga原子的半径为r2pm,则最近的两个As原子的距离为 pm。 22. 钛元素形成的单质及其化合物有重要的应用。请回答:(1)、钛位于元素周期表中区;与钛位于同一周期且含有相同未成对电子数的过渡元素为(填元素符号)。(2)、钛形成的 试剂常用作有机反应的烯化试剂,其结构如图所示。
22. 钛元素形成的单质及其化合物有重要的应用。请回答:(1)、钛位于元素周期表中区;与钛位于同一周期且含有相同未成对电子数的过渡元素为(填元素符号)。(2)、钛形成的 试剂常用作有机反应的烯化试剂,其结构如图所示。
其中氯原子和铝原子的杂化方式分别为。
(3)、钛形成的 是一种储氢材料。 的立体构型为。(4)、钛形成的不同卤化物熔沸点数据如表所示。熔点/℃
-24.1
38.25
155
沸点/℃
136.45
233.45
377
三种卤化物熔沸点数据呈现表中变化规律的原因为。
(5)、向紫色的 溶液中加入无水乙醚并通入 至饱和,则可得到绿色的 晶体。①晶体中所有元素的电负性由大到小的顺序为。
②晶体中配位原子为;晶体中粒子间存在的作用力有(填选项字母)。
a.离子键 b.σ键 c. 键 d.金属键 e.配位键
(6)、钛酸钡具有压电性,可用于留声机和水下侦察设备等。钛酸钡立方晶胞结构如图所示( 、 都分别与 相互接触),其晶胞参数 。 的配位数为;若 半径为140 ,则 的半径为 。 23. 有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:(1)、基态Co原子的价层电子排布图为;金属Co的熔点、沸点均高于金属K的原因为。(2)、 、 、 的键角由大到小的顺序为;C、N、O、F的第一电离能由大到小的顺序为。(3)、碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。
23. 有电极化特性、非磁绝缘性、光致发光性等多种优异性能。回答下类问题:(1)、基态Co原子的价层电子排布图为;金属Co的熔点、沸点均高于金属K的原因为。(2)、 、 、 的键角由大到小的顺序为;C、N、O、F的第一电离能由大到小的顺序为。(3)、碱金属离子镶入适合的冠醚空腔可形成特殊材料,两种冠醚结构如图1所示。
①冠醚中O原子的杂化形式为;H、C、O的电负性由小到大的顺序为。
② 不能镶入甲中而易镶入乙中的原因为。
(4)、 具有钙钛矿型立方结构,其晶胞中处于面心的F形成正八面体空隙,结构如图2所示。①每个晶胞中由K和F共同形成的正四面体空隙有个。
②晶胞的另一种表示中,Co处于各顶角位置,则K处于位置。
③若晶胞参数为a pm,阿伏加德罗常数的值为 ,晶体密度ρ= 。
24. 二氧化碳化学资源化利用已经显示出越来越重要的科技与经济价值,如用铜锌氧化物催化二氧化碳加氢生成 ,合成碳酸乙烯酯(EC)等。回答下列问题:(1)、基态铜原子价电子排布式为;第一电离能 的原因是。(2)、 的空间构型为。(3)、EC的结构简式为 ,其碳原子杂化方式为 , 每个分子中含个 键。 (4)、 加氢得到 , 的沸点比 的高,原因是。(5)、高温时,太阳能反应器中的 失去部分氧,温度稍低时,从 中重新夺取氧。一种铈(Ce)的氧化物的晶胞结构如图所示:
,其碳原子杂化方式为 , 每个分子中含个 键。 (4)、 加氢得到 , 的沸点比 的高,原因是。(5)、高温时,太阳能反应器中的 失去部分氧,温度稍低时,从 中重新夺取氧。一种铈(Ce)的氧化物的晶胞结构如图所示:
①Ce的配位数为。
②若高温下该晶胞中1个氧原子变为空位,个面心上的铈由+4价变为+3价(不考虑顶点)。
③已知 的密度为7.13g/cm3 , 设NA为阿伏加德罗常数的值,则晶胞边长a=pm。
25. S、Se 、N、Fe等元素及其化合物在科学研究和工业生产中具有重要的作用。(1)、臭鼬排放的臭气主要成分为3﹣MBT,键线式如图所示:
0.1mol 3﹣MBT中含有σ键数目为(NA为阿伏加德罗常数的值)。3﹣MBT的沸点低于(CH3)2C=CHCH2OH,主要原因是。
(2)、2020年12月17日,采撷月壤的嫦娥五号荣耀归来。嫦娥五号探测器采用太阳能电池板提供能量,在太阳能电池板材料中除单晶硅外,还有铜,铟,镓,硒等化学物质。硒为第四周期第VIA族元素,其氧化物有SeO2和SeO3两种,SeO3分子的立体构型为 , 与其互为等电子体的阴离子为 (举一例)。(3)、铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业,其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。①K3[Fe(CN)6]中所涉及的各元素的第一电离能由大到小的顺序为。
②(CN)2分子中存在碳碳键,C原子的杂化轨道类型为。
③下列选项是部分同学画的基态氮原子的核外电子排布图,其中违背泡利原理的是 (填序号,下同),违背洪特规则的是。
A.
 B.
B. 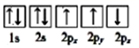 C.
C. 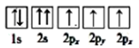 (4)、如图是金属铁晶体中的一个晶胞。
(4)、如图是金属铁晶体中的一个晶胞。
①该晶体中原子总体积占晶体体积的比值为(用含π的最简代数式表示)。
②铁原子的半径为rpm,其晶体密度为g•cm﹣3(用含有r、NA的最简代数式表示)。
26. 海洋是元素的摇篮,海水中含有的大量元素在生产、生活、科学研究等多方面具有重要作用。回答下列问题。(1)、写出基态溴原子的价电子排布式 , 氟、氯、溴、氧四种元素中,电负性由大到小的顺序为(填元素符号) 。(2)、Mg、Al的氟化物晶格能分别是2957 kJ•mol-1、5492 kJ•mol-1 , 二者相差很大的原因是。(3)、X射线衍射测定等发现,I3AsF6 中存在I 离子。I 离子的几何构型为 , 中心原子的杂化类型为。(4)、C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上。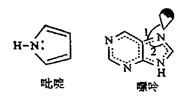
①1mol吡啶分子中含有σ键数目是NA。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因。
③分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为。
(5)、CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示: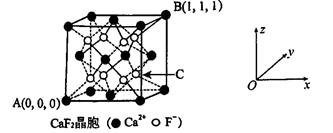
①“ 原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为( , , )
②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA , 则其密度为g•cm-3 (列出计算式即可) 。
27. 硒(Se)是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:(1)、Se元素基态原子的电子排布式为;第四周期中第一电离能比Se元素大的共有种(氪元素除外)。(2)、气态SeO3分子的价层电子对互斥模型为 ;SeO42-离子中Se原子的杂化方式为 。(3)、固态SeO2是以[SeO3]角锥体以角相连接的展平的聚合结构,每一锥体带有一悬垂的终端O原子(如下图1所示)。①图1中Se-O键键长较短的是 (填“a"或“b"),其原因是。
②SeO2熔点为350℃,固态SeO2属于晶体,其熔点远高于SO2(-75.5℃)的原因是 。
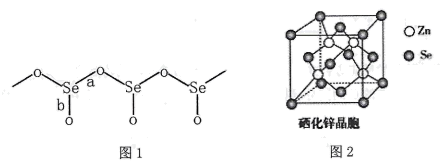 (4)、硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如上图2所示,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得ZnSe的晶胞参数a=0. 560nm,则Se2-的离子半径r(Se2-)= nm(计算结果保留3位有效数字,下同);硒化锌晶体的密度为 g.cm-3。28. 闪锌矿与纤锌矿的主要成分均为ZnS。在一定条件下ZnO与ZnS、Se共热可制备荧光材料ZnSe。回答下列问题:(1)、基态Se原子的价电子排布式为 , 基态Zn与S原子成对电子数之比为。(2)、 的电负性由大到小的顺序为。制备 过程中会产生少量 ,其中 原子采用杂化, 的空间构型为。(3)、 晶胞与 晶胞相似(如图),晶胞中距离最近的两个 的距离为 ,请计算 晶胞的密度 。
(4)、硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如上图2所示,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得ZnSe的晶胞参数a=0. 560nm,则Se2-的离子半径r(Se2-)= nm(计算结果保留3位有效数字,下同);硒化锌晶体的密度为 g.cm-3。28. 闪锌矿与纤锌矿的主要成分均为ZnS。在一定条件下ZnO与ZnS、Se共热可制备荧光材料ZnSe。回答下列问题:(1)、基态Se原子的价电子排布式为 , 基态Zn与S原子成对电子数之比为。(2)、 的电负性由大到小的顺序为。制备 过程中会产生少量 ,其中 原子采用杂化, 的空间构型为。(3)、 晶胞与 晶胞相似(如图),晶胞中距离最近的两个 的距离为 ,请计算 晶胞的密度 。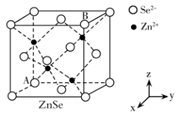 (4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。ZnSe晶胞中部分原子的分数坐标为:A点Se2-(0,0,0),B点Se2-的分数坐标为;从该晶胞中找出距离B点Se2-最远的Zn2+的位置(用分数坐标表示)。29. B、Si和P 是组成半导体材料的重要元素。回答下列问题(1)、基态B、Si 和P中,单电子数最多的是 , 电负性最大的是。(2)、PCl3中心原子的杂化类型为 , BCl3与阴离子互为等电子体。(3)、SiCl4 极易与水反应,其反应机理如图。
(4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。ZnSe晶胞中部分原子的分数坐标为:A点Se2-(0,0,0),B点Se2-的分数坐标为;从该晶胞中找出距离B点Se2-最远的Zn2+的位置(用分数坐标表示)。29. B、Si和P 是组成半导体材料的重要元素。回答下列问题(1)、基态B、Si 和P中,单电子数最多的是 , 电负性最大的是。(2)、PCl3中心原子的杂化类型为 , BCl3与阴离子互为等电子体。(3)、SiCl4 极易与水反应,其反应机理如图。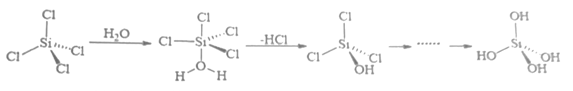
①上述反应机理涉及的分子中属于非极性分子的是。(填化学式)
②关于上述反应机理的说法正确的是。
A. Si 的杂化方式一直没有发生变化
B. H2O 中 O 通过孤对电子与 Si 形成配位键
C.只涉及了极性共价键的断裂与形成
(4)、两种含硅化合物的晶胞结构如图所示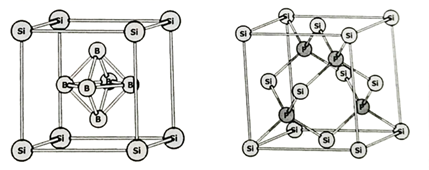
I Ⅱ
①这两种含硅化合物的化学式分别为和。
②I的晶胞参数为a pm,则Ⅰ的密度为 。
③Ⅱ的晶胞参数为b pm,Si和P的原子半径分别为 pm和 pm,则Ⅱ的空间占有率为。
30. 铜是人类最早使用的金属之一,最近科学家发现 Cu 元素有很强的杀菌作用,还可代替Al 布线在硅芯片上。用黄铜矿(主要成分为 CuFeS2)生产粗铜,其反应原理如下: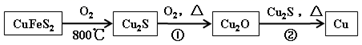
回答下列问题:
(1)、S 和 O 相比,第一电离能较小的元素是 ;在下列图示中,Si 的基态价电子排布图是(填选项字母)。A、
 B、
B、 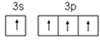 C、
C、  D、
D、 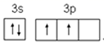 (2)、Cu2O 和 Cu2S 均为离子晶体,Cu2O 的熔点为 1235℃,Cu2S 的熔点为 1130℃,Cu2O熔点较高的原因是 。(3)、反应①、②中生成的气体 SO2中心原子的杂化方式为 , 分子的立体构型为 。(4)、与 NH3互为等电子体的粒子的化学式有 (写出一种)。工业上常用铜氨溶液制造人造丝,某学生做了如下实验:CuSO4溶液 蓝色沉淀 深蓝色溶液,蓝色沉淀溶于氨水的离子方程式为 。(5)、Cu2O 的晶胞结构如图所示,若原子坐标参数 A 为(0,0,0),B 为 ,则 C 原子的坐标参数为 。若该晶体的密度为 dg/cm3 , 阿伏加德罗常数的值为NA , 则该晶胞中 Cu 原子与 O 原子之间的距离为 pm。(用含 d 和 NA的式子表示)。
(2)、Cu2O 和 Cu2S 均为离子晶体,Cu2O 的熔点为 1235℃,Cu2S 的熔点为 1130℃,Cu2O熔点较高的原因是 。(3)、反应①、②中生成的气体 SO2中心原子的杂化方式为 , 分子的立体构型为 。(4)、与 NH3互为等电子体的粒子的化学式有 (写出一种)。工业上常用铜氨溶液制造人造丝,某学生做了如下实验:CuSO4溶液 蓝色沉淀 深蓝色溶液,蓝色沉淀溶于氨水的离子方程式为 。(5)、Cu2O 的晶胞结构如图所示,若原子坐标参数 A 为(0,0,0),B 为 ,则 C 原子的坐标参数为 。若该晶体的密度为 dg/cm3 , 阿伏加德罗常数的值为NA , 则该晶胞中 Cu 原子与 O 原子之间的距离为 pm。(用含 d 和 NA的式子表示)。