高考二轮复习知识点:原子轨道杂化方式及杂化类型判断3
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 、属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在键、键。下列说法错误的是( )A、的熔点高于 B、晶体中所有化学键均为极性键 C、晶体中所有原子均采取杂化 D、晶体中所有原子的配位数均相同2. 弱酸型指示剂的电离平衡可表示为: , 其分子、离子为不同颜色。下表是酚酞在pH不同的溶液中的结构和变色规律。下列说法中错误的是( )

(图中环状结构为苯环)
A、pH改变时,酸碱指示剂的分子、离子相对含量变化引起溶液颜色变化 B、溶液从酸性到强碱性的过程中,酚酞中的碳原子a从杂化转化为杂化 C、当指示剂的 , 则 , 此时的pH为理论变色点 D、温度改变,指示剂的变色范围可能发生改变3. 异黄酮类化合物是药用植物的有效成分之一,一种异黄酮类化合物Z的部分合成路线如图:
下列说法错误的是( )
A、X能被 溶液氧化 B、1molY最多能与4molNaOH反应 C、Z中环上的氧原子的杂化方式为 D、X、Y、Z均能发生加成、取代反应4. 木犀草素有镇咳化痰的作用,其结构简式如图。下列说法错误的是( ) A、分子中有3种含氧官能团 B、分子中碳原子均为sp2杂化 C、能与NaHCO3溶液反应,产生气泡 D、能与Br2发生取代反应和加成反应5. 羧酸与醇发生酯化反应的机理如图,下列说法错误的是( )
A、分子中有3种含氧官能团 B、分子中碳原子均为sp2杂化 C、能与NaHCO3溶液反应,产生气泡 D、能与Br2发生取代反应和加成反应5. 羧酸与醇发生酯化反应的机理如图,下列说法错误的是( ) A、该反应历程包括质子化加成、消去、和去质子化 B、同一个碳原子上连接两个羟基是不稳定的结构 C、物质a中所有中心原子杂化方式相同 D、可以用同位素标记的CH3CO18OH来研究酯化反应断键的规律6. Calebin A可用于治疗阿尔茨海默病,其合成路线如下。下列说法正确的是( )
A、该反应历程包括质子化加成、消去、和去质子化 B、同一个碳原子上连接两个羟基是不稳定的结构 C、物质a中所有中心原子杂化方式相同 D、可以用同位素标记的CH3CO18OH来研究酯化反应断键的规律6. Calebin A可用于治疗阿尔茨海默病,其合成路线如下。下列说法正确的是( ) A、X分子中有3种含氧官能团 B、Y、Z分子中碳原子都是sp2杂化 C、X和Z可以用银氨溶液或氯化铁溶液鉴别 D、Z分子中虚线框内所有碳原子不一定共平面7. 5-氨基四唑硝酸盐受热迅速生成以为主的环境友好型气体,并放出大量的热,是制造HTPB火箭推进剂的重要原料,结构简式如图,其中五元环为平面结构,下列说法正确的是 ( )
A、X分子中有3种含氧官能团 B、Y、Z分子中碳原子都是sp2杂化 C、X和Z可以用银氨溶液或氯化铁溶液鉴别 D、Z分子中虚线框内所有碳原子不一定共平面7. 5-氨基四唑硝酸盐受热迅速生成以为主的环境友好型气体,并放出大量的热,是制造HTPB火箭推进剂的重要原料,结构简式如图,其中五元环为平面结构,下列说法正确的是 ( ) A、基态N原子核外电子的运动状态有3种 B、阴离子的空间构型为三角锥形 C、该化合物中五元环上的5个原子的杂化方式都相同 D、该化合物因存在类似于苯分子的大键,所以非常稳定8. 某化合物的结构为
A、基态N原子核外电子的运动状态有3种 B、阴离子的空间构型为三角锥形 C、该化合物中五元环上的5个原子的杂化方式都相同 D、该化合物因存在类似于苯分子的大键,所以非常稳定8. 某化合物的结构为 , 其中X、Y、Z、W四种元素分布在三个短周期,原子序数依次增大,且Y、Z、W的简单离子具有相同的电子层结构。下列叙述错误的是( ) A、该化合物中,W、X、Y、Z最外层均满足8电子稳定结构 B、四种元素中,Y元素电负性最大 C、该化合物中,W和Y的杂化方式相同 D、元素Z与W最高价氧化物对应水化物可以发生反应9. 制取H2O2的反应为Na2O2+H2SO4+10H2O=Na2SO4·10H2O+H2O2 , 下列说法不正确的是( )A、钠离子的结构示意图:
, 其中X、Y、Z、W四种元素分布在三个短周期,原子序数依次增大,且Y、Z、W的简单离子具有相同的电子层结构。下列叙述错误的是( ) A、该化合物中,W、X、Y、Z最外层均满足8电子稳定结构 B、四种元素中,Y元素电负性最大 C、该化合物中,W和Y的杂化方式相同 D、元素Z与W最高价氧化物对应水化物可以发生反应9. 制取H2O2的反应为Na2O2+H2SO4+10H2O=Na2SO4·10H2O+H2O2 , 下列说法不正确的是( )A、钠离子的结构示意图: B、H2O2的电子式:
B、H2O2的电子式: C、的空间结构为正四面体型
D、基态O原子的轨道表示式:
C、的空间结构为正四面体型
D、基态O原子的轨道表示式: 10. 下列分子中的碳原子为sp杂化的是( )A、CH4 B、HCHO C、C2H2 D、C2H411. 中国科学院发现CO2在核(Fe—Zn—Zr)—壳(Zeolite)催化剂内能高效氢化成异构化烷烃,反应机理如图所示。下列说法正确的是( )
10. 下列分子中的碳原子为sp杂化的是( )A、CH4 B、HCHO C、C2H2 D、C2H411. 中国科学院发现CO2在核(Fe—Zn—Zr)—壳(Zeolite)催化剂内能高效氢化成异构化烷烃,反应机理如图所示。下列说法正确的是( ) A、该过程中没有发生电子的转移 B、1个四氨合锌(II)—[Zn(NH3)4]2+中含12个σ键 C、示意图中含碳化合物碳原子的杂化方式均相同 D、催化剂内能高效氢化成异构化烷烃与催化剂的选择性有关
A、该过程中没有发生电子的转移 B、1个四氨合锌(II)—[Zn(NH3)4]2+中含12个σ键 C、示意图中含碳化合物碳原子的杂化方式均相同 D、催化剂内能高效氢化成异构化烷烃与催化剂的选择性有关二、多选题
-
12. 氧化石墨烯基水凝胶是一类新型复合材料,对氧化石墨烯进行还原可得到还原石墨烯,二者的结构如图所示。下列说法正确的是( )
 A、还原石墨烯中碳原子的杂化方式均为sp2 B、在水中溶解度氧化石墨烯比还原石墨烯更大 C、氧化石墨烯能形成氢键,而还原石墨烯不能 D、氧化石墨烯转化为还原石墨烯时,1号C与其相邻 C原子间键能变大13. 海葵毒素是最复杂的有机物之一,是非多肽类物质中毒性非常大的一个,仅用2.3-31.5µg就可以致人于死地。岩沙海葵毒素结构简式如下,其分子式C129H223N3O54 , 分子量2680.14g/mol。(手性碳原子是指与四个各不相同的原子或者原子团相连的碳原子)
A、还原石墨烯中碳原子的杂化方式均为sp2 B、在水中溶解度氧化石墨烯比还原石墨烯更大 C、氧化石墨烯能形成氢键,而还原石墨烯不能 D、氧化石墨烯转化为还原石墨烯时,1号C与其相邻 C原子间键能变大13. 海葵毒素是最复杂的有机物之一,是非多肽类物质中毒性非常大的一个,仅用2.3-31.5µg就可以致人于死地。岩沙海葵毒素结构简式如下,其分子式C129H223N3O54 , 分子量2680.14g/mol。(手性碳原子是指与四个各不相同的原子或者原子团相连的碳原子)
关于海葵毒素描述正确的是( )
A、海葵毒素中碳元素的杂化方式只有sp2杂化 B、该分子中含氧官能团有羧基、羰基、醚键等 C、岩沙海葵毒素是一种能使溴水褪色的有机高分子化合物 D、海葵毒素中含有手性碳原子14. CH3+、﹣CH3(甲基)、CH3﹣都是重要的有机反应中间体,有关它们的说法正确的是 ( )A、它们均由甲烷去掉一个氢原子所得 B、它们互为等电子体,碳原子均采取sp2杂化 C、CH3﹣与NH3、H3O+互为等电子体,几何构型均为三角锥形 D、CH3+中的碳原子采取sp2杂化,所有原子均共面三、非选择题
-
15. 研究笼形包合物结构和性质具有重要意义。化学式为的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为。回答下列问题:
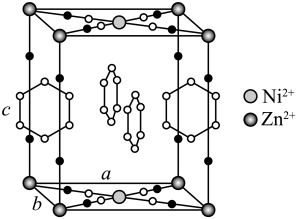 (1)、基态原子的价电子排布式为 , 在元素周期表中位置为。(2)、晶胞中N原子均参与形成配位键,与的配位数之比为;;晶胞中有d轨道参与杂化的金属离子是。(3)、吡啶(
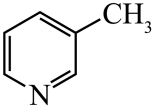
(1)、基态原子的价电子排布式为 , 在元素周期表中位置为。(2)、晶胞中N原子均参与形成配位键,与的配位数之比为;;晶胞中有d轨道参与杂化的金属离子是。(3)、吡啶(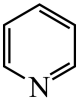 )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大键、则吡啶中N原子的价层孤电子对占据____(填标号)。 A、2s轨道 B、2p轨道 C、sp杂化轨道 D、sp2杂化轨道(4)、在水中的溶解度,吡啶远大于苯,主要原因是① , ②。(5)、
)替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大键、则吡啶中N原子的价层孤电子对占据____(填标号)。 A、2s轨道 B、2p轨道 C、sp杂化轨道 D、sp2杂化轨道(4)、在水中的溶解度,吡啶远大于苯,主要原因是① , ②。(5)、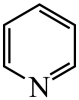 、
、 、
、 的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 16. [选修3:物质结构与性质]
的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 16. [选修3:物质结构与性质]铁和硒( )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。回答下列问题:
(1)、乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
①基态 原子的核外电子排布式为 ;
②该新药分子中有种不同化学环境的C原子;
③比较键角大小:气态 分子 离子(填“>”“<”或“=”),原因是。
(2)、富马酸亚铁 是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中 键与 键的数目比为;
②富马酸亚铁中各元素的电负性由大到小的顺序为。
(3)、科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将 转化为 ,反应过程如图所示:
①产物中N原子的杂化轨道类型为;
②与 互为等电子体的一种分子为(填化学式)。
(4)、钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
①该超导材料的最简化学式为;
② 原子的配位数为;
③该晶胞参数 、 。阿伏加德罗常数的值为 ,则该晶体的密度为 (列出计算式)。
17. 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含 的新型 分子 的合成路线如下: (1)、 与S同族,基态硒原子价电子排布式为。(2)、 的沸点低于 ,其原因是。(3)、关于I~III三种反应物,下列说法正确的有_________。A、I中仅有 键 B、I中的 键为非极性共价键 C、II易溶于水 D、II中原子的杂化轨道类型只有 与 E、I~III含有的元素中,O电负性最大(4)、IV中具有孤对电子的原子有。(5)、硒的两种含氧酸的酸性强弱为 (填“>”或“<”)。
(1)、 与S同族,基态硒原子价电子排布式为。(2)、 的沸点低于 ,其原因是。(3)、关于I~III三种反应物,下列说法正确的有_________。A、I中仅有 键 B、I中的 键为非极性共价键 C、II易溶于水 D、II中原子的杂化轨道类型只有 与 E、I~III含有的元素中,O电负性最大(4)、IV中具有孤对电子的原子有。(5)、硒的两种含氧酸的酸性强弱为 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。 的立体构型为。
(6)、我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图a,沿x、y、z轴方向的投影均为图b。
①X的化学式为。
②设X的最简式的式量为 ,晶体密度为 ,则X中相邻K之间的最短距离为 (列出计算式, 为阿伏加德罗常数的值)。
18. [化学——选修3:物质结构与性质]卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)、氟原子激发态的电子排布式有 , 其中能量较高的是。(填标号)a. b. c. d.
(2)、①一氯乙烯分子中,C的一个杂化轨道与的轨道形成键,并且的轨道与C的轨道形成3中心4电子的大键。②一氯乙烷、一氯乙烯、一氯乙炔分子中,键长的顺序是 , 理由:(ⅰ)C的杂化轨道中s成分越多,形成的键越强;(ⅱ)。
(3)、卤化物受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为。解释X的熔点比Y高的原因。(4)、晶体中离子作体心立方堆积(如图所示),主要分布在由构成的四面体、八面体等空隙中。在电场作用下,不需要克服太大的阻力即可发生迁移。因此,晶体在电池中可作为。
已知阿伏加德罗常数为 , 则晶体的摩尔体积(列出算式)。
19. 卟啉化合物在生命科学、太阳能储存等众多领域具有广阔的应用前景。回答下列问题:I.四苯基金属锌卟啉配合物具有促进细胞组织呼吸、改善蛋白质和糖代谢等作用,其合成过程如下(ph-为苯基):
 (1)、配合物中基态Zn原子的价电子排布式为 , C原子的杂化类型为。(2)、合成过程所用的试剂乙醇中所含元素的电负性由大到小的顺序为。(3)、乙醇的沸点高于二氯甲烷的沸点,主要原因是。(4)、II.研究表明利用卟啉配合物对钙钛矿薄膜进行修饰调控,可大幅度提高钙钛矿太阳能电池器件的性能和稳定性。
(1)、配合物中基态Zn原子的价电子排布式为 , C原子的杂化类型为。(2)、合成过程所用的试剂乙醇中所含元素的电负性由大到小的顺序为。(3)、乙醇的沸点高于二氯甲烷的沸点,主要原因是。(4)、II.研究表明利用卟啉配合物对钙钛矿薄膜进行修饰调控,可大幅度提高钙钛矿太阳能电池器件的性能和稳定性。
钙钛矿晶胞如图所示,Ti4+处于6个O2-组成的空隙中,若Ca2+与O2-的最短距离为anm,设NA为阿伏加德罗常数的值,则晶体的密度为g∙cm-3(列出计算表达式)。
(5)、在钙钛矿晶胞结构的另一种表示中,Ti4+处于各顶点位置,则O2-处于位置。20. 卤族元素是重要的非金属元素,用途广泛。回答下列问题:(1)、卤族元素位于元素周期表区,其中电负性最大的是(填元素符号)。(2)、基态氟原子核外有种运动状态不同的电子,其中含有单电子的轨道形状为。(3)、溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性(填“强”或“弱”),原因是。(4)、化合物 I3 AsF6为离子化合物,其中阳离子(I )中心原子的杂化方式为。该晶体中不含有的化学键类型为(填选项字母)。a.配位键 b.金属键 c.极性键 d.非极性键
(5)、由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为 , 晶胞中位置与 K+紧邻的 O 的个数为。 (6)、有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确。(已知: )21. 硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:(1)、氨硼烷(H3NBH3)是目前最具潜力的储氢材料之一。
(6)、有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确。(已知: )21. 硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:(1)、氨硼烷(H3NBH3)是目前最具潜力的储氢材料之一。①氨硼烷能溶于水,其原因是。
②氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是。
A.苯和三氯甲烷 B.LiH和HCN C.C2H4和C2H2 D.B2H6和NH3
③氨硼烷电池放电时的总反应为:H3NBH3+3H2O2=NH4BO2+4H2O。写出负极电极反应。
(2)、在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式,图(a)为一种无限长单链状结构的多硼酸根,其化学式为;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型。 (3)、硼氢化钠是一种常用的还原剂。其晶胞结构如图所示:
(3)、硼氢化钠是一种常用的还原剂。其晶胞结构如图所示:
①该晶体中Na+的配位数为。标注为“1”的Na+分数坐标为。
②H3BO3分子中的O—B—O的键角(填“大于”、“等于”或“小于”)BH 中的H—B—H的键角。
③已知硼氢化钠晶体的密度为ρg·cm-3 , NA代表阿伏加德罗常数的值,则a=(用含ρ、NA的代数式表示);
④若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为。
22. 高熵合金通常被定义为含有5种以上主要元素的固溶体,每种元素的摩尔比为 。这个概念已经扩展到创造熵稳定的功能材料中。此类材料有熵稳定高熵功能材料( 的氧化物),以及尖晶石、碳化物和硅化物等。根据所学知识回答下列问题:(1)、基态 原子的价电子排布式为 , 有个未成对电子。(2)、镍及其化合物常用作有机合成的催化剂,如 ( 表示苯基),在该化合物中,配体的空间构型为; 晶体中存在的化学键类型有(填标号)。A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(3)、尖晶石是镁铝氧化物组成的矿物,含有铁、锌、锰等元素。 三种元素的第一电离能由大到小的顺序为。(4)、已知: 是强还原剂,与水反应能生成 , 中含有 键与 键的数目之比为 , 该离子中C的杂化方式为。(5)、 的晶胞结构如图所示,若碳和硅的原子半径分别为 和 ,密度为 ,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为(用含 的代数式表示, 表示阿伏加德罗常数的值)。 23. 镍是一种亲铁元素,地核主要由铁、镍元素组成。(1)、基态镍原子的价电子排布式为。(2)、配合物Ni(CO)4常温为液体,其最可能的晶体类型是 , 配位原子为。CO与N2互为等电子体,熔沸点更高的是CO,其原因是。(3)、NiSO4溶液与丁二酮肟的反应如图,该反应可以用来鉴别Ni2+。
23. 镍是一种亲铁元素,地核主要由铁、镍元素组成。(1)、基态镍原子的价电子排布式为。(2)、配合物Ni(CO)4常温为液体,其最可能的晶体类型是 , 配位原子为。CO与N2互为等电子体,熔沸点更高的是CO,其原因是。(3)、NiSO4溶液与丁二酮肟的反应如图,该反应可以用来鉴别Ni2+。
①丁二酮肟中四种元素电负性由大到小的顺序为 , 碳原子的杂化轨道类型为。
②二(丁二酮肟)合镍(II)中存在的化学键有(填选项字母)。
A.σ键 B.π键 C.配位健 D.氢键 E.范德华力
(4)、镍可做许多有机物与氢气加成的催化剂,例如吡啶( )的反应方程式为:
)的反应方程式为: 3H2+


吡啶中大Π键可以表示为。
(5)、某种镁、镍和碳三种元素形成的晶体具有超导性。该晶体可看作是镁原子做顶点,镍原子作面心的面心立方堆积(晶胞结构如图,未标出碳原子位置),碳原子只填充在由镍构成的八面体空隙。
①图中碳原子的位置位于晶胞的。
②已知晶胞中相邻且最近的镁、碳原子间核间距为a nm,NA为阿伏加德罗常数的值,其密度为g/cm3(列出算式即可)。
24. 托特罗定(G)是毒覃碱受体拮抗剂,其一种合成路线流程图如图
请按要求回答下列问题:
(1)、A的名称。(2)、F中含氧官能团名称为 , 其中碳原子的杂化类型有。(3)、F→G的反应类型为 , G中手性碳原子的数目是。(4)、B与NaOH溶液加热条件下反应的化学方程式。(5)、同时满足下列条件的C的同分异构体有.种。a.在酸性条件下完全水解,得到两种产物:有机物M和碳酸(
 )
)b.M分子能与FeCl,溶液发生显色反应
c.M分子核磁共振氢谱有6组峰且峰面积之比为1:1:1:1:3:3
(6)、已知:R -CHO (R'、R 代表烃基或H),请结合上述信息,写出以
(R'、R 代表烃基或H),请结合上述信息,写出以  和乙醛为主要原料制备
和乙醛为主要原料制备  的合成路线流程图(无机试剂任选)。 25. 和 都是常见的氧化剂。(1)、 的基态原子的核外电子排布式为 , 的基态原子核外电子有种运动状态。(2)、 是石油化工中重要的催化剂之一,可催化异丙苯裂化生成苯和丙烯。 丙烯分子中含有 键与 键数目之比为 , 丙烯分子中碳原子的杂化轨道类型为。(3)、H、O、 三种元素的电负性按由大到小的顺序为(用元素符号表示)。(4)、 是一种弱酸,其结构式为。(5)、 的氧化物有多种,其中五氧化铬,常温下为蓝色结晶,化学式为 ,也可写成 ,则其中过氧键的数目为。(6)、 的某种氧化物晶体的晶胞结构如图所示,其化学式为.设阿伏加德罗常数的值为 ,则该晶体的密度为 。
的合成路线流程图(无机试剂任选)。 25. 和 都是常见的氧化剂。(1)、 的基态原子的核外电子排布式为 , 的基态原子核外电子有种运动状态。(2)、 是石油化工中重要的催化剂之一,可催化异丙苯裂化生成苯和丙烯。 丙烯分子中含有 键与 键数目之比为 , 丙烯分子中碳原子的杂化轨道类型为。(3)、H、O、 三种元素的电负性按由大到小的顺序为(用元素符号表示)。(4)、 是一种弱酸,其结构式为。(5)、 的氧化物有多种,其中五氧化铬,常温下为蓝色结晶,化学式为 ,也可写成 ,则其中过氧键的数目为。(6)、 的某种氧化物晶体的晶胞结构如图所示,其化学式为.设阿伏加德罗常数的值为 ,则该晶体的密度为 。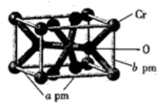 26. 氮化镓(GaN)结构与金刚石类似,是一种半导体材料,因其具有良好的电学特性,广泛的应用于电子行业,近年智能手机的快速充电器中就使用了氮化镓材料。(1)、基态N原子的电子排布式为;基态Ga原子核外电子能量最高的电子占据的能级为。(2)、GaN、GaP、GaAs熔点如下表所示,分析其变化原因。
26. 氮化镓(GaN)结构与金刚石类似,是一种半导体材料,因其具有良好的电学特性,广泛的应用于电子行业,近年智能手机的快速充电器中就使用了氮化镓材料。(1)、基态N原子的电子排布式为;基态Ga原子核外电子能量最高的电子占据的能级为。(2)、GaN、GaP、GaAs熔点如下表所示,分析其变化原因。晶体
GaN
GaP
GaAs
熔点/℃
1700
1480
1238
(3)、GaN可在高温下由金属Ga和NH3反应制取。N原子和H原子可以形成多种微粒,如:NH3、NH 、NH 、N2H4、N2H 、N2H 等。在N2H 中,N原子的杂化方式为。与N2H 互为等电子体的物质是(写出一种);在N2H 中存在的化学键类型有。a.极性键 b.非极性键 c.离子键 d.配位键
(4)、GaN的晶胞结构如图所示:其中与Ga原子最近的N原子所构成的空间结构为;若GaN晶体的密度为6.1 g/cm3 , 阿伏加德罗常数为NA , 则距离最近的两个N原子间的距离为nm(写出表达式即可)。 27. 近年来,我国工程建设自主创新能力实现大跨越,尤其在新材料研究方面有重大突破,回答下列问题:(1)、钛是一种新兴的结构材料,比钢轻、比铝硬。基态钛原子的价电子排布式为 , 与钛同周期的元素中,基态原子的未成对电子数与钛相同的有种;(2)、铁能与三氮唑(结构见图甲)形成多种配合物。
27. 近年来,我国工程建设自主创新能力实现大跨越,尤其在新材料研究方面有重大突破,回答下列问题:(1)、钛是一种新兴的结构材料,比钢轻、比铝硬。基态钛原子的价电子排布式为 , 与钛同周期的元素中,基态原子的未成对电子数与钛相同的有种;(2)、铁能与三氮唑(结构见图甲)形成多种配合物。
①1mol三氮唑中所含σ键的数目为 mol; 碳原子杂化方式是;
②三氮唑的沸点为260℃,与之结构相似且相对分子质量接近的环戊二烯(结构见图乙)的沸点为42.5℃,前者沸点较高的原因是。
(3)、碳化钨是耐高温耐磨材料。图丙为碳化钨晶体的部分结构,碳原子嵌入金属的晶格间隙,并不破坏原有金属的晶格,形成填隙化合物。
①在该结构中,每个钨原子周围距离其最近的碳原子有个:
②假设该部分晶体的体积为Vcm3 , 碳化钨的摩尔质量为M g•mol-1 , 密度为d g•cm-3 , 则阿伏加德罗常数的值NA用上述数据表示为。
③金属镁的晶体结构与碳化钨相似,金属镁的晶胞可用图丁表示,已知镁原子的半径为r pm,晶胞高为h pm,求晶胞中镁原子的空间利用率(用化简后含字时π、r和h的代数式表示)
28. 金属Ni可以与Mg、C形成一种化合物M,M是一种新型超导体,它的临界温度为8K。回答下列问题:(1)、在基态Mg原子中,核外存在对自旋相反的电子。(2)、碳在矿物中,通常以碳酸盐形式存在。根据价层电子对互斥理论,可推知CO 的空间构型为 , 其中碳原子的杂化轨道类型为。NaHCO3的溶解度比Na2CO3的小,其原因是HCO 在水溶液中易形成多聚离子,请解释HCO 形成多聚离子的原因是。(3)、Ni的基态原子的价层电子排布式为。区分晶体Ni和非晶体Ni的最可靠的科学方法为。向绿色的NiSO4溶液中滴加过量的氨水,溶液会变成深蓝色,其原因是溶液中生成了一种六配体的配离子,该配离子的化学式为。(4)、已知M的晶胞(α = β = γ = 90°)结构如下图所示,则M的化学式为。其晶胞参数为:a = b = c = d pm,该晶体的密度为g·cm-3.(列出计算式)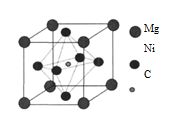 29. 已知Mn、Fe、Co是组成合金的重要元素,P、S、Cl是农药中的重要元素。回答下列问题:(1)、Mn元素位于元素周期表的区,基态锰原子的价电子排布图为 。(2)、P、S、Cl三种元素的第一电离能由大到小顺序为 。(3)、已知NH3的沸点高于PH3 , 原因是。(4)、农药“乐果”中的主要成分O,O-二甲基-S-(N-甲基氨基甲酰甲基)二硫代磷酸酯的分子结构为:
29. 已知Mn、Fe、Co是组成合金的重要元素,P、S、Cl是农药中的重要元素。回答下列问题:(1)、Mn元素位于元素周期表的区,基态锰原子的价电子排布图为 。(2)、P、S、Cl三种元素的第一电离能由大到小顺序为 。(3)、已知NH3的沸点高于PH3 , 原因是。(4)、农药“乐果”中的主要成分O,O-二甲基-S-(N-甲基氨基甲酰甲基)二硫代磷酸酯的分子结构为: ,其中N原子的杂化类型为 。 (5)、已知P4(白磷)为正四面体结构,与氧气反应生成非极性分子P4O10 , 其中P在空间的相对位置不变,则P4O10中σ键和π键的数目之比为。(6)、已知一种立方型FeS2晶体的晶胞如图所示,则与体心Fe2+距离最近且等距离的S 的数目为。如可用晶胞参数为单位长度建立的坐标系表示晶胞中各原子的位置,并称作原子分数坐标,则该晶胞中体心Fe2+的坐标为 。(7)、已知该立方型FeS2晶体的晶胞参数为a pm,密度为d g·cm-3 , 阿伏加德罗常数的值为NA , 则a与d的关系是a = (用d、NA表示a)。
,其中N原子的杂化类型为 。 (5)、已知P4(白磷)为正四面体结构,与氧气反应生成非极性分子P4O10 , 其中P在空间的相对位置不变,则P4O10中σ键和π键的数目之比为。(6)、已知一种立方型FeS2晶体的晶胞如图所示,则与体心Fe2+距离最近且等距离的S 的数目为。如可用晶胞参数为单位长度建立的坐标系表示晶胞中各原子的位置,并称作原子分数坐标,则该晶胞中体心Fe2+的坐标为 。(7)、已知该立方型FeS2晶体的晶胞参数为a pm,密度为d g·cm-3 , 阿伏加德罗常数的值为NA , 则a与d的关系是a = (用d、NA表示a)。 30. 铜及其化合物在生产生活中有广泛的应用,宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色就是来自Cu(OH)2•CuCO3。回答下列问题:(1)、基态Cu2+的核外电子排布式 , Cu在元素周期表中属于区。(2)、CO 的空间构型为。(3)、铜的某种配合物结构如图,该配合物中Cu2+的配位数为 , 其中C、N、O按第一电离能由小到大的顺序排列为。该配合物中碳原子的杂化方式为。该配体能Cu2+形成稳定的环状离子,其原因是。
30. 铜及其化合物在生产生活中有广泛的应用,宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色就是来自Cu(OH)2•CuCO3。回答下列问题:(1)、基态Cu2+的核外电子排布式 , Cu在元素周期表中属于区。(2)、CO 的空间构型为。(3)、铜的某种配合物结构如图,该配合物中Cu2+的配位数为 , 其中C、N、O按第一电离能由小到大的顺序排列为。该配合物中碳原子的杂化方式为。该配体能Cu2+形成稳定的环状离子,其原因是。 (4)、钇钡铜氧是一种新型节能高温超导体,其晶胞结构如图a。研究发现,此高温超导体中的Cu元素有两种价态,分别为+2和+3,Y元素的化合价为+3。该物质的化学式为 , 该物质中Cu2+与Cu3+的个数比为。
(4)、钇钡铜氧是一种新型节能高温超导体,其晶胞结构如图a。研究发现,此高温超导体中的Cu元素有两种价态,分别为+2和+3,Y元素的化合价为+3。该物质的化学式为 , 该物质中Cu2+与Cu3+的个数比为。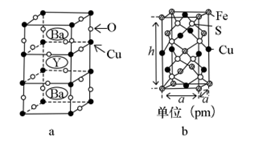 (5)、已知黄铜矿中铁、硫、铜组成晶胞结构如图b,化学式为CuFeS2。若晶体密度为dg•cm-3 , 则晶胞的高h=pm(写出简化后的计算式即可)。31. 第IVA元素在地壳中含量丰富,在人类生活各方面都有广泛的应用。回答下列问题。(1)、基态C原子中填充了电子的原子轨道共有个,基态Si原子的价电子电子排布式为 , 第 一电离能C Ge (填“大于”、“小于”或“等于”)。(2)、X是碳的一种氧化物,X的五聚合体结构如图1所示。则X的分子式为 ; X分子中每个原子都满足最外层8电子结构,X分子的电子式为。X的沸点CO2的沸点(填“大于”、“小于” 或“等于”)
(5)、已知黄铜矿中铁、硫、铜组成晶胞结构如图b,化学式为CuFeS2。若晶体密度为dg•cm-3 , 则晶胞的高h=pm(写出简化后的计算式即可)。31. 第IVA元素在地壳中含量丰富,在人类生活各方面都有广泛的应用。回答下列问题。(1)、基态C原子中填充了电子的原子轨道共有个,基态Si原子的价电子电子排布式为 , 第 一电离能C Ge (填“大于”、“小于”或“等于”)。(2)、X是碳的一种氧化物,X的五聚合体结构如图1所示。则X的分子式为 ; X分子中每个原子都满足最外层8电子结构,X分子的电子式为。X的沸点CO2的沸点(填“大于”、“小于” 或“等于”) (3)、C20分子是由许多正五边形构成的空心笼状结构如图2所示,分子中每个碳原子只跟相邻的3个碳原子形成化学键。则C20分子中含个 σ键, 请你大胆猜测:C20 分子中碳原子的杂化轨道为(4)、β-SiC晶胞如图3所示,若碳和硅的原子半径分别为a pm和b pm,密度为 g/cm3 , 其原子的空间利用率( 即晶胞中原子体积占空间体积的百分率)为(用含a、b、p、NA的代数式表示,NA表示阿伏加德罗常数的值)。32. VA族元素及其化合物在生产、生活中用途广泛。(1)、①P4S3常用于制造火柴,P和S的第一电离能较大的是。
(3)、C20分子是由许多正五边形构成的空心笼状结构如图2所示,分子中每个碳原子只跟相邻的3个碳原子形成化学键。则C20分子中含个 σ键, 请你大胆猜测:C20 分子中碳原子的杂化轨道为(4)、β-SiC晶胞如图3所示,若碳和硅的原子半径分别为a pm和b pm,密度为 g/cm3 , 其原子的空间利用率( 即晶胞中原子体积占空间体积的百分率)为(用含a、b、p、NA的代数式表示,NA表示阿伏加德罗常数的值)。32. VA族元素及其化合物在生产、生活中用途广泛。(1)、①P4S3常用于制造火柴,P和S的第一电离能较大的是。②As4S4俗称雄黄,其中基态As原子的价电子排布式为 , 有个未成对电子。
③P、S、As电负性由大到小的顺序是。
(2)、氢化物PH3、CH4、NH3的沸点由高到低的顺序为。(3)、白磷在氯气中燃烧可以得到PCl3和PCl5。气态PCl3分子中P原子的轨道杂化方式为。(4)、超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与个氮原子相连,与同一个氮原子相连的铝原子构成的立体构型为。(5)、贵金属磷化物Rh2P(化学式式量为237)可用作电解水的高效催化剂,其立方晶胞如图所示。已知晶胞参数为apm,晶体中与P距离最近的Rh的数目为 , 晶体的密度为g·cm-3(列出计算式)。 33. 秦兵马俑展现了我国古代科技文化的伟大成就。近年来人们研究发现秦俑彩绘所用的原料的主要成分为BaCuSi2O6 , 含有微量硫元素等。回答下列问题:(1)、原子轨道是指电子在原子核外的。Cu原子核外电子占据最高能级的符号是 , Cu原子核外最外层电子的电子云轮廓图形状为。(2)、硫化硅为白色晶体,分子式为SiS2 , 遇水分解为SiO2及H2S气体,分解反应中所涉及的
33. 秦兵马俑展现了我国古代科技文化的伟大成就。近年来人们研究发现秦俑彩绘所用的原料的主要成分为BaCuSi2O6 , 含有微量硫元素等。回答下列问题:(1)、原子轨道是指电子在原子核外的。Cu原子核外电子占据最高能级的符号是 , Cu原子核外最外层电子的电子云轮廓图形状为。(2)、硫化硅为白色晶体,分子式为SiS2 , 遇水分解为SiO2及H2S气体,分解反应中所涉及的所有元素的电负性由大到小的顺序为(填元素符号);SiS2的结构与CS2类似,则SiS2分子的空间构型为。
(3)、一种含Cu、S元素的有机物的结构简式如图1所示,该有机物中存在的作用力类型有 (填标号),N原子的杂化方式为。a.极性键 b.离子键 c.非极性键 d.配位键 e.金属键
 (4)、TiO2与BaCO3一起熔融可制得钛酸钡(BaTiO3),晶胞结构如图2所示(O2−均与Ti4+、Ba2+相接触),已知O2−的半径为xpm,晶胞边长为ypm,则Ti4+、Ba2+的半径分别为pm、pm。
(4)、TiO2与BaCO3一起熔融可制得钛酸钡(BaTiO3),晶胞结构如图2所示(O2−均与Ti4+、Ba2+相接触),已知O2−的半径为xpm,晶胞边长为ypm,则Ti4+、Ba2+的半径分别为pm、pm。