高考二轮复习知识点:相似相溶原理及其应用
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 中科院院士研究发现,纤维素可在低温下溶于NaOH溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,为纤维素绿色再生利用提供了新的解决方案。下列说法错误的是
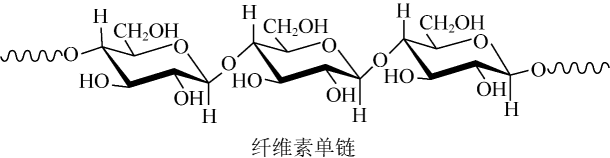 A、纤维素是自然界分布广泛的一种多糖 B、纤维素难溶于水的主要原因是其链间有多个氢键 C、NaOH提供破坏纤维素链之间的氢键 D、低温降低了纤维素在NaOH溶液中的溶解性2. 下列事实与解释不相符的是
A、纤维素是自然界分布广泛的一种多糖 B、纤维素难溶于水的主要原因是其链间有多个氢键 C、NaOH提供破坏纤维素链之间的氢键 D、低温降低了纤维素在NaOH溶液中的溶解性2. 下列事实与解释不相符的是选项
事实
解释
A
甲苯能使酸性高锰酸钾溶液褪色,而烷烃不能
苯环活化了甲基
B
比稳定
水分子间可以形成氢键
C
易溶于而微溶于
和为非极性分子,而为极性分子
D
酸性弱于
甲基为推电子基,使乙酸羧基中的羟基的极性变小,电离程度比甲酸弱
A、A B、B C、C D、D3. 邮票背面的粘合剂可用水浸除去,根据“相似相溶”原理,该粘合剂的成分可能是( )A、 B、
B、 C、
C、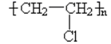 D、
D、 4. 下列有关有机化合物的叙述正确的是( )A、分子式为C2H6O的有机物具有相同的化学性质 B、分子式为C8H10的芳香烃共有3种 C、在水中的溶解度:甲酸甲酯<乙酸 D、可以用酸性高锰酸钾溶液除去甲烷中的乙烯5. 下列现象不能用“相似相溶”规律解释的是( )A、甲烷不溶于水 B、氯化氢易溶于水 C、单质碘易溶于苯 D、氯气易溶于NaOH溶液6. 最简单的氨基酸是甘氨酸(),它是人体非必需的一种氨基酸。下列有关说法错误的是( )A、1个分子中σ键与π键数目比为8∶1 B、碳原子的杂化轨道类型是sp3和sp2 C、分子间可以形成不止3种类型的氢键 D、易溶于极性溶剂,难溶于非极性溶剂7. 三氟乙酸乙酯是制备某种抗新冠病毒药物的原料,下列说法错误的是( )A、该分子是极性分子,所以在水中的溶解度很大 B、该分子中的碳原子有两种杂化方式 C、合成该分子所需的原料三氟乙酸的酸性大于乙酸 D、1个该分子中含有13个σ键和1个π键8. 利巴韦林为广谱抗病毒药,其结构如图所示。下列说法错误的是( )
4. 下列有关有机化合物的叙述正确的是( )A、分子式为C2H6O的有机物具有相同的化学性质 B、分子式为C8H10的芳香烃共有3种 C、在水中的溶解度:甲酸甲酯<乙酸 D、可以用酸性高锰酸钾溶液除去甲烷中的乙烯5. 下列现象不能用“相似相溶”规律解释的是( )A、甲烷不溶于水 B、氯化氢易溶于水 C、单质碘易溶于苯 D、氯气易溶于NaOH溶液6. 最简单的氨基酸是甘氨酸(),它是人体非必需的一种氨基酸。下列有关说法错误的是( )A、1个分子中σ键与π键数目比为8∶1 B、碳原子的杂化轨道类型是sp3和sp2 C、分子间可以形成不止3种类型的氢键 D、易溶于极性溶剂,难溶于非极性溶剂7. 三氟乙酸乙酯是制备某种抗新冠病毒药物的原料,下列说法错误的是( )A、该分子是极性分子,所以在水中的溶解度很大 B、该分子中的碳原子有两种杂化方式 C、合成该分子所需的原料三氟乙酸的酸性大于乙酸 D、1个该分子中含有13个σ键和1个π键8. 利巴韦林为广谱抗病毒药,其结构如图所示。下列说法错误的是( ) A、分子中有5个手性碳原子 B、利巴韦林水溶性较好,可以与盐酸反应 C、利巴韦林能够发生氧化、取代反应和消去反应 D、羟基中的极性强于亚甲基(-CH2-)中的极性9. 下列理论解释不符合实验事实的是( )
A、分子中有5个手性碳原子 B、利巴韦林水溶性较好,可以与盐酸反应 C、利巴韦林能够发生氧化、取代反应和消去反应 D、羟基中的极性强于亚甲基(-CH2-)中的极性9. 下列理论解释不符合实验事实的是( )选项
实验事实
理论解释
A
的熔点高于
的相对分子质量更大
B
和都能溶于溶液
和在元素周期表中是对角线关系,性质相似
C
酸性:
中非羟基氧原子个数更多,中心原子的正电性更高
D
在苯中的溶解度比在水中大
和苯都是非极性分子,而是极性分子
A、A B、B C、C D、D10. 下列说法中错误的是( )A、硫难溶于水,微溶于酒精,易溶于 , 说明分子极性: B、有的金属和非金属融合制成的合金延展性变差可以用电子气理论解释 C、乳酸[]分子中只存在1个手性碳原子 D、是含非极性键的极性分子11. 下列说法错误的是( )A、夏天当厕所里比较刺鼻时,用大量水冲洗可避免其气味,利用了气体的相似相溶原理 B、s区所有元素原子的价电子都在s轨道 C、含1mol[Ti(NH3)5Cl]Cl2 的水溶液中加入足量 AgNO3溶液,产生 3mol白色沉淀 D、以极性键结合起来的分子不一定是极性分子12. 已知的空间结构为V形,分子中正电中心与负电中心不重合。下列关于和的说法错误的是( )A、分子中的化学键为非极性键 B、在水中的溶解度比在中的大 C、在水中的溶解度和一样 D、在中的溶解度比在水中的大13. 类比推理是化学中常用的思维方法,下列推理正确的是( )A、CCl4的熔沸点小于SiCl4 , 则NCl3的熔沸点小于PCl3 B、CH3CH2OH在水中的溶解度很大,则1−戊醇在水中的溶解度也很大 C、N≡N由于键能大而结构稳定,则C≡C键能也大结构也很稳定 D、AgNO3溶液和过量NaOH反应先生成白色沉淀,然后转变为灰色,则AgNO3溶液和过量NH3·H2O反应现象也相同14. 对下列实验事实的理论解释错误的是( )选项
实验事实
理论解释
A
碘单质在苯中溶解度比在水中大
苯和都是非极性分子,而是极性分子
B
Be单质能溶于KOH溶液
Be和Al在周期表中是对角线关系,性质相似
C
稳定性:HF>HI
非金属性:F>I
D
的分解温度高于
的式量比大
A、A B、B C、C D、D15. 下列叙述正确的是( )A、氯仿、四氯甲烷和苯是工业上重要的有机溶剂 B、、、、是同系物 C、烷烃分子中的碳原子与其它原子的结合方式是通过两个共价键 D、在一定条件下,可与、浓硫酸发生化学反应16. 下列说法中错误的是( )A、邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低 B、碘易溶于四氦化碳, 在水中的溶解度很小都可用“相似相溶”原理解释 C、向含0.1mol 的水溶液中加入足量 溶液只生成0.1mol AgCl D、液态氟化氢中氟化氢分子之间形成氢键,可写为 ,则 分子间也是因氢键而聚合形成17. 下列现象不能用“相似相溶”原理解释的是( )A、氯化氢易溶于水 B、氯气易溶于 溶液 C、用 萃取碘水中的碘 D、苯与水混合静置后分层18. 下列对分子结构及其性质的解释中,错误的是( )A、 与 中心原子的价层电子对数相同 B、液态氟化氢的化学式有时写成(HF)n的形式与氢键有关 C、碘易溶于四氯化碳、甲烷难溶于水都可用相似相溶原理解释 D、酸性:H3PO4>HClO,是因为H3PO4分子中氢原子数比HClO的多19. 分别将下列各物质等体积混合,在室温下剧烈振荡,静置后能形成均匀溶液的是( )A、乙酸乙酯 水 B、苯 水 C、乙醇 水 D、四氯化碳 碘水20. 下列各项比较中前者高于(或大于或强于)后者的是( )A、CCl4和SiCl4的熔点 B、对羟基苯甲醛( )和邻羟基苯甲醛(
)和邻羟基苯甲醛(  )的沸点
C、I2在水中的溶解度和I2在CCl4溶液中的溶解度
D、H2SO3和H2SO4的酸性
21. 下列说法正确的是( )A、物质的溶解性为难溶,则该物质不溶于水 B、不溶于水的物质溶解度为0 C、绝对不溶解的物质是不存在的 D、某离子被沉淀完全是指该离子在溶液中的浓度为022. 根据实际和经验推知,下列叙述错误的是( )A、卤化氢易溶于水,不易溶于四氯化碳 B、碘易溶于汽油,微溶于水 C、氯化钠易溶于水,也易溶于食用油 D、丁烷易溶于煤油,难溶于水23. HCl气体易溶于溶剂A,那么下列物质也可能易溶于A的是( )A、NH3 B、CH4 C、CCl4 D、O224. 下列对一些实验事实的理论解释正确的是( )
)的沸点
C、I2在水中的溶解度和I2在CCl4溶液中的溶解度
D、H2SO3和H2SO4的酸性
21. 下列说法正确的是( )A、物质的溶解性为难溶,则该物质不溶于水 B、不溶于水的物质溶解度为0 C、绝对不溶解的物质是不存在的 D、某离子被沉淀完全是指该离子在溶液中的浓度为022. 根据实际和经验推知,下列叙述错误的是( )A、卤化氢易溶于水,不易溶于四氯化碳 B、碘易溶于汽油,微溶于水 C、氯化钠易溶于水,也易溶于食用油 D、丁烷易溶于煤油,难溶于水23. HCl气体易溶于溶剂A,那么下列物质也可能易溶于A的是( )A、NH3 B、CH4 C、CCl4 D、O224. 下列对一些实验事实的理论解释正确的是( )选项
实验事实
理论解释
A
碘单质在 CCl4 中溶解度比在水中大
CCl4 和 I2 都是非极性分子, 而 H2O 是极性分子
B
CO2 为直线形分子
CO2 分子中 C═O 是极性键
C
金刚石的熔点低于石墨
金刚石是分子晶体,石墨是原子晶体
D
HF 的沸点高于 HCl
HF 的相对分子质量小于 HCl
A、A B、B C、C D、D25. 下列说法正确的是( )A、室温下,在水中的溶解度:丙三醇>苯酚>1﹣氯丁烷 B、用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 C、用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 D、油脂在酸性或碱性条件下均可发生水解反应,且产物相同二、非选择题
-
26. 氯化钡是重要的化工原料,是制备其他钡盐的主要中间原料,以毒重石(主要成分为BaCO3 , 还含有SiO2及含Ca、Mg、Fe、Al的化合物)为原料制备BaCl2·2H2O的工艺流程如下:
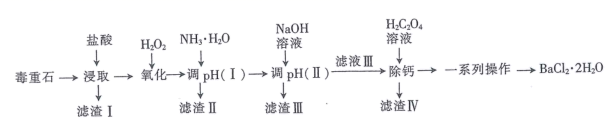
已知:盐酸“浸取”后,Ca、Mg、Fe、Al元素分别以Ca2+、Mg2+、Fe2+、Al3+形式存在于溶液中。
回答下列问题:
(1)、在“浸取”时,除温度、酸的浓度、液固比等因素影响钡的浸出率外,还有因素。(2)、下表列举了不同温度、盐酸的浓度、液固比下钡的浸出率实验数据,每个实验只改变一个条件:改变的条件
温度(℃)
盐酸的浓度(%)
液固比
30
55
75
10
15
20
25。
3:1
4:1
5:1
6:1
钡的浸出率(%)
74.31
69.60
68.42
59.21
74.31
74.15
55.32
59.84
65.12
74.31
74.35
分析表中数据,温度越高钡的浸出率越低的可能原因是;判断“浸取”的最佳液固比为。
(3)、常温时,几种金属离子沉淀的pH如图所示,加H2O2时发生反应的离子方程式为。“调pH(I)”时,调节溶液pH≈5,则“滤渣II”的主要成分为(填化学式)。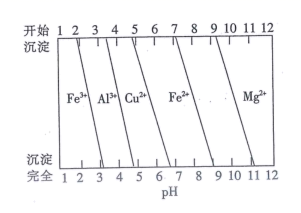 (4)、“一系列操作”中洗涤晶体时,通常采用乙醇洗而不采用水洗,原因是。(5)、“除钙”前,需测定溶液中钙离子的含量,从而确定加入草酸的量,测钙离子含量的操作为取“滤液III”V1mL,加入稍过量的铬酸钾,使钡离子完全沉淀,过滤,将滤液转入250mL容量瓶后再加水定容,取其中25. 00 mL于锥形瓶中,用NaOH溶液将pH调为13,加入黄绿素作指示剂(黄绿素溶液为红色,能与钙离子形成络合物使溶液呈黄绿色) ,用0.100 mol·L-1的标准EDTA溶液滴定(EDTA能与Ca2+以1: 1形成无色络合物)至终点,消耗标准EDTA溶液V2 mL。
(4)、“一系列操作”中洗涤晶体时,通常采用乙醇洗而不采用水洗,原因是。(5)、“除钙”前,需测定溶液中钙离子的含量,从而确定加入草酸的量,测钙离子含量的操作为取“滤液III”V1mL,加入稍过量的铬酸钾,使钡离子完全沉淀,过滤,将滤液转入250mL容量瓶后再加水定容,取其中25. 00 mL于锥形瓶中,用NaOH溶液将pH调为13,加入黄绿素作指示剂(黄绿素溶液为红色,能与钙离子形成络合物使溶液呈黄绿色) ,用0.100 mol·L-1的标准EDTA溶液滴定(EDTA能与Ca2+以1: 1形成无色络合物)至终点,消耗标准EDTA溶液V2 mL。①滴定至终点时的现象为。
②该溶液中钙离子的浓度为 (用含 V1、V2的代数式表示)g·mL-1。
27. 据报道复旦大学修发贤教授课题组成功制备出砷化铌纳米带,并观测到其表面态具有百倍于金属铜薄膜和千倍于石墨烯的导电性。相关研究论文已在线发表于权威科学期刊《自然》。回答下列问题:(1)、铌元素(Nb)为一种金属元素,其基态原子的核外电子排布式为[Kr]4d55s1。下列是Nb的不同微粒的核外电子排布式,其中失去最外层1个电子所需能量最小的是(填标号)。a.[Kr]4d35s15p1b.[Kr]4d45s1c.Kr]4d2d.Kr]4d3
(2)、砷为第VA族元素,砷可以与某些有机基团形成有机化合物,如(ClCH=CH)2AsCl,其中As原子与2个C原子、1个Cl原子形成的VSEPR模型为。(3)、英国曼彻斯特大学物理学家安德烈·盖姆和康斯坦丁诺沃肖洛夫用微机械剥离法成功从石墨中分离出石墨烯,因此共同获得2010年诺贝尔物理学奖;而石墨烯具有优异的光学、电学、力学特性在材料学、微纳加工、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来革命性的材料。已知“石墨烯”的平面结构如图所示,一定条件下石墨烯与H2发生加成反应生成石墨烷,石墨烷中碳原子杂化类型是 , 石墨烯导电的原因是。
 (4)、石墨烯也可采用化学方法进行制备如采用六氯苯、六溴苯作为原料可制备石墨烯。下表给出了六氯苯、六溴苯、苯六酸俗名为蜜石酸的熔点和水溶性:
(4)、石墨烯也可采用化学方法进行制备如采用六氯苯、六溴苯作为原料可制备石墨烯。下表给出了六氯苯、六溴苯、苯六酸俗名为蜜石酸的熔点和水溶性:物质
六氯苯

六溴苯

苯六酸

熔点/℃
231
325
287
水溶性
不溶
不溶
易溶
六溴苯的熔点比六氯苯高的原因是 , 苯六酸与六溴苯、六氯苯的水溶性存在明显的差异本质原因是。
(5)、出于以更高效率利用太阳光等目的研制出金红石型铌氧氮化物(NbON),比以往的光学半导体更能够吸收长波长侧的光,作为光学半导体的新材料。该化合物的晶胞有如图所示的两种构型,若晶胞的边长为apm,该晶体的密度为g·cm-3。(NA是阿伏加德罗常数的值,相关原子量:Nb—93) 28. 按要求回答以下问题:(1)、已知MgCl2水解时会生成中间产物碱式氯化镁Mg(OH)Cl(白色,不溶于水),写出该反应的离子方程式;(2)、由以下数据可知:
28. 按要求回答以下问题:(1)、已知MgCl2水解时会生成中间产物碱式氯化镁Mg(OH)Cl(白色,不溶于水),写出该反应的离子方程式;(2)、由以下数据可知:羧酸
pKa
乙酸(CH3COOH)
4.76
三氯乙酸(CCl3COOH)
0.65
酸性比较:乙酸三氯乙酸(填“>”、“<”或“=”),并说明原因:;
(3)、向碘的四氯化碳溶液中加入一定量 KI水溶液,振荡后,四氯化碳层紫红色变浅,水层溶液显黄色,请从平衡和结构的角度解释产生该现象的原因:;29. 乙酰水杨酸( )又名阿司匹林,是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[ ]为主要原料合成阿司匹林,反应原理如下:
)又名阿司匹林,是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[ ]为主要原料合成阿司匹林,反应原理如下:  +(CH3CO)2O
+(CH3CO)2O  +CH3COOH
+CH3COOH主要试剂和产品的物理常数如下表所示:
名称
相对分子质量
熔点或沸点(℃)
水溶性
水杨酸
138
158(熔点)
微溶
醋酸酐
102
139.4(沸点)
易水解
乙酰水杨酸
180
135(熔点)
微溶
请根据以上信息回答下列问题:
(1)、制备阿司匹林时要使用干燥的仪器,其原因是。(2)、合成阿司匹林时,最合适的加热方法是。(3)、提纯粗产品流程如下,加热回流装置如图。
粗产品 乙酰水杨酸
①实验过程中发现忘记加沸石,正确的处理方法是
②冷凝水的进水口是(填“a”或“b”)。
③提纯实验中乙酸乙酯的作用为。
④请设计实验判断粗产品中是否有未反应完全的水杨酸。
(4)、在实验中原料用量:3.0g水杨酸、10.0mL醋酸酐( ),最终称得产品质量为3.2g,则所得乙酰水杨酸的产率为(用百分数表示,保留小数点后一位)。30. 苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是 , 不溶于水,且密度比水小的是 .