高考二轮复习知识点:晶体的类型与物质的性质的相互关系及应用
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
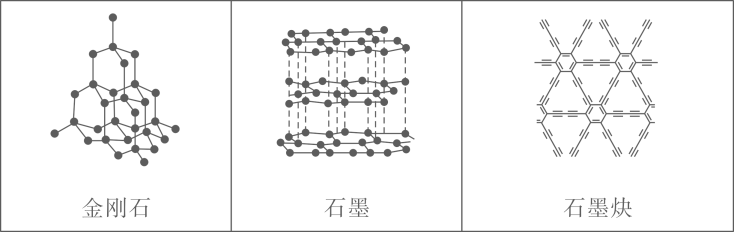
下列关于金刚石、石墨、石墨炔的说法正确的是( )
A、三种物质中均有碳碳原子间的键 B、三种物质中的碳原子都是杂化 C、三种物质的晶体类型相同 D、三种物质均能导电2. 阅读下列材料,完成5~7题:周期表中IVA族元素及其化合物应用广泛。甲烷具有较大的燃烧热(890.3 kJ·mol-1),是常见燃料;Si、 Ge是重要的半导体材料,硅晶体表面SiO2能与氢氟酸(HF,弱酸)反应生成H2SiF6 (H2SiF6在水中完全电离为H+和SiF62- ); 1885年德国化学家将硫化锗(GeS2)与H2共热制得了门捷列夫预言的类硅-锗;我国古代就掌握了青铜(铜-锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料。
(1)、下列说法正确的是( )A、金刚石与石墨烯中的夹角都为 B、、都是由极性键构成的非极性分子 C、锗原子()基态核外电子排布式为 D、ⅣA族元素单质的晶体类型相同(2)、下列化学反应表示正确的是( )A、与HF溶液反应: B、高温下还原: C、铅蓄电池放电时的正极反应: D、甲烷的燃烧:(3)、下列物质性质与用途具有对应关系的是( )A、石墨能导电,可用作润滑剂 B、单晶硅熔点高,可用作半导体材料 C、青铜比纯铜熔点低、硬度大,古代用青铜铸剑 D、含铅化合物颜色丰富,可用作电极材料3. 铝的卤化物AlX3(X=Cl、Br、I)气态时以Al2X6双聚形态存在,下列说法错误的是
性质
AlF3
AlCl3
AlBr3
AlI3
熔点/℃
1290
192.4
97.8
189.4
沸点/℃
1272
180
256
382
A、AlF3晶体类型与其他三种不同 B、1molAl2Cl6中所含配位键数目为4NA C、Al2X6中Al、X原子价电子层均满足8e-结构 D、AlCl3熔点高于AlBr3原因是Cl的电负性大于Br,具有一定离子晶体特征4. 西安交通大学和上海大学利用冷冻透射电子显微镜,在石墨烯膜上直接观察到了自然环境下生长的由钙元素和氯元素构成的二维晶体,其结构如图。下列说法中错误的是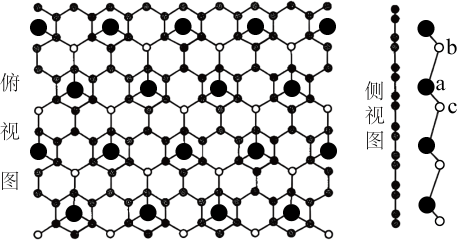 A、该二维晶体的化学式为 B、石墨烯C原子与键数之比为 C、图中a离子分别与b、c离子的距离不相等 D、该晶体的形成可能与钙离子和石墨间存在强的阳离子相互作用有关5. 只由非金属元素组成的化合物,一定不具有的性质是( )A、固体导电 B、能溶于水 C、硬度大 D、熔点低6. 利用超分子可分离C60和C70.将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如图。下列说法错误的是( )
A、该二维晶体的化学式为 B、石墨烯C原子与键数之比为 C、图中a离子分别与b、c离子的距离不相等 D、该晶体的形成可能与钙离子和石墨间存在强的阳离子相互作用有关5. 只由非金属元素组成的化合物,一定不具有的性质是( )A、固体导电 B、能溶于水 C、硬度大 D、熔点低6. 利用超分子可分离C60和C70.将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如图。下列说法错误的是( )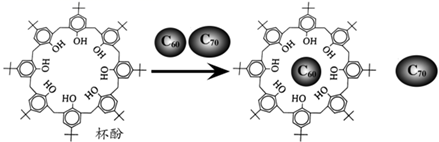 A、第一电离能:C<O B、杯酚分子中存在大π键 C、杯酚与C60形成氢键 D、C60与金刚石晶体类型不同7. 某晶体中含有非极性共价键,关于该晶体的说法错误的是( )A、可能是化合物 B、不可能是离子晶体 C、可能是分子晶体 D、可能有很高的熔沸点8. 已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中正确的是( )A、C3N4晶体是分子晶体 B、C3N4晶体中C—N键的键长比金刚石中的C—C键的键长长 C、C3N4晶体中C、N原子个数之比为4∶3 D、C3N4晶体中粒子间通过共价键相结合9. 常温常压下呈气态的化合物,降温使其固化得到的晶体一般属于( )A、原子晶体 B、离子晶体 C、金属晶体 D、分子晶体10. 沸点为316℃,常用于蚀刻电路板。硫酸亚铁铵[]常用于治疗缺铁性贫血,向硫酸亚铁铵溶液中加入几滴双氧水,振荡后再向其中滴加几滴KSCN溶液,溶液呈红色,该红色物质为下列说法错误的是( )A、中三种非金属元素的氢化物沸点大小一定符合 B、为分子晶体 C、与具有相似的空间构型 D、中心离子的配位数为611. 碘的晶胞结构示意图如图,下列说法正确的是
A、第一电离能:C<O B、杯酚分子中存在大π键 C、杯酚与C60形成氢键 D、C60与金刚石晶体类型不同7. 某晶体中含有非极性共价键,关于该晶体的说法错误的是( )A、可能是化合物 B、不可能是离子晶体 C、可能是分子晶体 D、可能有很高的熔沸点8. 已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中正确的是( )A、C3N4晶体是分子晶体 B、C3N4晶体中C—N键的键长比金刚石中的C—C键的键长长 C、C3N4晶体中C、N原子个数之比为4∶3 D、C3N4晶体中粒子间通过共价键相结合9. 常温常压下呈气态的化合物,降温使其固化得到的晶体一般属于( )A、原子晶体 B、离子晶体 C、金属晶体 D、分子晶体10. 沸点为316℃,常用于蚀刻电路板。硫酸亚铁铵[]常用于治疗缺铁性贫血,向硫酸亚铁铵溶液中加入几滴双氧水,振荡后再向其中滴加几滴KSCN溶液,溶液呈红色,该红色物质为下列说法错误的是( )A、中三种非金属元素的氢化物沸点大小一定符合 B、为分子晶体 C、与具有相似的空间构型 D、中心离子的配位数为611. 碘的晶胞结构示意图如图,下列说法正确的是 A、碘晶体熔化时需克服共价键 B、1个碘晶胞中含有4个碘分子 C、晶体中碘分子的排列有3种不同取向 D、碘晶体中每个I2周围等距且紧邻的I2有6个12. 下列各组物质中,化学键类型相同,形成的晶体类型也相同的是A、和 B、和 C、和 D、KCl和HCl13. 下列物质发生变化时,所克服的粒子间相互作用力属于同种类型的是( )A、石墨和二氧化硅分别受热熔化 B、干冰和苯酚分别受热变为气体 C、硫酸钠和镁分别受热熔化 D、食盐和葡萄糖分别溶解在水中
A、碘晶体熔化时需克服共价键 B、1个碘晶胞中含有4个碘分子 C、晶体中碘分子的排列有3种不同取向 D、碘晶体中每个I2周围等距且紧邻的I2有6个12. 下列各组物质中,化学键类型相同,形成的晶体类型也相同的是A、和 B、和 C、和 D、KCl和HCl13. 下列物质发生变化时,所克服的粒子间相互作用力属于同种类型的是( )A、石墨和二氧化硅分别受热熔化 B、干冰和苯酚分别受热变为气体 C、硫酸钠和镁分别受热熔化 D、食盐和葡萄糖分别溶解在水中二、非选择题
-
14. CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:(1)、Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为 , 其固体的晶体类型为。(2)、NH3、PH3、AsH3的沸点由高到低的顺序为(填化学式,下同),还原性由强到弱的顺序为 , 键角由大到小的顺序为。(3)、含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有mol,该螯合物中N的杂化方式有种。
 (4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
(4)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。坐标
原子
x
y
z
Cd
0
0
0
Sn
0
0
0.5
As
0.25
0.25
0.125

一个晶胞中有个Sn,找出距离Cd(0,0,0)最近的Sn(用分数坐标表示)。CdSnAs2
晶体中与单个Sn键合的As有个。
15. 【选修三:物质结构与性质】磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。回答下列问题:(1)、在周期表中,与Li的化学性质最相似的邻族元素是 , 该元素基态原子核外M层电子的自旋状态(填“相同”或“相反”)。(2)、FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为 , 其中Fe的配位数为。(3)、苯胺 )的晶体类型是。苯胺与甲苯(
)的晶体类型是。苯胺与甲苯(  )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是。 (4)、NH4H2PO4中,电负性最高的元素是;P的杂化轨道与O的2p轨道形成键。(5)、NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是。 (4)、NH4H2PO4中,电负性最高的元素是;P的杂化轨道与O的2p轨道形成键。(5)、NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示: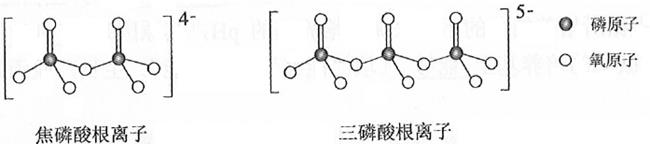
这类磷酸根离子的化学式可用通式表示为(用n代表P原子数)。
16. 回答下列问题:(1)、①基态Ni原子价层电子的电子排布图为。②含有4个水分子的醋酸镍[Ni(C2H3O2)2·4H2O]构型为八面体,则中心Ni原子的配位数为。
(2)、富马酸 结构中,碳原子的杂化类型是 , 其中元素的电负性由大到小排序为。 (3)、NaBH4是有机合成中常用的还原剂,BH离子的空间构型为 ,与BH互为等电子体的一种阳离子为 (填离子符号), NaBH4中存在 (填字母)。
结构中,碳原子的杂化类型是 , 其中元素的电负性由大到小排序为。 (3)、NaBH4是有机合成中常用的还原剂,BH离子的空间构型为 ,与BH互为等电子体的一种阳离子为 (填离子符号), NaBH4中存在 (填字母)。A.离子键 B.σ键 C.π键 D.氢键
(4)、OF2的熔、沸点低于Cl2O,原因是。(5)、TiO2通过氮掺杂反应生成TiO2-aNb , 表示如图。
①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为 g/cm3
②图乙TiO2-aNb晶体中a=。
17. 我国科学家研究发现,在KOH催化下,CO(NH2)2和LiTPSI还原形成稳定的LiF/高分子双层SEI,使LiMn2O4//Li4T15O12电池稳定工作。请回答下列问题:(1)、基态Mn2+的电子排布式为[Ar]。基态K原子核外电子云轮廓图呈球形的能级上占据的电子总数为。(2)、Mn的第三电离能大于Fe的第三电离能的主要原因是。(3)、CO(NH2)2中元素电负性由大到小的顺序为(用元素符号表示)。CO(NH2)2分子中碳原子的杂化方式为。(4)、几种钛的卤化物的熔点如表所示:卤化物
TiF4
TiCl4
TiBr4
TiI4
熔点/℃
377
-25
39
150
钛的卤化物熔点呈上述变化的主要原因是。
(5)、一种钛的氧化物晶胞如图1所示,其化学式为。 (6)、由钾、镍、氟组成的一种晶体结构如图2所示,该晶体密度为g·cm-3(只列计算式即可)。
(6)、由钾、镍、氟组成的一种晶体结构如图2所示,该晶体密度为g·cm-3(只列计算式即可)。 18. 我国科研工作者最近发现并制备了一系列主要由 O、P、Se、Bi 等元素组成的导电材料。回答下列问题:(1)、基态硒原子的价电子排布式为;SeO2的熔点为 350 ℃,加热易升华,固态SeO2属于 晶体。(2)、O、P、S三种元素中,电负性最大的是;键角:H2OH2Se(填">"、"<"或"=")。(3)、纯净的磷酸粘度极大,随温度升高粘度迅速下降,原因是;熔融状态的磷酸导电性很好,这是由于在纯磷酸中存在如下质子交换导电机理。
18. 我国科研工作者最近发现并制备了一系列主要由 O、P、Se、Bi 等元素组成的导电材料。回答下列问题:(1)、基态硒原子的价电子排布式为;SeO2的熔点为 350 ℃,加热易升华,固态SeO2属于 晶体。(2)、O、P、S三种元素中,电负性最大的是;键角:H2OH2Se(填">"、"<"或"=")。(3)、纯净的磷酸粘度极大,随温度升高粘度迅速下降,原因是;熔融状态的磷酸导电性很好,这是由于在纯磷酸中存在如下质子交换导电机理。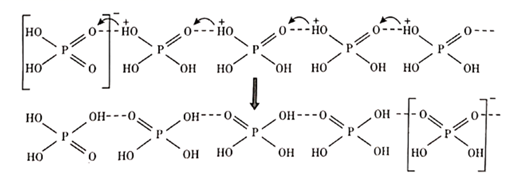
由此可以推知纯磷酸液体中存在的导电微粒是 和 , 的空间构型为。
(4)、硒氧化铋是一类全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的 层与带负电的 层交替堆叠。据此推断硒氧化铋的化学式为 , 其中Se的分数坐标为。晶胞棱边夹角均为90°,硒氧化铋的摩尔质量为 M g·mol-1 , 则晶体密度的表达式为g·cm-3(NA为阿伏加德罗常数的值)。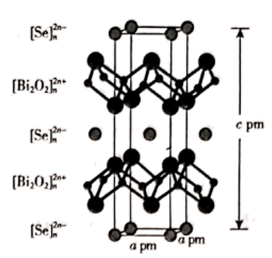 19. 钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、生物材料等领域。钛的氯化物有如下转变关系:2TiCl3 TiCl4↑+TiCl2 , 回答下列问题:(1)、基态钛原子的价电子排布式为。与钛同周期的第ⅡB族和ⅢA族两种元素中第一电离能较大的是(写元素符号),原因是。(2)、钛的氯化物的部分物理性质如下表:
19. 钛(Ti)被称为“未来金属”,广泛应用于国防、航空航天、生物材料等领域。钛的氯化物有如下转变关系:2TiCl3 TiCl4↑+TiCl2 , 回答下列问题:(1)、基态钛原子的价电子排布式为。与钛同周期的第ⅡB族和ⅢA族两种元素中第一电离能较大的是(写元素符号),原因是。(2)、钛的氯化物的部分物理性质如下表:氯化物
熔点/℃
沸点/℃
溶解性
TiCl4
-24
136
可溶于非极性的甲苯和氯代烃
TiCl2
1035
1500
不溶于氯仿、乙醚
①TiCl4与TiCl2的晶体类型分别是、。
②TiCl4与 互为等电子体,因为它们相同; 中心原子的杂化方式是。
(3)、Ti的配合物有多种。 的配体所含原子中电负性最小的是; 的球棍结构如图Ⅰ,Ti的配位数是。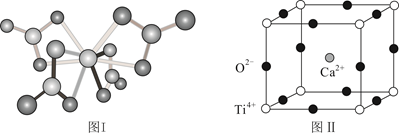 (4)、钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图Ⅱ。
(4)、钙钛矿(CaTiO3)是自然界中的一种常见矿物,其晶胞结构如图Ⅱ。①设NA为阿伏加德罗常数的值,计算一个晶胞的质量为g。
②假设O2-采用面心立方最密堆积,Ti4+与O2-相切,则 。
20. LiFePO4、聚乙二醇、LiPF6、LiAsF6、LiCl等常用作锂离子聚合物电池的材料和载体。回答下列问题:
(1)、LiFePO4中Fe的价层电子排布式为。(2)、LiPF6、LiAsF6和LiCl中所含的四种非金属元素电负性由大到小的顺序为。(3)、含氧酸的通式可写为(HO)mROn , 根据化学学科的规律下列几种酸中酸性与H3PO4相近的有。a.HClO b.HClO3 c.H2SO3 d.HNO2
(4)、通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸( )常被用作碳包覆的碳源,其易溶于水的原因是 , 该分子中碳原子的杂化方式为。 (5)、电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)
)常被用作碳包覆的碳源,其易溶于水的原因是 , 该分子中碳原子的杂化方式为。 (5)、电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)
①从化学键角度看,Li+迁移过程发生(填“物理变化”或“化学变化”)。
②相同条件,Li+在(选填“LiPF6”或“LiAsF6”)中迁移较快,原因是。
(6)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl·3H2O属正交晶系(长方体形)晶胞参数为0.72mm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。
①该晶胞中Cl原子的数目为。
②LiCl·3H2O的摩尔质量为Mg·mol-1 , 设NA为阿伏加德罗常数的值,则LiCl·3H20晶体的密度为g·cm-3(列出计算表达式)。
21. 氮化镓( )材料具有低的热产生率和高的击穿电场,是制造大功率和高频微波电子器件的理想半导体材料。
)材料具有低的热产生率和高的击穿电场,是制造大功率和高频微波电子器件的理想半导体材料。 已知:①Ga和Al同主族且相邻,化学性质与铝相似;②在室温下,氮化镓不溶于水,硬度高,熔点高,能与热的碱溶液缓慢反应。
(1)、配平氮化镓制备的化学方程式:□Ga(l)+□NH3(g)⇌□GaN(s)+□H2(g)+QkJ(Q>0)(2)、上述反应的平衡常数表达式K=;在恒温恒容密闭容器中制备氮化镓,下列有关说法正确的是
A.Ⅰ图像中如果纵坐标为正反应速率,则t时刻改变的条件可能是加压
B.Ⅱ图像中纵坐标可以为镓的转化率
C.Ⅲ图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为平衡常数
(3)、Ga最外层电子的核外电子排布式 , N核外能量最高的电子亚层上电子云空间伸展方向有种;(4)、氮化镓的晶体类型 , 氮化铝和氮化镓晶体类型相同,且结构相似,比较两者熔点的高低并解释原因;(5)、写出氮化镓溶于热的NaOH溶液的离子方程式。22. 青蒿素是从黄花蒿中提取的一种无色针状晶体,其结构如图1,请回答下列问题:
 (1)、基态O原子的价电子排布图为。(2)、组成青蒿素的三种元素中电负性最大的是 (填元素符号,下同),第一电离能最大的是。(3)、基态N原子的未成对电子数为。(4)、双氢青蒿素是青蒿素的重要衍生物,其抗疟疾疗效优于青蒿素,双氢青蒿素的合成一般是在相转移催化剂聚乙二醇的作用下,用硼氢化钠(NaBH4)还原青蒿素。两种硼氢化物的合成原理如下:
(1)、基态O原子的价电子排布图为。(2)、组成青蒿素的三种元素中电负性最大的是 (填元素符号,下同),第一电离能最大的是。(3)、基态N原子的未成对电子数为。(4)、双氢青蒿素是青蒿素的重要衍生物,其抗疟疾疗效优于青蒿素,双氢青蒿素的合成一般是在相转移催化剂聚乙二醇的作用下,用硼氢化钠(NaBH4)还原青蒿素。两种硼氢化物的合成原理如下:2LiH+B2H6=2LiBH4;4NaH+BF3=NaBH4+3NaF
BH4-的空间构型为;B2H6分子的结构如图2,B2H6中B的杂化方式为。
聚乙二醇[HO(CH2CH2O)nH]随着n值的增大,水溶性降低,原因是。
(5)、NaH的晶胞与NaCl相同,NaH晶体中阳离子的配位数是;设晶胞中阴、阳离子为刚性球体且恰好相切,阴、阳离子的半径比约为 (已知 ≈1.414,结果保留三位有效数字)。23.(1)、I.向蓝色{[Cu(H2O)4]2+}硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色{[Cu(NH3)4]2+}。H2O和NH3分子中心原子的杂化类型分别为、。分子中的键角:H2ONH3填(“大于”或“小于’)。原因是。
(2)、通过上述实验现象可知,与Cu2+的配位能力:H2O NH3(填“大于”或“小于”)。(3)、II.铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4 ( UO2(CO3)3〕等。回答下列问题:UF4用Mg或Ca还原可得金属铀。基态氟原子的价电子排布图为;
(4)、①已知:(NH4)4[UO2(CO3)3] 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒间作用力是。a.离子键 b.共价键 c.配位键 d.金属键
② CO32-的空间构型 ,写出它的等电子体的化学式(分子、离子各写一种 、 。
(5)、UO2的晶胞结构如下图所示:
①晶胞中U原子位于面心和顶点,氧原子填充在U原子堆积形成的空隙中,在该空隙中氧原子堆积形成的立体的空间构型为(填“立方体”、“四面体、“八面体”);
②若两个氧原子间的最短距离为a nm,则UD2晶体的密度为g·cm-3。(列出含a计算式即可。用NA表示阿伏加德罗常数的值。)
24. 【化学——选修3:物质结构与性质】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)、基态钛原子的价电子排布式为 , 与钛同周期的元素中,基态原子的未成对电子数与钛相同的有种。(2)、钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是。(3)、在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,则该配合离子的化学式为。(4)、半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
①组成M的元素中,电负性最大的是(填名称)。
②M中碳原子的杂化方式为。
③M中不含(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)、金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
①A,B,C,D 4种微粒,其中氧原子是(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a, , );钛氧键的键长d=(用代数式表示)。
25. 铜元素可形成多种重要化合物。回答下列问题:(1)、铜元素位于元素周期表中的区,其基态原子的价电子排布图为。(2)、往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4溶液,该溶液可用于溶解纤维素。①[Cu(NH3)4]SO4中阴离子的立体构型是。
②在[Cu(NH3)4]SO4中,Cu2+与NH3 之间形成的化学键称为 , 提供孤电子对的成键原子是。
③除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为。
④NF3与NH3 的立体构型相同,中心原子的轨道杂化类型均为。但NF3不易与Cu2+形成化学键,其原因是。
(3)、一种Hg—Ba—Cu—O高温超导材料的晶胞(长方体)如图所示。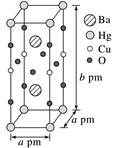
①该物质的化学式为。
②已知该晶胞中两个Ba2+的间距为c pm,则距离Ba2+最近的Hg+数目为个,二者的最短距离为pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M , 阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3。
26. [化学——选修3:物质结构与性质]2019年1月30日,《nature》发表了中科大在去除氢气中微量CO研究方面的突破性进展,科学家在SiO2负载的Pt金属纳米颗粒表面上,选择性的以原子级别的方式将FeOx沉积得到的催化剂可以在198~380K下实现完全选择性氧化CO。请回答下列问题:
(1)、基态铁原子的外围电子排布式为。(2)、C、Si、O三种元素的电负性由大到小的顺序为。(3)、CO的电子式为 , 从原子结构分析,CO2中C、O原子间能形成π键,而SiO2中Si、O原子间不能形成π键的原因为。(4)、Pt晶体采用“ABCAB……”型堆积方式(如图1),其堆积方式的名称为 , 晶胞中Pt原子的配位数为。(5)、常见配合物Pt(NH3)2Cl2存在两种不同的结构,其中一种为黄绿色(M),具有抗癌作用,在水中溶解度较大,则M为(填“极性”或“非极性”),Pt(NH3)2Cl2中N原子的杂化方式为。 (6)、FeOx晶体的晶胞与NaCl的相似,NaCl的晶胞如图2所示,由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FeOx(x>1),若测得FeOx晶体密度为d g·cm-3 , 晶胞边长为a pm,则FeOx中x=(用含a、d的代数式表示,不要求算出具体结果)。27. 氮是极其重要的化学元素。我国科学家最近成功合成了超高含能材料聚合氮和金属氮。基于氮气的能源研究也是未来能源发展的重要方向。(1)、基态氮原子的价电子排布式为。(2)、14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为 , 以“肩并肩”方式形成的共价键数目为。(3)、C、N、O三种元素按第一电离能从大到小的排列顺序为。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495kJ·mol-1 , 其第二电离能增幅较大的原因是。(4)、某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和。CrCl3·6NH3有三种异构体,按络离子式量增大的顺序分别是[Cr(NH3)6]Cl3、、[Cr(NH3)4Cl2]Cl·2NH3。(5)、NH4N3是高能量度材料,其晶胞如下图所示。N3-是直线型结构,N3-中氮原子的杂化类型是。在VSEPR模型中NH4+的几何构型名称为。
(6)、FeOx晶体的晶胞与NaCl的相似,NaCl的晶胞如图2所示,由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FeOx(x>1),若测得FeOx晶体密度为d g·cm-3 , 晶胞边长为a pm,则FeOx中x=(用含a、d的代数式表示,不要求算出具体结果)。27. 氮是极其重要的化学元素。我国科学家最近成功合成了超高含能材料聚合氮和金属氮。基于氮气的能源研究也是未来能源发展的重要方向。(1)、基态氮原子的价电子排布式为。(2)、14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为 , 以“肩并肩”方式形成的共价键数目为。(3)、C、N、O三种元素按第一电离能从大到小的排列顺序为。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495kJ·mol-1 , 其第二电离能增幅较大的原因是。(4)、某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和。CrCl3·6NH3有三种异构体,按络离子式量增大的顺序分别是[Cr(NH3)6]Cl3、、[Cr(NH3)4Cl2]Cl·2NH3。(5)、NH4N3是高能量度材料,其晶胞如下图所示。N3-是直线型结构,N3-中氮原子的杂化类型是。在VSEPR模型中NH4+的几何构型名称为。 (6)、已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA , 则NH4N3的密度为g·cm-3。28. 碳、氮、铜形成的单质及它们形成的化合物有重要研究和应用价值,回答下列问题:(1)、邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结简式如图所示。
(6)、已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA , 则NH4N3的密度为g·cm-3。28. 碳、氮、铜形成的单质及它们形成的化合物有重要研究和应用价值,回答下列问题:(1)、邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结简式如图所示。
①基态Cu原子的价电子排布式为 , 在元素周期表中铜位于区(填“s”“p”“d”或“ds”)。
②C、N、O三种元素的第一电离能由大到小的顺序为。
③邻氨基吡啶的铜配合物中,Cu2+的配位数是 , N原子的杂化类型为。
(2)、C60是富勒烯族分子中稳定性最高的一种,N60是未来的火箭燃料,二者结构相似。①有关C60和N60的说法中正确的是。
A.C60和N60均属于分子晶体
B.N60的稳定性强于N2
C.C60中碳原子是sp3杂化
D.C60易溶于CS2、苯
②近年来,科学家合成了一种具有“二重结构”的球形分子,它是把足球形分子C60容纳在足球形分子Si60中,则该分子中含有的化学键类型为 (填“极性键”“非极性键”)。
(3)、原子坐标参数和晶胞参数是晶胞的两个基本参数。①图中原子坐标参数分别为:A(0,0,0),B(1/2,1/2,0),C(1/2,0,1/2),则D的原子坐标参数为。

②图为铜的晶胞,铜原子半径为Rnm,NA是阿伏加德罗常数的值,则铜晶体的密度为g·cm-3(用含R、NA的式子表示)
 29. 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。
29. 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)、请写出:D基态原子的价层电子排布图:;F基态原子的价电子排布式:。(2)、下列说法错误的是________。A、二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2 B、电负性顺序:B<C<D C、N2与CO为等电子体,结构相似 D、稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键(3)、F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F的硫酸盐溶液中通入过量的C与A形成的气体X可生成[F(X)4]2+ , 该离子的结构式为(用元素符号表示)。(4)、某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有。 (5)、B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为。(6)、D与F形成离子个数比为1∶1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率。30. 钛被称为继铁、铝之后的第三金属,在工业上有着广泛而重要的用途。(1)、基态钛原子的价电子排布图为;基态铝原子核外电子分布在个能级上。(2)、许多金属及其化合物灼烧时会产生特征焰色,产生焰色的原因是。(3)、FeCl3熔点306℃、沸点315℃,CaCl2熔点782℃、沸点1600℃,同是金属氯化物,熔沸点差别很大的原因是。(4)、煅烧铁矿石常会生成SO2 , SO2 为分子(填“极性”或“非极性”);分子中的大π键可用符号Пnm表示,其中m代表参与形成大π键的原子数,n 代表参与形成大π 键的电子数(如苯分子中的大π键可表示为П66)。推测SO2分子中的大π键可表示为。(5)、钙钛矿可用来冶炼钛,它的晶胞结构如图所示。钛离子位于立方晶胞的角顶,被个氧离子包围成配位八面体;钙离子离子位于立方晶胞的体心,被个氧离子包围。钙钛矿晶体的化学式为。若该晶胞的边长为a pm,则钙钛矿晶体的密度为g·cm-3(用NA 表示阿保加德罗常数的值,只要求列算式,不必计算出数值)
(5)、B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为。(6)、D与F形成离子个数比为1∶1的化合物,晶胞与NaCl类似,设D离子的半径为a pm,F离子的半径b pm,求该晶胞的空间利用率。30. 钛被称为继铁、铝之后的第三金属,在工业上有着广泛而重要的用途。(1)、基态钛原子的价电子排布图为;基态铝原子核外电子分布在个能级上。(2)、许多金属及其化合物灼烧时会产生特征焰色,产生焰色的原因是。(3)、FeCl3熔点306℃、沸点315℃,CaCl2熔点782℃、沸点1600℃,同是金属氯化物,熔沸点差别很大的原因是。(4)、煅烧铁矿石常会生成SO2 , SO2 为分子(填“极性”或“非极性”);分子中的大π键可用符号Пnm表示,其中m代表参与形成大π键的原子数,n 代表参与形成大π 键的电子数(如苯分子中的大π键可表示为П66)。推测SO2分子中的大π键可表示为。(5)、钙钛矿可用来冶炼钛,它的晶胞结构如图所示。钛离子位于立方晶胞的角顶,被个氧离子包围成配位八面体;钙离子离子位于立方晶胞的体心,被个氧离子包围。钙钛矿晶体的化学式为。若该晶胞的边长为a pm,则钙钛矿晶体的密度为g·cm-3(用NA 表示阿保加德罗常数的值,只要求列算式,不必计算出数值) 31. 【化学——选修3:物质结构与性质】
31. 【化学——选修3:物质结构与性质】第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。请回答:
(1)、科学研究表明用TiO2作光催化剂可将废水中CN−转化为OCN−、并最终氧化为N2、CO2。OCN—中三种元素的第一电离能由大到小的顺序为。与OCN−互为等电子体的一种分子为(填化学式)。(2)、Ti(BH4)2是一种储氢材料。写出基态Ti2+的电子排布式 , BH4−中B原子的杂化轨道类型是。(3)、[Cr(H2O)4Cl2]Cl·2H2O中Cr的配位数为;已知CrO5中Cr为+6价,则CrO5的结构式为。
(4)、金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4 , 该物质晶胞呈正四面体构型。试推测Ni(CO)4的晶体类型为 , Ni(CO)4易溶于下列(填选项字母)中。A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(5)、FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69 pm和78 pm,则熔点NiO FeO(填“>”或“<”),原因为。(6)、硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,则该晶胞中硒原子的配位数为;若该晶胞密度为ρ g·cm−3 , 硒化锌的摩尔质量为M g/mol。NA代表阿伏加德罗常数,则晶胞参数a为pm。
 32. A、B、C、D为原子序数依次增大的四种元素,A2﹣和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:(1)、四种元素中电负性最大的是(填元素符号),其中C原子的核外电子排布式为 .(2)、单质A有两种同素异形体,其中沸点高的是(填分子式),原因是;A和B的氢化物所属的晶体类型分别为和 .(3)、C和D反应可生成组成比为1:3的化合物E,E的立体构型为 , 中心原子的杂化轨道类型 .(4)、化合物D2A的立体构型为 , 中心原子的价层电子对数为 , 单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 .(5)、A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为 , 晶胞中A原子的配位数为;列式计算晶体F的密度(g•cm﹣3).
32. A、B、C、D为原子序数依次增大的四种元素,A2﹣和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:(1)、四种元素中电负性最大的是(填元素符号),其中C原子的核外电子排布式为 .(2)、单质A有两种同素异形体,其中沸点高的是(填分子式),原因是;A和B的氢化物所属的晶体类型分别为和 .(3)、C和D反应可生成组成比为1:3的化合物E,E的立体构型为 , 中心原子的杂化轨道类型 .(4)、化合物D2A的立体构型为 , 中心原子的价层电子对数为 , 单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为 .(5)、A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为 , 晶胞中A原子的配位数为;列式计算晶体F的密度(g•cm﹣3). 33. Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
33. Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:元素
Mn
Fe
电离能/kJ•mol﹣1
I1
717
759
I2
1509
1561
I3
3248
2957
回答下列问题:
(1)、Mn元素价电子层的电子排布式为 , 比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是(2)、Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是 .(3)、三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为晶体.(4)、金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为 , 其中体心立方晶胞空间利用率为 .