高考二轮复习知识点:极性分子和非极性分子2
试卷更新日期:2023-07-31 类型:二轮复习
一、多选题
-
1. 下列说法中,正确的是A、表示能级有两个轨道 B、处于最低能量的原子叫做基态原子 C、都是极性分子 D、和的中心原子的杂化轨道类型均为杂化2. 已知H2O2分子的空间结构可在二面角中表示,如图所示,下列有关H2O2结构的说法正确的是( )
 A、H2O2中有3个σ键、1个π键 B、H2O2为非极性分子 C、H2O2中氧原子为sp3杂化 D、H2O2沸点高达158 ℃,可推测H2O2分子间可形成氢键
A、H2O2中有3个σ键、1个π键 B、H2O2为非极性分子 C、H2O2中氧原子为sp3杂化 D、H2O2沸点高达158 ℃,可推测H2O2分子间可形成氢键二、选择题
-
3. 阅读下列材料,完成5~7题:
周期表中IVA族元素及其化合物应用广泛。甲烷具有较大的燃烧热(890.3 kJ·mol-1),是常见燃料;Si、 Ge是重要的半导体材料,硅晶体表面SiO2能与氢氟酸(HF,弱酸)反应生成H2SiF6 (H2SiF6在水中完全电离为H+和SiF62- ); 1885年德国化学家将硫化锗(GeS2)与H2共热制得了门捷列夫预言的类硅-锗;我国古代就掌握了青铜(铜-锡合金)的冶炼、加工技术,制造出许多精美的青铜器;Pb、PbO2是铅蓄电池的电极材料,不同铅化合物一般具有不同颜色,历史上曾广泛用作颜料。
(1)、下列说法正确的是( )A、金刚石与石墨烯中的夹角都为 B、、都是由极性键构成的非极性分子 C、锗原子()基态核外电子排布式为 D、ⅣA族元素单质的晶体类型相同(2)、下列化学反应表示正确的是( )A、与HF溶液反应: B、高温下还原: C、铅蓄电池放电时的正极反应: D、甲烷的燃烧:(3)、下列物质性质与用途具有对应关系的是( )A、石墨能导电,可用作润滑剂 B、单晶硅熔点高,可用作半导体材料 C、青铜比纯铜熔点低、硬度大,古代用青铜铸剑 D、含铅化合物颜色丰富,可用作电极材料4. 下列叙述错误的是( )A、是极性分子 B、原子的中子数为10 C、与互为同素异形体 D、 和
和 互为同系物
5. 磷酰三叠氮是一种高能分子,结构简式为。下列关于该分子的说法正确的是( )A、为非极性分子 B、立体构型为正四面体形 C、加热条件下会分解并放出 D、分解产物的电子式为6. SF6可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关SF6的说法正确的是( )
互为同系物
5. 磷酰三叠氮是一种高能分子,结构简式为。下列关于该分子的说法正确的是( )A、为非极性分子 B、立体构型为正四面体形 C、加热条件下会分解并放出 D、分解产物的电子式为6. SF6可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关SF6的说法正确的是( )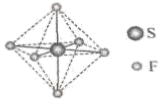 A、是非极性分子 B、键角 都等于90° C、 与 之间共用电子对偏向S D、 原子满足8电子稳定结构7. 关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( )A、CH3OH为极性分子 B、N2H4空间结构为平面形 C、N2H4的沸点高于(CH3)2NNH2 D、CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同8. 碳氮硫共脱除工艺可以协同除去工业废水中的S2-、NO和CH3COO- , 过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是
A、是非极性分子 B、键角 都等于90° C、 与 之间共用电子对偏向S D、 原子满足8电子稳定结构7. 关于CH3OH、N2H4和(CH3)2NNH2的结构与性质,下列说法错误的是( )A、CH3OH为极性分子 B、N2H4空间结构为平面形 C、N2H4的沸点高于(CH3)2NNH2 D、CH3OH和(CH3)2NNH2中C、O、N杂化方式均相同8. 碳氮硫共脱除工艺可以协同除去工业废水中的S2-、NO和CH3COO- , 过程如图所示。已知:成键原子共平面,每个原子能提供一个相互平行的p轨道且p轨道电子数小于参加成键的p轨道数的两倍时可形成离域π键。下列说法错误的是 A、N2和CO2都是非极性分子 B、NO和NO的空间构型相同 C、NO中存在离域π键 D、冰醋酸中CH3COOH分子间存在范德华力和氢键9. 碱式碳酸氧钒铵晶体是制备多种含钒产品的原料。有关说法错误的是A、的空间构型为正四面体形 B、基态的核外电子排布式为 C、中C的轨道杂化类型为杂化 D、是非极性分子10. 用NaClO氧化NH3可制备火箭推进剂的燃料N2H4。下列说法正确的是A、NH3是非极性分子 B、NaClO仅含离子键 C、N2H4中N元素的化合价为-2 D、中子数为8的氮原子可表示为11. 陈述I和II均正确,但不具有因果关系的是
A、N2和CO2都是非极性分子 B、NO和NO的空间构型相同 C、NO中存在离域π键 D、冰醋酸中CH3COOH分子间存在范德华力和氢键9. 碱式碳酸氧钒铵晶体是制备多种含钒产品的原料。有关说法错误的是A、的空间构型为正四面体形 B、基态的核外电子排布式为 C、中C的轨道杂化类型为杂化 D、是非极性分子10. 用NaClO氧化NH3可制备火箭推进剂的燃料N2H4。下列说法正确的是A、NH3是非极性分子 B、NaClO仅含离子键 C、N2H4中N元素的化合价为-2 D、中子数为8的氮原子可表示为11. 陈述I和II均正确,但不具有因果关系的是选项
陈述 I
陈述 II
A
金刚砂的熔沸点高
金刚砂(SiC)可用作切割钢板的砂轮
B
碘单质和 CCl4 都是非极性分子
碘单质易溶于 CCl4
C
盐卤中氯化镁、硫酸钾属于电解质
盐卤可使豆浆中的蛋白质聚沉
D
活性炭具有吸附性
活性炭可用作制糖业的脱色剂
A、A B、B C、C D、D12. 铜氨液可以吸收CO,其反应为:。下列说法正确的是A、价层电子排布式为: B、CO为非极性分子 C、空间构型为三角锥形 D、中含有3mol配位键13. X、Y为同周期主族元素, Y有8种不同运动状态的电子,二者形成的一种化合物固态时以[XY2]+[XY3]-的形式存在。下列说法错误的是A、Y形成的单质可能是极性分子 B、[XY3] -中心原子杂化方式为sp2 C、[XY2]+空间结构为直线形 D、X、Y形成的简单氢化物稳定性: X> Y14. 下列物质中,由极性键构成的极性分子的是A、 B、 C、 D、15. 如图是月球基地运行功能愿景图的一部分。下列说法错误的是 A、可以通过热还原法得到 B、分子的共价键是键 C、可以通过电解法得到 D、水是非极性分子16. 用氨水吸收硫酸工厂尾气中的 , 发生的反应为:。下列说法正确的是A、分子的空间结构呈V形 B、的电子式为
A、可以通过热还原法得到 B、分子的共价键是键 C、可以通过电解法得到 D、水是非极性分子16. 用氨水吸收硫酸工厂尾气中的 , 发生的反应为:。下列说法正确的是A、分子的空间结构呈V形 B、的电子式为 C、是非极性分子
D、的VSEPR模型为平面三角形
17. 下列关于H2O和H2S的说法中错误的是A、都是极性分子 B、H-O比H-S键长更短,键能更大 C、分子中所有原子的最外层都达到8电子稳定结构 D、H2O的沸点比H2S高,是因为水分子间形成了氢键18. 我国力争于2060年前实现碳中和。与重整是利用的研究热点之一。下列关于和说法正确的是
C、是非极性分子
D、的VSEPR模型为平面三角形
17. 下列关于H2O和H2S的说法中错误的是A、都是极性分子 B、H-O比H-S键长更短,键能更大 C、分子中所有原子的最外层都达到8电子稳定结构 D、H2O的沸点比H2S高,是因为水分子间形成了氢键18. 我国力争于2060年前实现碳中和。与重整是利用的研究热点之一。下列关于和说法正确的是 A、固态属于共价晶体 B、键角大于键角 C、分子中含有极性共价键,是极性分子 D、干冰中每个分子周围紧邻12个分子19. 通常状况下,是无色透明液体,下列对的有关叙述错误的是A、分子中的所有原子均达到8电子稳定结构 B、中P原子采用杂化 C、分子是极性分子 D、分子中四个原子共平面20. 下列关于的说法错误的是( )A、是极性键构成的极性分子 B、分子中含键,该共价键电子云图形是轴对称的 C、分子的键角为107°,表明共价键有方向性 D、分子中的N有孤电子对,可以与形成配位键21. HC3N是一种星际分子,分子内不含环状结构,下列有关这种星际分子的说法错误的是( )A、HC3N的结构可能为H-C≡C-C≡N B、HC3N为极性分子 C、HC3N中所含有的σ键与π键数目比为1:1 D、HC3N分子中所有原子不可能都在一条直线上22. 纯碱()是重要的基础化工原料,我国化学家侯德榜在1943年提出了著名侯氏制碱法。原理为:将通入氨化的饱和食盐水中析出晶体,将得到的晶体加热分解生成。下列有关、、和的说法正确的是( )A、电负性: B、沸点: C、键角: D、为极性分子,CO2为非极性分子23. 参与有机合成是实现“碳中和”的途径之一、高温、高压条件下和可合成尿素。与苯酚经过一系列反应可制得水杨酸(沸点),水杨酸和甲醇(沸点)发生如下反应制取冬青油(沸点:
A、固态属于共价晶体 B、键角大于键角 C、分子中含有极性共价键,是极性分子 D、干冰中每个分子周围紧邻12个分子19. 通常状况下,是无色透明液体,下列对的有关叙述错误的是A、分子中的所有原子均达到8电子稳定结构 B、中P原子采用杂化 C、分子是极性分子 D、分子中四个原子共平面20. 下列关于的说法错误的是( )A、是极性键构成的极性分子 B、分子中含键,该共价键电子云图形是轴对称的 C、分子的键角为107°,表明共价键有方向性 D、分子中的N有孤电子对,可以与形成配位键21. HC3N是一种星际分子,分子内不含环状结构,下列有关这种星际分子的说法错误的是( )A、HC3N的结构可能为H-C≡C-C≡N B、HC3N为极性分子 C、HC3N中所含有的σ键与π键数目比为1:1 D、HC3N分子中所有原子不可能都在一条直线上22. 纯碱()是重要的基础化工原料,我国化学家侯德榜在1943年提出了著名侯氏制碱法。原理为:将通入氨化的饱和食盐水中析出晶体,将得到的晶体加热分解生成。下列有关、、和的说法正确的是( )A、电负性: B、沸点: C、键角: D、为极性分子,CO2为非极性分子23. 参与有机合成是实现“碳中和”的途径之一、高温、高压条件下和可合成尿素。与苯酚经过一系列反应可制得水杨酸(沸点),水杨酸和甲醇(沸点)发生如下反应制取冬青油(沸点: +CH3OH
+CH3OH +H2O。下列说法正确的是( ) A、是极性分子 B、第一电离能: C、
+H2O。下列说法正确的是( ) A、是极性分子 B、第一电离能: C、 的沸点高于
D、在合成尿素的反应中作氧化剂
24. 交警用三氧化铬()硅胶可以查酒驾。元素的几种化合物转化关系如图所示。下列判断错误的是( )
的沸点高于
D、在合成尿素的反应中作氧化剂
24. 交警用三氧化铬()硅胶可以查酒驾。元素的几种化合物转化关系如图所示。下列判断错误的是( )A.根据相似相溶原理,乙醇易溶于水
A、中各原子均满足8电子稳定结构 B、、都只有极性键但分子极性不同 C、基态铬原子的价电子排布式为25. 磷元素可组成多种物质。白磷化学性质活泼,需要放在水中保存,图a为1个白磷分子的结构示意图。黑磷在微电子和光探测领域有独特的应用价值,其晶体是与石墨类似的层状结构,图b为相邻两层的结构示意图。
下列说法错误的是( )
A、1mol白磷中有非极性键 B、白磷不溶于水与分子极性有关 C、黑磷结构中层与层之间的作用力是共价键 D、白磷与黑磷结构不同造成性质不同三、非选择题
-
26. 配合物顺铂是临床使用的第一代铂类抗癌药物。(1)、的配体为和 , 写出的电子式:。(2)、顺铂的抗癌机理:在铜转运蛋白的作用下,顺铂进入人体细胞发生水解,生成的与结合,破坏的结构,阻止癌细胞增殖。如:

①基态原子价层电子的轨道表示式为 , 属于区元素。
②生成物中a、b示的作用力类型分别是。
③在中,配体与铂(II)的结合能力:(填“>”或“<”)。此外,顺铂还能躲避癌细胞对受损的修复,使癌细胞彻底死亡。
(3)、顺铂和反铂互为同分异构体,两者的结构和性质如下。顺铂
反铂
结构


25℃时溶解度/g
0.2577
0.0366
①推测中的杂化轨道类型不是 , 依据是。
②顺铂在水中的溶解度大于反铂的原因是。
(4)、顺铂的发现与铂电极的使用有关。铂晶胞为正方体,边长为 , 结构如下图。
①铂晶体的摩尔体积(阿伏加德罗常数为)。
②通常情况下铂电极为惰性电极,但在溶液中使用会产生而略有损耗,分析原因:。
资料:i.单位物质的量的物质所具有的体积叫做摩尔体积;ii.。
27. 过渡区金属元素原子或离子易形成配合物,广泛用作催化剂。例如Ni、Fe、Mo三种元素可以合成一种新型高效催化剂,在碱性条件下可展示出优异的OER(电催化析氧)催化活性。回答下列问题:(1)、电催化析氧过程中常用通NH3的方法来调节溶液酸碱性:I.若溶液中有次氯酸盐,NH3有可能被氧化成NH2-NH2 , NH2-NH2中N原子的杂化方式是。
II.若溶液中含有铜离子,可形成配离子[Cu(NH3)4]2+。
①[Cu(NH3)4]2+具有对称的空间构型,若其中两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为。
②Cu2+还可与其他微粒形成配离子,如与乙二胺形成
 , 此配离子内部不含有的化学键类型是(填标号)。
, 此配离子内部不含有的化学键类型是(填标号)。A.离子键 B.非极性键 C.配位键 D.氢键
③上述乙二胺和三甲胺[N(CH3)3]均属于胺。但乙二胺比三甲胺的沸点高很多,原因是。
(2)、下列状态的铁中,失去最外层的一个电子所需能量最大的是____(填标号)。A、 B、
B、 C、
C、 D、
D、 (3)、配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,是获得高纯度纳米镍的原料,推测Ni(CO)4属于(填“极性”或“非极性”)分子。(4)、立方NiO(氧化镍)晶体的晶胞结构如图所示,晶胞边长为apm,则NiO晶体的密度为g/cm3(NA表示阿伏加德罗常数)。
(3)、配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,是获得高纯度纳米镍的原料,推测Ni(CO)4属于(填“极性”或“非极性”)分子。(4)、立方NiO(氧化镍)晶体的晶胞结构如图所示,晶胞边长为apm,则NiO晶体的密度为g/cm3(NA表示阿伏加德罗常数)。 28. 已知A、B、C、D为原子序数依次增大的短周期元素,A的核外电子总数与其周期序数相同;B的基态原子的核外有3个能级,且每个能级上的电子数相等;D的基态原子2p轨道中含有两种不同自旋方向的电子,且电子数之比为3∶1。回答下列问题:(1)、B、C、D的第一电离能由大到小的顺序为(填元素符号)。(2)、简单氢化物的稳定性:CD(填“>”或“<”),原因为.(3)、分子式为ABC的化合物属于(填“极性”或“非极性")分子,其结构中键与键的比例为。(4)、桂皮中含有的肉桂醛(
28. 已知A、B、C、D为原子序数依次增大的短周期元素,A的核外电子总数与其周期序数相同;B的基态原子的核外有3个能级,且每个能级上的电子数相等;D的基态原子2p轨道中含有两种不同自旋方向的电子,且电子数之比为3∶1。回答下列问题:(1)、B、C、D的第一电离能由大到小的顺序为(填元素符号)。(2)、简单氢化物的稳定性:CD(填“>”或“<”),原因为.(3)、分子式为ABC的化合物属于(填“极性”或“非极性")分子,其结构中键与键的比例为。(4)、桂皮中含有的肉桂醛( )是一种食用香料,广泛用于牙膏、洗涤剂、糖果和调味品中,根据其结构特征,分析预测其可发生如下反应,完成表格。
)是一种食用香料,广泛用于牙膏、洗涤剂、糖果和调味品中,根据其结构特征,分析预测其可发生如下反应,完成表格。序号
参与反应的试剂
反应方程式
反应类型
①
新制的氢氧化铜
②
溴的四氯化碳溶液
29. 学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。(1)、的空间结构为 , 属于分子(填“极性”或“非极性”)。(2)、我国空间站日常运行所需电源主要由太阳能电池提供,太阳能电池主要材料是砷化镓(GaAs)、碲化镉(CdTe),它们可以直接把光能转化成电能给空间站供电。①Cd与Zn是相邻周期同族元素,基态Cd的价电子排布为。
②砷化镓(GaAs)能够承受太空高温环境,原因是。
(3)、二个甲酸分子通过氢键形成二聚体(含八元环),画出该二聚体的结构:。(4)、具有高稳定性、超导电性的二维硼烯氧化物()的部分结构如图所示,则该氧化物的化学式为 , 其中B-B键的键长B-O键的键长(填“>”“<”或“=”)。 30. 氮族、氧族元素及其化合物种类繁多,有许多用途,部分物质的熔沸点如下表所示:
30. 氮族、氧族元素及其化合物种类繁多,有许多用途,部分物质的熔沸点如下表所示:H2O
H2S
S8
SO2
SO3
H2SO4
N2H4
熔点/℃。
0
-85.5
115.2
-75.5
16.8
10.3
1.4
沸点/℃
100
-60.3
444.6
-10.0
45.0
337.0
113.5
(1)、H2O、N2H4的熔沸点要比H2S的熔沸点高很多,主要原因为。(2)、根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是。(3)、如图为S8的结构,S原子的杂化轨道类型是。 (4)、键角:H2O(填“大于”或“小于”)H2S,原因为。(5)、N2H4是火箭发射常用的燃料,N2H4的电子式为 , 它属于(填“极性”或“非极性”)分子。(6)、已知含氧酸的酸性与结构中非羟基氧的数目有关,强酸一般有两个非羟基氧(如硫酸:
(4)、键角:H2O(填“大于”或“小于”)H2S,原因为。(5)、N2H4是火箭发射常用的燃料,N2H4的电子式为 , 它属于(填“极性”或“非极性”)分子。(6)、已知含氧酸的酸性与结构中非羟基氧的数目有关,强酸一般有两个非羟基氧(如硫酸: ),中强酸一般有一个非羟基氧(如磷酸:
),中强酸一般有一个非羟基氧(如磷酸: )。已知亚磷酸(H3PO3)是一种二元中强酸。请写出亚磷酸的结构式。 31. 我国科学家及其合作团队研究发现,六方相(hep)Fe—H、Fe—C和Fe—O合金在地球内核温压下转变成超离子态。该研究表明地球内核并非传统认知的固态,而是由固态铁和流动的轻元素组成的超离子态。请用所学知识回答下列问题:(1)、基态铁原子最外层电子所在能级的电子云轮廓图为形。(2)、H、C、O三种元素的电负性由大到小的排序为(填元素符号)。(3)、锰和铁处于同一周期,锰、铁电离能数据如表所示:
)。已知亚磷酸(H3PO3)是一种二元中强酸。请写出亚磷酸的结构式。 31. 我国科学家及其合作团队研究发现,六方相(hep)Fe—H、Fe—C和Fe—O合金在地球内核温压下转变成超离子态。该研究表明地球内核并非传统认知的固态,而是由固态铁和流动的轻元素组成的超离子态。请用所学知识回答下列问题:(1)、基态铁原子最外层电子所在能级的电子云轮廓图为形。(2)、H、C、O三种元素的电负性由大到小的排序为(填元素符号)。(3)、锰和铁处于同一周期,锰、铁电离能数据如表所示:元素
Mn
717.3
1509.9
3248
Fe
762.5
1561.9
2953
请解释的主要原因:。
(4)、H、C、O三种元素可以组成很多种物质。①、、、、中属于非极性分子的有(填化学式)。
②
 的沸点(填“大于”、“小于”或“等于”)
的沸点(填“大于”、“小于”或“等于”) 的沸点。(5)、用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。
的沸点。(5)、用X射线衍射仪测定发现铁晶体有两种晶胞结构,如图1、图2所示。
①原子坐标参数可以描述晶胞内部各微粒的相对位置。设图1中1号原子的坐标参数为(0,0,0),3号原子的坐标参数为(1,1,1),则2号原子的坐标参数为。
②若图2中晶胞参数为apm,则该晶胞的空间利用率()为(用含π的式子表示)%。
32. 回答下列问题(1)、已知:三氟乙酸()的 , 三氯乙酸()的 , 则比较两者的酸性强弱:三氟乙酸三氯乙酸(填“>”“<”),原因是。(2)、已知邻羟基苯胺的结构为 , 邻羟基苯胺的沸点对羟基苯胺的沸点(填“低于”“高于”),原因是。 33. 前四周期元素X、Y、Z、W、T的原子序数依次增大,已知X原子的最外层电子数是次外层电子数的2倍;基态Y原子s能级的电子总数比p能级的多1;Z原子基态成对电子数是未成对电子数的3倍;W原子的简单离子半径在第三周期元素形成的简单离子中最小;T为应用最广泛的金属,其基态原子中有4个未成对电子。回答下列问题:
, 邻羟基苯胺的沸点对羟基苯胺的沸点(填“低于”“高于”),原因是。 33. 前四周期元素X、Y、Z、W、T的原子序数依次增大,已知X原子的最外层电子数是次外层电子数的2倍;基态Y原子s能级的电子总数比p能级的多1;Z原子基态成对电子数是未成对电子数的3倍;W原子的简单离子半径在第三周期元素形成的简单离子中最小;T为应用最广泛的金属,其基态原子中有4个未成对电子。回答下列问题: (1)、基态原子T的电子排布式是。(2)、元素Y、Z、W第一电离能由小到大的顺序为(用元素符号回答)。(3)、离子的空间构型为。(4)、常温下是一种浅黄色液体,熔点-20℃,不溶于水、易溶于苯。每个XZ分子与T原子间均有1个配位键。分子的结构可能为下图中的(填“甲”或“乙”),理由是。34. 回答下列问题:(1)、分子中所有原子均满足8电子构型,分子中键和键的个数比为 , 中心原子的杂化方式为。(2)、的分子结构如图所示,其中原子的杂化方式为。
(1)、基态原子T的电子排布式是。(2)、元素Y、Z、W第一电离能由小到大的顺序为(用元素符号回答)。(3)、离子的空间构型为。(4)、常温下是一种浅黄色液体,熔点-20℃,不溶于水、易溶于苯。每个XZ分子与T原子间均有1个配位键。分子的结构可能为下图中的(填“甲”或“乙”),理由是。34. 回答下列问题:(1)、分子中所有原子均满足8电子构型,分子中键和键的个数比为 , 中心原子的杂化方式为。(2)、的分子结构如图所示,其中原子的杂化方式为。 (3)、中,原子的杂化方式为;列举与立体构型相同的一种离子和一种分子、(填化学式)。(4)、用价层电子对互斥理论推断分子中,价层电子对数为 , 的VSEPR模型名称是;属于分子(填“极性”或“非极性”)分子中的键角(填“>”“<”或“=”)。35. 中国医学工作者曾因“硒与克山病”和“硒预防肝癌研究”的突破性科研成果而两次获得由国际生物无机化学家协会颁发的“施瓦茨奖”。请回答下列问题:(1)、基态Se原子的价电子排布图为 , Se与其同周期且相邻的两种元素的第一电离能由大到小的顺序为(用元素符号表示)。(2)、SeO2与水反应能生成H2SeO3 , H2SeO3中Se原子的杂化轨道类型为 , H2SeO3与H2SO3相比酸性较强的是(填化学式)。(3)、SeO3属于(填“极性”或“非极性”)分子。SeO3与SeO2相比,O-Se-O键角较大的是(填化学式),原因为。(4)、一种由In、Cd、Se三种元素组成的化合物的立方晶胞结构如图所示:
(3)、中,原子的杂化方式为;列举与立体构型相同的一种离子和一种分子、(填化学式)。(4)、用价层电子对互斥理论推断分子中,价层电子对数为 , 的VSEPR模型名称是;属于分子(填“极性”或“非极性”)分子中的键角(填“>”“<”或“=”)。35. 中国医学工作者曾因“硒与克山病”和“硒预防肝癌研究”的突破性科研成果而两次获得由国际生物无机化学家协会颁发的“施瓦茨奖”。请回答下列问题:(1)、基态Se原子的价电子排布图为 , Se与其同周期且相邻的两种元素的第一电离能由大到小的顺序为(用元素符号表示)。(2)、SeO2与水反应能生成H2SeO3 , H2SeO3中Se原子的杂化轨道类型为 , H2SeO3与H2SO3相比酸性较强的是(填化学式)。(3)、SeO3属于(填“极性”或“非极性”)分子。SeO3与SeO2相比,O-Se-O键角较大的是(填化学式),原因为。(4)、一种由In、Cd、Se三种元素组成的化合物的立方晶胞结构如图所示:
①该化合物的化学式为;
②若晶胞密度为dg·cm-3 , 阿伏加德罗常数的值为NA , 则晶胞中距离最近的两个Se原子的核间距为pm。