高考二轮复习知识点:极性分子和非极性分子1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( )A、键的键能小于键的键能 B、三氟乙酸的大于三氯乙酸的 C、氟化氢分子的极性强于氯化氢分子的极性 D、气态氟化氢中存在 , 而气态氯化氢中是分子2. 价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是A、和的VSEPR模型均为四面体 B、和的空间构型均为平面三角形 C、和均为非极性分子 D、与的键角相等3. W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,是氧化性最强的单质,4种元素可形成离子化合物。下列说法正确的是A、分子的极性: B、第一电离能:X<Y<Z C、氧化性: D、键能:4. “肼合成酶”以其中的配合物为催化中心,可将与转化为肼(),其反应历程如下所示。
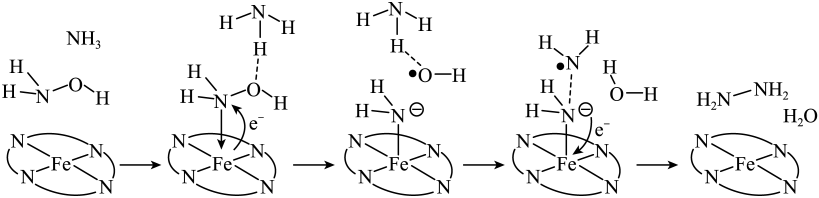
下列说法错误的是
A、、和均为极性分子 B、反应涉及、键断裂和键生成 C、催化中心的被氧化为 , 后又被还原为 D、将替换为 , 反应可得5. 共价化合物中所有原子均满足8电子稳定结构,一定条件下可发生反应: , 下列说法错误的是A、的结构式为 B、为非极性分子
C、该反应中的配位能力大于氯
D、比更难与发生反应
6. 三氟化氯()是极强助燃剂,能发生自耦电离: , 其分子的空间构型如图,下列推测合理的是
B、为非极性分子
C、该反应中的配位能力大于氯
D、比更难与发生反应
6. 三氟化氯()是极强助燃剂,能发生自耦电离: , 其分子的空间构型如图,下列推测合理的是 A、分子的中心原子杂化轨道类型为 B、与反应生成和 C、分子是含有极性键的非极性分子 D、比更易发生自耦电离7. 碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图,下列有关该物质的说法错误的是( )
A、分子的中心原子杂化轨道类型为 B、与反应生成和 C、分子是含有极性键的非极性分子 D、比更易发生自耦电离7. 碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图,下列有关该物质的说法错误的是( ) A、能使酸性高锰酸钾溶液褪色 B、该分子属于极性分子 C、1mol该分子最多可与加成 D、分子中键和键个数比为8. 氨、氮、硫的化合物应用广泛。ClO2(分子空间填充模型为
A、能使酸性高锰酸钾溶液褪色 B、该分子属于极性分子 C、1mol该分子最多可与加成 D、分子中键和键个数比为8. 氨、氮、硫的化合物应用广泛。ClO2(分子空间填充模型为 )。NaClO等含氯消毒剂可用于杀菌消毒。人工固氮可将N2转化为NH3 , 再进一步制备肼(N2H4)、硝酸、铵盐等化合物,肼和偏二甲肼(C2H8N2)常用作火箭燃料,肼的燃烧热为622.08 kJ·mol-1 , H2S可除去废水中Hg2+等重金属禹子,H2S 水溶液在空气中会缓慢氧化生成S而变诨浊。下列说法正确的是 A、基态氮原子的核外电子有5种运动状态 B、NH和H2S中心原子均采用sp3杂化方式 C、ClO2是由极性键构成的非极性分子 D、偏二甲肼(C2H8N2)的结构简式为:
)。NaClO等含氯消毒剂可用于杀菌消毒。人工固氮可将N2转化为NH3 , 再进一步制备肼(N2H4)、硝酸、铵盐等化合物,肼和偏二甲肼(C2H8N2)常用作火箭燃料,肼的燃烧热为622.08 kJ·mol-1 , H2S可除去废水中Hg2+等重金属禹子,H2S 水溶液在空气中会缓慢氧化生成S而变诨浊。下列说法正确的是 A、基态氮原子的核外电子有5种运动状态 B、NH和H2S中心原子均采用sp3杂化方式 C、ClO2是由极性键构成的非极性分子 D、偏二甲肼(C2H8N2)的结构简式为: 9. 明星分子单三键交替纯碳原子18环的一种合成方法如图。下列分析错误的是( )
9. 明星分子单三键交替纯碳原子18环的一种合成方法如图。下列分析错误的是( ) A、中C原子有和两种杂化方式 B、中存在大π键 C、和金刚石均为共价晶体 D、和均为非极性分子10. 我国科学家发现一种名为“Methanoliparia”的微生物,能以石油为食物产生甲烷和二氧化碳。下列不属于甲烷和二氧化碳共性的是( )A、非电解质 B、非极性分子 C、温室气体 D、平面型分子11. 下列实验操作对应的现象及所得结论均正确的是( )
A、中C原子有和两种杂化方式 B、中存在大π键 C、和金刚石均为共价晶体 D、和均为非极性分子10. 我国科学家发现一种名为“Methanoliparia”的微生物,能以石油为食物产生甲烷和二氧化碳。下列不属于甲烷和二氧化碳共性的是( )A、非电解质 B、非极性分子 C、温室气体 D、平面型分子11. 下列实验操作对应的现象及所得结论均正确的是( )选项
实验操作
现象
结论
A
将用皮毛摩擦过的橡胶棒靠近三氯甲烷液流
三氯甲烷的流动方向未发生改变
三氯甲烷是非极性分子
B
将溶液与溶液混合
有白色絮状沉淀产生
结合质子的能力:
C
向盛有丙烯醛的试管中加入溴水
溴水褪色
丙烯醛中含有碳碳双键
D
将铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体
加热时无明显现象,加入硝酸钾后溶液变蓝
硝酸钾起催化作用
A、A B、B C、C D、D12. 2022年北京冬奥会首次使用CO2跨临界直冷新型环保制冰技术。下列有关说法错误的是( ) A、CO2是由极性键构成的非极性分子 B、干冰中CO2分子间只存在范德华力 C、冰中H2O分子之间的主要作用力是氢键 D、此技术制冰的过程中发生的是化学变化13. 用氨水吸收硫酸工厂尾气中的发生反应:。下列说法正确的是( )A、的电子式为 B、是非极性分子 C、的结构式为
A、CO2是由极性键构成的非极性分子 B、干冰中CO2分子间只存在范德华力 C、冰中H2O分子之间的主要作用力是氢键 D、此技术制冰的过程中发生的是化学变化13. 用氨水吸收硫酸工厂尾气中的发生反应:。下列说法正确的是( )A、的电子式为 B、是非极性分子 C、的结构式为 D、的空间构型为直线形
14. 下列事实不是由于分子的极性导致的是( )A、N2的沸点比CO低 B、常温常压下,CO2为气体,CS2为液体 C、HCl气体易溶于水 D、用毛皮摩擦过的橡胶棒靠近水流,水流方向发生变化15. 实验室制备Na2S2O3的反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。下列有关说法正确的是( )A、SO2为非极性分子 B、Na2S的电子式为
D、的空间构型为直线形
14. 下列事实不是由于分子的极性导致的是( )A、N2的沸点比CO低 B、常温常压下,CO2为气体,CS2为液体 C、HCl气体易溶于水 D、用毛皮摩擦过的橡胶棒靠近水流,水流方向发生变化15. 实验室制备Na2S2O3的反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。下列有关说法正确的是( )A、SO2为非极性分子 B、Na2S的电子式为 C、为三角锥形
D、基态O原子的轨道表示式:
C、为三角锥形
D、基态O原子的轨道表示式: 16. 科技创新让2022年北京冬奥会举世瞩目。对下列科技创新所涉及的化学知识判断正确的是( )
16. 科技创新让2022年北京冬奥会举世瞩目。对下列科技创新所涉及的化学知识判断正确的是( ) A、“黑金”石墨烯为冬奥赛场留住温暖,石墨烯是有机物 B、冰墩墩的外壳材质主要是有机硅橡胶,有机硅橡胶是纯净物 C、速滑竞赛服使用聚氨酯材料可减少空气阻力,聚氨酯是高分子材料 D、二氧化碳跨临界直接制成的冰被誉为“最快的冰”,二氧化碳是极性分子17. 资源化利用CO2是实现“碳中和”的重要途径,CO2光催化转化为CH4的方法入选了2020年世界十大科技进展,其原理为:CO2+4H2CH4+2H2O。下列有关CO2、CH4的说法正确的是( )A、CO2的空间构型是V形 B、CH4是极性分子 C、电负性:O>C>H D、CO2转化为CH4体现了CO2的还原性18. 碳化钙是一种基本化工原料,可用于制备乙炔: .下列有关说法正确的是( )A、C2H2为极性分子 B、中子数为10的氧原子为 C、H2O的电子式为
A、“黑金”石墨烯为冬奥赛场留住温暖,石墨烯是有机物 B、冰墩墩的外壳材质主要是有机硅橡胶,有机硅橡胶是纯净物 C、速滑竞赛服使用聚氨酯材料可减少空气阻力,聚氨酯是高分子材料 D、二氧化碳跨临界直接制成的冰被誉为“最快的冰”,二氧化碳是极性分子17. 资源化利用CO2是实现“碳中和”的重要途径,CO2光催化转化为CH4的方法入选了2020年世界十大科技进展,其原理为:CO2+4H2CH4+2H2O。下列有关CO2、CH4的说法正确的是( )A、CO2的空间构型是V形 B、CH4是极性分子 C、电负性:O>C>H D、CO2转化为CH4体现了CO2的还原性18. 碳化钙是一种基本化工原料,可用于制备乙炔: .下列有关说法正确的是( )A、C2H2为极性分子 B、中子数为10的氧原子为 C、H2O的电子式为 D、Ca2+的结构示意图为
D、Ca2+的结构示意图为  19. 一种新型锂盐可作为锂电池的电解液,其结构如图所示。其中元素W、X、Y、Z处于元素周期表的同一周期,Y原子的最外层电子数是电子层数的3倍。下列叙述正确的是( )
19. 一种新型锂盐可作为锂电池的电解液,其结构如图所示。其中元素W、X、Y、Z处于元素周期表的同一周期,Y原子的最外层电子数是电子层数的3倍。下列叙述正确的是( ) A、X与W能够形成具有极性键的非极性分子 B、W、X、Y、Z的原子半径大小关系:r(W)>r(Y)>r(Z)>r(X) C、简单气态氢化物的还原性:W>Y D、X的最高价氧化物对应水化物的酸性大于Z20. 短周期主族元素X、Y、Z、W、M的原子序数依次增大;X的氢化物种类繁多,其中含氢量最高的为25%;Z和W的基态原子均满足s轨道电子总数和p轨道上的电子总数相等;M是同周期中电负性最大的元素。下列说法错误的是( )A、第一电离能:X<Z<Y B、Y的简单氢化物可用作制冷剂 C、X和Z、X和M均可以形成含有极性键的非极性分子 D、W和M的化合物的水溶液中,阳离子与阴离子数目之比等于1:221. BF3是非极性分子,下列有关说法错误的是( )A、B-F键是极性键 B、空间结构为三角锥型 C、键角均为120° D、所有原子共平面22. 将摩擦带电的玻璃棒接近液流,实验现象如图。该实验能说明( )
A、X与W能够形成具有极性键的非极性分子 B、W、X、Y、Z的原子半径大小关系:r(W)>r(Y)>r(Z)>r(X) C、简单气态氢化物的还原性:W>Y D、X的最高价氧化物对应水化物的酸性大于Z20. 短周期主族元素X、Y、Z、W、M的原子序数依次增大;X的氢化物种类繁多,其中含氢量最高的为25%;Z和W的基态原子均满足s轨道电子总数和p轨道上的电子总数相等;M是同周期中电负性最大的元素。下列说法错误的是( )A、第一电离能:X<Z<Y B、Y的简单氢化物可用作制冷剂 C、X和Z、X和M均可以形成含有极性键的非极性分子 D、W和M的化合物的水溶液中,阳离子与阴离子数目之比等于1:221. BF3是非极性分子,下列有关说法错误的是( )A、B-F键是极性键 B、空间结构为三角锥型 C、键角均为120° D、所有原子共平面22. 将摩擦带电的玻璃棒接近液流,实验现象如图。该实验能说明( ) A、 分子带电, 分子不带电 B、 是由非极性键形成的极性分子 C、 是正四面体形分子 D、 分子中正负电荷的重心是重合的23. “天问一号”于2021年2月被火星捕获。火星大气中含有羰基硫(COS)分子,其结构与 相似,关于羰基硫的说法正确的是( )A、比例模型:
A、 分子带电, 分子不带电 B、 是由非极性键形成的极性分子 C、 是正四面体形分子 D、 分子中正负电荷的重心是重合的23. “天问一号”于2021年2月被火星捕获。火星大气中含有羰基硫(COS)分子,其结构与 相似,关于羰基硫的说法正确的是( )A、比例模型: B、结构式:
C、共用电子对都偏向碳
D、是含有极性键的非极性分子
24. 反应CO2 + 2NaOH → Na2CO3 + H2O可用于捕捉废气中的CO2 , 下列叙述正确的是( )A、CO2是由极性键构成的非极性分子 B、Na2CO3属于弱电解质,其水溶液呈碱性 C、NaOH溶液既含离子键,又含共价键 D、CO 的水解方程式:CO + 2H2O H2CO3 + 2OH−25. 含有极性键的非极性分子是( )A、SiO2 B、CO2 C、N2 D、NaOH26. BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是( )
B、结构式:
C、共用电子对都偏向碳
D、是含有极性键的非极性分子
24. 反应CO2 + 2NaOH → Na2CO3 + H2O可用于捕捉废气中的CO2 , 下列叙述正确的是( )A、CO2是由极性键构成的非极性分子 B、Na2CO3属于弱电解质,其水溶液呈碱性 C、NaOH溶液既含离子键,又含共价键 D、CO 的水解方程式:CO + 2H2O H2CO3 + 2OH−25. 含有极性键的非极性分子是( )A、SiO2 B、CO2 C、N2 D、NaOH26. BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法不正确的是( ) A、该过程的总反应:C6H6O+7O2 6CO2+3H2O B、该过程中BMO表现较强还原性 C、降解产物的分子中只含有极性分子 D、①和②中被降解的苯酚的物质的量之比为3:127. 属于极性分子的是( )A、CO2 B、H2O C、CCl4 D、N228. 下列各组物质中,由极性键和非极性键构成的非极性分子是( )A、 B、 C、 D、NaOH
A、该过程的总反应:C6H6O+7O2 6CO2+3H2O B、该过程中BMO表现较强还原性 C、降解产物的分子中只含有极性分子 D、①和②中被降解的苯酚的物质的量之比为3:127. 属于极性分子的是( )A、CO2 B、H2O C、CCl4 D、N228. 下列各组物质中,由极性键和非极性键构成的非极性分子是( )A、 B、 C、 D、NaOH二、非选择题
-
29. 据《自然·通讯》(Nature Communications)报道,我国科学家发现了硒化铜纳米催化剂在二氧化碳电化学还原法生产甲醇过程中催化效率高。铜和硒等元素化合物在生产、生活中应用广泛。
请回答下列问题:
(1)、基态硒原子的价电子排布式为;硒所在主族元素的简单氢化物中沸点最低的是。(2)、电还原法制备甲醇的原理为2CO2+4H2O 2CH3OH+3O2。
2CH3OH+3O2。 ①写出该反应中由极性键构成的非极性分子的结构式;
②标准状况下,V L CO2气体含有个π键。
(3)、苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键,可记为(π 右下角“6”表示6个原子,右上角“6”表示6个共用电子)。已知某化合物的结构简式为 ,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为 , Se的杂化方式为。 (4)、黄铜矿由Cu+、Fe3+、S2-构成,其四方晶系晶胞结构如图所示。则Cu+的配位数为;若晶胞参数a=b=524pm,c=1032pm,用NA表示阿伏加德罗常数的值,该晶系晶体的密度是g·cm-3(不必计算或化简,列出计算式即可)。
,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为 , Se的杂化方式为。 (4)、黄铜矿由Cu+、Fe3+、S2-构成,其四方晶系晶胞结构如图所示。则Cu+的配位数为;若晶胞参数a=b=524pm,c=1032pm,用NA表示阿伏加德罗常数的值,该晶系晶体的密度是g·cm-3(不必计算或化简,列出计算式即可)。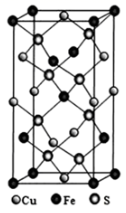 30. 硼及其化合物广泛应用于能源、材料等领域。(1)、钕铁硼是磁性材料,被称为“磁王”。钕的价电子排布式为4f46s2 , 则钕原子的未成对电子数有个。(2)、氟化硼(BF3)是石油化工的重要催化剂。BF3BF3是分子(填“极性”或“非极性”),BF3中B—F比BF4-中B—F的键长短,原因是。(3)、乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。
30. 硼及其化合物广泛应用于能源、材料等领域。(1)、钕铁硼是磁性材料,被称为“磁王”。钕的价电子排布式为4f46s2 , 则钕原子的未成对电子数有个。(2)、氟化硼(BF3)是石油化工的重要催化剂。BF3BF3是分子(填“极性”或“非极性”),BF3中B—F比BF4-中B—F的键长短,原因是。(3)、乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。
①B2H6的分子结构如图所示,其中B原子的杂化方式为。
②H3NBH3的相对分子质量与B2H6相差不大,但是H3NBH3的沸点却比B2H6高得多,原因是。
③同一周期中,第一电离能介于B、N之间的元素有种。
(4)、硼酸盐是重要的防火材料。图(a)是一种无限链式结构的硼酸根,则该硼酸根离子符号是 , 图(b)是硼酸钠晶体中阴离子(含B、O、H三种元素)的结构,该晶体中含有的化学键有。A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键
 (5)、立方氮化硼(BN)是超硬、耐磨、耐高温的新型材料。其晶体结构与金刚石相似,如图c所示,则B的配位数为 , 测得B与N的原子核间距为anm,晶体的密度为dg·cm-3 , 则阿伏加德罗常数NA=(列计算式即可)。
(5)、立方氮化硼(BN)是超硬、耐磨、耐高温的新型材料。其晶体结构与金刚石相似,如图c所示,则B的配位数为 , 测得B与N的原子核间距为anm,晶体的密度为dg·cm-3 , 则阿伏加德罗常数NA=(列计算式即可)。 31. 英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法从石墨中成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如图:
31. 英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁·诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法从石墨中成功获得超薄材料石墨烯而获奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如图: (1)、下列有关石墨烯说法正确的是。
(1)、下列有关石墨烯说法正确的是。a.12 g石墨烯含 键数为NA
b.石墨烯分子中所有原子可以处于同一平面
c.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
d.石墨烯中每个C原子连接3个六元环,每个六元环占有6个C原子
(2)、化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。①基态铜原子能量最高的电子占据的能级符号是;第四周期元素中,最外层电子数与铜相同的元素还有。
②下列分子属于非极性分子的是。
a.甲烷
b.二氯甲烷
c.苯
d.乙醇
③乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因。
④酞菁与酞菁铜染料分子结构如下图1,酞菁分子中碳原子采用的杂化方式是。

⑤金与铜可形成的金属互化物合金(如上图2),它的化学式可表示为;在Au周围最近并距离相等的Cu有个,若2个Cu原子核的最小距离为d pm,该晶体的密度可以表示为g/cm3。(阿伏加德罗常数用NA表示)
32. 氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)高 Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡.完成下列填空:
(1)、上述反应所涉及的元素,原子半径由大到小的顺序是 .其中一种元素的原子核外s电子数与p电子数相等,写出它的最外层电子排布的轨道表示式 .
比较碳、硅两种元素的非金属性强弱,可以通过比较(填:化合物性质的差异)来判断.
(2)、上述反应混合物中的极性分子是 , 写出非极性分子的电子式 .从晶体类型的角度分析用氮化硅制造发动机中耐热部件的原因是
(3)、下列措施可以提高二氧化硅转化率的是(选填编号).a.增加二氧化硅用量b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)、下列描述中能说明反应已达平衡的是(选填编号).a.c(CO)=3c(N2) b.v (CO)=3v(N2)
c. 保持不变d.气体的压强保持不变
(5)、测得平衡时固体质量减少了11.2g,则用氮气表示的平均反应速率为 .