高考二轮复习知识点:用电子式表示简单的离子化合物和共价化合物的形成
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
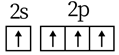
1. 下列化学用语使用正确的是( )A、基态C原子价电子排布图:
 B、 结构示意图:
B、 结构示意图: 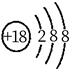 C、 形成过程:
C、 形成过程: 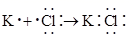 D、质量数为2的氢核素:
2. 下列图示错误的是A、的电子云:
D、质量数为2的氢核素:
2. 下列图示错误的是A、的电子云: B、金刚石晶体结构模型:
B、金刚石晶体结构模型: C、形成过程:
D、球棍模型:
C、形成过程:
D、球棍模型: 3. 下列事实用化学用语表述错误的是A、用电子式表示NaCl的形成过程:
3. 下列事实用化学用语表述错误的是A、用电子式表示NaCl的形成过程: B、中子数为20的K原子:
C、常温时,0.1mol·L−1氨水的pH≈11.1:
D、O2-的结构示意图:
B、中子数为20的K原子:
C、常温时,0.1mol·L−1氨水的pH≈11.1:
D、O2-的结构示意图: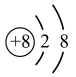 4. 下列表示错误的是( )A、碳酸二甲酯的结构简式: B、用电子式表示氯化钠的形成过程:
4. 下列表示错误的是( )A、碳酸二甲酯的结构简式: B、用电子式表示氯化钠的形成过程: C、的空间结构:
C、的空间结构: D、乙烯的球棍模型:
D、乙烯的球棍模型: 5. 正确掌握化学用语是学好化学的基础,下列化学用语正确的是( )A、乙烯的结构简式为:CH2CH2 B、甲基的电子式:
5. 正确掌握化学用语是学好化学的基础,下列化学用语正确的是( )A、乙烯的结构简式为:CH2CH2 B、甲基的电子式: C、比例模型
C、比例模型 可以表示二氧化碳分子
D、Mg和Cl形成离子键的过程:
可以表示二氧化碳分子
D、Mg和Cl形成离子键的过程: 6. 下列有关化学用语表示正确的是( )A、聚丙烯的结构简式为:
6. 下列有关化学用语表示正确的是( )A、聚丙烯的结构简式为: B、乙酸的分子式:CH3COOH
C、CO2分子的比例模型:
B、乙酸的分子式:CH3COOH
C、CO2分子的比例模型: 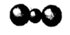 D、用电子式表示HCl的形成过程:
D、用电子式表示HCl的形成过程: 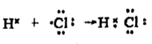 7. 下列化学用语书写正确的是( )A、用电子式表示NaCl的形成过程:
7. 下列化学用语书写正确的是( )A、用电子式表示NaCl的形成过程: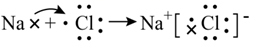 B、
B、 按照系统命名法的名称:2-乙基丙烷
C、中子数为18的氯原子:
D、 的球根模型:
按照系统命名法的名称:2-乙基丙烷
C、中子数为18的氯原子:
D、 的球根模型:  8. 下列化学用语对事实的表述错误的是( )A、电解精炼铜的阴极反应: B、由Na和Cl形成离子键的过程:
8. 下列化学用语对事实的表述错误的是( )A、电解精炼铜的阴极反应: B、由Na和Cl形成离子键的过程: C、常温时,0.1mol/L氨水的pH=11.1:
D、石灰水敞口存放,出现白色固体:
9. 下列化学用语表达正确的是( )A、乙烯的实验式: B、电镀铜时,铁制镀件上的电极反应式: C、 在水中的电离方程式: D、用电子式表示 的形成过程:
C、常温时,0.1mol/L氨水的pH=11.1:
D、石灰水敞口存放,出现白色固体:
9. 下列化学用语表达正确的是( )A、乙烯的实验式: B、电镀铜时,铁制镀件上的电极反应式: C、 在水中的电离方程式: D、用电子式表示 的形成过程: 10. 下列表述中,正确的是( )A、碳酸钠溶液呈碱性的原因: B、 溶液中滴加足量氢氧化钠溶液: C、用电子式表示 和 形成 的过程:
10. 下列表述中,正确的是( )A、碳酸钠溶液呈碱性的原因: B、 溶液中滴加足量氢氧化钠溶液: C、用电子式表示 和 形成 的过程: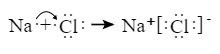 D、钢铁发生电化学腐蚀的正极反应:
11. 已知黑火药爆炸的反应:S+2KNO3+3C → K2S+3CO2+ N2↑,下列说法正确的是( )A、该反应中氧化剂只有硝酸钾 B、该反应中还原剂只有碳 C、每生成0.1 mol N2转移电子1 mol D、产物中有两种共价化合物12. 对下列过程的化学用语表述正确的是( )A、用硫酸铜溶液除去乙炔中的硫化氢气体:H2S+Cu2+=CuS↓+2H+ B、向氯化铝溶液中滴入过量氨水:Al3++4OH-=AlO2-+2H2O C、用电子式表示Na和Cl形成NaCl的过程:
D、钢铁发生电化学腐蚀的正极反应:
11. 已知黑火药爆炸的反应:S+2KNO3+3C → K2S+3CO2+ N2↑,下列说法正确的是( )A、该反应中氧化剂只有硝酸钾 B、该反应中还原剂只有碳 C、每生成0.1 mol N2转移电子1 mol D、产物中有两种共价化合物12. 对下列过程的化学用语表述正确的是( )A、用硫酸铜溶液除去乙炔中的硫化氢气体:H2S+Cu2+=CuS↓+2H+ B、向氯化铝溶液中滴入过量氨水:Al3++4OH-=AlO2-+2H2O C、用电子式表示Na和Cl形成NaCl的过程: D、钢铁发生电化学腐蚀的正极反应:Fe-3e-=Fe3+
13. 一定条件下,氨气与氟气发生反应:4NH3+3F2→NF3+3NH4F,其中NF3空间结构与NH3相似。下列有关说法错误的是( )A、反应物和生成物均为共价化合物 B、NF3空间结构为三角锥形 C、NF3中只含极性共价键 D、NH4F中既含有离子键又含有共价键14. 正确使用化学用语是学习化学必需的基本技能。下列化学用语表达错误的是( )A、CO2的结构式为:O=C=O B、Mg原子的结构示意图:
D、钢铁发生电化学腐蚀的正极反应:Fe-3e-=Fe3+
13. 一定条件下,氨气与氟气发生反应:4NH3+3F2→NF3+3NH4F,其中NF3空间结构与NH3相似。下列有关说法错误的是( )A、反应物和生成物均为共价化合物 B、NF3空间结构为三角锥形 C、NF3中只含极性共价键 D、NH4F中既含有离子键又含有共价键14. 正确使用化学用语是学习化学必需的基本技能。下列化学用语表达错误的是( )A、CO2的结构式为:O=C=O B、Mg原子的结构示意图: C、中子数为10的氧元素,其核素符号是
D、HCl的形成过程可用下式表示:
C、中子数为10的氧元素,其核素符号是
D、HCl的形成过程可用下式表示: 15. 正确掌握化学用语是学好化学的基础,下列有关化学用语表述正确的是A、S2-核外电子排布结构示意图:
15. 正确掌握化学用语是学好化学的基础,下列有关化学用语表述正确的是A、S2-核外电子排布结构示意图: B、质子数为18、中子数为22的氩原子:Ar
C、“氢燃烧”反应H+H→He+γ涉及的三种核素互为同位素
D、Mg和Cl形成离子键的过程:
B、质子数为18、中子数为22的氩原子:Ar
C、“氢燃烧”反应H+H→He+γ涉及的三种核素互为同位素
D、Mg和Cl形成离子键的过程: 16. 下列关于Cl−、ClO2、和的说法错误的是A、Cl−提供孤电子对与Cu2+可形成CuCl B、ClO2属于共价化合物 C、的空间结构为三角锥 D、的键角比的键角大17. 下列化学用语错误的是A、中子数为20的氯原子:Cl B、H2O的分子结构模型:
16. 下列关于Cl−、ClO2、和的说法错误的是A、Cl−提供孤电子对与Cu2+可形成CuCl B、ClO2属于共价化合物 C、的空间结构为三角锥 D、的键角比的键角大17. 下列化学用语错误的是A、中子数为20的氯原子:Cl B、H2O的分子结构模型: C、HClO的结构式:H-O-Cl
D、用电子式表示HCl的形成过程:
C、HClO的结构式:H-O-Cl
D、用电子式表示HCl的形成过程: 18. 下列对图示的解释错误的是
18. 下列对图示的解释错误的是A
B
C
D
固体在水中形成水合离子

向稀硫酸中加入溶液,溶液导电能力变化

的形成示意图

光照过程中氯水的变化

a时刻稀硫酸与溶液恰好完全反应

降低的原因是氯气逸出
A、A B、B C、C D、D19. 下列化学用语书写错误的是( )A、的结构示意图: B、的电子式:
B、的电子式: C、用电子式表示的形成过程:
C、用电子式表示的形成过程: D、苯的结构简式:
D、苯的结构简式: 20. 下列化学用语表示正确的是( )A、氯气的分子结构模型:
20. 下列化学用语表示正确的是( )A、氯气的分子结构模型: B、硫原子的结构示意图:
B、硫原子的结构示意图: C、的电离方程式:
D、用电子式表示的形成过程:
C、的电离方程式:
D、用电子式表示的形成过程: 21. 下列化学用语表达不正确的是( )A、的结构式:N≡N B、的结构示意图:
21. 下列化学用语表达不正确的是( )A、的结构式:N≡N B、的结构示意图: C、形成过程:
C、形成过程: D、石墨的一种同素异形体的分子式:
22. 下列化学用语的书写正确的是( )A、O2-的离子结构示意图:
D、石墨的一种同素异形体的分子式:
22. 下列化学用语的书写正确的是( )A、O2-的离子结构示意图: B、质子数为27、中子数为60的Co原子:Co
C、H2O的电子式:
B、质子数为27、中子数为60的Co原子:Co
C、H2O的电子式: D、用电子式表示氢溴酸的形成过程为:
D、用电子式表示氢溴酸的形成过程为: 23. 下列有关化学用语正确的是( )A、基态氮原子的电子排布图:
23. 下列有关化学用语正确的是( )A、基态氮原子的电子排布图: B、如图是食盐晶体的晶胞:
B、如图是食盐晶体的晶胞: C、NH4Br的电子式:
C、NH4Br的电子式: D、CCl4分子的比例模型:
D、CCl4分子的比例模型: 24. 下列化学用语中不正确的是( )A、CO2的电子式为
24. 下列化学用语中不正确的是( )A、CO2的电子式为 B、Cl-的结构示意图:
B、Cl-的结构示意图: C、N2的结构式:N≡N
D、用电子式表示HCl的形成过程为
C、N2的结构式:N≡N
D、用电子式表示HCl的形成过程为 25. 下列化学用语表示正确的是( )A、和都是共价化合物 B、、、和是氢元素的四种不同粒子 C、的电子式:
25. 下列化学用语表示正确的是( )A、和都是共价化合物 B、、、和是氢元素的四种不同粒子 C、的电子式: D、次氯酸的结构式:H-Cl-O
26. A、B、C、D、E均为短周期元素,A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3∶4,E原子半径是短周期元素原子半径最大的。则下列叙述正确的是( )A、E和C能形成不止一种化合物,且不同化合物化学键类型完全相同 B、由B,D组成的物质是电解质 C、由A,B,C,D四种元素形成的化合物一定不属于离子化合物 D、A和C能形成共价化合物27. 下列化学用语使用正确的是( )A、N2的电子式是
D、次氯酸的结构式:H-Cl-O
26. A、B、C、D、E均为短周期元素,A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3∶4,E原子半径是短周期元素原子半径最大的。则下列叙述正确的是( )A、E和C能形成不止一种化合物,且不同化合物化学键类型完全相同 B、由B,D组成的物质是电解质 C、由A,B,C,D四种元素形成的化合物一定不属于离子化合物 D、A和C能形成共价化合物27. 下列化学用语使用正确的是( )A、N2的电子式是 B、结构示意图:
B、结构示意图: C、质量数为2的氢原子:
D、形成过程:
C、质量数为2的氢原子:
D、形成过程: 28. 下列化学用语对事实的表述错误的是( )A、硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH C17H35COOC2H5+H218O B、常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O NH4++OH− C、由Na和Cl形成离子键的过程:
28. 下列化学用语对事实的表述错误的是( )A、硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH C17H35COOC2H5+H218O B、常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O NH4++OH− C、由Na和Cl形成离子键的过程: D、电解精炼铜的阴极反应:Cu2+ +2e−=Cu
D、电解精炼铜的阴极反应:Cu2+ +2e−=Cu
二、非选择题
-
29.(1)、按系统命名法,
 的名称是:。 (2)、石灰氮Ca(CN)2是离子化合物,其中CN-离子内部均满足各原子8电子稳定结构,写出Ca(CN) 2的电子式:。(3)、氮的氢化物之一肼(N2H4)是一种油状液体,常做火箭燃料,与水任意比互溶,并且沸点高达113 ℃。肼的沸点高达113 ℃的原因是。30. 铝及其化合物在生产生活中具有重要的作用。(1)、铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)(2)、铝电池性能优越,在现代生产、生活中有广泛的应用。铝-空气电池以其环保、安全而受到越来越多的关注,其原理如下图所示。
的名称是:。 (2)、石灰氮Ca(CN)2是离子化合物,其中CN-离子内部均满足各原子8电子稳定结构,写出Ca(CN) 2的电子式:。(3)、氮的氢化物之一肼(N2H4)是一种油状液体,常做火箭燃料,与水任意比互溶,并且沸点高达113 ℃。肼的沸点高达113 ℃的原因是。30. 铝及其化合物在生产生活中具有重要的作用。(1)、铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)(2)、铝电池性能优越,在现代生产、生活中有广泛的应用。铝-空气电池以其环保、安全而受到越来越多的关注,其原理如下图所示。
该电池的正极反应方程式为 ;电池中NaCl溶液的作用是 ;以该电池为电源,用惰性电极电解Na2SO4溶液,当Al电极质量减少1.8g时,电解池阴极生成的气体在标准状况下的体积为L。
(3)、AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2。NaN3晶体中阴、阳离子个数比为 , 写出反应化学方程式为(4)、同主族的元素应用广泛。2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:①基态Ga原子价电子排布式 , 核外电子占据最高能级的电子云形状为;基态As原子最高能层上有个电子。
②镓失去电子的逐级电离能(单位:kJ/mol)的数值依次为577、1985、2962、6192,-1由此可推知镓的主要化合价为和+3,砷的第一电离能比镓填“大”或“小”)。
③第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为。
④砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中C原子的杂化方式为 , AsH3分子的空间构型为。
⑤相同压强下,AsH3的沸点NH3(填“大于”或“小于”),原因为。
31. 某研究性学习小组同学试图用如图装置(气密性好)研究与的反应。
实验步骤:
①将一定量浓盐酸滴在粉末上,立即产生黄绿色气体。
②待黄绿色气体均匀充满集气瓶时,关闭止水夹。
③再向钠粒滴2滴水,片刻后钠燃烧,产生白烟,白色固体附着在集气瓶内壁上。
回答下列问题:
(1)、步骤①,仪器a的名称是 , 黄绿色气体是 , 的作用是(填“氧化剂”或“还原剂”)。(2)、步骤③向钠滴水时发生反应的化学方程式为。(3)、钠能够燃烧的原因是 , 生成的白色固体的电子式为。(4)、右侧烧杯中溶液是为了吸收未反应的试剂X可以选用的是。A.浓溶液 B.浓硫酸 C.澄清石灰水 D.饱和食盐水
此时烧杯中发生反应的离子方程式为:。
32. A~G是几种烃分子的球棍模型(如图),据此回答下列问题: (1)、其中含氢量最高的烃是(填对应字母);能够发生加成反应的烃有(填数字)种;(2)、写出A失去一个氢原子形成的甲基的电子式;(3)、F与浓硝酸和浓硫酸的混酸共热至50℃~60℃发生反应的化学方程式为(4)、上述物质中互为同系物的是或(填对应字母)。(5)、D与等物质的量溴反应的化学方程式为所得产物的名称为33. 元素X、Y、Z、Q、R为原子序数依次增大的短周期主族元素,其原子半径和最外层电子数之间的关系如图所示。
(1)、其中含氢量最高的烃是(填对应字母);能够发生加成反应的烃有(填数字)种;(2)、写出A失去一个氢原子形成的甲基的电子式;(3)、F与浓硝酸和浓硫酸的混酸共热至50℃~60℃发生反应的化学方程式为(4)、上述物质中互为同系物的是或(填对应字母)。(5)、D与等物质的量溴反应的化学方程式为所得产物的名称为33. 元素X、Y、Z、Q、R为原子序数依次增大的短周期主族元素,其原子半径和最外层电子数之间的关系如图所示。 (1)、Q离子的结构示意图是。(2)、R元素在周期表中位于第周期族;关于R所在主族的单质及化合物的叙述错误的是(填字母)。
(1)、Q离子的结构示意图是。(2)、R元素在周期表中位于第周期族;关于R所在主族的单质及化合物的叙述错误的是(填字母)。A.从上到下,单质颜色越来越深,熔、沸点越来越高
B.单质均可与水发生反应生成两种酸
C.单质均具有强氧化性,能将氧化至
D.氢化物均易溶于水,且均为强酸
(3)、X、Q、R三种元素的最高价氧化物对应的水化物酸性由强到弱的顺序是(填化学式)。(4)、Z与R可以形成(填“共价”或“离子”)化合物,用电子式表示其形成过程为。(5)、Y与Q非金属性较强的是(填元素符号),请从原子结构的角度解释原因:。34. X、Y、M、Z、W是原子序数依次增大的短周期主族元素,X、Z最外层电子数相同,X2-和M2+电子层结构相同。含0.9%YW化合物的水溶液称为生理盐水。(1)、Z在周期表中的位置为。(2)、X2-离子的电子式是 , W可形成化合物MW2、ZW2 , 由此说明,化学键可以使相结合,也可以使相结合。(3)、用电子式表示化合物Y2Z的形成过程。(4)、上述5种元素中原子半径最大的是(用元素符号表示)。(5)、数字化实验是将传感器、数据采集器和计算机连接起来,采集实验过程中各种物理量变化的数据。如图是用强光照射广口瓶中新制W2的水溶液时所获得的图像,下列纵坐标代表的物理量与图像不相符的是(填标号)
A.溶液颜色 B.溶液中氢离子的数目
C.瓶中氧气的体积分数 D.溶液的导电能力
工业上用W2制漂粉精的化学方程式是。
35. 现有A、B、C、D、E、F六种短周期元素,其相关性质信息如下。请回答下列问题:元素
特征
元素
特征
A
常见金属,其最高价氧化物对应的水化物可以溶于强碱
D
在地壳中含量最多
B
常见化肥的主要元素,单质常温下呈气态
E
单质为黄绿色有毒气体
C
在短周期主族元素中,原子半径最大
F
原子的核外电子只有1个
(1)、元素D在元素周期表中的位置为 , 其原子的结构示意图为。(2)、A,C,D对应的简单离子的半径由大到小的排序是(用离子符号表示)。(3)、B的最简单氢化物的稳定性(填“>”、“<”或“=”) 的稳定性。(4)、 溶液中存在的化学键类型有(填“离子键”、“共价键”或“离子键和共价键”)。A的最高价氧化物的水化物与 溶液反应的离子方程式为。(5)、用电子式表示化合物 的形成过程。(6)、已知 是一种强氧化性漂白剂,它在碱性环境中稳定存在。在碱性条件下, 和 恰好完全反应,该反应的离子方程式为。