高考二轮复习知识点:金属晶体的基本堆积模型
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 铁有δ、γ、α三种晶体结构,以下依次是δ、γ、α三种晶体在不同温度下转化的图示。下列有关说法中正确的是( )

δ-Fe γ-Fe α-Fe
A、δ、γ、α三种晶体互为同分异构体 B、γ-Fe晶体为面心立方体紧密堆积 C、α-Fe晶体与每个Fe原子距离相等且最近的Fe原子有8个 D、将Fe加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同2. 铁的晶体有多种结构,其中两种晶体的晶胞结构如下图甲、乙所示(acm、bcm分别为晶胞边长),下列说法正确的是 A、两种铁晶体中均存在金属阳离子和阴离子 B、乙晶体晶胞中所含有的铁原子数为14 C、甲、乙两种晶胞中铁原子的配位数之比为1:2 D、甲、乙两种铁晶体的密度比为b3:2a33. 鲍鱼壳有内层和外层之分,一层是霰石,一层是方解石,他们的组成成分都是碳酸钙,但它们的晶体结构不同,霰石光滑,方解石坚硬,称为“同质多象”现象。金刚石和石墨也是一种同质多象现象。下列说法错误的是( )
A、两种铁晶体中均存在金属阳离子和阴离子 B、乙晶体晶胞中所含有的铁原子数为14 C、甲、乙两种晶胞中铁原子的配位数之比为1:2 D、甲、乙两种铁晶体的密度比为b3:2a33. 鲍鱼壳有内层和外层之分,一层是霰石,一层是方解石,他们的组成成分都是碳酸钙,但它们的晶体结构不同,霰石光滑,方解石坚硬,称为“同质多象”现象。金刚石和石墨也是一种同质多象现象。下列说法错误的是( ) A、霰石晶体结构图的方框中含有4个钙离子、4个碳酸根离子 B、方解石晶体结构图的平行六面体中含有2个钙离子、2个碳酸根离子 C、霰石转化成方解石是物理变化 D、方解石与霰石的某些性质不同4. 已知空间利用率是指构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。下列有关说法错误的是( )
A、霰石晶体结构图的方框中含有4个钙离子、4个碳酸根离子 B、方解石晶体结构图的平行六面体中含有2个钙离子、2个碳酸根离子 C、霰石转化成方解石是物理变化 D、方解石与霰石的某些性质不同4. 已知空间利用率是指构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。下列有关说法错误的是( ) A、铜碘杂化团簇分子结构如图1所示,分子间通过范德华力聚集在一起 B、晶体的晶胞如图2所示,标记为X的的分子坐标为 C、H原子的电子云如图3所示,H原子核外大多数电子在原子核附近运动 D、金属Cu为面心立方晶胞(如图4所示),其空间利用率约为74%5. GaAs是人工合成的新型半导体材料,其晶体结构与金刚石相似,晶胞边长为anm,下列说法正确的是( )
A、铜碘杂化团簇分子结构如图1所示,分子间通过范德华力聚集在一起 B、晶体的晶胞如图2所示,标记为X的的分子坐标为 C、H原子的电子云如图3所示,H原子核外大多数电子在原子核附近运动 D、金属Cu为面心立方晶胞(如图4所示),其空间利用率约为74%5. GaAs是人工合成的新型半导体材料,其晶体结构与金刚石相似,晶胞边长为anm,下列说法正确的是( ) A、GaAs晶体中,As与Ga之间存在配位键 B、As原子在晶胞的内部,Ga原子在晶胞的顶角和面上 C、每一个As原子周围最近的As原子有8个 D、As原子与最近的Ga原子之间的距离为6. 下列示意图或图示正确的是( )A、的分子模型示意图
A、GaAs晶体中,As与Ga之间存在配位键 B、As原子在晶胞的内部,Ga原子在晶胞的顶角和面上 C、每一个As原子周围最近的As原子有8个 D、As原子与最近的Ga原子之间的距离为6. 下列示意图或图示正确的是( )A、的分子模型示意图 B、键电子云模型
B、键电子云模型 C、砷原子结构示意图
C、砷原子结构示意图 D、Na晶体堆积方式
D、Na晶体堆积方式 7. 下列有关氯化钠晶体的叙述中,正确的是( )A、氯化钠晶体是由钠离子和氯离子构成的,所以氯化钠晶体能导电 B、钠离子和氯离子之间因静电吸引而形成氯化钠晶体 C、氯化钠的分子式为NaCl D、每个钠离子周围吸引6个氯离子,每个氯离子周围同样吸引6个钠离子8. 在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图)。该晶体可能为( )
7. 下列有关氯化钠晶体的叙述中,正确的是( )A、氯化钠晶体是由钠离子和氯离子构成的,所以氯化钠晶体能导电 B、钠离子和氯离子之间因静电吸引而形成氯化钠晶体 C、氯化钠的分子式为NaCl D、每个钠离子周围吸引6个氯离子,每个氯离子周围同样吸引6个钠离子8. 在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如图)。该晶体可能为( ) A、NaCl B、CsCl C、 D、9. 下列是典型晶体的结构示意图,从①到④对应正确的是:( )
A、NaCl B、CsCl C、 D、9. 下列是典型晶体的结构示意图,从①到④对应正确的是:( ) A、金刚石 Cu B、 金刚石 Cu C、NaCl 金刚石 D、Cu 金刚石10. 下列有关图示,能直观形象地展示化学知识。以下图示正确的是( )
A、金刚石 Cu B、 金刚石 Cu C、NaCl 金刚石 D、Cu 金刚石10. 下列有关图示,能直观形象地展示化学知识。以下图示正确的是( ) A、①表示石墨的空间结构 B、②表示2s电子云轮廓图 C、③表示非晶态SiO2、晶态SiO2X-衍射粉末图谱 D、④表示NaCl晶体的晶胞结构图11. 是常用的还原剂,下列有关说法正确的是( )A、中心原子的杂化方式是杂化,其阴离子的空间构型是正四面体形 B、中存在离子键、键、氢键 C、该化合物中,H元素呈-1价,易被还原 D、Li原子电子排布图(
A、①表示石墨的空间结构 B、②表示2s电子云轮廓图 C、③表示非晶态SiO2、晶态SiO2X-衍射粉末图谱 D、④表示NaCl晶体的晶胞结构图11. 是常用的还原剂,下列有关说法正确的是( )A、中心原子的杂化方式是杂化,其阴离子的空间构型是正四面体形 B、中存在离子键、键、氢键 C、该化合物中,H元素呈-1价,易被还原 D、Li原子电子排布图( )表示的状态中,能量高的是①
12. 科学家研究利用CaF2晶体释放出的Ca2+和脱除硅烷,拓展了金属氟化物材料的生物医学功能。已知:晶胞中Ca2+的位置如图1所示,位于Ca2+所构成的四面体中如图2所示。下列说法错误的是( )
)表示的状态中,能量高的是①
12. 科学家研究利用CaF2晶体释放出的Ca2+和脱除硅烷,拓展了金属氟化物材料的生物医学功能。已知:晶胞中Ca2+的位置如图1所示,位于Ca2+所构成的四面体中如图2所示。下列说法错误的是( ) A、CaF2晶体中,每个周围距离相等且最近的有6个 B、OF2与SiO2中氧原子杂化方式相同 C、若图中A处原子分数坐标为(0,0,0),一个的坐标为( , , ),则在( , , )处也存在 D、若脱除硅烷反应速率依赖于晶体提供自由氟离子的能力,则脱硅能力BaF2<CaF2<MgF213. 仔细观察下图,这种堆积方式是:( )
A、CaF2晶体中,每个周围距离相等且最近的有6个 B、OF2与SiO2中氧原子杂化方式相同 C、若图中A处原子分数坐标为(0,0,0),一个的坐标为( , , ),则在( , , )处也存在 D、若脱除硅烷反应速率依赖于晶体提供自由氟离子的能力,则脱硅能力BaF2<CaF2<MgF213. 仔细观察下图,这种堆积方式是:( ) A、简单立方堆积 B、体心立方堆积 C、六方最密堆积 D、面心立方最密堆积14. 下列关于晶体的说法正确的是( )A、共价晶体中,共价键键能越大,熔点越高 B、晶体中有阳离子时,必有阴离子 C、晶胞是晶体中最小的平行六面体 D、玻璃吊坠具有规则的几何外形,所以玻璃是晶体15. 利用反应 可合成金刚石。下列说法错误的是( )A、CCl4晶体、Na晶体、NaCl晶体均以密堆积的方式降低体系能量 B、金属Na的晶胞为体心立方晶胞,Na原子的配位数为12 C、金刚石属于原子晶体,晶体中C原子数目与C-C键数目之比为1:2 D、NaCl晶体中每个Na+周围距离最近的Cl-有6个16. 金属晶体的中金属原子的堆积基本模式有( )A、1 B、2 C、3 D、4
A、简单立方堆积 B、体心立方堆积 C、六方最密堆积 D、面心立方最密堆积14. 下列关于晶体的说法正确的是( )A、共价晶体中,共价键键能越大,熔点越高 B、晶体中有阳离子时,必有阴离子 C、晶胞是晶体中最小的平行六面体 D、玻璃吊坠具有规则的几何外形,所以玻璃是晶体15. 利用反应 可合成金刚石。下列说法错误的是( )A、CCl4晶体、Na晶体、NaCl晶体均以密堆积的方式降低体系能量 B、金属Na的晶胞为体心立方晶胞,Na原子的配位数为12 C、金刚石属于原子晶体,晶体中C原子数目与C-C键数目之比为1:2 D、NaCl晶体中每个Na+周围距离最近的Cl-有6个16. 金属晶体的中金属原子的堆积基本模式有( )A、1 B、2 C、3 D、4二、非选择题
-
17. 电池在人类生产生活中具有十分重要的作用,工业上采用FeCl3、NH4H2PO4、LiCl和苯胺(
 )等作为原料制备锂离子电池正极材料磷酸亚铁锂(LiFePO4),采用单晶硅和铜、锗、镓、硒等的化合物作为太阳能电池的制备原料。 (1)、基态硒原子的价电子排布式是。(2)、下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示碳元素的曲线是 (填标号)。
)等作为原料制备锂离子电池正极材料磷酸亚铁锂(LiFePO4),采用单晶硅和铜、锗、镓、硒等的化合物作为太阳能电池的制备原料。 (1)、基态硒原子的价电子排布式是。(2)、下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示碳元素的曲线是 (填标号)。 (3)、苯胺中N原子的杂化方式为 , 分子中σ键与π键的数目比为。(4)、自然界中含硼元素的钠盐存在于天然矿藏中,其化学式为Na2B4O7·10H2O,它的结构单元是由两个H3BO3和两个[B(OH4)]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]·8H2O,其结构如下图所示,则该晶体中不存在的作用力是___________。(填选项字母)。
(3)、苯胺中N原子的杂化方式为 , 分子中σ键与π键的数目比为。(4)、自然界中含硼元素的钠盐存在于天然矿藏中,其化学式为Na2B4O7·10H2O,它的结构单元是由两个H3BO3和两个[B(OH4)]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]·8H2O,其结构如下图所示,则该晶体中不存在的作用力是___________。(填选项字母)。 A、离子键 B、共价键 C、金属键 D、范德华力 E、氢键(5)、①图1为某金属单质的晶胞示意图,其堆积方式的名称为。
A、离子键 B、共价键 C、金属键 D、范德华力 E、氢键(5)、①图1为某金属单质的晶胞示意图,其堆积方式的名称为。
②图2为铜的某种氯化物晶胞示意图,该物质的化学式是。原子坐标参数可表示晶胞内部各原子的相对位置,上图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为。
③图示晶胞中C、D两原子核间距为298 pm,阿伏加德罗常数的值为NA , 则该晶体密度为 g▪cm-3(列出计算式即可)。
18. Cr、Co、Al的合金及其相关化合物用途非常广泛。(1)、Cr3+基态核外电子排布式为。(2)、1951年Tsao最早报道用LiAlH4还原腈,如反应: 。
。 ①LiAlH4中三种元素的电负性从大到小的顺序为。
②
 分子中碳原子的轨道杂化类型为 , 1mol该分子中含σ键的物质的量为。(3)、[Co(15-冠-5)(H2O)2]2+是一种配位离子(“15-冠-5”是指冠醚的环上原子总数为15,其中O原子数为5),请在该配位离子结构示意图(图-1)中的相应位置补画出配位键。
分子中碳原子的轨道杂化类型为 , 1mol该分子中含σ键的物质的量为。(3)、[Co(15-冠-5)(H2O)2]2+是一种配位离子(“15-冠-5”是指冠醚的环上原子总数为15,其中O原子数为5),请在该配位离子结构示意图(图-1)中的相应位置补画出配位键。 图1
图1 图2(4)、全惠斯勒合金CrxCoyAlz的晶胞结构如题图-2所示,则其化学式为19. 铜是人类最早使用的金属之一。也是中学中常见的过镀金属元素。铜是与人类关系非常密切的有色金属。被广泛地作力导线应用于电气、轻工、机械制造、建筑工业、国防工业等领域在中国有色金属材料的消费中仅次于铝。回答下列问题:(1)、基态Cu+原子核外电子排式为。(2)、CuCl晶体的晶格能可通过如图的Born-Haber循环计算得到:
图2(4)、全惠斯勒合金CrxCoyAlz的晶胞结构如题图-2所示,则其化学式为19. 铜是人类最早使用的金属之一。也是中学中常见的过镀金属元素。铜是与人类关系非常密切的有色金属。被广泛地作力导线应用于电气、轻工、机械制造、建筑工业、国防工业等领域在中国有色金属材料的消费中仅次于铝。回答下列问题:(1)、基态Cu+原子核外电子排式为。(2)、CuCl晶体的晶格能可通过如图的Born-Haber循环计算得到:
铜原子的第一电离能为kJ•mol-1;Cl-Cl键键能为kJ•mol-1;CuCl的晶格能为kJ•mol-1。
(3)、铜盐属于重金属盐,铜盐中毒可用青霉胺解毒,解毒原理如下:Cu2+能与青霉胺成环状络合物,该环状络合物无毒、易溶于水,可经尿液排出。
①青霉胺分子中S原子的轨道杂化类型为;
②硫化氢与氨气键角的大小:H2SNH3(填“>”或“<”)。
③第二周期元素中,第一电离能大于N的元素有(用元素符号表示)。
④该环状络合物无毒、易溶于水,可经尿液排出,请解释该化合物易溶于水的主要原因:。
(4)、某含铜的离子化合物M由Cs、Cu、Cl三种元素构成,M属于立方体晶系的离子晶体,其结构如图所示。试回答下列问题:①离子化合物M的化学式为;
②已知Cs和Cl两元素离子的半径大小相近,该晶体中两种离子联合组成何种形式的密堆积;
③若晶胞参数为anm,则这种晶体密度为g•cm-3(用含a、和NA的式子表示)。
 20. 有A,B,C,D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。
20. 有A,B,C,D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2∶1。回答下列问题:
 (1)、A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于(填写“六方”、“面心立方”或“体心立方”)。(2)、B-的电子排布式为 , 在CB3分子中C元素原子的原子轨道发生的是杂化。(3)、C的氢化物的空间构型为 , 其氢化物在同族元素所形成的氢化物中沸点最高的原因是。(4)、B元素的电负性D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明。(5)、如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为。(阿伏加德罗常数用NA表示)21. 电池在人类生产生活中具有十分重要的作用,其中锂离子电池与太阳能电池占有很大比重。太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。
(1)、A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于(填写“六方”、“面心立方”或“体心立方”)。(2)、B-的电子排布式为 , 在CB3分子中C元素原子的原子轨道发生的是杂化。(3)、C的氢化物的空间构型为 , 其氢化物在同族元素所形成的氢化物中沸点最高的原因是。(4)、B元素的电负性D元素的电负性(填“>”、“<”或“=”);用一个化学方程式说明。(5)、如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。试计算R晶体的密度为。(阿伏加德罗常数用NA表示)21. 电池在人类生产生活中具有十分重要的作用,其中锂离子电池与太阳能电池占有很大比重。太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。 (1)、基态亚铜离子中电子占据的原子轨道数目为。(2)、若基态硒原子价层电子排布式写成4s24p4p,则其违背了。(3)、上图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是(填标号)。(4)、元素X与硅同主族且原子半径最小,X形成的最简单氢化物Q的电子式为 , 该分子其中心原子的杂化类型为。
(1)、基态亚铜离子中电子占据的原子轨道数目为。(2)、若基态硒原子价层电子排布式写成4s24p4p,则其违背了。(3)、上图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是(填标号)。(4)、元素X与硅同主族且原子半径最小,X形成的最简单氢化物Q的电子式为 , 该分子其中心原子的杂化类型为。写出一种与Q互为等电子体的离子。
(5)、与镓元素处于同一主族的硼元素具有缺电子性。自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4]·8H2O。其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是________________(填字母)。
 A、离子键 B、共价键 C、金属键 D、范德华力 E、氢键(6)、GaAs的熔点为1 238 ℃,密度为ρ g·cm-3 , 其晶胞结构如图所示。
A、离子键 B、共价键 C、金属键 D、范德华力 E、氢键(6)、GaAs的熔点为1 238 ℃,密度为ρ g·cm-3 , 其晶胞结构如图所示。
已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为 , GaAs的熔点(填“高于”或“低于”)GaN。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1 , 原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA , 则GaAs晶胞中原子的体积占晶胞体积的百分率为。
22. [化学—选修3:物质结构与性质]含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)、基态B原子电子占据最高能级的电子云轮廓图为;基态Cu+的核外电子排布式为 。(2)、化合物(CH3)3N分子中N原子杂化方式为 , 该物质能溶于水的原因是 。(3)、PH3分子的键角小于NH3分子的原因是 ;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式 为。(4)、磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示: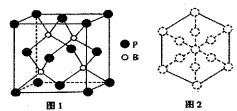
①在一个晶胞中磷原子的配位数为。
②已知磷化硼晶体的密度为ρg/cm3 , 阿伏加德罗常数为NA , 则B-P键长为pm。
③磷化硼晶胞沿着体对角线方向的投影如图2,请在答题卡上将表示B原子的圆圈涂黑。
23. [化学-选修3:物质结构与性质]铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)、基态K原子核外电子排布简写式为。 K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是 , 各元素的第一电离能由大到小的顺序为。(2)、(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为。KCN与盐酸作用可生成HCN,HCN的中心原子的杂化轨道类型为。(3)、CO能与金属Fe形成Fe(CO)5 , 该化合物熔点为253 K,沸点为为376 K,其固体属于晶体。(4)、下图是金属单质常见的两种堆积方式的晶胞模型。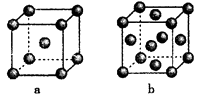
①铁采纳的是a堆积方式.铁原子的配位数为 , 该晶体中原子总体积占晶体体积的比值为(用含π的最简代数式表示)。
②常见的金属铝采纳的是b堆积方式,铝原子的半径为r pm,则其晶体密度为g·cm-3(用含有r、NA的最简代数式表示)。
24. CO 易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5; [Cu(NH3)2]Ac 溶液用于除去CO的化学反应方程式:[Cu(NH3)2]Ac+CO+NH3=[Cu(NH3)3] Ac·CO (式中Ac-代表醋酸根)。请回答下列问题:(1)、C、N、O的第一电离能最大的是 , 原因是。基态Fe 原子的价电子排布图为。(2)、Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是 , 羰基铁的结构如图,根据该图可知CO作为配位体是以原子为配位原子与Fe原子结合。 (3)、离子水化能是气态离子溶于大量水中成为无限稀释溶液时释放的能量。离子在溶液中的稳定性可以从离子的大小、电荷、水化能等因素来解释。Cu2+和Cu+的水化能分别是-2121kJ·mol-1和-582 kJ·mol-1 , 在水溶液里Cu2+比Cu+稳定的原因是。[Cu(NH3)2]+在水溶液中相对稳定,在配合物[Cu(NH3)2]Ac中碳原子的杂化类型是。(4)、用[Cu(NH3)2]Ac除去CO的反应中,肯定有形成。
(3)、离子水化能是气态离子溶于大量水中成为无限稀释溶液时释放的能量。离子在溶液中的稳定性可以从离子的大小、电荷、水化能等因素来解释。Cu2+和Cu+的水化能分别是-2121kJ·mol-1和-582 kJ·mol-1 , 在水溶液里Cu2+比Cu+稳定的原因是。[Cu(NH3)2]+在水溶液中相对稳定,在配合物[Cu(NH3)2]Ac中碳原子的杂化类型是。(4)、用[Cu(NH3)2]Ac除去CO的反应中,肯定有形成。a.离子键
b.配位键
c.非极性键
d. σ键
(5)、钙铜合金的晶体结构可看成(a) (b) 两种原子层交替堆积排列而成图(c),则该合金六方晶胞(即平行六面体晶胞)中含为Cu个。已知同层的Ca-Cu的距离为294pm,根据图示求同层相邻Ca-Ca的距离pm (已知 =1.73 计算结果保留整数)。 25. 某药物中含有As、Cu、H、O、Cl、Fe等元素。(1)、Cu单质在不同条件下可形成晶体和非晶体,可通过区分晶体和非晶体;基态Cu原子的价电子排布式为 , 基态Cu原子的核外电子排布中有对自旋状态相反的电子。(2)、CH4分子中C原子的杂化方式为 , NH3沸点比CH4高的原因是。(3)、酸性:H3AsO4H3AsO3 , 原因。(4)、H3O+、H2O相比较,键角较大的是 , 其原因是。(5)、一种Fe晶体晶胞如图所示,晶胞边长为a cm,已知该晶体的密度为ρ g·cm-3 , Fe的相对原子质量为M,NA为阿伏加德罗常数的值,NA=(列式表示即可)。
25. 某药物中含有As、Cu、H、O、Cl、Fe等元素。(1)、Cu单质在不同条件下可形成晶体和非晶体,可通过区分晶体和非晶体;基态Cu原子的价电子排布式为 , 基态Cu原子的核外电子排布中有对自旋状态相反的电子。(2)、CH4分子中C原子的杂化方式为 , NH3沸点比CH4高的原因是。(3)、酸性:H3AsO4H3AsO3 , 原因。(4)、H3O+、H2O相比较,键角较大的是 , 其原因是。(5)、一种Fe晶体晶胞如图所示,晶胞边长为a cm,已知该晶体的密度为ρ g·cm-3 , Fe的相对原子质量为M,NA为阿伏加德罗常数的值,NA=(列式表示即可)。 26. 钾和碘的相关化合物在化工医药材料等领域有着广泛的应用。回答下列问题:(1)、基态K原子中,核外电子的空间运动状态共种,占据最高能级的电子的电子云轮廓图形状为。(2)、K和Cr属于同一周期,且核外最外层电子构型相同。第一电离能比较:K(填“>”或“<”)Cr,金属键强度比较:K(填“>”或“<")Cr.(3)、IO3-离子的立体构型的名称为 , 中心原子的杂化方式为.(4)、HIO4的酸性强于HIO3 , 其原因为(5)、KIO3晶体是一种性能良好的非线性光学材料,晶胞如图所示。
26. 钾和碘的相关化合物在化工医药材料等领域有着广泛的应用。回答下列问题:(1)、基态K原子中,核外电子的空间运动状态共种,占据最高能级的电子的电子云轮廓图形状为。(2)、K和Cr属于同一周期,且核外最外层电子构型相同。第一电离能比较:K(填“>”或“<”)Cr,金属键强度比较:K(填“>”或“<")Cr.(3)、IO3-离子的立体构型的名称为 , 中心原子的杂化方式为.(4)、HIO4的酸性强于HIO3 , 其原因为(5)、KIO3晶体是一种性能良好的非线性光学材料,晶胞如图所示。
晶胞的棱长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与I间的最短距离为nm,与K紧邻的O的个数为。阿伏加德罗常数的值为6.02×1023 , 列式计算晶体的密度为g/cm3. (不必计算结果)
27. 钛及其化合物的应用正越来越受到人们的关注。(1)、基态下原子核外电子排布的最高能级的符号是。与钛同周期的元素中,基态原子的未成对电子数与钛相同的有种。(2)、钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是。(3)、TiCl4是氯化法制取钛的中间产物。TiCl4和SiCl4在常温下都是液体,分子结构相同。采用蒸馏的方法分离SiCl4和TiCl4的混合物,先获得的馏分是(填化学式)。(4)、半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯等的聚合,其结构如右图所示。
①组成该物质的元素中,电负性最大的是 (填元素名称)。
②M中,碳原子的杂化形式有种。
③M中,不含(填标号)。
a. π键 b. σ键 c.配位键 d.氢键 e.离子键
(5)、金红石(TiO2)是含钛的主要矿物之一,具有四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如下图所示。
①4个微粒A、B、C、D中,属于氧原子的是。
②若A、B、C的原子坐标分别为A (0,0,0)、B (0.69a,0.69a,c)、c (a, a,c),则D的原子坐标为D (0.19a, , );钛氧键的键长d=(用代数式表示)。
28.(1)、写出基态镍原子的电子排布式.与其同周期的基态原子的M 层电子全充满的元素位于周期表的区; 基态原子变成激发态原子产生的光谱叫光谱。(2)、丙酮( )分子中2号碳原子的杂化方式为;与CS2互为等电子体的阴离子是(写一种);CO32-的立体构型是。 (3)、含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成mol AgCl沉淀。H2O分子的键角比H2S分子的键角大,原因是。(4)、如图所示为GaAs的晶胞结构。
)分子中2号碳原子的杂化方式为;与CS2互为等电子体的阴离子是(写一种);CO32-的立体构型是。 (3)、含0.1mol[Cr(H2O)Cl]Cl2·H2O的水溶液与足量硝酸银溶液反应生成mol AgCl沉淀。H2O分子的键角比H2S分子的键角大,原因是。(4)、如图所示为GaAs的晶胞结构。
①一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是
②已知晶胞棱长a=5.64×10-10m.则该晶胞密度为ρ=。
29. 铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:(1)、画出基态Cu原子的价电子排布图;(2)、已知高温下Cu2O比CuO稳定,从核外电子排布角度解释高温下Cu2O更稳定的原因;(3)、配合物 [Cu(NH3)2]OOCCH3中碳原子的杂化类型是 , 配体中提供孤对电子的原子是。C、N、O三元素的第一电离能由大到小的顺序是(用元素符号表示)。(4)、铜晶体中铜原子的堆积方式如图1所示,则晶体铜原子的堆积方式为。 (5)、M原子的价电子排布式为3s23p5 , 铜与M形成化合物的晶胞如图2所示(黑点代表铜原子)。
(5)、M原子的价电子排布式为3s23p5 , 铜与M形成化合物的晶胞如图2所示(黑点代表铜原子)。①该晶体的化学式为。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于化合物(填“离子”、“共价”)。
③已知该晶体的密度为ρg·cm-3 , 阿伏加德罗常数为NA , 已知该晶体中Cu原子和M原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和M原子之间的最短距离为pm(写出计算列式)。
30. 锰是钢的一种重要添加剂,支撑“中国天眼”FAST的角钢塔架中就含有锰。回答下列问题:(1)、Mn元素位于元素周期表的区,价层电子排布式为。(2)、金属锰有多种晶型,其中锰(面心立方)晶胞俯视图为____(选填编号)。A、 B、
B、 C、
C、 D、
D、 (3)、第三电离能(选填“>”或“<”),原因是。(4)、能形成配离子为八面体的配合物。已知含1mol该配合物与足量溶液反应可生成 , 则配合物中 , 。(5)、硫化锰是一种重要的半导体材料,其中具有稳定的岩盐矿结构,晶胞结构如图所示。若晶胞参数为 , 为阿伏加德罗常数的值,晶胞的密度是。(列出计算式)
(3)、第三电离能(选填“>”或“<”),原因是。(4)、能形成配离子为八面体的配合物。已知含1mol该配合物与足量溶液反应可生成 , 则配合物中 , 。(5)、硫化锰是一种重要的半导体材料,其中具有稳定的岩盐矿结构,晶胞结构如图所示。若晶胞参数为 , 为阿伏加德罗常数的值,晶胞的密度是。(列出计算式) 31. 铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。(1)、按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于区。(2)、Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ , 请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别 , Mn2+的半径Fe3+的半径(选填”>”、”<”或“=”)。(3)、金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为(用含π的式子表示)。(4)、向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的【Fe(SCN)(H2O)5】2+。N、H、O三种元素的电负性由大到小的顺序为。【Fe(SCN)(H2O)5】2+中Fe3+的配位数为。H2O中氧原子的杂化方式为。(5)、二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2 , 可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π),则C5H的大π键表示为 , 二茂铁为黄色针状晶体,熔点173℃(在100℃时开始升华),沸点249℃,水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是(填标号)。
31. 铁元素是最重要的金属元素之一,其不仅是各种钢材的主要成分,很多含铁化合物也具有重要意义。(1)、按照电子排布,可把元素周期表中的元素划分成五个区,铁元素属于区。(2)、Mn2+在水溶液中难被氧化,而Fe2+则易被氧化为Fe3+ , 请从离子的价电子式角度解释Mn2+与Fe2+还原能力的差别 , Mn2+的半径Fe3+的半径(选填”>”、”<”或“=”)。(3)、金属铁晶体中铁原子采用体心立方堆积,该铁晶体的空间利用率为(用含π的式子表示)。(4)、向含Fe3+的溶液中滴加少量的KSCN溶液,溶液中生成红色的【Fe(SCN)(H2O)5】2+。N、H、O三种元素的电负性由大到小的顺序为。【Fe(SCN)(H2O)5】2+中Fe3+的配位数为。H2O中氧原子的杂化方式为。(5)、二茂铁是一种含铁的有机化合物,其化学式为Fe(C5H5)2 , 可看作是Fe2+离子与两个正五边形的环戊二烯负离子(C5H)配体形成的夹心型分子(如下图a所示)。已知大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π),则C5H的大π键表示为 , 二茂铁为黄色针状晶体,熔点173℃(在100℃时开始升华),沸点249℃,水中难溶,但可溶于很多有机溶剂。下列相互作用中,二茂铁晶体中不存在的是(填标号)。
A.离子键B.配位键C.δ键D.范德华力
32. 日常生活中常用A的单质通入自来水中杀菌消毒,B的单质或合金做电线的导体部分。A的负一价离子的最外层电子数和次外层电子数相同。B为第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。(1)、A单质通入水中发生反应的离子方程式:;写出起到杀菌作用的产物的电子式:。(2)、B元素在周期表中的位置是;B金属晶体的空间堆积方式为;B原子的配位数为。(3)、A与B形成的一种化合物的立方晶胞如图所示:
①该化合物的化学式为。
②该晶胞棱长为0.542 nm,则晶体的密度为(写出计算式即可,不计算结果)。
③该化合物难溶于水易溶于氨水,是因为可与氨形成易溶于水的配位化合物,若配位数是4,则络离子的化学式为。
该络离子在空气中易被氧化而导致溶液呈现色。
(4)、如图A、B形成离子晶体的晶格能为kJ/mol。 33. 太阳能电池板材料除单晶硅外,还有氮、硼、硒、钛、钴、钙等化学物质。(1)、基态钙原子的电子排布式为 , 金属钴的堆积方式与镁相似,都属于六方最密堆积,其配位数是 。(2)、氮元素的第一电离能在同周期中从大到小排第位;写出与NO-互为等电子体的一种非极性分子的化学式。(3)、晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),其中有两个原子为10B,其余为11B,则该结构单元有种不同的结构类型。
33. 太阳能电池板材料除单晶硅外,还有氮、硼、硒、钛、钴、钙等化学物质。(1)、基态钙原子的电子排布式为 , 金属钴的堆积方式与镁相似,都属于六方最密堆积,其配位数是 。(2)、氮元素的第一电离能在同周期中从大到小排第位;写出与NO-互为等电子体的一种非极性分子的化学式。(3)、晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),其中有两个原子为10B,其余为11B,则该结构单元有种不同的结构类型。 (4)、六方相氮化硼的结构与石墨相似,B的杂化方式是 , 其不导电的原因是。(5)、在浓的TiCl3盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为TiCl3·6H2O的晶体,该晶体中两种配体的物质的量之比为1∶5,则该配离子的化学式为。(6)、钴晶体的一种晶胞是体心立方堆积(如图所示),若该晶胞的边长为a nm,密度为ρ g·cm-3 , NA表示阿伏加德罗常数的值,则钴的相对原子质量可表示为。
(4)、六方相氮化硼的结构与石墨相似,B的杂化方式是 , 其不导电的原因是。(5)、在浓的TiCl3盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6,组成为TiCl3·6H2O的晶体,该晶体中两种配体的物质的量之比为1∶5,则该配离子的化学式为。(6)、钴晶体的一种晶胞是体心立方堆积(如图所示),若该晶胞的边长为a nm,密度为ρ g·cm-3 , NA表示阿伏加德罗常数的值,则钴的相对原子质量可表示为。