高考二轮复习知识点:金属键
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列说法不正确的是( )A、金属键的本质是金属阳离子与自由电子间的相互作用 B、H2O的热稳定性大于H2S,这与H2O分子间易形成氢键无关 C、
 的沸点高于
的沸点高于 是因为其范德华力更大
D、离子键无方向性和饱和性,而共价键有方向性和饱和性
2. 下列叙述错误的是( )
是因为其范德华力更大
D、离子键无方向性和饱和性,而共价键有方向性和饱和性
2. 下列叙述错误的是( )①离子键没有方向性和饱和性,而共价键有方向性和饱和性
②配位键在形成时,是由成键双方各提供一个电子形成共用电子对
③金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
④在冰晶体中,既有极性键、非极性键,又有氢键
⑤化合物NH4Cl和CuSO4·5H2O都存在配位键
⑥NaCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同
A、①③ B、②④ C、②⑤ D、④⑥3. 下列推测正确的是( )A、Mg2+半径比Ca2+半径小,可推测金属镁的熔点比钙的低 B、Si原子半径比Ge原子半径小,可推测晶体硅的硬度大于晶体锗 C、某物质在熔融状态下能导电,可推测该物质在固态时为离子晶体 D、N-H键比P-H键牢固,可推测NH3的沸点高于PH34. 金属键的形成是通过( )A、金属原子与自由电子之间的相互作用 B、金属离子与自由电子之间强烈的相互作用 C、自由电子之间的相互作用 D、金属离子之间的相互作用5. 下列关于金属及金属键的说法正确的是( )A、金属键具有方向性与饱和性 B、金属键是金属阳离子与自由电子间的相互作用 C、金属导电是因为在外加电场作用下产生自由电子 D、金属具有光泽是因为金属阳离子吸收并放出可见光6. 金属能导电的原因是( )A、金属晶体中金属阳离子与自由电子间的相互作用较弱 B、金属晶体中的自由电子在外加电场作用可发生定向移动 C、金属晶体中的金属阳离子在外加电场作用下可发生定向移动 D、金属晶体在外加电场作用可失去电子7. 某新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线.当玻璃被击碎时,与金属线相连的警报系统就会立即报警.“防盗玻璃”能报警是利用了金属的( )A、延展性 B、导电性 C、弹性 D、导热性8. 要使金属晶体熔化必须破坏其中的金属键.金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱.由此判断下列说法正确的是( )A、金属镁的熔点高于金属铝 B、碱金属单质的熔、沸点从Li到Cs是逐渐升高的 C、金属镁的硬度小于金属钙 D、金属铝的硬度大于金属钠9. 下列说法中错误的是 A、从CH4、、为正四面体结构,可推测、也为正四面体结构 B、1mol金刚石晶体中,平均含有2molC-C键 C、金属能导电是因为内部的自由电子在外加电场作用下可发生定向移动 D、某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE10. 化学中很多“规律”都可以类推,下列有关“规律”推理正确的( )A、铁与氯气反应生成FeCl3 , 则铁与碘蒸气反应生成FeI3 B、CO2通入Ba(NO3)2溶液中不产生沉淀,则SO2通入Ba(NO3)2溶液中也不产生沉淀 C、CH4为正四面体分子,则CCl4也为正四面体分子 D、卤族元素单质随核电荷数增加熔点升高,则碱金属单质熔点也随核电荷数增加而升高11. 下列有关化学键、氢键和范德华力的叙述中,错误的是( )A、金属键是金属离子与“电子气”之间的强烈作用,金属键无方向性和饱和性 B、共价键是原子之间通过共用电子对形成的化学键,共价键有方向性和饱和性 C、范德华力是分子间存在的一种作用力,分子的极性越大,范德华力越大 D、氢键不是化学键而是一种较弱的作用力,所以氢键只存在于分子与分子之间12. 下列有关金属键的叙述中,错误的是( )A、金属键没有饱和性和方向性 B、金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用 C、金属键中的电子属于整块金属 D、金属的性质和金属固体的形成都与金属键有关13. 金属键的强弱与金属价电子数多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,半径越大,金属键越弱。据此判断下列金属熔点逐渐升高的是( )A、Li Na K B、Na Mg Al C、Li Be Mg D、Li Na Mg14. 下列关于金属晶体的叙述正确的是( )A、用铂金做首饰不能用金属键理论解释 B、固态和熔融时易导电,熔点在1000℃左右的晶体可能是金属晶体 C、金属晶体最密堆积方式只有面心立方堆积方式 D、金属导电和熔融电解质(或电解质溶液)导电的原理一样。15. 下列说法中正确的是( )A、SO2、CO2、SiO2中的S、C、Si均为sp3杂化 B、H3O+、NH4+、[Cu(NH3)4]2+均含有配位键 C、SO32﹣、CO32﹣、SiO32﹣均为平面三角形 D、石墨、新型高分子导电材料聚乙炔、金属晶体均含有金属键
A、从CH4、、为正四面体结构,可推测、也为正四面体结构 B、1mol金刚石晶体中,平均含有2molC-C键 C、金属能导电是因为内部的自由电子在外加电场作用下可发生定向移动 D、某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE10. 化学中很多“规律”都可以类推,下列有关“规律”推理正确的( )A、铁与氯气反应生成FeCl3 , 则铁与碘蒸气反应生成FeI3 B、CO2通入Ba(NO3)2溶液中不产生沉淀,则SO2通入Ba(NO3)2溶液中也不产生沉淀 C、CH4为正四面体分子,则CCl4也为正四面体分子 D、卤族元素单质随核电荷数增加熔点升高,则碱金属单质熔点也随核电荷数增加而升高11. 下列有关化学键、氢键和范德华力的叙述中,错误的是( )A、金属键是金属离子与“电子气”之间的强烈作用,金属键无方向性和饱和性 B、共价键是原子之间通过共用电子对形成的化学键,共价键有方向性和饱和性 C、范德华力是分子间存在的一种作用力,分子的极性越大,范德华力越大 D、氢键不是化学键而是一种较弱的作用力,所以氢键只存在于分子与分子之间12. 下列有关金属键的叙述中,错误的是( )A、金属键没有饱和性和方向性 B、金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用 C、金属键中的电子属于整块金属 D、金属的性质和金属固体的形成都与金属键有关13. 金属键的强弱与金属价电子数多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,半径越大,金属键越弱。据此判断下列金属熔点逐渐升高的是( )A、Li Na K B、Na Mg Al C、Li Be Mg D、Li Na Mg14. 下列关于金属晶体的叙述正确的是( )A、用铂金做首饰不能用金属键理论解释 B、固态和熔融时易导电,熔点在1000℃左右的晶体可能是金属晶体 C、金属晶体最密堆积方式只有面心立方堆积方式 D、金属导电和熔融电解质(或电解质溶液)导电的原理一样。15. 下列说法中正确的是( )A、SO2、CO2、SiO2中的S、C、Si均为sp3杂化 B、H3O+、NH4+、[Cu(NH3)4]2+均含有配位键 C、SO32﹣、CO32﹣、SiO32﹣均为平面三角形 D、石墨、新型高分子导电材料聚乙炔、金属晶体均含有金属键二、非选择题
-
16. 以、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)、基态O原子的电子排布式 , 其中未成对电子有个。(2)、Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是。(3)、酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取杂化。邻苯二甲酸酐(
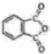 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(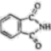 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。 (4)、金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。(5)、ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是。(6)、下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。
(4)、金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。(5)、ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是。(6)、下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。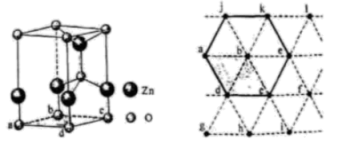 17. 均为元素周期表第II A族元素。回答下列问题:(1)、基态 原子L能层有个运动状态不同的电子, 的第一电离能(填“大于”或“小于”) 的第一电离能。(2)、 和 位于同一周期,且核外最外层电子排布相同,但金属 的熔、沸点等都比金属 的高,原因是。(3)、氯气与熟石灰反应制漂白粉时会生成副产物 , 中电负性最小的元素是(填元素符号); 的空间构型是; 原子的杂化方式为。(4)、离子化合物 的晶体结构如图所示。 中的作用力为 , 从钙离子看该晶体属于堆积,一个晶胞中含有的π键有个。
17. 均为元素周期表第II A族元素。回答下列问题:(1)、基态 原子L能层有个运动状态不同的电子, 的第一电离能(填“大于”或“小于”) 的第一电离能。(2)、 和 位于同一周期,且核外最外层电子排布相同,但金属 的熔、沸点等都比金属 的高,原因是。(3)、氯气与熟石灰反应制漂白粉时会生成副产物 , 中电负性最小的元素是(填元素符号); 的空间构型是; 原子的杂化方式为。(4)、离子化合物 的晶体结构如图所示。 中的作用力为 , 从钙离子看该晶体属于堆积,一个晶胞中含有的π键有个。 (5)、镁单质晶体中原子的堆积模型如图,已知图中底边长为 ,高为 ,阿伏加德罗常数的值为 ,则镁的密度为(用含 、a、b的计算式表示)。
(5)、镁单质晶体中原子的堆积模型如图,已知图中底边长为 ,高为 ,阿伏加德罗常数的值为 ,则镁的密度为(用含 、a、b的计算式表示)。 18. 元素周期表中第四周期某些过渡元素(如Ti、Mn、Zn等)在生产生活中有着广泛的应用。回答下列问题:(1)、钛的应用越来越受到人们的关注。
18. 元素周期表中第四周期某些过渡元素(如Ti、Mn、Zn等)在生产生活中有着广泛的应用。回答下列问题:(1)、钛的应用越来越受到人们的关注。①第四周期元素中,基态原子的未成对电子数与钛相同的有(填元素符号)。
②钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是。
(2)、锰及其化合物的应用研究是前沿科学之一①已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列(选填字母编号)。

②三醋酸锰[(CH3COO)3Mn]是一种很好的有机反应氧化剂。三醋酸锰[(CH3COO)3Mn]中阳离子的价层电子排布式中电子的自旋状态(填“相同”或“相反”)。
③Mn2+能形成配离子为八面体的配合物MnClm·nNH3 , 在该配合物的配离子中,Mn2+位于八面体的中心。若含1 mol该配合物的溶液与足量AgNO3溶液作用可生成1mol AgCl沉淀,则该配离子化学式为。
(3)、比较Fe和Mn的第三电离能,I3(Fe)I3(Mn)(填“大于”或“小于”),原因是。(4)、某钙钛型复合氧化物如图,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有巨磁电阻效应。
已知La为+3价,当被钙等+2价元素A替代时,可形成复合钙钛矿化合物LaxA1-xMnO3 , (x>0.9),此时一部分+3价锰转变为+4价,导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则复合钙钛矿化合物中+3价锰与+4价锰的物质的量之比为(用含x的代数式表示)。
(5)、具有较高催化活性的材料金红石的晶胞结构如图所示。已知该晶体的密度为d g·cm-3 , Ti、O原子半径分别为a pm和b pm,阿伏加德罗常数的值为NA , 则金红石晶体的空间利用率为(列出计算式)。 19. 钛及其化合物的应用越来越受到人们的关注。(1)、基态Ti原子核外电子排布的最高能级符号是。与钛同周期元素中,基态原子的未成对电子数与钛相同的有种。(2)、钛比钢轻,比铝硬,是种新兴的结构材料。钛硬度比铝大的原因是(3)、催化剂M能催化乙烯、丙烯、米乙烯等的聚合,其结构如图所示。
19. 钛及其化合物的应用越来越受到人们的关注。(1)、基态Ti原子核外电子排布的最高能级符号是。与钛同周期元素中,基态原子的未成对电子数与钛相同的有种。(2)、钛比钢轻,比铝硬,是种新兴的结构材料。钛硬度比铝大的原因是(3)、催化剂M能催化乙烯、丙烯、米乙烯等的聚合,其结构如图所示。
①M中,碳原子的杂化形式有种。
②M中,不含(填标号)。
a.π键 b.σ键 c.配位键 d.氢键 e.离子健
(4)、金红石(TiO2)是含钛的主要矿物之一,具有典型的四方晶系结构。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
①4个微粒A,B,C,D中,属于氧原子的是
②若A、B、C的原子坐标分别为A(0,0,0)、(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a, , );钛氧键键长d=(用代数式表示)。
20. 有下列八种晶体:A 水晶(SiO2)、B 冰醋酸、C 氧化镁、D 白磷(P4)、E 干冰(CO2)、F氯化铵、G 铝、H 金刚石。回答下列问题:(1)、属于原子晶体的化合物是(填字母,下同),受热熔化后化学键不发生变化的是。(2)、1mol SiO2 含有mol Si—O 键,1mol 白磷(P4)含有mol P—P 键。(3)、从原子半径大小角度解释,同一主族的 C 与 Si,形成 CO2 和 SiO2 时,C、O 原子间 能形成π键,而 Si、O 之间不能的原因。(4)、升高温度,金属铝的电导率(填“升高”、“降低”或“不变”)。21. 碱金属元素形成的单质及其化合物有广泛的应用。回答下列问题:(1)、K与 反应可形成离子晶体 ,其离子键形成的 循环如图所示。可知,K原子的第一电离能为 , 键键能为 。 (2)、K与 属于同一周期,且核外最外层电子构型相同,但单质K的熔点较低,其原因为。(3)、 与 在高压下可以形成组成和结构均不相同的晶体。下图是其中一种晶体的晶胞。则该晶体的化学式为。
(2)、K与 属于同一周期,且核外最外层电子构型相同,但单质K的熔点较低,其原因为。(3)、 与 在高压下可以形成组成和结构均不相同的晶体。下图是其中一种晶体的晶胞。则该晶体的化学式为。 22. 磷酸盐几乎是所有食物的天然成分之一,作为重要的食品配料和功能添加剂被广泛用于食品加工中。在食品加工中使用的磷酸盐通常为钠盐、钙盐、钾盐以及作为营养强化剂的铁盐和锌盐。天然存在的磷酸盐是磷矿石[主要成分为Ca3(PO4)2 , 同时还有SiO2等],用硫酸跟磷矿石反应,能生成被植物吸收的Ca(H2PO4)2。
22. 磷酸盐几乎是所有食物的天然成分之一,作为重要的食品配料和功能添加剂被广泛用于食品加工中。在食品加工中使用的磷酸盐通常为钠盐、钙盐、钾盐以及作为营养强化剂的铁盐和锌盐。天然存在的磷酸盐是磷矿石[主要成分为Ca3(PO4)2 , 同时还有SiO2等],用硫酸跟磷矿石反应,能生成被植物吸收的Ca(H2PO4)2。回答下列问题:
(1)、金属铁可导电、导热,具有金属光泽,有延展性,这些性质都可以用“理论”解释。(2)、SiO2硬而脆,其原因是。(3)、Ca、Fe、K、Zn的第一电离能由大到小的顺序为。(4)、O、Si、P、S四种元素形成的最简单氢化物的稳定性最强的是 (填化学式);P4难溶于水却易溶于CS2 , 其原因为。(5)、PO 的空间构型为 , 酸性条件下,PO 可与Fe3+形成H3[Fe(PO4)2]从而掩蔽溶液中的Fe3+ , 基态Fe3+核外M层有种空间运动状态不同的电子。