高考二轮复习知识点:晶胞的计算5
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 某立方晶系的锑钾(Sb—K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构图,图b表示晶胞的一部分。下列说法正确的是( )
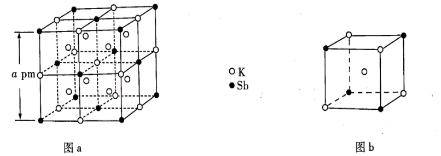 A、该晶胞的体积为a3×10-36cm-3 B、K和Sb原子数之比为3∶1 C、与Sb最邻近的K原子数为4 D、K和Sb之间的最短距离为 apm2. 单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( )
A、该晶胞的体积为a3×10-36cm-3 B、K和Sb原子数之比为3∶1 C、与Sb最邻近的K原子数为4 D、K和Sb之间的最短距离为 apm2. 单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图。下列说法错误的是( ) A、S位于元素周期表p区 B、该物质的化学式为 C、S位于H构成的八面体空隙中 D、该晶体属于分子晶体3. SiO2是合成“中国蓝”的重要原料之一。如图是SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图,O原子略去。),Si原子旁标注的数字是Si原子位于z轴的高度,则SiA与SiB的距离是( )
A、S位于元素周期表p区 B、该物质的化学式为 C、S位于H构成的八面体空隙中 D、该晶体属于分子晶体3. SiO2是合成“中国蓝”的重要原料之一。如图是SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图,O原子略去。),Si原子旁标注的数字是Si原子位于z轴的高度,则SiA与SiB的距离是( ) A、 B、 d C、 d D、d4. NaCl晶体结构如图所示,现测知NaCl晶体中Na+与Cl﹣平均距离为a cm,该晶体密度为ρg•cm﹣3 , 则阿伏加德罗常数可表示为( )
A、 B、 d C、 d D、d4. NaCl晶体结构如图所示,现测知NaCl晶体中Na+与Cl﹣平均距离为a cm,该晶体密度为ρg•cm﹣3 , 则阿伏加德罗常数可表示为( ) A、 B、 C、 D、5. 在催化作用下与空气中的在接触室中发生可逆反应,反应的热化学方程式表示为
A、 B、 C、 D、5. 在催化作用下与空气中的在接触室中发生可逆反应,反应的热化学方程式表示为。下列说法正确的是( )
 A、的晶胞如图所示 B、该反应在任何条件下均能自发 C、使用作催化剂同时降低了正、逆反应的活化能 D、2mol (g)和1mol (g)中所含化学键键能总和比2mol (g)中大196.66. CaO晶胞如图所示,该晶胞中含Ca2+的个数为
A、的晶胞如图所示 B、该反应在任何条件下均能自发 C、使用作催化剂同时降低了正、逆反应的活化能 D、2mol (g)和1mol (g)中所含化学键键能总和比2mol (g)中大196.66. CaO晶胞如图所示,该晶胞中含Ca2+的个数为 A、4 B、6 C、8 D、127. 银氨溶液可用于检验葡萄糖,实验如下:
A、4 B、6 C、8 D、127. 银氨溶液可用于检验葡萄糖,实验如下:步骤1:向试管中加入1 mL 2% AgNO3溶液,边振荡边滴加2%氨水,观察到有白色沉淀产生并迅速转化为灰褐色。
步骤2:向试管中继续滴加2%氨水,观察到沉淀完全溶解。
步骤3:再向试管中加入1 mL 10%葡萄糖溶液,振荡,在60~70℃水浴中加热,观察到试管内壁形成了光亮银镜。
下列说法错误的是
 A、步骤1中观察到的白色沉淀为AgOH B、步骤2所得溶液中大量存在的离子:Ag+、、 C、步骤3中产生银镜说明葡萄糖具有还原性 D、图中所示银的晶胞中Ag原子周围等距且紧邻的Ag原子有12个8. 科学家发现固体电解质具有良好的导电能力,为锂离子电池的发展做出了重要贡献,其晶胞结构如图所示,其中位于体心。下列说法正确的是
A、步骤1中观察到的白色沉淀为AgOH B、步骤2所得溶液中大量存在的离子:Ag+、、 C、步骤3中产生银镜说明葡萄糖具有还原性 D、图中所示银的晶胞中Ag原子周围等距且紧邻的Ag原子有12个8. 科学家发现固体电解质具有良好的导电能力,为锂离子电池的发展做出了重要贡献,其晶胞结构如图所示,其中位于体心。下列说法正确的是 A、该晶胞中位于体心和棱心 B、电负性: C、周围距离最近且相等的的个数为4 D、若晶胞参数为 , 则晶体密度为9. 氢卤酸和AgNO3溶液反应可生成卤化银,已知AgCl、AgBr、AgI的溶解度依次减小,AgI的立方晶胞如图所示。下列说法错误的是
A、该晶胞中位于体心和棱心 B、电负性: C、周围距离最近且相等的的个数为4 D、若晶胞参数为 , 则晶体密度为9. 氢卤酸和AgNO3溶液反应可生成卤化银,已知AgCl、AgBr、AgI的溶解度依次减小,AgI的立方晶胞如图所示。下列说法错误的是 A、推测AgF的溶解度比AgCl的大 B、1个AgI晶胞中平均含有4个I- C、晶胞中I-的配位数是2 D、该晶体密度为g·cm-310. 医学上利用碳酸锌 (ZnCO3)为原料,通过热分解来制备氧化锌,同时产生。氧化锌有六边纤锌矿和立方闪锌矿两种常见晶体结构,晶胞结构如图所示。下列说法正确的是
A、推测AgF的溶解度比AgCl的大 B、1个AgI晶胞中平均含有4个I- C、晶胞中I-的配位数是2 D、该晶体密度为g·cm-310. 医学上利用碳酸锌 (ZnCO3)为原料,通过热分解来制备氧化锌,同时产生。氧化锌有六边纤锌矿和立方闪锌矿两种常见晶体结构,晶胞结构如图所示。下列说法正确的是 A、碳酸锌的组成元素在元素周期表中属于同区元素 B、晶体碳化硅与立方闪锌矿的晶胞结构相似,晶体中粒子之间的作用力也相同 C、六边纤锌矿和立方闪锌矿两种氧化锌晶体中,锌原子周围配位的氧原子数目不相同 D、六边纤锌矿和立方闪锌矿两种氧化锌晶体的空间利用率相同,晶胞密度也相同11. 纳米ZnS具有独特的光电效应。以工业废渣锌灰(主要成分为Zn、ZnO,还含有、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
A、碳酸锌的组成元素在元素周期表中属于同区元素 B、晶体碳化硅与立方闪锌矿的晶胞结构相似,晶体中粒子之间的作用力也相同 C、六边纤锌矿和立方闪锌矿两种氧化锌晶体中,锌原子周围配位的氧原子数目不相同 D、六边纤锌矿和立方闪锌矿两种氧化锌晶体的空间利用率相同,晶胞密度也相同11. 纳米ZnS具有独特的光电效应。以工业废渣锌灰(主要成分为Zn、ZnO,还含有、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
下列说法正确的是
 A、“酸浸”时FeO反应的离子方程式为 B、“还原”的目的是将转化为 C、“沉淀”的离子方程式为 D、ZnS晶胞(如图所示)中每个周围距离最近的有4个12. 的晶胞结构如图所示。下列说法错误的是
A、“酸浸”时FeO反应的离子方程式为 B、“还原”的目的是将转化为 C、“沉淀”的离子方程式为 D、ZnS晶胞(如图所示)中每个周围距离最近的有4个12. 的晶胞结构如图所示。下列说法错误的是 A、属于离子晶体 B、每个晶胞中平均含有4个和4个 C、每个周围有6个紧邻的和6个紧邻的 D、和间存在较强的离子键,因此具有较高的熔点13. 自从第一次合成稀有气体元素的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。如图甲为XeF4的结构示意图,图乙为XeF2晶体的晶胞结构图。下列有关说法正确的是
A、属于离子晶体 B、每个晶胞中平均含有4个和4个 C、每个周围有6个紧邻的和6个紧邻的 D、和间存在较强的离子键,因此具有较高的熔点13. 自从第一次合成稀有气体元素的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等。如图甲为XeF4的结构示意图,图乙为XeF2晶体的晶胞结构图。下列有关说法正确的是 A、XeF4是极性分子 B、XeF2晶体属于离子晶体 C、一个XeF2晶胞中实际拥有2个XeF2 D、XeF2晶体中距离最近的两个XeF2之间的距离为a(a为晶胞边长)
A、XeF4是极性分子 B、XeF2晶体属于离子晶体 C、一个XeF2晶胞中实际拥有2个XeF2 D、XeF2晶体中距离最近的两个XeF2之间的距离为a(a为晶胞边长)二、多选题
-
14. 某原子半径为r的金属的堆积方式为六方最密堆积,结构如图1所示,该晶体晶胞结构如图2所示,1、2、3、4原子形成正四面体,下列说法错误的是
 A、该晶胞中含有的金属原子数目为2 B、该晶胞的高为 C、图1结构中含4个晶胞 D、该晶胞的空间利用率为15. 晶体在熔融状态下能够导电,下图为该晶体的立方晶胞结构示意图,该结构也被称为反萤石结构。下列说法正确的是( )
A、该晶胞中含有的金属原子数目为2 B、该晶胞的高为 C、图1结构中含4个晶胞 D、该晶胞的空间利用率为15. 晶体在熔融状态下能够导电,下图为该晶体的立方晶胞结构示意图,该结构也被称为反萤石结构。下列说法正确的是( )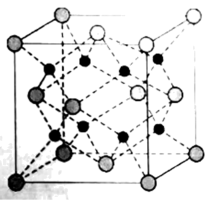 A、该晶体属于离子晶体 B、熔点比高 C、该晶体中Li和O的配位数之比为2∶1 D、若该晶体密度为 , 则该晶体的晶胞参数为(NA为阿伏加德罗常数的值)16. 铁与镁组成的储氢合金的立方晶胞结构如图所示。铁原子位于顶点和面心的位置,镁原子位于将晶胞平分为8个立方单位的体心位置。下列说法错误的是
A、该晶体属于离子晶体 B、熔点比高 C、该晶体中Li和O的配位数之比为2∶1 D、若该晶体密度为 , 则该晶体的晶胞参数为(NA为阿伏加德罗常数的值)16. 铁与镁组成的储氢合金的立方晶胞结构如图所示。铁原子位于顶点和面心的位置,镁原子位于将晶胞平分为8个立方单位的体心位置。下列说法错误的是 A、Fe原子的配位数为8 B、a位置原子的分数坐标为(0.25, 0.75, 0.75) C、Fe原子与镁原子间最短距离为b nm D、晶体储氢时,H2在晶胞的体心和棱的中心位置。若储氢后化学式为FeMg2 H,则储氢率为100%17. 晶胞是描述晶体结构的基本单元。下列示意图中(不同的小球代表不同的原子或离子)可以表示化学式为AB2型化合物晶胞的是( )A、
A、Fe原子的配位数为8 B、a位置原子的分数坐标为(0.25, 0.75, 0.75) C、Fe原子与镁原子间最短距离为b nm D、晶体储氢时,H2在晶胞的体心和棱的中心位置。若储氢后化学式为FeMg2 H,则储氢率为100%17. 晶胞是描述晶体结构的基本单元。下列示意图中(不同的小球代表不同的原子或离子)可以表示化学式为AB2型化合物晶胞的是( )A、 B、
B、 C、
C、 D、
D、 18. 普鲁士蓝晶胞的结构如图所示(K+未标出),下列说法正确的是( )
18. 普鲁士蓝晶胞的结构如图所示(K+未标出),下列说法正确的是( ) A、化学式可以表示为KFe2(CN)6 B、每一个立方体中平均含有24个π键 C、一个晶胞中K+的个数为4个 D、每个Fe3+周围与之相邻的Fe2+有12个19. M的硫化物有MS和M2S两种。已知:二者晶胞中 的位置如图1所示,M离子位于硫离子所构成的四面体中如图2所示(○表示M离子,●表示 )。下列说法错误的是( )
A、化学式可以表示为KFe2(CN)6 B、每一个立方体中平均含有24个π键 C、一个晶胞中K+的个数为4个 D、每个Fe3+周围与之相邻的Fe2+有12个19. M的硫化物有MS和M2S两种。已知:二者晶胞中 的位置如图1所示,M离子位于硫离子所构成的四面体中如图2所示(○表示M离子,●表示 )。下列说法错误的是( ) A、 的排列方式与ZnS中 相似 B、在MS晶胞中如果A处 的坐标为(0,0,0),一个 的坐标为( ),则在( )处也存在 C、MS晶胞中,距离 最近的 为4个 D、MS和M2S晶胞的俯视图均为
A、 的排列方式与ZnS中 相似 B、在MS晶胞中如果A处 的坐标为(0,0,0),一个 的坐标为( ),则在( )处也存在 C、MS晶胞中,距离 最近的 为4个 D、MS和M2S晶胞的俯视图均为
三、非选择题
-
20. [化学——选修3:物质结构与性质]
卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)、氟原子激发态的电子排布式有 , 其中能量较高的是。(填标号)a. b. c. d.
(2)、①一氯乙烯分子中,C的一个杂化轨道与的轨道形成键,并且的轨道与C的轨道形成3中心4电子的大键。②一氯乙烷、一氯乙烯、一氯乙炔分子中,键长的顺序是 , 理由:(ⅰ)C的杂化轨道中s成分越多,形成的键越强;(ⅱ)。
(3)、卤化物受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为。解释X的熔点比Y高的原因。(4)、晶体中离子作体心立方堆积(如图所示),主要分布在由构成的四面体、八面体等空隙中。在电场作用下,不需要克服太大的阻力即可发生迁移。因此,晶体在电池中可作为。
已知阿伏加德罗常数为 , 则晶体的摩尔体积(列出算式)。
21. 铁单质及其化合物的应用非常广泛。(1)、基态Fe原子的价层电子排布式为。(2)、用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为。每个晶胞B中含Fe原子数为。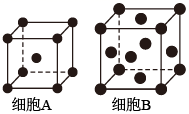 (3)、合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式。从能量角度分析,铁触媒的作用是。
(3)、合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式。从能量角度分析,铁触媒的作用是。 (4)、Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如 、 、 。某同学按如下步骤完成实验:
(4)、Fe3+可与H2O、SCN-、F-等配体形成配位数为6的配离子,如 、 、 。某同学按如下步骤完成实验:
① 为浅紫色,但溶液Ⅰ却呈黄色,其原因是 , 为了能观察到溶液Ⅰ中 的浅紫色,可采取的方法是。
②已知Fe3+与SCN-、F-的反应在溶液中存在以下平衡: ; ,向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为 , 平衡常数为(用K1和K2表示)。
22. 金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。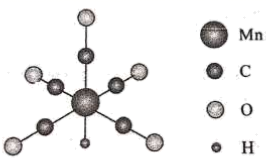
回答问题:
(1)、基态锰原子的价层电子排布式为。(2)、配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为。(3)、第一电离能的大小:CO(填“大于”或“小于”)。(4)、 中碳原子的杂化轨道类型是 , 写出一种与具有相同空间结构的-1价无机酸根离子的化学式。(5)、CH3Mn(CO)5可看作是HMn(CO)5中的氢原子被甲基取代的产物。CH3Mn(CO)5与I2反应可用于制备CH3I,反应前后锰的配位数不变,CH3Mn(CO)5与I2反应的化学方程式为。(6)、MnS晶胞与NaCl晶胞属于同种类型,如图所示。前者的熔点明显高于后者,其主要原因是。
以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在晶胞坐标系中,a点硫原子坐标为 ,b点锰原子坐标为 ,则c点锰原子坐标为。
23. TIC、TiN、MnS、MnSe在电化学领域均有巨大的应用潜力。回答下列问题:(1)、基态Ti2+和Mn2+中未成对电子数之比为;N、S、Mn的第一电离能由大到小的顺序为。(2)、键能:H—SH—Se(填“>”或“<"),理由为。(3)、C3N4的硬度可以和金刚石媲美,其中N原子的杂化方式为。(4)、SeO2的VSEPR模型为。(5)、H2S2O8是一种强氧化剂,可看作两个H2SO4分子通过形成过氧键结合而成。1molH2S2O8中σ键的数目为。(6)、MnSe具有NaCl型结构,其立方晶胞结构如图1所示。
①MnSe晶体可以看成是由Se原子堆成的正八面体中空隙被Mn原子填充,填充率为。
②图2所示单元不是MnSe的晶胞单元,原因为。

③若阿伏加德罗常数的值为NA , 晶体密度为ρg·cm-3 , 则该晶体中Se原子与Mn原子之间最短距离为pm。
24. 铁、钴、镍等金属及其化合物在科学研究和工业生产中应用非常广泛。回答下列问题:(1)、基态铁原子的核外电子排布式为。(2)、K3[Fe(CN)6 ]溶液可以检验Fe2+。K3[Fe(CN)6]中含有的σ键与π键的数目之比 , 与CN-互为等电子体的分子有(举一例,填化学式)。(3)、酞菁钴的结构简式如图所示,其中三种非金属元素的电负性由大到小的顺序为。 (4)、NiSO4是制备磁性材料和催化剂的重要中间体,的空间构型为 , 硫原子的杂化方式为。(5)、某氮化铁的晶胞结构如图所示:
(4)、NiSO4是制备磁性材料和催化剂的重要中间体,的空间构型为 , 硫原子的杂化方式为。(5)、某氮化铁的晶胞结构如图所示:
①原子坐标参数表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数A(0,0,0);B为( , , );C为(0,1,1)。则D原子的坐标参数为。
②若该晶体的密度是ρg·cm-3 ,则晶胞中两个最近的Fe的核间距为cm(用含ρ的代数式表示,NA表示阿伏加德罗常数的值)。
25. 国际权威学术期刊《自然》最近报道,我国科学家选择碲化锆(ZrTe5)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应。请回答下列问题:(1)、Zr是Ti的同族相邻元素,位于周期表的区;基态Te原子的价电子排布式是。(2)、周期表中As、Te分别与Se相邻,这三种元素第一电离能由大到小的顺序是。(3)、Cd2+与NH3可形成配离子[Cd(NH3)4]2+①该离子中不含的化学键类型有(填字母)。
A.离子键 B.配位键 C.σ键 D.共价键 E.氢键 F.π键
②已知该离子中2个NH3被2个Cl- 替代只得到一种结构,则该离子的立体构型为。
(4)、含砷有机物“对氨基苯砷酸”的结构简式如图所示,As原子的轨道杂化类型为 ,1 个对氨基苯砷酸分子中含有σ键的数目为。 (5)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系Cd-Sn-As形成的化合物的晶胞结构如图所示,晶胞棱边夹角均为90° ,晶胞中部分原子的分数坐标如下表所示。
(5)、以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系Cd-Sn-As形成的化合物的晶胞结构如图所示,晶胞棱边夹角均为90° ,晶胞中部分原子的分数坐标如下表所示。
坐标原子
x
y
z
Cd
0
0
0
Sn
0
0
0.5
As
0.25
0.25
0. 125
①找出此晶胞中距离Cd(0,0,0)最远的As的位置(用分数坐标表示)。
②该化合物的化学式为 , 此晶体的密度为g·cm-3(列出计算式,阿伏。加德罗常数的值为NA)。
26. 钠、铁、铜、锌的单质及其化合物在社会实际中有着广泛的应用。回答下列相关问题: (1)、碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如图所示,则A的化学式是 , A中铜元素的化合价为。(2)、向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的沉淀,该物质中的通过键与中心离子结合,分子中N原子的杂化方式是。与分子互为等电子体的一种阳离子是。(3)、某的晶胞如图1所示,可以完全替代该晶体中a位置的或者b位置的 , 形成替代型产物。转化为两种替代型产物的能量变化如图2所示,其中更稳定的替代型产物的化学式为。
(1)、碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如图所示,则A的化学式是 , A中铜元素的化合价为。(2)、向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的沉淀,该物质中的通过键与中心离子结合,分子中N原子的杂化方式是。与分子互为等电子体的一种阳离子是。(3)、某的晶胞如图1所示,可以完全替代该晶体中a位置的或者b位置的 , 形成替代型产物。转化为两种替代型产物的能量变化如图2所示,其中更稳定的替代型产物的化学式为。 (4)、在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方晶体结构如下图所示,其晶胞边长为 , 密度为(列式并计算),a位置与b位置之间的距离为(列式表示)。
(4)、在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方晶体结构如下图所示,其晶胞边长为 , 密度为(列式并计算),a位置与b位置之间的距离为(列式表示)。 27. 铜是人类广泛使用的一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:(1)、基态Cu原子的价电子排布式为 , 原子核外的电子有种空间运动状态。(2)、配合物Cu(NH3)2OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是 , NH3分子的价层电子对互斥模型是 , C、N、O、H的电负性由大到小的顺序为。(3)、Cu+与CN-形成的阴离子为[Cu(CN)3]2- , 该阴离子中σ键与π键数目之比为。(4)、铜能与拟卤素(SCN)2反应。拟卤素(SCN)2对应的酸有两种,理论上异硫氰酸(H-N=C=S)的沸点高于硫氰酸(H-S-C≡N),其原因为。(5)、某立方磷青铜晶体的晶胞结构如图所示。
27. 铜是人类广泛使用的一种金属,含铜物质在生产生活中有着广泛应用。回答下列问题:(1)、基态Cu原子的价电子排布式为 , 原子核外的电子有种空间运动状态。(2)、配合物Cu(NH3)2OOCCH3中,铜显+1价,则其中碳原子的杂化轨道类型是 , NH3分子的价层电子对互斥模型是 , C、N、O、H的电负性由大到小的顺序为。(3)、Cu+与CN-形成的阴离子为[Cu(CN)3]2- , 该阴离子中σ键与π键数目之比为。(4)、铜能与拟卤素(SCN)2反应。拟卤素(SCN)2对应的酸有两种,理论上异硫氰酸(H-N=C=S)的沸点高于硫氰酸(H-S-C≡N),其原因为。(5)、某立方磷青铜晶体的晶胞结构如图所示。
①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为。
②若晶体密度为ρg·cm-3 ,最近的Cu原子核间距为(用含ρ、NA的代数式表示)pm。
28. 镓(31Ga)是化学史上第一种先理论预言,后在自然界中被发现并验证的元素。镓的化合物半导体广泛用于电子与微电子工业。(1)、基态Ga原子中,核外电子占据的最高能层的符号是。(2)、门捷列夫预言的“类硼”(即钪,21Sc),“类铝”(即镓,31Ga),“类硅”(即锗,32Ge)三种元素中,未成对电子数最多的是(填元素符号)。(3)、氮化镓(GaN)和砷化镓(GaAs)都是新型的半导体材料,与晶体硅属于同一晶体类型。①Ga、N、As三种元素的电负性由大到小的顺序是。
②GaN熔点(1700℃)高于GaAs熔点(1238℃)的原因是。
③GaAs可由Ga(CH3)3和AsH3在一定条件下制得,该反应的化学方程式是 , Ga(CH3)3分子中Ga原子的杂化方式是 , AsH3分子的空间构型是。
(4)、钆镓石榴石是一种激光介质材料,其晶体结构单位简图如下。
①钆镓石榴石的化学式是。
②已知晶体结构单位的边长为a nm,晶体的密度为ρ g·cm−3 , 则阿伏加德罗常数NA=(用含a、ρ的代数式表示)。
29. 总订单数已经超过1000架的国产大飞机C919预定在今年交付,其制造使用了较多含硼材料(如硼纤维、氮化硼等),多项技术打破了外国垄断。(1)、原子的能量由核电荷数、电子数、三个因素共同决定;基态B原子的核外电子填充在个轨道中。(2)、耐高温材料立方BN制备流程中用到NH3、BCl3和触媒剂Ca3B2N4。①Ca、B、N三种元素电负性从大到小的顺序为。
②BCl3中B原子的轨道与Cl原子的轨道形成σ键;形成BCl3过程中基态B原子价电子层电子先激发,再杂化,激发后B原子的价电子排布图为。
③BCl3在四氯化碳中的溶解度远大于NH3 , 原因是。
(3)、硼砂是非常重要的含硼矿物。一种硼砂阴离子的结构如图1所示,则1mol该阴离子存在的配位键物质的量为 , n=。 (4)、制造硼合金的原料硼化钙(CaB6)晶胞结构如图2所示,硼原子全部组成B6正八面体,各个顶点通过B-B键互相连接成三维骨架。已知该晶体晶胞参数为apm,B6八面体中B-B键的键长为dpm,M点原子的坐标参数为( , , ),则N点原子的坐标参数为( , 1,0)。
(4)、制造硼合金的原料硼化钙(CaB6)晶胞结构如图2所示,硼原子全部组成B6正八面体,各个顶点通过B-B键互相连接成三维骨架。已知该晶体晶胞参数为apm,B6八面体中B-B键的键长为dpm,M点原子的坐标参数为( , , ),则N点原子的坐标参数为( , 1,0)。 30. 碳是形成许多有机材料和无机非金属材料的重要组成元素。回答下列问题:(1)、基态碳原子的价电子排布式为。(2)、 的沸点比 高的主要原因为。(3)、一种半导体材料,由C、N形成类石墨烯平面结构,通过层层堆叠而成,其晶胞结构如图1,晶胞左侧四边形结构如图2。
30. 碳是形成许多有机材料和无机非金属材料的重要组成元素。回答下列问题:(1)、基态碳原子的价电子排布式为。(2)、 的沸点比 高的主要原因为。(3)、一种半导体材料,由C、N形成类石墨烯平面结构,通过层层堆叠而成,其晶胞结构如图1,晶胞左侧四边形结构如图2。
①图1中“3”碳原子不处于晶胞面心的理由为。
②同一层中“1”氮原子和“2”氮原子配位数之比为。
③每个“2”氮原子提供个电子参与形成π键。
④已知该晶胞的体积为Vcm3 , 阿伏加德罗常数的值为 ,则该品胞的密度为 。
31. 氮元素是地球上含量丰富的一种元素,不仅是制造农药、医药的重要元素,也是构成蛋白质的重要元素。根据所学知识回答以下问题。(1)、基态N原子的成对电子数与未成对电子数之比为 , 离子的空间构型为(2)、N-甲基咪唑( )是一种有机化合物,可作为有机合成中间体和树脂固化N剂,其中碳原子杂化方式为 , 所含元素第一电离能由大到小的顺序是 , 0.1molN-甲基咪唑中含σ键的数目为NA。 (3)、N-甲基咪唑的某种衍生物与甘氨酸形成的离子化合物
)是一种有机化合物,可作为有机合成中间体和树脂固化N剂,其中碳原子杂化方式为 , 所含元素第一电离能由大到小的顺序是 , 0.1molN-甲基咪唑中含σ键的数目为NA。 (3)、N-甲基咪唑的某种衍生物与甘氨酸形成的离子化合物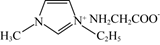 ,常温下为液态而非固态,原因是。 (4)、TiO2-aNb是常见的光学活性物质,由TiO2通过氮掺杂反应生成,表示如下图。
,常温下为液态而非固态,原因是。 (4)、TiO2-aNb是常见的光学活性物质,由TiO2通过氮掺杂反应生成,表示如下图。
①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为g·cm-3(写计算式, NA代表阿伏加德罗常数)。
②图乙TiO2-aNb晶体中a:b=。
32. 非金属元素及其化合物在生产、生活和科研中应用广泛。回答下列问题:(1)、As4S4俗称雄黄,其中基态砷原子外围电子排布式为。(2)、HOCH2CN分子中含有的σ键与π键数目之比为 , 该化合物中处于同周期的元素中第一电离能由大到小的顺序为:(3)、三硝基胺N(NO2)3(其结构为 )是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为 , 并且与三个硝基中的N构成形。 (4)、甘氨酸(H2NCH2COOH)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是。(5)、NH3易与Cu2+形成[Cu(NH3)4]2+配离子,在该配离子中H-N-H键角比NH3分子中H-N-H键角大的原因是。[Cu(NH3)4]2+中2个NH3被2个H2O取代,得到两种结构的配离子,则[Cu(NH3)4]2+的空间构型是。(6)、某立方磷青铜晶体的晶胞结构如图所示。
)是一种新型的火箭燃料,因硝基吸电子能力强,中心N原子上无孤电子对,则中心N原子的杂化方式为 , 并且与三个硝基中的N构成形。 (4)、甘氨酸(H2NCH2COOH)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是。(5)、NH3易与Cu2+形成[Cu(NH3)4]2+配离子,在该配离子中H-N-H键角比NH3分子中H-N-H键角大的原因是。[Cu(NH3)4]2+中2个NH3被2个H2O取代,得到两种结构的配离子,则[Cu(NH3)4]2+的空间构型是。(6)、某立方磷青铜晶体的晶胞结构如图所示。
①原子分数坐标可表示晶胞内部各原子的相对位置,图中各原子分数坐标:A为(0,0,0),B为(1,1,0),C为(0,1,1),则D原子的分数坐标为。
②若晶体密度为ρg/cm-3 , 最近的Cu原子核间距为pm(用含ρ、NA的代数式表示)。
33. 钛及其化合物在生产、生活中有着广泛的用途。回答下列问题:(1)、Ti(BH4)3是一种储氢材料。BH的空间构型为;Ti 、B、H元素的电负性由大到小排列顺序为。(2)、已知Ti3+易形成多种配合物,[TiCl( H2O)5]Cl2· H2O是其中的一种。①1 mol该配合物中含有molσ键。
②中心离子杂化方式为(填标号)。
a.sp2 b.sp3 c.sp3d d.sp3d2
③Ti3+具有较强还原性的原因是。
(3)、研究表明,TiO2通过氮掺杂反应可生成TiO2-x Ny , 能使TiO2对可见光具有活性,反应如图所示。
①上图TiO2晶胞中钛原子占据个氧原子围成的八面体空隙。
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为( , , ),则A点原子的分数坐标为;晶胞中A、B间距离为pm;TiO2晶体密度为g·cm-3(设NA为阿伏加德罗常数的值)。
③TiO2-x Ny晶体中x=。
34. 三氯异氰尿酸是一种极强的氧化剂和氯化剂,具有高效、广谱、较为安全的消毒作用。三氯异氰尿酸之所以有杀菌、消毒功能,是因为三氯异氰尿酸溶于水能迅速生成次氯酸,反应方程式如图:
回答下列问题:
(1)、Cl的基态原子核外电子排布式。在三氯异氰尿酸分子中,C和N原子的杂化类型分别为、 , 基态C和N核外未成对电子数较多的是(2)、苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键,可记为(右下角“6”表示6个原子,右上角“6”表示6个共用电子),则氰尿酸分子中存在的大π键可表示为。(3)、1mol异氰尿酸分子中σ键的数目为 , π键的数目为。HClO分子属于(填“极性”或“非极性”)分子,其立体构型为。(4)、异氰尿酸分子和氰尿酸分子的熔点都高于三氯异氰尿酸分子的熔点,其原因是。(5)、CO2的综合利用有利于“碳中和”,CO2分子在晶体中的堆积方式如图所示,该晶体面心立方最密堆积结构,晶胞边长为apm,则该晶体的密度ρ=g/cm3(列出计算式,设NA为阿伏加德罗常数) 35. 稀土元素是指钪(Sc)、钇(Y)和镧系元素,共17种,位于元素周期表中第IIIB族,均为金属元素,在工业。生产中有重要的作用。回答下列问题:(1)、钇(Y)位于元素周期表中钪(Sc)的下一周期,基态钇(Y)元素的原子价电子排布图为。(2)、稀土元素常常能和许多配位体形成配合物。若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,其中有一个能提供孤电子对的原子为一齿(已知:碳氧双键中的氧原子不能提供孤电子对)。DEDTA(结构见图甲)是齿配位体,其中碳原子的杂化方式有 , 该物质中所含元素的电负性由大到小的顺序是。
35. 稀土元素是指钪(Sc)、钇(Y)和镧系元素,共17种,位于元素周期表中第IIIB族,均为金属元素,在工业。生产中有重要的作用。回答下列问题:(1)、钇(Y)位于元素周期表中钪(Sc)的下一周期,基态钇(Y)元素的原子价电子排布图为。(2)、稀土元素常常能和许多配位体形成配合物。若一个配位体含有两个或两个以上的能提供孤电子对的原子,这种配位体就叫多齿配位体,其中有一个能提供孤电子对的原子为一齿(已知:碳氧双键中的氧原子不能提供孤电子对)。DEDTA(结构见图甲)是齿配位体,其中碳原子的杂化方式有 , 该物质中所含元素的电负性由大到小的顺序是。
②EDTA与正二十一烷的相对分子质量非常接近,但EDTA的沸点(540.6℃)比正二十一烷的沸点(100℃)高得多,原因是。
(3)、钪(Sc)离子在水中以稳定的[Sc(H2O)6]3+存在,其空间构型为。(4)、铈(Ce)属于镧系元素,氧化铈是一种重要的光催化材料。氧化铈的晶体结构如图乙所示,氧化铈的化学式为;若晶胞参数为anm,阿伏加德罗常数为NA , 则该晶体的密度=g/cm3(写出表达式)。