高考二轮复习知识点:晶胞的计算4
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 我国科学家发明了高选择性的 加氢合成 的催化剂,其组成为 固溶体,其中 摩尔质量为M g/mol,晶胞如图所示,晶胞的棱长为a pm。下列说法错误的是( )
 A、 离子在晶胞中的配位数为8 B、 位于元素周期表中ds区 C、该晶胞的密度为 D、O位于Zr构成的正四面体空隙中2. 一种I2的制备工艺流程如下:
A、 离子在晶胞中的配位数为8 B、 位于元素周期表中ds区 C、该晶胞的密度为 D、O位于Zr构成的正四面体空隙中2. 一种I2的制备工艺流程如下:
下列说法不正确的是( )
 A、“富集”得到的悬浊液中含有AgI,1个AgI晶胞(如图)中含有4个I− B、“转化”过程中的离子反应方程式为Fe+2AgI=2Ag+Fe2++ 2I− C、“沉淀”与足量的浓硝酸反应,氧化产物可循环使用,还原产物为NO D、“氧化”过程中若氯气过量,单质碘的产率降低,可能原因是I2被进一步氧化3. 钛铁基储氢合金是由钛、铁两种元素组成的金属间化合物。一种钛铁合金的晶胞如图ⅰ所示,晶胞边长约为3×10-10m,该合金吸收的氢位于体心立方正八面体的中心,氢被4个钛原子和2个铁原子包围,如图ⅱ所示。下列说法不正确的是( )
A、“富集”得到的悬浊液中含有AgI,1个AgI晶胞(如图)中含有4个I− B、“转化”过程中的离子反应方程式为Fe+2AgI=2Ag+Fe2++ 2I− C、“沉淀”与足量的浓硝酸反应,氧化产物可循环使用,还原产物为NO D、“氧化”过程中若氯气过量,单质碘的产率降低,可能原因是I2被进一步氧化3. 钛铁基储氢合金是由钛、铁两种元素组成的金属间化合物。一种钛铁合金的晶胞如图ⅰ所示,晶胞边长约为3×10-10m,该合金吸收的氢位于体心立方正八面体的中心,氢被4个钛原子和2个铁原子包围,如图ⅱ所示。下列说法不正确的是( ) A、钛铁合金的化学式:TiFe B、钛铁合金中每个Ti周围距离最近且等距的Fe有8个 C、钛铁合金的密度约为6g/cm3(计算结果保留到整数) D、如图ⅱ所示的每个体心立方正八面体均填充1个氢原子,则理论上形成的金属氢化物的化学式:TiFeH24. 下列有关说法正确的是( )
A、钛铁合金的化学式:TiFe B、钛铁合金中每个Ti周围距离最近且等距的Fe有8个 C、钛铁合金的密度约为6g/cm3(计算结果保留到整数) D、如图ⅱ所示的每个体心立方正八面体均填充1个氢原子,则理论上形成的金属氢化物的化学式:TiFeH24. 下列有关说法正确的是( ) A、SO2溶于水所得溶液能导电,所以SO2是电解质 B、的空间构型为平面三角形 C、电负性:O<S D、黄铜矿的晶胞如图所示,则其化学式为:CuFeS25. FeO晶胞结构如图所示,其摩尔质量为Mg/mol,阿伏加德罗常数为NA , 晶体的密度为dg/cm3 , 下列说法错误的是( )
A、SO2溶于水所得溶液能导电,所以SO2是电解质 B、的空间构型为平面三角形 C、电负性:O<S D、黄铜矿的晶胞如图所示,则其化学式为:CuFeS25. FeO晶胞结构如图所示,其摩尔质量为Mg/mol,阿伏加德罗常数为NA , 晶体的密度为dg/cm3 , 下列说法错误的是( )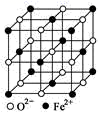 A、Fe位于第四周期第ⅧB族,属于d区 B、Fe2+的电子排布简式为[Ar]3d6 C、该晶体中,距Fe2+最近的O2-形成正八面体 D、该晶体中两个距离最近的同种离子的核间距为 cm6. 设NA为阿伏加德罗常数的值下列有关叙述正确的是( )A、100mL1mol·L-1NH4Cl溶液中含有阳离子的数目小于0.1NA B、0.5L0.5mol·L-1醋酸溶液中含有的分子数目小于0.25NA C、60gSiO2晶体中含有[SiO4]四面体结构单元的数目为NA D、25℃时Ksp(CaSO4)=9×10-6 , 则该温度下CaSO4饱和溶液中含有3×10-3NA个Ca2+7. 白磷(P4)易自燃,易溶于CS2 , Ca(H2PO4)2是磷肥的有效成分;砷化镓是重要的半导体材料。下列关于氮、磷、砷的单质及化合物的说法正确的是( )
A、Fe位于第四周期第ⅧB族,属于d区 B、Fe2+的电子排布简式为[Ar]3d6 C、该晶体中,距Fe2+最近的O2-形成正八面体 D、该晶体中两个距离最近的同种离子的核间距为 cm6. 设NA为阿伏加德罗常数的值下列有关叙述正确的是( )A、100mL1mol·L-1NH4Cl溶液中含有阳离子的数目小于0.1NA B、0.5L0.5mol·L-1醋酸溶液中含有的分子数目小于0.25NA C、60gSiO2晶体中含有[SiO4]四面体结构单元的数目为NA D、25℃时Ksp(CaSO4)=9×10-6 , 则该温度下CaSO4饱和溶液中含有3×10-3NA个Ca2+7. 白磷(P4)易自燃,易溶于CS2 , Ca(H2PO4)2是磷肥的有效成分;砷化镓是重要的半导体材料。下列关于氮、磷、砷的单质及化合物的说法正确的是( ) A、磷肥与草木灰混合施肥效果更佳 B、肼的沸点为113.5℃,说明肼分子间可能存在氢键 C、白磷分子(P4)是极性分子,白磷可保存在水中 D、砷化镓的晶胞结构如上图所示,镓原子配位数为88. 蔗糖水解及产物检验实验步骤如下:
A、磷肥与草木灰混合施肥效果更佳 B、肼的沸点为113.5℃,说明肼分子间可能存在氢键 C、白磷分子(P4)是极性分子,白磷可保存在水中 D、砷化镓的晶胞结构如上图所示,镓原子配位数为88. 蔗糖水解及产物检验实验步骤如下:步骤1:取1mL20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min。
步骤2:向步骤1所得溶液中加入NaOH溶液调节pH至碱性。
步骤3:再加入少量新制备的Cu(OH)2 , 加热3~5min,观察到生成砖红色沉淀。
下列有关说法错误的是( )
 A、步骤1中稀硫酸是蔗糖水解的催化剂 B、上述实验可证明蔗糖水解有还原性糖生成 C、上述实验可证明蔗糖已完全水解 D、如图所示的Cu2O晶胞中铜原子的配位数为29. 下列有关说法错误的是( )
A、步骤1中稀硫酸是蔗糖水解的催化剂 B、上述实验可证明蔗糖水解有还原性糖生成 C、上述实验可证明蔗糖已完全水解 D、如图所示的Cu2O晶胞中铜原子的配位数为29. 下列有关说法错误的是( ) A、MgO的晶格能大于CaO B、干冰和SiO2的晶体类型相同 C、如图上所示的晶胞的化学式为KZnF3 D、DNA双螺旋的两个螺旋链通过氢键相互结合10. 钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点为( ,0, )。下列说法中错误的是( )
A、MgO的晶格能大于CaO B、干冰和SiO2的晶体类型相同 C、如图上所示的晶胞的化学式为KZnF3 D、DNA双螺旋的两个螺旋链通过氢键相互结合10. 钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点为( ,0, )。下列说法中错误的是( ) A、配合物中Co2+价电子排布式为3d7 B、钴的配位数为6 C、C点的原子坐标参数为( ) D、该物质的化学式为TiCoO2
A、配合物中Co2+价电子排布式为3d7 B、钴的配位数为6 C、C点的原子坐标参数为( ) D、该物质的化学式为TiCoO2二、多选题
-
11. 是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是( )
 A、每个晶胞中个数为x B、每个晶胞完全转化为晶胞,转移电子数为8 C、每个晶胞中0价Cu原子个数为 D、当转化为时,每转移电子,产生原子12. 一种以FeS2(晶胞如下图所示)为原料制备Ca2[Fe(CN)6]·11H2O的工艺流程如下:
A、每个晶胞中个数为x B、每个晶胞完全转化为晶胞,转移电子数为8 C、每个晶胞中0价Cu原子个数为 D、当转化为时,每转移电子,产生原子12. 一种以FeS2(晶胞如下图所示)为原料制备Ca2[Fe(CN)6]·11H2O的工艺流程如下:

下列说法正确的是( )
A、“焙烧”每生成1 mol Fe2O3 , 转移电子的物质的量为22 mol B、FeS2晶胞中距离每个Fe2+最近的S有4个 C、1 mol [Fe(CN)6]2-中含σ键的数目为12 mol。 D、“操作”为将溶液蒸干13. 砷化镉(砷化镉的摩尔质量为M g·mol-1)晶胞结构如图。图中“①”和“②”位是“真空”,晶胞参数为a pm,建立如图的原子坐标系,①号位的坐标为( , , )。NA为阿伏加德罗常数的值。下列说法错误的是( ) A、与每个As原子距离相等且最近的As原子有6个 B、两个Cd原子间最短距离为0.5a pm C、③号位原子坐标参数为( , 1,) D、该晶胞的密度为 g·cm-314. 具有反萤石结构,晶胞结构如图所示,其晶胞参数为a nm。设为阿伏加德罗常数的值,下列叙述正确的是( )
A、与每个As原子距离相等且最近的As原子有6个 B、两个Cd原子间最短距离为0.5a pm C、③号位原子坐标参数为( , 1,) D、该晶胞的密度为 g·cm-314. 具有反萤石结构,晶胞结构如图所示,其晶胞参数为a nm。设为阿伏加德罗常数的值,下列叙述正确的是( ) A、Si的配位数为4 B、紧邻的两个Mg原子的距离为 C、紧邻的两个Si原子间的距离为 D、的密度计算式为15. 铁镁合金储氢时分子在晶胞的棱心和体心位置,且最近的两个铁原子之间的距离为anm,晶胞结构如下图所示。下列说法错误的是( )
A、Si的配位数为4 B、紧邻的两个Mg原子的距离为 C、紧邻的两个Si原子间的距离为 D、的密度计算式为15. 铁镁合金储氢时分子在晶胞的棱心和体心位置,且最近的两个铁原子之间的距离为anm,晶胞结构如下图所示。下列说法错误的是( ) A、晶胞中与铁原子等距离且最近的镁原子有4个 B、晶胞中Fe原子的堆积方式为面心立方最密堆积 C、该合金储氢后晶体的化学式为 D、储氢后,该晶体的密度为16. 钙钛矿是以俄罗斯矿物学家Perovski的名字命名的,最初单指钛酸钙这种矿物[如图(a)],此后,把结构与之类似的晶体(化学式与钛酸钙相同)统称为钙钛矿物质。某钙钛矿型太阳能光伏电池的有机半导材料的结构如图(b)所示,其中为 , 另两种离子为和。
A、晶胞中与铁原子等距离且最近的镁原子有4个 B、晶胞中Fe原子的堆积方式为面心立方最密堆积 C、该合金储氢后晶体的化学式为 D、储氢后,该晶体的密度为16. 钙钛矿是以俄罗斯矿物学家Perovski的名字命名的,最初单指钛酸钙这种矿物[如图(a)],此后,把结构与之类似的晶体(化学式与钛酸钙相同)统称为钙钛矿物质。某钙钛矿型太阳能光伏电池的有机半导材料的结构如图(b)所示,其中为 , 另两种离子为和。
下列说法错误的是( )
A、钛酸钙的化学式为 B、图(b)中,为 C、中含有配位键 D、晶胞中与每个紧邻的有6个三、非选择题
-
17. 工业中可利用生产钛白的副产物和硫铁矿联合制备铁精粉和硫酸,实现能源及资源的有效利用。(1)、结构示意图如图1。
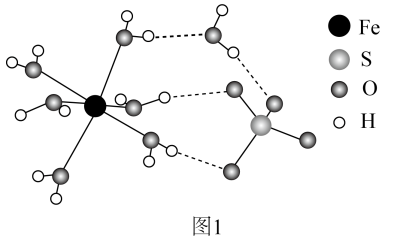
①的价层电子排布式为。
②中O和中S均为杂化,比较中键角和中键角的大小并解释原因。
③中与与的作用力类型分别是。
(2)、晶体的晶胞形状为立方体,边长为 , 结构如图2。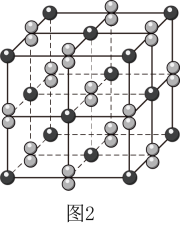
①距离最近的阴离子有个。
②的摩尔质量为 , 阿伏加德罗常数为。
该晶体的密度为。
(3)、加热脱水后生成 , 再与在氧气中掺烧可联合制备铁精粉和硫酸。分解和在氧气中燃烧的能量示意图如图3。利用作为分解的燃料,从能源及资源利用的角度说明该工艺的优点。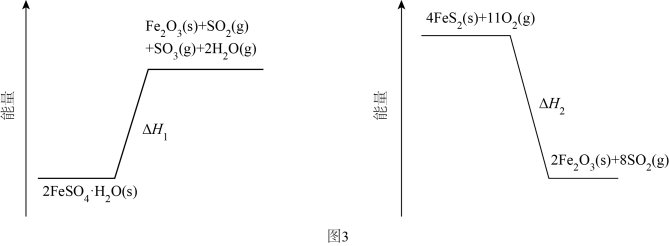 18. 研究笼形包合物结构和性质具有重要意义。化学式为的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为。回答下列问题:
18. 研究笼形包合物结构和性质具有重要意义。化学式为的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞。晶胞参数为。回答下列问题: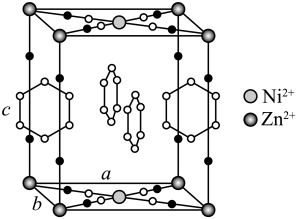 (1)、基态原子的价电子排布式为 , 在元素周期表中位置为。(2)、晶胞中N原子均参与形成配位键,与的配位数之比为;;晶胞中有d轨道参与杂化的金属离子是。(3)、吡啶(
(1)、基态原子的价电子排布式为 , 在元素周期表中位置为。(2)、晶胞中N原子均参与形成配位键,与的配位数之比为;;晶胞中有d轨道参与杂化的金属离子是。(3)、吡啶(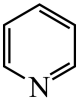 )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大键、则吡啶中N原子的价层孤电子对占据____(填标号)。 A、2s轨道 B、2p轨道 C、sp杂化轨道 D、sp2杂化轨道(4)、在水中的溶解度,吡啶远大于苯,主要原因是① , ②。(5)、
)替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的大键、则吡啶中N原子的价层孤电子对占据____(填标号)。 A、2s轨道 B、2p轨道 C、sp杂化轨道 D、sp2杂化轨道(4)、在水中的溶解度,吡啶远大于苯,主要原因是① , ②。(5)、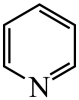 、
、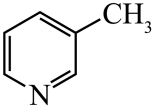 、
、 的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 19. [选修3:物质结构与性质]
的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 19. [选修3:物质结构与性质]铁和硒( )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。回答下列问题:
(1)、乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
①基态 原子的核外电子排布式为 ;
②该新药分子中有种不同化学环境的C原子;
③比较键角大小:气态 分子 离子(填“>”“<”或“=”),原因是。
(2)、富马酸亚铁 是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中 键与 键的数目比为;
②富马酸亚铁中各元素的电负性由大到小的顺序为。
(3)、科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将 转化为 ,反应过程如图所示:
①产物中N原子的杂化轨道类型为;
②与 互为等电子体的一种分子为(填化学式)。
(4)、钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
①该超导材料的最简化学式为;
② 原子的配位数为;
③该晶胞参数 、 。阿伏加德罗常数的值为 ,则该晶体的密度为 (列出计算式)。
20. 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含 的新型 分子 的合成路线如下: (1)、 与S同族,基态硒原子价电子排布式为。(2)、 的沸点低于 ,其原因是。(3)、关于I~III三种反应物,下列说法正确的有_________。A、I中仅有 键 B、I中的 键为非极性共价键 C、II易溶于水 D、II中原子的杂化轨道类型只有 与 E、I~III含有的元素中,O电负性最大(4)、IV中具有孤对电子的原子有。(5)、硒的两种含氧酸的酸性强弱为 (填“>”或“<”)。
(1)、 与S同族,基态硒原子价电子排布式为。(2)、 的沸点低于 ,其原因是。(3)、关于I~III三种反应物,下列说法正确的有_________。A、I中仅有 键 B、I中的 键为非极性共价键 C、II易溶于水 D、II中原子的杂化轨道类型只有 与 E、I~III含有的元素中,O电负性最大(4)、IV中具有孤对电子的原子有。(5)、硒的两种含氧酸的酸性强弱为 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。 的立体构型为。
(6)、我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图a,沿x、y、z轴方向的投影均为图b。
①X的化学式为。
②设X的最简式的式量为 ,晶体密度为 ,则X中相邻K之间的最短距离为 (列出计算式, 为阿伏加德罗常数的值)。
21. 钛金属重量轻、强度高、有良好的抗腐蚀能力,其单质及其化合物在航空航天、武器装备、能源、化工、冶金建筑和交通等领域应用前景广阔。回答下列有关问题:(1)、基态钛原子的价电子排布式为;钛(Ti)和锆(Zr)是同一副族的相邻元素,钛和锆的价层电子结构相似,请画出基态锆原子的价电子排布图:。(2)、二氧化钛(TiO2)是常用的具有较高催化活性和稳定性的光催化剂。在TiO2催化作用下,可将CN-氧化成CNO- , 进而得到N2 , 与CNO-互为等电子体的分子化学式为(写出2个)。TiO2与光气COCl2反应可用于制取四氯化钛,COCl2的空间构型为。(3)、钛与卤素形成的化合物的熔、沸点如下表所示:TiCl4
TiBr4
TiI4
熔点/℃
-24.1
38.3
155
沸点/℃
136.5
233. 5
377
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是。
(4)、钛某配合物可用于催化环烯烃聚合,其结构如图所示:
①甲基上的碳原子的杂化类型是。
②该配合物中含有的化学键有 (填标号)。
a离子键 b.σ键 c.金属键 d.π键
(5)、已知TiO2晶胞中Ti4+位于O2-所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2-所构成的立方体的体心,其晶胞结构如下图所示。
①TiO2晶胞中Ti4+的配位数是。
②已知二氧化锆晶胞中Zr原子和O原子之间的最短距离为a pm,则二氧化锆晶体的密度为g·cm-3。(列出表达式即可,不用化简,NA为阿伏加德罗常数的值,ZrO2的摩尔质量为M g/mol)。
22.(1)、I.和均可以催化降解甲醛、苯等有害物质,具有去除效率高,且无二次污染等优点,广泛应用于家居装潢等领域,其中一种催化机理如图所示。
回答下列问题:
基态Ti和Mn原子中未成对电子数之比为。
(2)、CO2和·CHO中碳原子的杂化形式分别为、。(3)、HCHO的空间构型为。(4)、金属钛和锰可导电、导热,有金属光泽和延展性,这些性质都可以用理论解释。已知金属锰有多种晶型,y型锰的面心立方晶胞俯视图符合下列(填编号)。 (5)、II.2019年诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。、聚乙二醇、、和LiCl等可作锂离子聚合物电池的材料。
(5)、II.2019年诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。、聚乙二醇、、和LiCl等可作锂离子聚合物电池的材料。回答下列问题:
Fe的基态原子的价电子排布式为。
(6)、乙二醇(HOCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点高出100℃,原因是。(7)、III.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl3∙H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。LiCl3∙H2O的摩尔质量为 , 设为阿伏加德罗常数的值。
该晶胞中Cl原子的数目为 , 晶体的密度为(列出计算表达式)。
23. 锌的化合物在生产生活中有广泛的应用。(1)、L-赖氨酸锌螯合物X (结构为如图)易被人体吸收。
①X中元素(除H外)的第一电离能由小到大的顺序为 , 加“*”氧原子的杂化方式为。
②X的晶体中存在的微粒间作用力有.。
A.离子键 B.π键 C.金属键 D.配位键 E.非极性键
③L-赖氨酸易溶于水主要原因是。
(2)、某锌铁氧体[化学式为ZnxFe(III)yOz]制成的磁芯被广泛用于电子行业。①组成微粒的原子(或离子)中存在未成对电子,该微粒具有顺磁性。指出锌铁氧体晶体中具有顺磁性的离子,并说明理由。
②锌铁氧体晶胞结构如图所示,该晶胞由4个A型和4个B型小立方体构成。锌铁氧体的化学式为。
 24. 元素周期表中第VIIA族元素包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At),简称卤素。卤素及其化合物在生产生活中的应用非常广泛。回答下列问题:(1)、氯原子的核外电子排布式为。(2)、为了延长液氯的杀菌时间,某些自来水厂在用液氯进行消毒处理时还加入了液氨,其反应的化学方程式为NH3+HClO=H2O+NH2Cl,其中N、O、H的电负性由小到大的顺序为(用元素符号表示);HClO中氧原子的杂化方式为:NH3分子的VSEPR模型为;在水和苯两种溶剂中,NH2Cl更易溶于。(3)、卤素单质的化学键的键参数如表所示:
24. 元素周期表中第VIIA族元素包括氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At),简称卤素。卤素及其化合物在生产生活中的应用非常广泛。回答下列问题:(1)、氯原子的核外电子排布式为。(2)、为了延长液氯的杀菌时间,某些自来水厂在用液氯进行消毒处理时还加入了液氨,其反应的化学方程式为NH3+HClO=H2O+NH2Cl,其中N、O、H的电负性由小到大的顺序为(用元素符号表示);HClO中氧原子的杂化方式为:NH3分子的VSEPR模型为;在水和苯两种溶剂中,NH2Cl更易溶于。(3)、卤素单质的化学键的键参数如表所示:化学键
F-F
Cl-Cl
Br-Br
I-I
键长/pm
141
198
228
267
键能/(kJ·mol-1)
157
242.7
193.7
152.7
从物质结构角度分析,F—F键的键能反常的原因是。
(4)、AgCl的晶胞与NaCl的类似,AgCl的晶胞结构如图所示,已知晶胞边长为 a pm,则晶胞内Ag+的配位数为 , 晶胞的6个面心围成的正八面体的边长为pm,设阿伏加德罗常数的值为NA , 则该晶体的密度为(列出计算表达式)g·cm-3。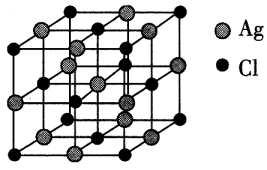 25. 磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷一石墨复合负极材料,其单层结构俯视图如图2所示。
25. 磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷一石墨复合负极材料,其单层结构俯视图如图2所示。
回答下列问题:
(1)、Li、C、P三种元素中,电负性最小的是(用元素符号作答)。(2)、基态磷原子的电子排布式为;第三周期中第一电离能比P大的元素有种。(3)、图2中,黑磷区P原子的杂化方式为;石墨区C原子的杂化方式为。(4)、P和B的溴化物在水中的溶解度PBr3BBr3(填“>”或“<”),原因是。(5)、根据图1和图2的信息,下列说法正确的有____(填字母)。A、黑磷区P-P键的键能不完全相同 B、黑磷与石墨都属于混合型晶体 C、由石墨与黑磷制备该复合材料的过程是物理变化 D、复合材料单层中,P原子与C原子之间的作用力属范德华力(6)、贵金属磷化物Rh2P可用作电解水的高效催化剂,其立方晶胞如下图所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为 , 晶体的密度为g·cm-3(列出计算式)。 26. 氮化镓(CaN)、碳化硅(SiC)是第三代半导体材料。(1)、基态Ga原子的核外电子排布式为。Ga、N和O的第一电离能由小到大的顺序为。(2)、GaCl3的熔点为77.9℃,气体在270℃左右以二聚物存在,CaF3的熔点为1000℃;GaCl3的熔点低于GaF3的原因为。(3)、GaCl3·xNH3(x=3,4,5,6)是一系列化合物,向含1molGaCl3·xNH3的溶液中加入足量AgNO3溶液,有难溶于稀硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1:2。
26. 氮化镓(CaN)、碳化硅(SiC)是第三代半导体材料。(1)、基态Ga原子的核外电子排布式为。Ga、N和O的第一电离能由小到大的顺序为。(2)、GaCl3的熔点为77.9℃,气体在270℃左右以二聚物存在,CaF3的熔点为1000℃;GaCl3的熔点低于GaF3的原因为。(3)、GaCl3·xNH3(x=3,4,5,6)是一系列化合物,向含1molGaCl3·xNH3的溶液中加入足量AgNO3溶液,有难溶于稀硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1:2。①NH3的VSEPR模型名称为。
②能准确表示GaCl3·xNH3结构的化学式为。
(4)、与镓同主族的硼(B)具有缺电子性,硼砂(四硼酸钠Na2B4O7·10H2O)中B4O是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应写成[B4O5(OH)4]2-的形式,结构如下图所示,则该离子中存在的作用力含有(填序号),B原子的杂化方式为。
A.离子键 B.极性键 C.氢键 D.范德华力 E.配位键
(5)、氮化镓的晶胞如图所示,Ga原子与N原子半径分别为apm和bpm,阿伏加德罗常数的值为NA , 晶胞密度为cg/cm3 , 则该晶胞的空间利用率为(已知空间利用率为晶胞内原子体积占晶胞体积的百分比)。 27. 材料的发展水平始终是时代进步和人类文明的标志。当前含铁的磁性材料在国防、电子信息等领域中具有广泛应用。请回答下列问题:(1)、基态铁原子的价电子排布图为 , 基态铁原子核外电子的空间运动状态有种, 其处在最高能层的电子的电子云形状为。(2)、一种新研发出的铁磁性材料M的分子结构如图1所示。
27. 材料的发展水平始终是时代进步和人类文明的标志。当前含铁的磁性材料在国防、电子信息等领域中具有广泛应用。请回答下列问题:(1)、基态铁原子的价电子排布图为 , 基态铁原子核外电子的空间运动状态有种, 其处在最高能层的电子的电子云形状为。(2)、一种新研发出的铁磁性材料M的分子结构如图1所示。
①M分子中C、N、O三种元素的电负性由大到小的顺序为。
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为(填序号)。
A.sp2 B.sp3 C.dsp2 D.d2sp3
③分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π), 则M分子中由碳、氧组成的五元环中的大π键应表示为。
(3)、铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如图2所示。
①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为。
②该化合物的化学式为 , 若晶胞中距离最近的铁原子和氮原子的距离为apm,阿伏加德罗常数的值为NA , 则该晶胞的密度为g·cm-3 (列出计算式即可)。
28. 2020年,自修复材料、自适应材料、新型传感材料等智能材料技术大量涌现,为生物医疗、国防军事以及航空航天等领城发展提供支撑。(1)、我国科研工作者基于丁二酮肟氨酯基团的多重反应性,研制了一种强韧、自愈的超级防护材料,其中的分子机制如图所示。
Cu在元素周期表中位于区,M层中核外电子能量最高的电子云在空间有个伸展方向。C、N、O第一电离能由大到小的顺序为。
(2)、氧化石墨烯基水凝胶是一类新型复合材料,对氧化石墨烯进行还原可得到还原氧化石墨烯,二者的结构如图所示:
还原石墨烯中碳原子的杂化方式是 , 上图中氧化石墨烯转化为还原石墨烯时,1号C与其相邻C原子间键能的变化是(填“变大”“变小”或“不变”),二者当中在水溶液中溶解度更大的是 (填物质名称) ,原因为。
(3)、砷化硼是近期受到广泛关注的一种III- V 半导体材料。砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:B:(0,0,0);( , , 0);( , 0,);(0, , )
As:( , , );( , , );( , , );( , , )
请在图中画出砷化硼晶胞的俯视图 , 已 知晶体密度为d g/cm3 ,As半径为a pm,假设As、B原子相切,则B原子的半径为 pm(写计算表达式)。
 29. FeSe基超导体是近几年发现并研究的一种新型材料。(1)、基态Se原子的价电子排布式为。基态离子核外电子云轮廓图呈哑铃形的能级上共有个电子。(2)、四氟化铌()的熔点(72℃)低于的熔点(1000℃)的原因可能是。(3)、硝普钠()可用于治疗急性心率衰竭。
29. FeSe基超导体是近几年发现并研究的一种新型材料。(1)、基态Se原子的价电子排布式为。基态离子核外电子云轮廓图呈哑铃形的能级上共有个电子。(2)、四氟化铌()的熔点(72℃)低于的熔点(1000℃)的原因可能是。(3)、硝普钠()可用于治疗急性心率衰竭。①硝普钠中不存在的作用力有(填序号)。
a.离子键 b.金属键 c.配位键 d.极性共价键 e.非极性共价键 f.氢键
②C、N、O三种元素中,由其中两种元素按原子个数比为1:3组成的常见阴离子的空间构型为。
(4)、金属锂溶于液氨时发生反应: , 得到反应活性很高的金属电子溶液,则X的化学式为。液氨存在自耦电离 , 则三种微粒的键角由大到小的顺序为。(5)、Li、Fe、Se可形成新型超导材料,晶胞如图所示:
①该晶体的化学式为。
②已知晶胞参数如图所示,晶胞棱边夹角均为90°,设阿伏加德罗常数的值为 , 相对分子质量为M,侧晶体的密度为(列式表示)。
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。Li原子①的坐标为 , Se原子②的坐标为 , Se原子③的坐标为 , 则Fe原子④的坐标为;Fe原子的配位数为。
30. 目前已经确认了16种元素是植物生长所必需的,其中硼、铁、铜、钼等7种元素为必需的微量元素。回答下列问题:(1)、钼位于第5周期与Cr同族,试写出钼的基态价电子排布式 , 钼位于周期表第纵行。(2)、铁元素能与多种分子或离子形成配位键,如[FeCl2(H2O)4]+、Fe(CO)5。①[FeCl2(H2O)4]+中每个H2O的O周围σ键电子对有对,游离态的水中H-O-H的键角比该配离子中H-O-H的键角小,其原因是。
②CO分子中C原子和O原子,上均存在孤电子对,在Fe(CO)5中(填元素符号)更容易为Fe提供孤电子对。
(3)、硼氢化钠(NaBH4)具有很强的还原性,常用于有机合成,的VSEPR模型为与其互为等电子体的阳离子有(写一种)。(4)、一种铜的溴化物立方晶胞如图所示。
该化合物的化学式为 , 在晶体中与Br紧邻的Br有个,若Cu原子与最近的Br原子的核间距为apm,则该晶体的密度计算表达式为g·cm-3(用NA表示阿伏加德罗常数的值)。