高考二轮复习知识点:晶胞的计算3
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是( )
 A、的配位数为6 B、与距离最近的是 C、该物质的化学式为 D、若换为 , 则晶胞棱长将改变2. 锂电池负极材料为Li嵌入两层石墨层中,形成如图所示的晶胞结构。下列说法中正确的是
A、的配位数为6 B、与距离最近的是 C、该物质的化学式为 D、若换为 , 则晶胞棱长将改变2. 锂电池负极材料为Li嵌入两层石墨层中,形成如图所示的晶胞结构。下列说法中正确的是 A、该负极材料的摩尔质量为79 B、碳原子的杂化方式为杂化 C、Li的配位数为8 D、晶胞中Li与C原子个数比为1:63. 锂电池负极材料为Li嵌入两层石墨层中,形成如图所示的晶胞结构。下列说法中正确的是
A、该负极材料的摩尔质量为79 B、碳原子的杂化方式为杂化 C、Li的配位数为8 D、晶胞中Li与C原子个数比为1:63. 锂电池负极材料为Li嵌入两层石墨层中,形成如图所示的晶胞结构。下列说法中正确的是 A、晶胞中Li与C原子个数比为1:6 B、Li的配位数为8 C、碳原子的杂化方式为杂化 D、该负极材料的摩尔质量为794. 我国科学家在相当于110万大气压下合成了一种稳定的氦钠化合物,为人类在木星和土星洞察化学过程提供了机会,结构如图所示,小球代表Na+ , 大正方体代表He,小正方体代表共用电子,共用电子被迫集中在晶体结构的立方空间内,下列说法正确的是
A、晶胞中Li与C原子个数比为1:6 B、Li的配位数为8 C、碳原子的杂化方式为杂化 D、该负极材料的摩尔质量为794. 我国科学家在相当于110万大气压下合成了一种稳定的氦钠化合物,为人类在木星和土星洞察化学过程提供了机会,结构如图所示,小球代表Na+ , 大正方体代表He,小正方体代表共用电子,共用电子被迫集中在晶体结构的立方空间内,下列说法正确的是 A、该物质属于一种新型合金 B、晶胞中的空隙He占有率为50% C、Na+的配位数为8 D、Na+-He之间的最短距离为a (设晶胞棱长为a)5. 硫化锌是一种优良的宽带隙半导体锂离子电池负极材料,具有在充电的同时合金化反应的特点。在充电过程中负极材料晶胞的组成变化如图所示。
A、该物质属于一种新型合金 B、晶胞中的空隙He占有率为50% C、Na+的配位数为8 D、Na+-He之间的最短距离为a (设晶胞棱长为a)5. 硫化锌是一种优良的宽带隙半导体锂离子电池负极材料,具有在充电的同时合金化反应的特点。在充电过程中负极材料晶胞的组成变化如图所示。
下列说法正确的是
A、当1 mol 完全转化为时,转移电子数为2 mol B、在体对角线的一维空间上会出现“ ”的排布规律
C、当完全转化为时,每转移6 mol电子,生成3 mol LiZn(合金相)
D、若的晶胞参数为a nm,则EF间的距离为nm
6. 砷化镉晶胞结构如图。图中“①”和“②”位是“真空”,晶胞参数为apm,建立如图的原子坐标系,①号位的坐标为( , , )。已知:砷化镉的摩尔质量为Mg/mol,NA为阿伏加德罗常数的值。下列说法错误的是( )
”的排布规律
C、当完全转化为时,每转移6 mol电子,生成3 mol LiZn(合金相)
D、若的晶胞参数为a nm,则EF间的距离为nm
6. 砷化镉晶胞结构如图。图中“①”和“②”位是“真空”,晶胞参数为apm,建立如图的原子坐标系,①号位的坐标为( , , )。已知:砷化镉的摩尔质量为Mg/mol,NA为阿伏加德罗常数的值。下列说法错误的是( ) A、砷化镉中Cd与As原子个数比为3:2 B、两个Cd原子间最短距离为0.5apm C、③号位原子坐标参数为( , 1,) D、该晶胞的密度为g·cm-37. 磷锡青铜合金广泛用于仪器仪表中的耐磨零件和抗磁元件等。其晶胞结构如图所示。已知晶胞参数为apm下列说法错误的是( )
A、砷化镉中Cd与As原子个数比为3:2 B、两个Cd原子间最短距离为0.5apm C、③号位原子坐标参数为( , 1,) D、该晶胞的密度为g·cm-37. 磷锡青铜合金广泛用于仪器仪表中的耐磨零件和抗磁元件等。其晶胞结构如图所示。已知晶胞参数为apm下列说法错误的是( ) A、磷锡青铜的化学式为 B、该晶胞中与Cu原子等距离且最近的Sn原子有4个 C、三种元素Cu、Sn、P在元素周期表中分别处于d区、p区、p区 D、Sn和P原子间的最短距离为pm8. 药物异博定(盐酸维拉帕米)能有效控制血压升高、促进血液循环,其合成路线中有如图转化过程:
A、磷锡青铜的化学式为 B、该晶胞中与Cu原子等距离且最近的Sn原子有4个 C、三种元素Cu、Sn、P在元素周期表中分别处于d区、p区、p区 D、Sn和P原子间的最短距离为pm8. 药物异博定(盐酸维拉帕米)能有效控制血压升高、促进血液循环,其合成路线中有如图转化过程:
已知NaH与NaCl的晶体结构相似。下列说法正确的是( )
A、NaH晶体中,Na+的配位数是12 B、X的沸点低于其同分异构体 C、Y中溴元素位于元素周期表的d区
D、Z中碳原子有三种杂化方式
9. 用低品铜矿(主要含CuS、FeO)制备Cu2O的一种工艺流程如下:
C、Y中溴元素位于元素周期表的d区
D、Z中碳原子有三种杂化方式
9. 用低品铜矿(主要含CuS、FeO)制备Cu2O的一种工艺流程如下:

下列说法正确的是( )
A、“酸浸”过程中CuS发生反应的离子方程式为: S2-+MnO2+4H+Mn2++S+2H2O B、“酸浸”所得溶液中的阳离子主要有H+、Mn2+、Cu2+和Fe2+ C、1个Cu2O晶胞(如图)中含4个氧原子 D、水合肼浓度过大,Cu2O产率下降,可能的原因是Cu2O进一步被还原成单质铜10. 在气体分析中,常用的盐酸溶液吸收并定量测定CO的含量。某工艺通过如图流程制备氯化亚铜固体(已知容易被氧化):
下列说法正确的是( )
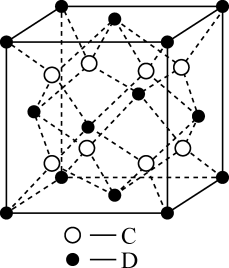
A、步骤①中不可用稀硫酸代替稀盐酸,步骤②中作为氧化剂 B、步骤③中用水溶液洗涤更有效,若洗涤液不含 , 则沉淀已洗净 C、晶胞结构如图所示,每个氯离子周围与之距离最近的氯离子数目为4 D、若晶胞的参数为 , 则晶胞的密度11. 某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。已知该晶体的密度为 , 阿伏加德罗常数的值为 , 下列说法中错误的是( )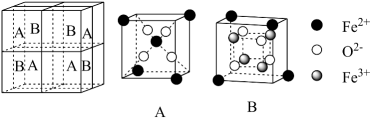 A、该铁的氧化物化学式为 B、距离Fe3+最近的有6个 C、晶体中的只能构成正四面体空隙 D、晶胞的边长为
A、该铁的氧化物化学式为 B、距离Fe3+最近的有6个 C、晶体中的只能构成正四面体空隙 D、晶胞的边长为二、多选题
-
12. 近日,科学家研究利用CaF2晶体释放出的Ca2+和F-脱除硅烷,拓展了金属氟化物材料的生物医学功能。下列说法错误的是( )
 A、F、Si和Ca,原子半径依次增大 B、SiO2与OF2的晶体类型及氧原子的杂化方式均相同 C、图中A处原子分数坐标为(0,0,0),则B处原子分数坐标为( , , ) D、脱除硅烷反应速率依赖于晶体提供自由氟离子的能力,脱硅能力BaF2<CaF2<MgF213. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、46g C2H6O完全燃烧,共有8NA个共价键断裂 B、1mol雄黄(主要成分为As4S4 , 结构为
A、F、Si和Ca,原子半径依次增大 B、SiO2与OF2的晶体类型及氧原子的杂化方式均相同 C、图中A处原子分数坐标为(0,0,0),则B处原子分数坐标为( , , ) D、脱除硅烷反应速率依赖于晶体提供自由氟离子的能力,脱硅能力BaF2<CaF2<MgF213. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、46g C2H6O完全燃烧,共有8NA个共价键断裂 B、1mol雄黄(主要成分为As4S4 , 结构为 )中含有6NA个S-As键
C、32g S8(
)中含有6NA个S-As键
C、32g S8(  )与S6(
)与S6(  )的混合物中所含共价键数目为2NA
D、NaCl晶体中Na+与最近Cl-的核间距离为a cm,则其晶体密度为 g·cm-3
14. 铁有δ、γ、α三种同素异形体,其晶胞结构如图所示,设 为阿伏加德罗常数的值。
)的混合物中所含共价键数目为2NA
D、NaCl晶体中Na+与最近Cl-的核间距离为a cm,则其晶体密度为 g·cm-3
14. 铁有δ、γ、α三种同素异形体,其晶胞结构如图所示,设 为阿伏加德罗常数的值。


下列说法正确的是( )
A、 晶胞中含有2个铁原子,每个铁原子等距离且最近的铁原子有8个 B、晶体的空间利用率: C、 晶胞中的原子堆积方式为六方最密堆积 D、铁原子的半径为 ,则 晶胞的密度为15. 高温下,某金属氧化物的晶体结构如图所示。其中氧的化合价可看作部分为0价、部分为-2价。下列有关说法中正确的是( ) A、元素A可能位于元素周期表第IA族 B、该离子晶体的化学式是A2O2 C、晶体中A+等距且最近的A+有12个 D、晶体中,0价氧原子与-2价氧原子的数目比为1:116. 已知 的熔点为2700℃,其晶胞结构如图所示。下列说法错误的是( )
A、元素A可能位于元素周期表第IA族 B、该离子晶体的化学式是A2O2 C、晶体中A+等距且最近的A+有12个 D、晶体中,0价氧原子与-2价氧原子的数目比为1:116. 已知 的熔点为2700℃,其晶胞结构如图所示。下列说法错误的是( ) A、 晶体中碳原子和硅原子均采用 杂化 B、硅单质的熔点高于2700℃ C、距离硅原子最近的硅原子数为4 D、若晶胞参数为 ,则该晶体的密度为
A、 晶体中碳原子和硅原子均采用 杂化 B、硅单质的熔点高于2700℃ C、距离硅原子最近的硅原子数为4 D、若晶胞参数为 ,则该晶体的密度为三、非选择题
-
17. 工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为:。回答下列问题:(1)、合成氨反应在常温下(填“能”或“不能”)自发。(2)、温(填“高”或“低”,下同)有利于提高反应速率,温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用。
针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
(3)、方案一:双温-双控-双催化剂。使用双催化剂,通过光辐射产生温差(如体系温度为时,的温度为 , 而的温度为)。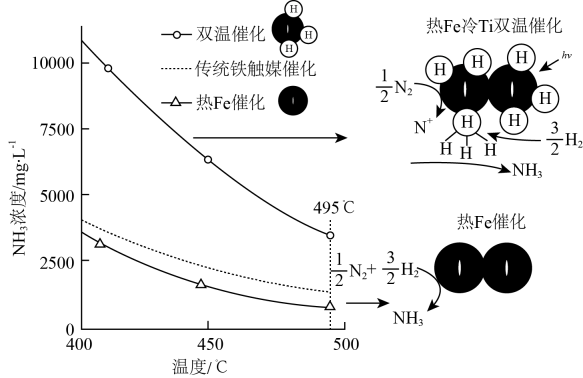
下列说法正确的是。
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率
(4)、方案二:复合催化剂。
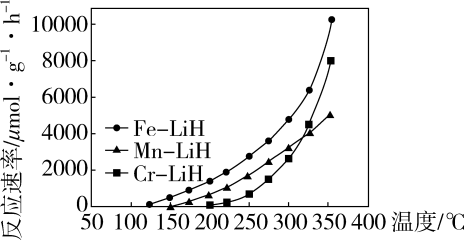
下列说法正确的是。
a.时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
(5)、某合成氨速率方程为: , 根据表中数据,;实验
1
m
n
p
q
2
2m
n
p
2q
3
m
n
0.1p
10q
4
m
2n
p
2.828q
在合成氨过程中,需要不断分离出氨的原因为。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率
(6)、某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为 , 则M元素为(填元素符号);在该化合物中,M离子的价电子排布式为。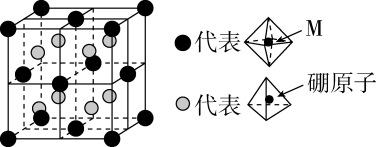 18. 【选修3:物质结构与性质】
18. 【选修3:物质结构与性质】含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)、基态S原子的价电子中,两种自旋状态的电子数之比为。(2)、Cu与Zn相比,第二电离能与第一电离能差值更大的是 , 原因是。(3)、SnCl的几何构型为 , 其中心离子杂化方式为。(4)、将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是____(填标号)。A、[Cu(NH3)2]Cl B、[Cu(NH3)4]SO4 C、[Zn(NH3)4]SO4 D、Na2[Zn(OH)4](5)、如图是硫的四种含氧酸根的结构:A.
 B.
B. C.
C. D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO的是(填标号),理由是。
(6)、如图是CZTS四元半导体化合物的四方晶胞。
①该物质的化学式为。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为( , , ),则B原子的坐标为。
19. 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:(1)、基态Na原子的价层电子轨道表示式为。(2)、NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na,电解反应方程式: , 加入的目的是。(3)、的电子式为。在25℃和101kPa时,Na与反应生成1mol 放热510.9kJ,写出该反应的热化学方程式:。(4)、采用空气和Na为原料可直接制备。空气与熔融金属Na反应前需依次通过、(填序号)a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.溶液
(5)、钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为。 (6)、天然碱的主要成分为 , 1mol 经充分加热得到的质量为g。20. 【选考题】配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。
(6)、天然碱的主要成分为 , 1mol 经充分加热得到的质量为g。20. 【选考题】配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。 (1)、基态Zn2+的电子排布式为。(2)、L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为形;每个L2-中采取sp2杂化的C原子数目为个,C与O之间形成σ键的数目为个。(3)、X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入____。(假设X晶胞形状不变)。A、-Cl B、-OH C、-NH2 D、-CH3(4)、X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
(1)、基态Zn2+的电子排布式为。(2)、L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为形;每个L2-中采取sp2杂化的C原子数目为个,C与O之间形成σ键的数目为个。(3)、X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入____。(假设X晶胞形状不变)。A、-Cl B、-OH C、-NH2 D、-CH3(4)、X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
①晶胞中与同一配体相连的两个[Zn4O]6+的不同之处在于。
②X晶体中Zn2+的配位数为。
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为nm。
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA , L2-与[Zn4O]6+的相对分子质量分别为M1和M2 , 则X的晶体密度为g•cm-3(列出化简的计算式)。
21. 中国科学家于嫦娥五号月壤的玄武岩碎屑中发现的“嫦娥石”,是一种磷酸盐矿物,其理想化学式为(Ca8Y)□Fe(PO4)7(“□”表示晶体存在缺陷)。请回答:
(1)、基态Fe2+价层电子的轨道表示式为。(2)、的空间结构为 , 其中P采取杂化方式;能与Fe3+形成无色的[Fe(PO4)2]3− , 其中与Fe3+配位的原子是(填元素符号)。(3)、PCl5是白色晶体,其晶胞结构如图所示。
PCl5熔融时形成一种能导电的液体。
①若晶胞边长为apm,阿伏加德罗常数的值为NA , 晶体的密度为g/cm3(列出计算式,1pm=1×10−10cm)。
②经测定,该晶体中P-Cl的键长只有198pm和206pm两种,写出P-Cl键长为206pm的粒子的化学式。
22. Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用,请回答下列问题:(1)、Fe元素属于元素周期表的 区(填分区)(2)、基态Ni2+核外电子排布式为。(3)、鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M的结构如图甲所示。
①组成M的5中元素中,除H元素外,另外4种元素第一电离能由大到小的顺序为(填元素符号),其中C原子的杂化类型为。
②图中各微粒不存在的作用力有 ( 填标号)
a. 极性键 b.非极性键 c. 配位键
d. π键 e.离子键 f.氢键
(4)、一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图乙所示。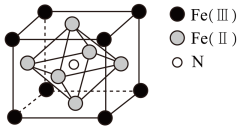
①铁氮化合物的化学式为。
②在该晶胞结构的另一种表示中,N处于顶点位置,则铁处于、位置
③若该化合物密度为pg·cm-3 , 用NA表示阿伏加德罗常数,则由Fe( II )构成的正八面体的体积为cm3
23. 钾离子电池以其优异的性能成为替代锂离子电池的一种选择,该电池的负极是由钾嵌入石墨中构成,正极主要含、铝箔、醚类有机物等。从某废旧钾离子电池中回收部分材料的流程如下:
已知:I.放电时负极的电极反应式为;
II.常温下, , 当溶液中某离子浓度低于时,认为该离子已沉淀完全。
回答下列问题:
(1)、废旧电池放电处理的原因为。(2)、“碱浸”时发生的化学反应方程式为。(3)、已知中的铁为+3价,则“酸溶”时主要反应的离子方程式为;该工序中温度需控制在40℃的原因为。(4)、若最终调节pH=3,则所得母液中的(填“已”或“未”)沉淀完全。(5)、实验室中从“反萃取”所得混合液中分离出溶液的操作名称为。(6)、废旧钾离子电池放电处理并拆解后,从负极得到石墨,其结构如图。石墨两层之间最近碳原子间距远大于层内最近碳原子间距的原因为;设阿伏加德罗常数的值为 , 则石墨晶体密度为(列式即可)。 24. 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、钴、硼、镓、硒等。已知铜的配合物A结构如图。请回答下列问题:
24. 太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、钴、硼、镓、硒等。已知铜的配合物A结构如图。请回答下列问题: (1)、基态二价铜离子的核外电子排布式为 , 已知高温下Cu2O比CuO更稳定,试从核外电子排布角度解释。(2)、配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2 , N2中σ键和π键数目之比是。(3)、硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的原因是。(4)、立方氮化硼(结构如图)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为。
(1)、基态二价铜离子的核外电子排布式为 , 已知高温下Cu2O比CuO更稳定,试从核外电子排布角度解释。(2)、配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2 , N2中σ键和π键数目之比是。(3)、硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的原因是。(4)、立方氮化硼(结构如图)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为。 (5)、六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构、硬度与金刚石相似,其晶胞如图,晶胞边长为apm,立方氮化硼的密度是g·cm-3(只列算式,NA为阿伏加德罗常数的值)。
(5)、六方氮化硼晶体结构与石墨晶体相似,层间相互作用力为。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构、硬度与金刚石相似,其晶胞如图,晶胞边长为apm,立方氮化硼的密度是g·cm-3(只列算式,NA为阿伏加德罗常数的值)。 25. 研究发现,过量摄入铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺病变。试回答下列问题:(1)、Fe也是人体需要补充的元素之一,写出Fe3+的核外电子排布式:。(2)、与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能由大到小的顺序是。(3)、氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上获取铝单质不是电解熔融氯化铝,而是电解熔融氧化铝,原因是;为降低熔点和增强导电性,电解熔融氧化铝时通常要加入Na3AlF6(冰晶石),Na3AlF6中含有的化学键类型有(填字母)。
25. 研究发现,过量摄入铝元素能损害人的脑细胞。适当地补充碘元素可预防甲状腺肿大,但摄入过多也会导致甲状腺病变。试回答下列问题:(1)、Fe也是人体需要补充的元素之一,写出Fe3+的核外电子排布式:。(2)、与Al同一周期的Na、Mg元素也是人体所需元素,Na、Mg、Al基态原子第一电离能由大到小的顺序是。(3)、氯化铝的熔点是194℃,氧化铝的熔点是2054℃,但是工业上获取铝单质不是电解熔融氯化铝,而是电解熔融氧化铝,原因是;为降低熔点和增强导电性,电解熔融氧化铝时通常要加入Na3AlF6(冰晶石),Na3AlF6中含有的化学键类型有(填字母)。A.离子键 B.金属键 C.氢键 D.配位键
(4)、F与I是同一主族的元素,BF3与H3O+都是由四个原子构成的粒子,两种粒子的中心原子B和O的杂化方式分别为、 , BF3的空间构型是 , H3O+的空间构型是。(5)、I2晶体的晶胞结构如图所示,该晶胞中含有I原子的数目为 , 已知该晶胞的晶胞参数为apm、bpm和cpm,则I2晶体的密度是g/cm3。(列出最简表达式,用NA表示阿伏加德罗常数的值) 26. 铁在史前就为人们所知,铁及其化合物推动了人类文明的发展。回答下列问题:(1)、Fe元素位于元素周期表的区,基态Fe2+的核外电子排布式为。(2)、复盐NH4Fe(SO4)2·12H2O俗称铁铵矾,可用于鞣革。铁铵矾中,所含N、O、S三种非金属元素第一电离能由小到大的顺序是 , 阴离子的空间构型为。的键角比NH3的键角(填“大”或“小”)。(3)、三价铁的强酸盐溶于水后经水解可以生成如图所示的二聚体,其中Fe3+的配位数为 , 过渡元素的s、p、d轨道可以参与杂化,含s、p、d轨道的杂化类型有:①dsp2、 ②sp3d、③sp3d2 , 该二聚体中Fe采取的杂化类型为(填标号)。
26. 铁在史前就为人们所知,铁及其化合物推动了人类文明的发展。回答下列问题:(1)、Fe元素位于元素周期表的区,基态Fe2+的核外电子排布式为。(2)、复盐NH4Fe(SO4)2·12H2O俗称铁铵矾,可用于鞣革。铁铵矾中,所含N、O、S三种非金属元素第一电离能由小到大的顺序是 , 阴离子的空间构型为。的键角比NH3的键角(填“大”或“小”)。(3)、三价铁的强酸盐溶于水后经水解可以生成如图所示的二聚体,其中Fe3+的配位数为 , 过渡元素的s、p、d轨道可以参与杂化,含s、p、d轨道的杂化类型有:①dsp2、 ②sp3d、③sp3d2 , 该二聚体中Fe采取的杂化类型为(填标号)。 (4)、三种化合物的熔点如下表所示:
(4)、三种化合物的熔点如下表所示:化合物
FeCl3
NaCl
MgO
熔点/℃
308
801
2852
试解释其熔点差异的原因:。
(5)、铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某立方FexNy的晶胞如图所示,晶胞参数为apm,该晶体密度为g·cm-3 (设NA为阿伏加德罗常数的值,写出表达式),Cu完全替代该晶体中b位置Fe,形成Cu替代型产物Fe(x-n)CunNy , n:y=。 27. KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:(1)、在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是(填离子符号)。(2)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为。(3)、已知有关氨、磷的单键和三键的键能(kJ•mol-1)如表:
27. KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:(1)、在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是(填离子符号)。(2)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为。(3)、已知有关氨、磷的单键和三键的键能(kJ•mol-1)如表:N—N
N≡N
P—P
P≡P
193
946
197
489
从能量角度看,氮以N2、而白磷以P4(结构式可表示为
 )形式存在的原因是。(4)、已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 , 其中P采取杂化方式。(5)、与PO电子总数相同的等电子体的分子式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如:
)形式存在的原因是。(4)、已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 , 其中P采取杂化方式。(5)、与PO电子总数相同的等电子体的分子式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如:
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。
(7)、分别用○、●表示H2PO和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA , 晶体的密度g•cm-3(写出表达式)。
②晶胞在x轴方向的投影图为 (填标号)。
 28. 碳族元素在生产生活中的应用极其广泛,请回答以下有关碳族元素的问题。(1)、Si位于周期表的区, 基态Si原子含有个未成对电子,其核外电子有种空间运动状态。(2)、甲醇重整制氢反应中,铜基催化剂(CuO/SiO2)具有重整温度低、催化选择性高等优点。Cu、Si、O三种元素的电负性由大到小的顺序是。(3)、锡(Sn)是人类最早使用的元素之一,化合物SnCl4常温下为无色液体,它的晶体类型是 , 属于(填“极性分子”或“非极性分子”),与SnCl4互为等电子体的阴离子(写一种)。(4)、C16S8是新型环烯类储氢材料,研究证明其分子呈平面结构(如图1所示)。
28. 碳族元素在生产生活中的应用极其广泛,请回答以下有关碳族元素的问题。(1)、Si位于周期表的区, 基态Si原子含有个未成对电子,其核外电子有种空间运动状态。(2)、甲醇重整制氢反应中,铜基催化剂(CuO/SiO2)具有重整温度低、催化选择性高等优点。Cu、Si、O三种元素的电负性由大到小的顺序是。(3)、锡(Sn)是人类最早使用的元素之一,化合物SnCl4常温下为无色液体,它的晶体类型是 , 属于(填“极性分子”或“非极性分子”),与SnCl4互为等电子体的阴离子(写一种)。(4)、C16S8是新型环烯类储氢材料,研究证明其分子呈平面结构(如图1所示)。
图1
①C16S8分子中C原子和S原子的杂化轨道类型分别为、。
②测得C16S8中碳硫键的键长介于C-S键和C=S键之间,其原因可能是。
(5)、锗(Ge)是典型的半导体材料,在电子、材料等领域应用广泛。锗单晶的晶胞结构如图2所示,其晶胞参数为apm,阿伏加德罗常数的值为NA , 则晶体密度为g·cm-3(列出计算式即可)。 29. 磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷-石墨复合负极材料,其单层结构俯视图如图2所示。
29. 磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷-石墨复合负极材料,其单层结构俯视图如图2所示。
回答下列问题:
(1)、Li 、C、P三种元素中,电负性最小的是(用元素符号作答)。(2)、基态磷原子的电子排布式为。(3)、图2中,黑磷区P原子的杂化方式为 , 石墨区C原子的杂化方式为。(4)、氢化物PH3、CH4、NH3的沸点最高的是 , 原因是。(5)、根据图1和图2的信息,下列说法正确的有(填字母)。a.黑磷区P- P键的键能不完全相同
b.黑磷与石墨都属于混合型晶体
c.复合材料单层中,P原子与C原子之间的作用力属范德华力
(6)、LiPF6、LiAsF6.等也可作为聚乙二醇锂离子电池的电极材料。电池放电时, Li+沿聚乙二醇分子中的碳氧链向正极迁移的过程如图所示(图中阴离子未画出)。
①从化学键角度看, Li+迁移过程发生(填“物理”或“化学” )变化。
②相同条件下,电极材料( 填“LiPF6”或“LiAsF6”)中的Li+迁移较快,原因是。
(7)、贵金属磷化物Rh2P(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图3所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为 , 晶体的密度为g·cm-3(列出计算式)。
图3
30. 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个电子;C的基态原子2p能级有1个电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:(1)、写出基态E原子的价电子排布式。基态A原子的第I电离能比B的大,其原因是。(2)、B元素的氢化物的沸点是同族元素氢化物中最高的,原因是。(3)、A的最简单氢化物分子的空间构型为 , 其中A原子的杂化类型是。(4)、向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。①该蓝色晶体的化学式为 , 加入乙醇的目的是。
②写出该配合物中配离子的结构简式。
(5)、C和D形成的化合物的晶胞结构如图所示,则D的配位数是 , 已知晶体的密度为ρg·cm-3 , 阿伏加德罗常数为NA , 求晶胞边长a=cm(含用ρ、NA的计算式表示)。