高考二轮复习知识点:晶胞的计算2
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 一种钴的氧化物在纳米储能领域研究广泛,其晶胞结构如图所示(白球为Co,黑球为O),已知该晶胞参数为 , 阿伏加德罗常数为。下列说法错误的是
 A、该晶体的化学式为CoO B、基态Co原子有3个未成对电子 C、与O原子最近且等距离的O原子有12个 D、氧化物的摩尔体积2. 设为阿伏加德罗常数的值,下列叙述正确的是
A、该晶体的化学式为CoO B、基态Co原子有3个未成对电子 C、与O原子最近且等距离的O原子有12个 D、氧化物的摩尔体积2. 设为阿伏加德罗常数的值,下列叙述正确的是 A、中含有的配位键数为22NA B、铬晶胞如图所示,铬能切割成如图晶胞的数目为NA C、参与氧化还原反应时,转移的电子数一定为2NA D、溶液中含有的数为0.1NA3. 一种钙镁矿的四方晶胞结构如图所示。已知该晶胞的参数为apm、apm、bpm,1号原子的坐标为( , , ),下列说法错误的是
A、中含有的配位键数为22NA B、铬晶胞如图所示,铬能切割成如图晶胞的数目为NA C、参与氧化还原反应时,转移的电子数一定为2NA D、溶液中含有的数为0.1NA3. 一种钙镁矿的四方晶胞结构如图所示。已知该晶胞的参数为apm、apm、bpm,1号原子的坐标为( , , ),下列说法错误的是 A、2号原子的坐标为( , , ) B、距离硫原子最近的硫原子数目为4 C、硫原子的配位数为4 D、该晶体的密度为g/cm34. 砷化镓是一种立方晶系如图甲所示,将Mn掺杂到晶体中得到稀磁性半导体材料如图乙所示,砷化镓的晶胞参数为x pm,密度为。下列说法错误的是
A、2号原子的坐标为( , , ) B、距离硫原子最近的硫原子数目为4 C、硫原子的配位数为4 D、该晶体的密度为g/cm34. 砷化镓是一种立方晶系如图甲所示,将Mn掺杂到晶体中得到稀磁性半导体材料如图乙所示,砷化镓的晶胞参数为x pm,密度为。下列说法错误的是
 A、砷化镓中配位键的数目是 B、Ga和As的最近距离是 C、沿体对角线a→b方向投影图如丙,若c在11处,则As的位置为7、9、11、13 D、Mn掺杂到砷化镓晶体中,和Mn最近且等距离的As的数目为65. 冰晶石晶胞结构如图甲所示,Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示。下列说法错误的是
A、砷化镓中配位键的数目是 B、Ga和As的最近距离是 C、沿体对角线a→b方向投影图如丙,若c在11处,则As的位置为7、9、11、13 D、Mn掺杂到砷化镓晶体中,和Mn最近且等距离的As的数目为65. 冰晶石晶胞结构如图甲所示,Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示。下列说法错误的是 A、甲图中大立方体的体心处小三角“△”所代表的应该是“小白球” B、Al晶胞中Al原子的配位数为12 C、若已知Al的原子半径为dcm,代表阿伏加德罗常数,Al的相对原子质量为M,Al晶体的密度为 D、中含有离子键、配位键6. 我国科学家开发铜钯催化剂高效实现电催化还原制备乙酸,铜钯晶胞如图。已知:、的原子半径分别为a pm,b pm。下列叙述正确的是
A、甲图中大立方体的体心处小三角“△”所代表的应该是“小白球” B、Al晶胞中Al原子的配位数为12 C、若已知Al的原子半径为dcm,代表阿伏加德罗常数,Al的相对原子质量为M,Al晶体的密度为 D、中含有离子键、配位键6. 我国科学家开发铜钯催化剂高效实现电催化还原制备乙酸,铜钯晶胞如图。已知:、的原子半径分别为a pm,b pm。下列叙述正确的是 A、乙酸的同分异构体均易溶于水 B、该晶胞的化学式为 C、离最近的有8个 D、该晶体的密度7. 氮化镓是一种优异的半导体,硬度很大,熔点约为1700℃,氮化镓有三种晶体结构,其中最稳定的结构如图。下列关于该结构及其对应晶体的说法正确的是
A、乙酸的同分异构体均易溶于水 B、该晶胞的化学式为 C、离最近的有8个 D、该晶体的密度7. 氮化镓是一种优异的半导体,硬度很大,熔点约为1700℃,氮化镓有三种晶体结构,其中最稳定的结构如图。下列关于该结构及其对应晶体的说法正确的是 A、氮化镓晶体属于分子晶体 B、该结构中有8个N原子 C、Ga原子周围等距且最近的Ga原子数为6 D、该晶体的密度为×1030g•cm-38. 某立方品系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构,图b表示晶胞的一部分,晶胞中1号、3号原子的分数坐标分别为(0,0,0)、(1,1,1)。下列说法错误的是
A、氮化镓晶体属于分子晶体 B、该结构中有8个N原子 C、Ga原子周围等距且最近的Ga原子数为6 D、该晶体的密度为×1030g•cm-38. 某立方品系的锑钾(Sb-K)合金可作为钾离子电池的电极材料,图a为该合金的晶胞结构,图b表示晶胞的一部分,晶胞中1号、3号原子的分数坐标分别为(0,0,0)、(1,1,1)。下列说法错误的是 A、晶胞中含有的Sb原子数为4 B、2号原子的分数坐标为 C、K和Sb之间的最短距离为pm D、该晶体的密度为9. 一种光催化材料的晶胞如图,属于立方晶系,其晶胞参数为。下列说法错误的是
A、晶胞中含有的Sb原子数为4 B、2号原子的分数坐标为 C、K和Sb之间的最短距离为pm D、该晶体的密度为9. 一种光催化材料的晶胞如图,属于立方晶系,其晶胞参数为。下列说法错误的是 A、晶体的化学式为 B、晶体中与距离最近且相等的有6个 C、氧原子位于构成的四面体空隙中 D、晶体密度为10. 硒化锌是一种重要的半导体材料;其晶胞结构如图甲所示,已知晶胞参数为pnm,乙图为晶胞的俯视图,下列说法正确的是
A、晶体的化学式为 B、晶体中与距离最近且相等的有6个 C、氧原子位于构成的四面体空隙中 D、晶体密度为10. 硒化锌是一种重要的半导体材料;其晶胞结构如图甲所示,已知晶胞参数为pnm,乙图为晶胞的俯视图,下列说法正确的是 A、晶胞中硒原子的配位数为12 B、晶胞中d点原子分数坐标为 C、相邻两个Zn原子的最短距离为nm D、电负性:Zn>Se
A、晶胞中硒原子的配位数为12 B、晶胞中d点原子分数坐标为 C、相邻两个Zn原子的最短距离为nm D、电负性:Zn>Se二、多选题
-
11. 下列有关说法不正确的是( )
 A、图1 NaCl晶体中,距最近的形成为正四面体形 B、图2晶体中,每个晶胞平均占有4个 C、图3立方相氮化硼中,硼原子与硼氮键个数的比为1∶4 D、金属Cu中原子堆积模型如图4所示,为最密堆积,Cu原子的配位数为812. 的晶胞结构示意图如图甲所示,其中Li位于立方体的顶点、部分棱心和面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,脱出部分 , 形成乙、丙。下列说法错误的是
A、图1 NaCl晶体中,距最近的形成为正四面体形 B、图2晶体中,每个晶胞平均占有4个 C、图3立方相氮化硼中,硼原子与硼氮键个数的比为1∶4 D、金属Cu中原子堆积模型如图4所示,为最密堆积,Cu原子的配位数为812. 的晶胞结构示意图如图甲所示,其中Li位于立方体的顶点、部分棱心和面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,脱出部分 , 形成乙、丙。下列说法错误的是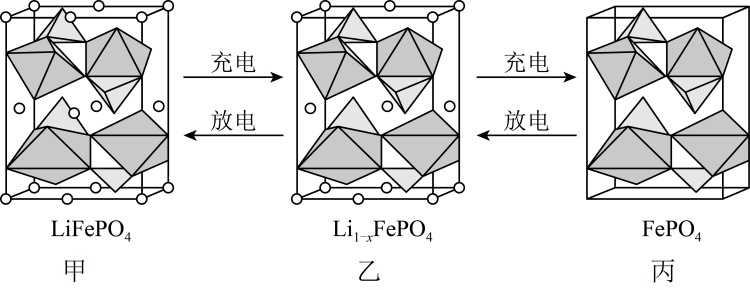 A、图甲中每个晶胞中含有的单元数有4个 B、 C、中 D、若晶胞丙的边长为a pm,则晶胞密度为 g⋅cm13. 某镁铝尖晶石的晶胞由立方体M区和N区组成,结构如图。
A、图甲中每个晶胞中含有的单元数有4个 B、 C、中 D、若晶胞丙的边长为a pm,则晶胞密度为 g⋅cm13. 某镁铝尖晶石的晶胞由立方体M区和N区组成,结构如图。
下列说法正确的是( )
A、该晶胞的体积为×10-30cm3 B、与O2-最邻近的Al3+离子数为4 C、Mg2+和Mg2+之间的最短距离为pm D、该物质的化学式为MgAl2O414. 硒化锌是一种黄色立方晶系,可用于荧光材料、半导体掺杂物。其晶胞结构如图,晶胞参数为 a pm。下列说法正确的是( ) A、硒的配位数为4 B、相邻的Se2-与 Zn2+之间的距离为pm C、若硒化锌晶体的密度为ρ g·cm-3 , 则阿伏加德罗常数 D、已知A点原子分数坐标为(0,0,0),则 C点的原子分数坐标为15. 下列有关说法错误的是( )
A、硒的配位数为4 B、相邻的Se2-与 Zn2+之间的距离为pm C、若硒化锌晶体的密度为ρ g·cm-3 , 则阿伏加德罗常数 D、已知A点原子分数坐标为(0,0,0),则 C点的原子分数坐标为15. 下列有关说法错误的是( ) A、图1 NaCl晶体中,距最近的形成为正四面体形 B、图2晶体中,每个晶胞平均占有4个 C、图3立方相氮化硼中,硼原子与硼氮键个数的比为1∶4 D、金属Cu中原子堆积模型如图4所示,为最密堆积,Cu原子的配位数为8
A、图1 NaCl晶体中,距最近的形成为正四面体形 B、图2晶体中,每个晶胞平均占有4个 C、图3立方相氮化硼中,硼原子与硼氮键个数的比为1∶4 D、金属Cu中原子堆积模型如图4所示,为最密堆积,Cu原子的配位数为8三、非选择题
-
16. 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物()。回答下列问题:(1)、基态原子的价电子排布式为。橄榄石中,各元素电负性大小顺序为 , 铁的化合价为。(2)、已知一些物质的熔点数据如下表:
物质
熔点/℃
800.7
与均为第三周期元素,熔点明显高于 , 原因是。分析同族元素的氯化物、、熔点变化趋势及其原因。的空间结构为 , 其中的轨道杂化形式为。
(3)、一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有个。该物质化学式为 , B-B最近距离为。 17. 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:(1)、根据图1数据计算反应的。
17. 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:(1)、根据图1数据计算反应的。 (2)、研究表明,合成氨反应在催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(填步骤前的标号),理由是。(3)、合成氨催化剂前驱体(主要成分为)使用前经还原,生成包裹的。已知属于立方晶系,晶胞参数 , 密度为 , 则晶胞中含有的原子数为(列出计算式,阿伏加德罗常数的值为)。(4)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为 , 另一种为。(物质i的摩尔分数:)
(2)、研究表明,合成氨反应在催化剂上可能通过图2机理进行(*表示催化剂表面吸附位,表示被吸附于催化剂表面的)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为(填步骤前的标号),理由是。(3)、合成氨催化剂前驱体(主要成分为)使用前经还原,生成包裹的。已知属于立方晶系,晶胞参数 , 密度为 , 则晶胞中含有的原子数为(列出计算式,阿伏加德罗常数的值为)。(4)、在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为 , 另一种为。(物质i的摩尔分数:)
①图中压强由小到大的顺序为 , 判断的依据是。
②进料组成中含有情性气体的图是。
③图3中,当、时,氮气的转化率。该温度时,反应的平衡常数(化为最简式)。
18. 将酞菁—钴钛—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:(1)、图1所示的几种碳单质,它们互为 , 其中属于原子晶体的是 , 间的作用力是。 (2)、酞菁和钴酞菁的分子结构如图2所示。
(2)、酞菁和钴酞菁的分子结构如图2所示。
酞菁分子中所有原子共平面,其中轨道能提供一对电子的原子是(填图2酞菁中原子的标号)。钴酞菁分子中,钴离子的化合价为 , 氮原子提供孤对电子与钴离子形成键。
(3)、气态通常以二聚体的形式存在,其空间结构如图3a所示,二聚体中的轨道杂化类型为。的熔点为 , 远高于的 , 由此可以判断铝氟之间的化学键为键。结构属立方晶系,晶胞如图3b所示,的配位数为。若晶胞参数为 , 晶体密度(列出计算式,阿伏加德罗常数的值为)。 19. 硅材料在生活中占有重要地位。请回答:(1)、分子的空间结构(以为中心)名称为 , 分子中氮原子的杂化轨道类型是。受热分解生成和 , 其受热不稳定的原因是。(2)、由硅原子核形成的三种微粒,电子排布式分别为:①、②、③ , 有关这些微粒的叙述,正确的是____。A、微粒半径:③>①>② B、电子排布属于基态原子(或离子)的是:①② C、电离一个电子所需最低能量:①>②>③ D、得电子能力:①>②(3)、Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 , 该化合物的化学式为。
19. 硅材料在生活中占有重要地位。请回答:(1)、分子的空间结构(以为中心)名称为 , 分子中氮原子的杂化轨道类型是。受热分解生成和 , 其受热不稳定的原因是。(2)、由硅原子核形成的三种微粒,电子排布式分别为:①、②、③ , 有关这些微粒的叙述,正确的是____。A、微粒半径:③>①>② B、电子排布属于基态原子(或离子)的是:①② C、电离一个电子所需最低能量:①>②>③ D、得电子能力:①>②(3)、Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 , 该化合物的化学式为。 20. 硫铁化合物(、等)应用广泛。(1)、纳米可去除水中微量六价铬。在的水溶液中,纳米颗粒表面带正电荷,主要以、、好形式存在,纳米去除水中主要经过“吸附→反应→沉淀”的过程。
20. 硫铁化合物(、等)应用广泛。(1)、纳米可去除水中微量六价铬。在的水溶液中,纳米颗粒表面带正电荷,主要以、、好形式存在,纳米去除水中主要经过“吸附→反应→沉淀”的过程。已知: , ;电离常数分别为、。
①在弱碱性溶液中,与反应生成、和单质S,其离子方程式为。
②在弱酸性溶液中,反应的平衡常数K的数值为。
③在溶液中,pH越大,去除水中的速率越慢,原因是。
(2)、具有良好半导体性能。的一种晶体与晶体的结构相似,该晶体的一个晶胞中的数目为 , 在晶体中,每个S原子与三个紧邻,且间距相等,如图给出了晶胞中的和位于晶胞体心的(中的键位于晶胞体对角线上,晶胞中的其他已省略)。如图中用“-”将其中一个S原子与紧邻的连接起来。 (3)、、在空气中易被氧化,将在空气中氧化,测得氧化过程中剩余固体的质量与起始的质量的比值随温度变化的曲线如图所示。时,氧化成含有两种元素的固体产物为(填化学式,写出计算过程)。
(3)、、在空气中易被氧化,将在空气中氧化,测得氧化过程中剩余固体的质量与起始的质量的比值随温度变化的曲线如图所示。时,氧化成含有两种元素的固体产物为(填化学式,写出计算过程)。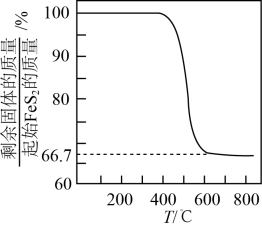 21. 磷及其化合物在工业生产中起着重要的作用。(1)、磷在元素周期表中的位置是;基态磷原子价电子排布式。(2)、磷元素有白磷、黑磷等常见的单质。
21. 磷及其化合物在工业生产中起着重要的作用。(1)、磷在元素周期表中的位置是;基态磷原子价电子排布式。(2)、磷元素有白磷、黑磷等常见的单质。①白磷()是分子晶体,易溶于 , 难溶于水,可能原因是。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如下图所示。下列有关黑磷晶体的说法正确的是(填字母序号)。

a.黑磷与白磷互为同分异构体 b.黑磷中磷原子采取杂化
c.黑磷能导电 d.黑磷属于混合型晶体
(3)、与水会形成黄色的配离子 , 为避免颜色干扰,常在溶液中加入形成无色的 , 此配离子中(填写化学式)是中心离子,空间构型是。(4)、第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。①实验测定磷化铝和磷化铜的熔点分别为2000℃、1070℃,从结构角度说明其熔点差异的原因。
②磷化硼是一种半导体材料,晶胞结构如图所示,磷化硼的化学式是 , 已知晶胞边长a pm,阿伏加德罗常数为 , 磷化硼晶体的密度是
 22. 某软锰矿含锰为50%,是重要的锰矿石。其主要成分如表:
22. 某软锰矿含锰为50%,是重要的锰矿石。其主要成分如表:软锰矿主要成分
杂质
MnO2
MgO、FeO、Fe2O3、Al2O3、SiO2等杂质
某科研团队设计制备高纯度MnCO3。反应原理为①MnO2+BaS+H2O=MnO+Ba(OH)2+S;②MnO+H2SO4=MnSO4+H2O;③硫酸锰+碳酸氢铵+一水合氨→MnCO3↓(白色)。工艺流程图如图。

回答下列问题:
(1)、软锰矿与硫化钡反应时,适当提高反应液温度的目的是。(2)、“不溶物”中除SiO2外,还有(“填化学式”)。(3)、工序2中加入H2O2的目的是 , 使用氨水调溶液的pH,理论上pH最小值为。(通常认为溶液中离子浓度小于10-5mol•L-1为沉淀完全;Ksp[Fe(OH)3]=10-38.6、Ksp[Fe(OH)2]=10-16.3、Ksp[Al(OH)3]=10-32.3、Ksp[Mn(OH)2]=10-12.7)(4)、MnF2难溶于水,工序3加入MnF2的目的是除去Mg2+ , 其反应的离子反应方程式为。(5)、碳化过程中发生反应的化学方程式为。(6)、由镍、锰、镓制备的磁性形状记忆型合金中,基态Mn原子的价电子的轨道表示式为。晶胞结构如图,晶胞参数为anm,则该晶体的密度为g•cm-3(NA表示阿伏加德罗常数)。 23. 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物等领域具有重要应用。(1)、Se与S同族,基态硒原子价电子排布式为。(2)、的沸点低于 , 其原因是。(3)、硒的两种含氧酸的酸性强弱为(填“>”或“<”)。的空间结构为。比较键角大小:气态分子离子(填“>”“<”或“=”)。
23. 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物等领域具有重要应用。(1)、Se与S同族,基态硒原子价电子排布式为。(2)、的沸点低于 , 其原因是。(3)、硒的两种含氧酸的酸性强弱为(填“>”或“<”)。的空间结构为。比较键角大小:气态分子离子(填“>”“<”或“=”)。 (4)、关于I~III三种反应物,下列说法正确的有____。A、I中仅有键 B、I中的Se-Se键为非极性共价键 C、I易溶于水 D、II中原子的杂化轨道类型只有sp与 E、I~III含有的元素中,O电负性最大(5)、IV中具有孤对电子的原子有。(6)、我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如左图,沿x、y、z轴方向的投影均为右图。
(4)、关于I~III三种反应物,下列说法正确的有____。A、I中仅有键 B、I中的Se-Se键为非极性共价键 C、I易溶于水 D、II中原子的杂化轨道类型只有sp与 E、I~III含有的元素中,O电负性最大(5)、IV中具有孤对电子的原子有。(6)、我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如左图,沿x、y、z轴方向的投影均为右图。
①X的化学式为。
②设X的最简式的式量为 , 晶体密度为 , 则X中相邻K之间的最短距离为nm(列出计算式,为阿伏加德罗常数的值)。
24. 在科研和工农业生产中,碳、氮、砷(As)、铜等元素形成的单质及其化合物有着广泛的应用。回答下列问题:(1)、As和N同族,基态砷原子的价电子排布式为。(2)、基态Cu原子的核外电子有种运动状态,未成对电子占据的原子轨道形状为。(3)、中C原子的杂化轨道类型为 , 其空间构型为。(4)、CuO在高温时分解为O2和Cu2O,请结合阳离子的结构分析,高温时Cu2O比CuO更稳定的原因。(5)、向盛有CuSO4溶液的试管中滴加少量氨水,产生蓝色沉淀,继续滴加氨水至过量得到深蓝色溶液。经测定,溶液呈深蓝色是因为存在[Cu(NH3)4]SO4 , 1mol[Cu(NH3)4]2+含σ键的数目为。(6)、金属晶体铜的晶胞如图所示,其堆积方式是 , 铜晶胞的密度为ρg∙cm−3 , NA为阿伏加德罗常数的值,则铜晶胞的边长为pm(用含ρ、NA的式子表示,写出计算式即可)。 25. 锗(Ge)是门捷列夫在1871年所预言的元素“亚硅”,高纯度的锗已成为目前重要的半导体材料,其化合物在治疗癌症方面也有着独特的功效。如图是以锗锌矿(主要成分为GeO2、ZnS,另外含有少量的Fe2O3等)为主要原料生产高纯度锗的工艺流程:
25. 锗(Ge)是门捷列夫在1871年所预言的元素“亚硅”,高纯度的锗已成为目前重要的半导体材料,其化合物在治疗癌症方面也有着独特的功效。如图是以锗锌矿(主要成分为GeO2、ZnS,另外含有少量的Fe2O3等)为主要原料生产高纯度锗的工艺流程:
已知:GeO2可溶于强碱溶液,生成锗酸盐;GeCl4的熔点为-49.5℃,沸点为84℃,在水中或酸的稀溶液中易水解。
(1)、Ge在元素周期表中的位置是 , GeCl4晶体所属类别是。(2)、步骤①NaOH溶液碱浸时发生的离子反应方程式为。(3)、步骤③沉锗过程中,当温度为90℃,pH为14时,加料量(CaCl2/Ge质量比)对沉锗的影响如表所示,选择最佳加料量为(填“10-15”“15-20”或“20-25”)。编号
加料量(CaCl2/Ge)
母液体积(mL)
过滤后滤液含锗(mg/L)
过滤后滤液pH
锗沉淀率(%)
1
10
500
76
8
93.67
2
15
500
20
8
98.15
3
20
500
2
11
99.78
4
25
500
1.5
12
99.85
(4)、步骤⑤中选择浓盐酸而不选择稀盐酸的原因是。(5)、步骤⑥的化学反应方程式为。(6)、Ge元素的单质及其化合物都具有独特的优异性能,请回答下列问题:①量子化学计算显示含锗化合物H5O2Ge(BH4)3具有良好的光电化学性能。CaPbI3是H5O2Ge(BH4)3的量子化学计算模型,CaPbI3的晶体结构如图所示,若设定图中体心钙离子的分数坐标为( , , ),则分数坐标为(0,0,)的离子是。

②晶体Ge是优良的半导体,可作高频率电流的检波和交流电的整流用。如图为Ge单晶的晶胞,设Ge原子半径为rpm,阿伏加德罗常数的值为NA , 则该锗晶体的密度计算式为(不需化简)ρ=g/cm3。
 26. 二甲基亚砜(
26. 二甲基亚砜( )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题: (1)、基态原子的价电子排布图(轨道表示式)为。(2)、铬和锰基态原子核外未成对电子数之比为。(3)、已知:二甲基亚砜能够与水和丙酮(
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题: (1)、基态原子的价电子排布图(轨道表示式)为。(2)、铬和锰基态原子核外未成对电子数之比为。(3)、已知:二甲基亚砜能够与水和丙酮( )分别以任意比互溶。
)分别以任意比互溶。①二甲基亚砜分子中硫原子的杂化类型为。
②丙酮分子中各原子电负性由大到小的顺序为。
③二甲基亚砜易溶于水,原因可能为。
(4)、的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为 , 对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为 , 该分子内的作用力不可能含有(填序号)。A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.范德华力
(5)、已知硫化锰()晶胞如图所示,该晶胞参数 , 。
①该晶体中,锰原子周围的硫原子数目为。
②空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别和 , 该晶体中原子的空间利用率为(列出计算式即可)。
27. 含银卤化物胶片是摄影中常用的感光材料。回答下列问题:(1)、卤化银曝光后会产生(黑色粉末)和。基态原子的价电子排布式为。(2)、加入显影剂(如 等),使潜影银核中的进一步还原为。
等),使潜影银核中的进一步还原为。 中(除H外)其他所含元素的第二电离能最大的是;该物质能溶于冷水,原因是。 (3)、用溶解胶片上多余的 , 形成可溶的直线形配离子 , 从而定影.离子的VSEPR模型为 , 中中心的杂化轨道类型为 , 其中配位时给出孤电子对能力较强的是(填“S”或“O”)。(4)、电解法可回收银单质。单质为面心立方最密堆积,晶胞参数为 , 则银原子的半径。
中(除H外)其他所含元素的第二电离能最大的是;该物质能溶于冷水,原因是。 (3)、用溶解胶片上多余的 , 形成可溶的直线形配离子 , 从而定影.离子的VSEPR模型为 , 中中心的杂化轨道类型为 , 其中配位时给出孤电子对能力较强的是(填“S”或“O”)。(4)、电解法可回收银单质。单质为面心立方最密堆积,晶胞参数为 , 则银原子的半径。 (5)、晶胞如右图,晶胞参数为。晶体中的配位数为;已知离子半径为 , 离子之间不相切,则晶体中离子半径。28. 分子人工光合作用的光捕获原理如图所示,WOC₁是水氧化催化剂WOC在水氧化过程中产生的中间体,HEC₁是析氢催化剂HEC在析氢过程中产生的中间体。
(5)、晶胞如右图,晶胞参数为。晶体中的配位数为;已知离子半径为 , 离子之间不相切,则晶体中离子半径。28. 分子人工光合作用的光捕获原理如图所示,WOC₁是水氧化催化剂WOC在水氧化过程中产生的中间体,HEC₁是析氢催化剂HEC在析氢过程中产生的中间体。
回答下列问题:
(1)、与Fe元素同周期,基态原子有2个未成对电子的金属元素有种,下列状态的铁中,电离最外层一个电子所需能量最大的是(填标号)。a.
 b.
b.
c.
 d.
d. (2)、含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。1 mol WOC₁中通过螯合作用形成的配位键有mol。(3)、HEC₁中的C、N、O三种元素都能与H元素形成含A-A(A表示C、N、O元素)键的氢化物。氢化物中A-A键的键能(kJ·moL⁻¹)如下表:
(2)、含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。1 mol WOC₁中通过螯合作用形成的配位键有mol。(3)、HEC₁中的C、N、O三种元素都能与H元素形成含A-A(A表示C、N、O元素)键的氢化物。氢化物中A-A键的键能(kJ·moL⁻¹)如下表:HO-OH
346
247
207
A-A键的键能依次降低的原因是。
(4)、在多原子分子中有相互平行的p轨道,它们连贯、重叠在一起,构成一个整体,p电子在多个原子间运动,像这样不局限在两个原子之间的π键称为离域π键,如苯分子中的离域π键可表示为。N元素形成的两种微粒、中,中的离域π键可表示为 , 、的键角由大到小的顺序为。(5)、水催化氧化是“分子人工光合作用”的关键步骤。水的晶体有普通冰和重冰等不同类型。普通冰的晶胞结构与水分子间的氢键如图甲、乙所示。晶胞参数pm,pm,;标注为1、2、3的氧原子在Z轴的分数坐标分别为:0.375c、0.5c、0.875c。
①晶胞中氢键的长度(O-H…O的长度)为pm(保留一位小数)。
②普通冰晶体的密度为g·cm⁻³(列出数学表达式,不必计算出结果)。
29. 镍铜合金是由60%镍、33%铜、7%铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性强,耐磨性好,容易加工,可作为航空发动机的结构材料。根据所学知识,回答下列问题:(1)、铜元素的焰色试验呈绿色,下列三种波长为橙、黄、绿色对应的波长,则绿色对应的辐射波长为____(填标号)。A、 B、 C、(2)、基态的价电子排布式为。(3)、乙酰丙酮(结构如图)中C原子的杂化轨道类型有 , 乙酰丙酮中σ键与π键数目之比为。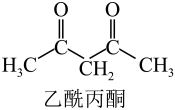 (4)、Cu与Fe的第二电离能分别为 , , 大于的主要原因是。(5)、已知的立方晶胞结构如图所示。
(4)、Cu与Fe的第二电离能分别为 , , 大于的主要原因是。(5)、已知的立方晶胞结构如图所示。
①已知a、b的坐标参数依次为(0,0,0)、( , , ),则d的坐标参数为。
②晶胞边长为cpm,该晶体的密度为。(列计算式,设为阿伏加德罗常数的数值)
30. 配合物是近代无机化学的重要研究对象,Fe、Cu等过渡元素常作为中心原子或离子,而H2O、Cl-、吡啶(C5H5N)等微粒则是常见的配体。(1)、基态Fe2+的价电子轨道表示式为。(2)、H3O+的电子式为 , 空间构型为。(3)、吡啶( )其中N的杂化方式为 , 吡啶和其衍生物(
)其中N的杂化方式为 , 吡啶和其衍生物( 、
、 )的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 (4)、吡啶(
)的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。 (4)、吡啶( )在水中的溶解度远大于苯,可能原因是①吡啶和H2O均为极性分子相似相溶,而苯为非极性分子;②。 (5)、MCln·xH2O的晶胞结构如下图所示,晶胞的棱长分别为a pm、b pm、c pm,夹角均为90°。(1 pm=1.0×10-10 cm)
)在水中的溶解度远大于苯,可能原因是①吡啶和H2O均为极性分子相似相溶,而苯为非极性分子;②。 (5)、MCln·xH2O的晶胞结构如下图所示,晶胞的棱长分别为a pm、b pm、c pm,夹角均为90°。(1 pm=1.0×10-10 cm)
若金属M的相对原子量Mr,则该晶体的密度为g.cm3。