高考二轮复习知识点:晶胞的计算1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为。阿伏加德罗常数的值为。下列说法错误的是
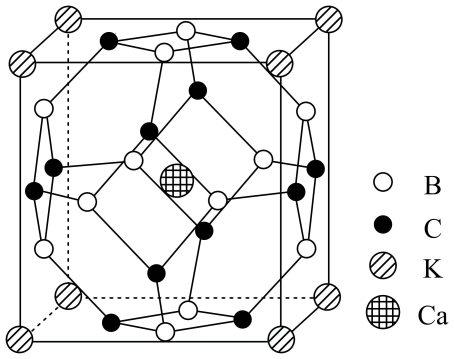 A、晶体最简化学式为 B、晶体中与最近且距离相等的有8个 C、晶胞中B和C原子构成的多面体有12个面 D、晶体的密度为2. 晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是
A、晶体最简化学式为 B、晶体中与最近且距离相等的有8个 C、晶胞中B和C原子构成的多面体有12个面 D、晶体的密度为2. 晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是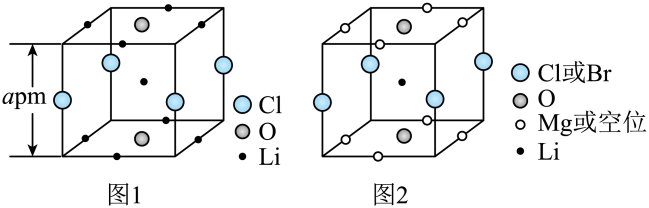 A、图1晶体密度为g∙cm-3 B、图1中O原子的配位数为6 C、图2表示的化学式为 D、取代产生的空位有利于传导3. 工业制备高纯硅的主要过程如下:
A、图1晶体密度为g∙cm-3 B、图1中O原子的配位数为6 C、图2表示的化学式为 D、取代产生的空位有利于传导3. 工业制备高纯硅的主要过程如下:石英砂粗硅高纯硅
下列说法错误的是
A、制备粗硅的反应方程式为 B、1molSi含Si-Si键的数目约为 C、原料气HCl和应充分去除水和氧气 D、生成的反应为熵减过程4. 镧La和H可以形成一系列晶体材料 , 在储氢和超导等领域具有重要应用。 , 属于立方晶系,晶胞结构和参数如图所示。高压下,中的每个H结合4个H形成类似的结构,即得到晶体。下列说法错误的是 A、晶体中La的配位数为8 B、晶体中H和H的最短距离: C、在晶胞中,H形成一个顶点数为40的闭合多面体笼 D、单位体积中含氢质量的计算式为5. 磷青铜是铜与锡、磷的合金,质地坚硬,主要用作耐磨零件和弹性元件。某立方磷青铜晶胞结构如图所示,晶胞参数为(表示阿伏加德罗常数的值)。下列说法正确的是
A、晶体中La的配位数为8 B、晶体中H和H的最短距离: C、在晶胞中,H形成一个顶点数为40的闭合多面体笼 D、单位体积中含氢质量的计算式为5. 磷青铜是铜与锡、磷的合金,质地坚硬,主要用作耐磨零件和弹性元件。某立方磷青铜晶胞结构如图所示,晶胞参数为(表示阿伏加德罗常数的值)。下列说法正确的是 A、的外围电子排布式为 B、Ni在元素周期表中位于ds区,属于过渡元素 C、该晶体中,距离Sn原子最近的Cu原子有8个 D、该晶体密度计算式为6. 一种含钒超导材料的晶胞结构及晶体结构俯视图如下图,晶胞参数为xnm、xnm、ynm,摩尔质量为Mrg/mol。(Sb原子有两种位置关系,分别用Sb1和Sb2代表),下列叙述中错误的是
A、的外围电子排布式为 B、Ni在元素周期表中位于ds区,属于过渡元素 C、该晶体中,距离Sn原子最近的Cu原子有8个 D、该晶体密度计算式为6. 一种含钒超导材料的晶胞结构及晶体结构俯视图如下图,晶胞参数为xnm、xnm、ynm,摩尔质量为Mrg/mol。(Sb原子有两种位置关系,分别用Sb1和Sb2代表),下列叙述中错误的是 A、该晶体的化学式为 B、与Cs原子距离最近的Sb1原子有6个 C、基态占据的最高能层的符号是M D、该含钒超导材料的晶体密度为7. 如图所示是氧化锆晶胞,其结构为立方体,氧化锆的摩尔质量为 , 若阿伏加德罗常数的值为 , 下列说法正确的是
A、该晶体的化学式为 B、与Cs原子距离最近的Sb1原子有6个 C、基态占据的最高能层的符号是M D、该含钒超导材料的晶体密度为7. 如图所示是氧化锆晶胞,其结构为立方体,氧化锆的摩尔质量为 , 若阿伏加德罗常数的值为 , 下列说法正确的是 A、立方氧化锆的化学式为ZrO B、每个Zr原子周围有8个O原子 C、氧化锆晶体密度的计算式为 D、相邻两个氧原子之间的最短距离为8. 一种理想的激光基质材料M由元素钾、镁和氟组成。晶体M的晶胞如图所示,已知:晶胞参数为。下列有关该晶体的说法错误的是
A、立方氧化锆的化学式为ZrO B、每个Zr原子周围有8个O原子 C、氧化锆晶体密度的计算式为 D、相邻两个氧原子之间的最短距离为8. 一种理想的激光基质材料M由元素钾、镁和氟组成。晶体M的晶胞如图所示,已知:晶胞参数为。下列有关该晶体的说法错误的是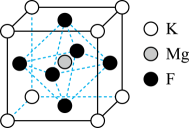 A、晶胞中K、、F的原子个数比为1∶1∶3 B、与K等距离且最近的F的数目为6 C、在M晶胞结构的另一种表示中,若K位于晶胞的体心,则F位于棱心 D、该晶体的密度为9. 某高效催化剂组成为固体。立方晶胞如下图所示,晶胞参数为 , 的摩尔质量为 , 下列说法错误的是
A、晶胞中K、、F的原子个数比为1∶1∶3 B、与K等距离且最近的F的数目为6 C、在M晶胞结构的另一种表示中,若K位于晶胞的体心,则F位于棱心 D、该晶体的密度为9. 某高效催化剂组成为固体。立方晶胞如下图所示,晶胞参数为 , 的摩尔质量为 , 下列说法错误的是 A、O元素位于元素周期表p区 B、在晶胞结构中,●表示微粒 C、该晶体密度为: D、离子在晶胞中的配位数是810. 可用于配制无机防锈颜料的复合氧化物的晶胞结构如图,下列说法中错误的是( )
A、O元素位于元素周期表p区 B、在晶胞结构中,●表示微粒 C、该晶体密度为: D、离子在晶胞中的配位数是810. 可用于配制无机防锈颜料的复合氧化物的晶胞结构如图,下列说法中错误的是( ) A、该复合氧化物的化学式为 B、若图中A、B的原子坐标均为(0,0,0),则C的原子坐标为(0,0.5,0.5) C、若该晶体密度为 , 钙和氧的最近距离为anm,则阿伏加德罗常数 D、由晶胞结构可知,与1个钙原子等距离且最近的氧原子有8个11. 我国科学家预言的T-碳已被合成。T-碳的晶体结构可看做将金刚石中的碳原子用由四个碳原子组成的正四面体结构单元取代所得,T-碳和金刚石的晶胞如图所示。下列说法错误的是
A、该复合氧化物的化学式为 B、若图中A、B的原子坐标均为(0,0,0),则C的原子坐标为(0,0.5,0.5) C、若该晶体密度为 , 钙和氧的最近距离为anm,则阿伏加德罗常数 D、由晶胞结构可知,与1个钙原子等距离且最近的氧原子有8个11. 我国科学家预言的T-碳已被合成。T-碳的晶体结构可看做将金刚石中的碳原子用由四个碳原子组成的正四面体结构单元取代所得,T-碳和金刚石的晶胞如图所示。下列说法错误的是 A、T-碳与金刚石互为同素异形体 B、T-碳与金刚石均属于共价晶体 C、T-碳与金刚石中键角均为 D、T-碳晶胞中平均含有32个碳原子12. 作为储氢材料的镧镍合金被广泛应用于电动车辆,某种镧镍合金储氢后所得晶体的化学式为LaNi5H6 , 晶胞结构如图,晶胞参数为a,下列有关表述错误的是
A、T-碳与金刚石互为同素异形体 B、T-碳与金刚石均属于共价晶体 C、T-碳与金刚石中键角均为 D、T-碳晶胞中平均含有32个碳原子12. 作为储氢材料的镧镍合金被广泛应用于电动车辆,某种镧镍合金储氢后所得晶体的化学式为LaNi5H6 , 晶胞结构如图,晶胞参数为a,下列有关表述错误的是 A、Z表示的微粒为H2 B、每个X原子周围最近且等距离的X原子有6个 C、若A的分数坐标为(0,0.5,0.5),B的分数坐标为(0.75,0.75,0),则C的分数坐标为(1,0.5,1) D、若四条竖直棱的棱心位置均插入Z,则晶体的化学式为LaNi5H713. 一种锂的氧化物的晶胞结构如图所示(晶胞参数a=b=c=0.4665nm,晶胞棱边夹角均为90°)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。下列有关说法错误的是
A、Z表示的微粒为H2 B、每个X原子周围最近且等距离的X原子有6个 C、若A的分数坐标为(0,0.5,0.5),B的分数坐标为(0.75,0.75,0),则C的分数坐标为(1,0.5,1) D、若四条竖直棱的棱心位置均插入Z,则晶体的化学式为LaNi5H713. 一种锂的氧化物的晶胞结构如图所示(晶胞参数a=b=c=0.4665nm,晶胞棱边夹角均为90°)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。下列有关说法错误的是 A、该氧化物的化学式为Li2O B、O原子之间的最短距离为×466.5pm C、与Li距离最近且相等的O有8个 D、若p原子的分数坐标为( , , ),则q原子的分数坐标为( , , )14. 下列化学用语或图示表达正确的是A、HClO的电子式:
A、该氧化物的化学式为Li2O B、O原子之间的最短距离为×466.5pm C、与Li距离最近且相等的O有8个 D、若p原子的分数坐标为( , , ),则q原子的分数坐标为( , , )14. 下列化学用语或图示表达正确的是A、HClO的电子式: B、中子数为1的氢原子:
C、NaCl的晶胞:
B、中子数为1的氢原子:
C、NaCl的晶胞: D、反-2-丁烯的结构简式:
D、反-2-丁烯的结构简式:
二、多选题
-
15. LiFePO4的晶胞如图所示,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构,电池充电时,LiFePO4脱出部分Li+ , 形成Li1-xFePO4晶胞。
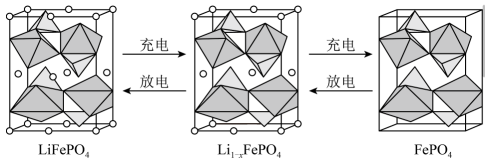
下列说法正确的是
A、每个LiFePO4晶胞中含有4个O原子 B、Li1-xFePO4晶胞中, C、每个LiFePO4晶胞完全转化为FePO4晶胞时,转移电子数为1 D、1molLi1-xFePO4全转化为LiFePO4时,消耗xmolFe3+16. 普鲁士蓝是一种辐射应急药物。最初,狄斯巴赫把草木灰和牛血混在一起,制成亚铁氰化钾(其三水合物俗称黄血盐),之后与反应获得了普鲁士蓝。如图是普鲁士蓝晶体的单元结构,下列说法正确的是( ) A、黄血盐的化学式为 B、在制备黄血盐时,牛血的作用是仅提供元素 C、普鲁士蓝中与的配位数均为6 D、普鲁士蓝的每个晶胞中实际含有3个17. 某水性钠离子电池电极材料由、、、组成,其立方晶胞嵌入和嵌出过程中,与含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图所示。下列说法错误的是
A、黄血盐的化学式为 B、在制备黄血盐时,牛血的作用是仅提供元素 C、普鲁士蓝中与的配位数均为6 D、普鲁士蓝的每个晶胞中实际含有3个17. 某水性钠离子电池电极材料由、、、组成,其立方晶胞嵌入和嵌出过程中,与含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图所示。下列说法错误的是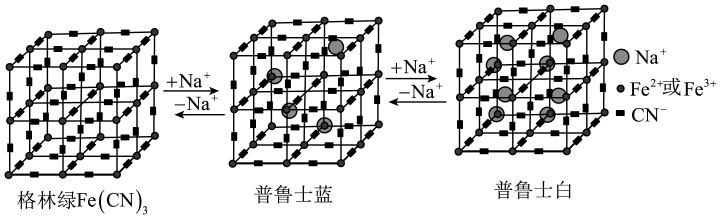 A、铁在元素周期表中位于第4周期ⅧB族 B、普鲁士蓝的导电能力小于普鲁士白 C、普鲁士蓝中与个数比为1:2 D、普鲁士白的化学式为18. 钛酸钙矿物的晶胞结构如图(a)所示,某钙钛矿型太阳能光伏电池的有机半导体材料的结构如图(b)所示,晶胞边长为a cm,其中A为 , 另两种离子为和。下列说法错误的是
A、铁在元素周期表中位于第4周期ⅧB族 B、普鲁士蓝的导电能力小于普鲁士白 C、普鲁士蓝中与个数比为1:2 D、普鲁士白的化学式为18. 钛酸钙矿物的晶胞结构如图(a)所示,某钙钛矿型太阳能光伏电池的有机半导体材料的结构如图(b)所示,晶胞边长为a cm,其中A为 , 另两种离子为和。下列说法错误的是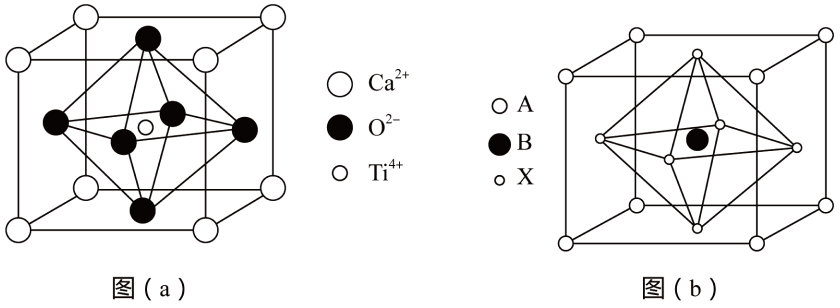 A、钛酸钙晶体中距离最近的有8个 B、图(b)中,X为 C、图(b)该晶体密度为 D、钛酸钙晶胞中距离最近的形成了正八面体,位于其中心19. 某FexNy的晶胞如图1所示,晶胞边长为apm,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示。下列说法正确的是( )
A、钛酸钙晶体中距离最近的有8个 B、图(b)中,X为 C、图(b)该晶体密度为 D、钛酸钙晶胞中距离最近的形成了正八面体,位于其中心19. 某FexNy的晶胞如图1所示,晶胞边长为apm,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示。下列说法正确的是( ) A、该FexNy的化学式为Fe2N B、与N等距且最近的N为8个 C、两个a位置Fe的最近距离为apm D、其中较稳定的Cu替代型产物的化学式为Fe3CuN
A、该FexNy的化学式为Fe2N B、与N等距且最近的N为8个 C、两个a位置Fe的最近距离为apm D、其中较稳定的Cu替代型产物的化学式为Fe3CuN三、非选择题
-
20. 硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根可看作是中的一个原子被原子取代的产物。(1)、基态原子价层电子排布式是。(2)、比较原子和原子的第一电离能大小,从原子结构的角度说明理由:。(3)、的空间结构是。(4)、同位素示踪实验可证实中两个原子的化学环境不同,实验过程为。过程中,断裂的只有硫硫键,若过程所用试剂是和 , 过程含硫产物是。(5)、的晶胞形状为长方体,边长分别为、 , 结构如图所示。

晶胞中的个数为。已知的摩尔质量是 , 阿伏加德罗常数为 , 该晶体的密度为。
(6)、浸金时,作为配体可提供孤电子对与形成。分别判断中的中心原子和端基原子能否做配位原子并说明理由:。21. 乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。(1)、CaC2中与互为等电子体,的电子式可表示为; 1mol 中含有的π键数目为。(2)、将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为。(3)、乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为。(4)、CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),则该晶胞中的碳原子个数为。 CaC2晶体中含有的中哑铃形的存在,使晶胞沿一个方向拉长。CaC2 晶体中1个Ca2+周围距离最近的数目为。 22. 石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图a所示,图中用虚线标出了石墨的一个六方晶胞。若按ABCABC方式堆积而成,则如图b所示,图中用虚线标出了石墨的一个三方晶胞。回答下列问题:
22. 石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图a所示,图中用虚线标出了石墨的一个六方晶胞。若按ABCABC方式堆积而成,则如图b所示,图中用虚线标出了石墨的一个三方晶胞。回答下列问题: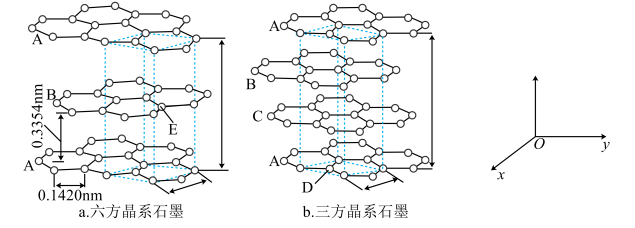 (1)、石墨中碳原子的杂化方式为 , 基态碳原子中电子的空间运动状态有种,D、E原子的分数坐标分别为、(以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标)。(2)、六方石墨晶体的密度为(写出计算表达式,要求化简)。(3)、1个三方石墨晶胞中碳原子的个数为。(4)、石墨可用作锂离子电池的负极材料,充电时可由形成计按如图所示均匀分布的锂碳化合物,该物质中存在的化学键有 , 充电时该电极的电极反应式为。
(1)、石墨中碳原子的杂化方式为 , 基态碳原子中电子的空间运动状态有种,D、E原子的分数坐标分别为、(以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标)。(2)、六方石墨晶体的密度为(写出计算表达式,要求化简)。(3)、1个三方石墨晶胞中碳原子的个数为。(4)、石墨可用作锂离子电池的负极材料,充电时可由形成计按如图所示均匀分布的锂碳化合物,该物质中存在的化学键有 , 充电时该电极的电极反应式为。 (5)、锂离子电池的正极材料为层状结构的。锂离子完全脱嵌时的层状结构会变得不稳定,用铝取代部分镍形成。可防止锂离子完全脱嵌而起到稳定结构的作用,其原因是。23. 砷化镓(GaAs)是优良的半导体材料,其晶体结构与单晶硅相似。(1)、基态Ga原子的价电子排布式为 , 其同周期元素中未成对电子数最多的是(填元素符号)。(2)、GaAs可用Ga(CH3)3(常温下为无色液体)和AsH3高温反应制得,同时生成另一种产物,写出反应方程式 , 另一种产物中心原子的杂化类型为。(3)、沸点AsH3NH3(填“>”、“<”、“=”),原因是。(4)、GaAs的晶胞结构如图所示,As的配位数 , 若晶胞中距离最近的两个Ga原子距离为anm,阿伏加德罗常数的值为,则GaAs的密度为。
(5)、锂离子电池的正极材料为层状结构的。锂离子完全脱嵌时的层状结构会变得不稳定,用铝取代部分镍形成。可防止锂离子完全脱嵌而起到稳定结构的作用,其原因是。23. 砷化镓(GaAs)是优良的半导体材料,其晶体结构与单晶硅相似。(1)、基态Ga原子的价电子排布式为 , 其同周期元素中未成对电子数最多的是(填元素符号)。(2)、GaAs可用Ga(CH3)3(常温下为无色液体)和AsH3高温反应制得,同时生成另一种产物,写出反应方程式 , 另一种产物中心原子的杂化类型为。(3)、沸点AsH3NH3(填“>”、“<”、“=”),原因是。(4)、GaAs的晶胞结构如图所示,As的配位数 , 若晶胞中距离最近的两个Ga原子距离为anm,阿伏加德罗常数的值为,则GaAs的密度为。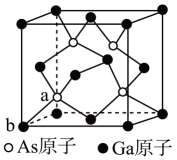 24. 工厂的含砷废水必须经过一定的处理。 某厂用某含砷废水(含HAsO2、H2SO4、及少量Fe3+、Cu2+、Bi2+ )提取三氧化二砷(俗称砒霜,分子式:As2O3)的流程如下:
24. 工厂的含砷废水必须经过一定的处理。 某厂用某含砷废水(含HAsO2、H2SO4、及少量Fe3+、Cu2+、Bi2+ )提取三氧化二砷(俗称砒霜,分子式:As2O3)的流程如下: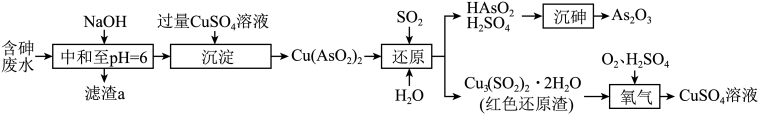
已知:Ksp[Fe(OH)3]=2.8 ×10-3920 ,Ksp[Cu(OH)2]=2.2 ×10-22 , Ksp [Bi(OH)3]=4.4 ×10-31。
回答下列问题:
(1)、滤渣a的成分是(写化学式)。(2)、“沉淀”时,CuSO4溶液必须过量的原因是。(3)、写出“还原”时Cu(AsO2)2与H2O、SO2发生反应的化学方程式:。(4)、红色还原渣(不溶于水)“氧化”时反应的离子方程式为。(5)、“沉砷”后废水中残留的砷可用PFS(聚铁)进一步去除,用石灰乳调节废水的pH值,通入空气,PFS用量[以表示]、终点pH值与砷去除率的关系如图所示。PFS除砷的最佳条件是。 (6)、 当废水中砷质量浓度为5.0g·L-1时,若实验取75 L含砷废水,制得475.2 gAs2O3 , 则As元的素回收率为。(7)、砷化镓(GaAs)为第三代半导体,其立方晶胞结构如图所示。已知晶胞参数为a nm,阿伏加德罗常数值为NA , 则砷化镓晶体密度为g· cm-3。
(6)、 当废水中砷质量浓度为5.0g·L-1时,若实验取75 L含砷废水,制得475.2 gAs2O3 , 则As元的素回收率为。(7)、砷化镓(GaAs)为第三代半导体,其立方晶胞结构如图所示。已知晶胞参数为a nm,阿伏加德罗常数值为NA , 则砷化镓晶体密度为g· cm-3。 25. I.回答下列问题:(1)、Pt的电子排布式为[Xe]4f145d96s1 , 则Pt在元素周期表中的位置是。(2)、基态As原子的价电子排布图为 , 基态Ga原子核外有个未成对电子。(3)、科学家合成了一种含硼阴离子[ , 其结构如图所示。其中硼原子的杂化方式为 , 该结构中共有种不同化学环境的氧原子。
25. I.回答下列问题:(1)、Pt的电子排布式为[Xe]4f145d96s1 , 则Pt在元素周期表中的位置是。(2)、基态As原子的价电子排布图为 , 基态Ga原子核外有个未成对电子。(3)、科学家合成了一种含硼阴离子[ , 其结构如图所示。其中硼原子的杂化方式为 , 该结构中共有种不同化学环境的氧原子。 (4)、四方晶系的CuFeS2晶胞结构如图所示:
(4)、四方晶系的CuFeS2晶胞结构如图所示:
①CuFeS2中各元素电负性数值从小到大的顺序为 , 晶胞中S原子的杂化方式为。
②晶胞中Cu和Fe的投影位置如图所示,设阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3。
 26. 一种用硫铜矿(主要含CuS、及少量FeO、等)为原料制备CuCl的工艺流程如下:
26. 一种用硫铜矿(主要含CuS、及少量FeO、等)为原料制备CuCl的工艺流程如下:
已知:①CuCl是难溶于水和醇的白色固体,在热水中迅速水解生成;
②CuCl在潮湿的空气中易被氧化,生成的碱式盐为;
③已知、、开始生成沉淀和沉淀完全时的pH如下表:
金属离子
开始沉淀pH
4.7
8.1
1.2
完全沉淀pH
6.7
9.6
3.2
回答下列问题:
(1)、“酸浸”时,富氧空气的作用。(2)、“酸浸”时,CuS反应的化学方程式为。(3)、用氨水调pH时,应将溶液的范围调整为。(4)、“合成”时,生成CuCl发生反应的离子方程式为。(5)、准确称取所制备的氯化亚铜样品m g,将其置于过量的溶液中,待样品完全溶解后,加入适量稀硫酸,用x mol⋅L的溶液滴定到终点,发生反应为 , 消耗溶液V mL,样品中CuCl的质量分数为(杂质不参与反应,列出计算式即可)。(6)、如图是氯化亚铜的晶胞结构,已知晶胞的棱长为a nm。
①图中原子的坐标参数:A为 , B为 , 则C的坐标参数为。
②与最短的距离是nm。
27. 氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
已知:①菱镁矿石的主要的成分是 , 还含有少量Fe、Al、Ca、Mg等元素;
②相关金属离子[]形成氢氧化物沉淀时的pH如下:
金属离子
开始沉淀的pH
3.8
1.5
6.3
10.6
8.8
9.6
沉淀完全的pH
5.2
2.8
8.3
12.6
10.8
11.6
③常温下,、的溶度积分别为、。
回答下列问题:
(1)、“焙烧”时发生的主要化学反应方程式为。(2)、浸出液“净化除杂”过程如下:首先加入 , 将氧化为 , 反应的离子方程式为。然后调节溶液pH使、沉淀完全,此时溶液的pH范围为。再加入沉淀、 , 当时,。(3)、流程中能循环利用的固态物质是。(4)、某种含Zn、Mn特殊材料的晶胞结构如图所示,该物质的化学式为。若该晶体的密度为 , 则晶体中相邻N之间的最短距离为nm(列出计算式,为阿伏加德罗常数的值)。 28. 铜、银、金在古代常用作货币,三种元素在周期表中位于同一族,回答下列问题:(1)、基态铜原子有种能量不同的电子,其价层电子排布式为:。(2)、熔点Cu Ag( 填“大于”或“小于”),原因是。(3)、Cu2+能与吡咯(
28. 铜、银、金在古代常用作货币,三种元素在周期表中位于同一族,回答下列问题:(1)、基态铜原子有种能量不同的电子,其价层电子排布式为:。(2)、熔点Cu Ag( 填“大于”或“小于”),原因是。(3)、Cu2+能与吡咯( )的阴离子(
)的阴离子( )形成双吡咯铜。
)形成双吡咯铜。①1mol吡咯中含有的σ键数为 , 吡咯熔点远高于环戊二烯(
 ), 主要原因是。
), 主要原因是。②已知吡咯中的各个原子均在同一平面内,则吡咯分子中N的杂化方式为。吡咯中的大π键可表示为。(大π键可用符号表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数, 如苯分子中的大π键可表示为 )。
(4)、Cu与Au的某种合金可形成面心立方最密堆积的晶体,Cu原子处于晶胞面心,该晶体具有储氢功能,氢原子可进到入Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构如下图所示,该晶体储氢后的化学式为。
若合金晶胞边长为apm,忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为。(写出表达式即可,储氢能力=)
29. 据《自然》学术期刊显示,厦门大学教授郑南峰,与北京大学教授江颖课题组密切合作,提出了一种铜材料表面配位防腐技术,可实现各种尺度的铜材料抗氧化。Cu及其化合物应用广泛。回答下列问题:(1)、基态Cu原子电子排布式为(2)、磷化铜与水作用产生有毒的磷化氢(PH3)。①P与N同主族,其最高价氧化物对应水化物的酸性:HNO3H3PO4(填“>”或“<”),从结构的角度说明理由:。
②P与N的氢化物空间构型相似,PH3键角NH3键角(填“>”“<"或“=”)。
(3)、胆矾(CuSO4·5H2O)为蓝色晶体,将其改写成配合物形式的化学式可书写成。其中配体的分子构型为 , 阴离子的中心原子杂化类型为 , S、O、H三种元素的电负性由大到小的顺序是; , 胆矾晶体中不包含的作用力有(填序号)。A.离子键 B.金属键 C.氢键 D.共价键 E.配位键
(4)、铜镍合金的立方晶胞结构如图所示:
已知原子O、A的分数坐标为(0,0,0)和(1,1,1),原子B的分数坐标为 , 若该晶体密度为dg·cm-3 , 则铜镍原子间最短距离为pm(列出计算式,设NA为阿伏加德罗常数的值)
30. 磷酸亚铁锂()是新能源汽车中锂离子电池常用的电极材料。对废旧电极(含、Al箔、石墨粉等)回收并获得高纯的工艺流程如下:
已知:在水中的溶解度不大,且溶解度随温度升高而减小。
(1)、回收的废旧锂离子电池需进行预放电、拆分破碎、热处理等预处理,筛分后获得正极片。下列分析不合理的是____(填标号)。A、拆分前对废旧电池进行预放电,有利于释放残余能量,消除安全隐患 B、预放电时电池中的锂离子移向正极,有利于提高正极片中锂元素的回收率 C、热处理过程可以除去废旧锂离子电池中的难溶有机物、碳粉等 D、锂离子电池不含汞、镉、铅等有毒重金属,可用普通垃圾处理方法处理(2)、过程Ⅰ为粉碎处理,为加快过程Ⅱ的反应速率,还可以采用的措施有(写出其中一种即可),过程Ⅱ中足量NaOH溶液的作用是(用离子方程式表示)。(3)、过程Ⅲ采用不同氧化剂分别进行实验,均采用Li含量为3.7%的原料,控制pH为3.5,浸取1.5h后,实验结果如下表所示:序号
酸
氧化剂
浸出液浓度(g/L)
滤渣中Li含量/%
实验1
HCl
9.02
0.10
实验2
HCl
9.05
0.08
实验3
HCl
7.05
0.93
实验2中,可与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量。综合考虑的浸出率及环保因素,选择的氧化剂最好为。
(4)、过程Ⅵ首先需洗涤“粗品”,应该用(填“热水”或“冷水”)洗。若滤液2中 , 过程Ⅴ中加入等体积的溶液后,若沉淀中的Li元素占滤液中Li元素总量的95.0%,则加入的碳酸钠溶液浓度为[已知: , 溶液混合引起的体积变化可忽略]。(5)、工业上用、、LiCl及苯胺(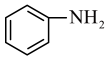 )为原料制取磷酸亚铁锂。中,的空间结构为。LiCl和均为金属氯化物,LiCl沸点1350℃,沸点315℃,两者沸点差异明显的主要原因是。 (6)、某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶胞结构(底面为平行四边形)如图所示。该晶体的化学式为 , 该晶体中最近的两个碳原子核间距离为142pm,石墨烯层间距离为335pm,则该晶体的密度为(列出计算式,用表示阿伏加德罗常数)。
)为原料制取磷酸亚铁锂。中,的空间结构为。LiCl和均为金属氯化物,LiCl沸点1350℃,沸点315℃,两者沸点差异明显的主要原因是。 (6)、某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶胞结构(底面为平行四边形)如图所示。该晶体的化学式为 , 该晶体中最近的两个碳原子核间距离为142pm,石墨烯层间距离为335pm,则该晶体的密度为(列出计算式,用表示阿伏加德罗常数)。