高考二轮复习知识点:晶体熔沸点的比较2
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列物质沸点的比较,正确的是( )A、 B、HF>HCl C、 D、
 2. 、属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在键、键。下列说法错误的是( )A、的熔点高于 B、晶体中所有化学键均为极性键 C、晶体中所有原子均采取杂化 D、晶体中所有原子的配位数均相同3. 某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍;W的最高价氧化物对应的水化物具有两性,W、X、Y三种简单离子的核外电子排布相同。下列说法正确的是( )
2. 、属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在键、键。下列说法错误的是( )A、的熔点高于 B、晶体中所有化学键均为极性键 C、晶体中所有原子均采取杂化 D、晶体中所有原子的配位数均相同3. 某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍;W的最高价氧化物对应的水化物具有两性,W、X、Y三种简单离子的核外电子排布相同。下列说法正确的是( ) A、X与Y、Y与Z均可形成X2Y、Z2Y2型化合物 B、离子半径:X>W>Y>Z C、X、Y、Z组成的化合物中只含有离子键 D、常温常压下熔点:X2Y<Z2Y4. 下列排序正确的是( )A、酸性: B、碱性: C、熔点: (金刚石) D、沸点:5. 、和均可作为燃料电池的燃料。下列说法错误的是A、、和中C、N杂化方式均相同 B、和的空间结构分别为正四面体形、三角锥形 C、、和均为极性分子 D、沸点:6. 下列事实的解释错误的是
A、X与Y、Y与Z均可形成X2Y、Z2Y2型化合物 B、离子半径:X>W>Y>Z C、X、Y、Z组成的化合物中只含有离子键 D、常温常压下熔点:X2Y<Z2Y4. 下列排序正确的是( )A、酸性: B、碱性: C、熔点: (金刚石) D、沸点:5. 、和均可作为燃料电池的燃料。下列说法错误的是A、、和中C、N杂化方式均相同 B、和的空间结构分别为正四面体形、三角锥形 C、、和均为极性分子 D、沸点:6. 下列事实的解释错误的是事实
解释
A
气态再失去一个电子比气态再失去一个电子更难
的价层电子排布为 , 轨道为半充满比较稳定;
的价层电子排布为 , 再失去一个电子可达到轨道半充满的比较稳定状态
B
中H-O-H键角比中的大
的中心原子的孤电子对数为1,的中心原子的孤电子对数为2,孤电子对之间的斥力<孤电子对与成键电子对之间的斥力<成键电子对之间的斥力
C
晶体熔点:
分子间能形成氢键
D
酸性:
氟的电负性大于氯的电负性,的极性大于的极性,使的极性大于的极性,导致的羧基中的羟基的极性更大,更易电离出
A、A B、B C、C D、D7. 下列说法错误的是A、键角: B、沸点: C、的空间结构为平面三角形 D、是极性分子8. 下列物质性质的变化与化学键强弱无关的是( )A、HF、HCl、HBr、HI的热稳定性依次减弱 B、NaF、NaCl、NaBr、NaI的熔点依次降低 C、Li、Na、K、Rb 的熔点逐渐降低 D、F2、Cl2、Br2、I2的熔、沸点逐渐升高9. 在通常条件下,下列排序错误的是( )A、硬度大小:金刚石>碳化硅>晶体硅 B、酸性强弱:甲酸>乙酸>一氯乙酸>三氯乙酸>三氟乙酸 C、水溶性大小: D、稳定性大小:10. 2021年5月15日“天问一号”着陆火星,我国拟于2028年实施火星取样返回任务。火星土壤中含有原子序数依次增大的短周期主族元素W、X、Y、Z。W为地壳中含量最多的元素,且W、Z位于同一族。X、Y、Z为同周期互不相邻的元素,Z的最外层电子数是X和Y的最外层电子数之和。下列说法正确的是( )A、熔点: B、最简单氢化物的稳定性:W>Z>Y C、和分子的VSEPR模型不同 D、工业上通常利用电解熔融XW的方法来制备X的单质11. 下列说法正确的是( )A、臭氧在水中的溶解度比氧气的小 B、的空间构型为平面三角形 C、 的沸点比
的沸点比 的高
D、基态原子3d轨道上有5个电子的元素位于VIB族或VIIB族
12. 下列事实不能从原子结构角度解释的是( )A、稳定性: B、第一电离能:N>O C、熔点: D、有机物中碳的化学键以共价键为主13. 下列各组性质的比较中,正确的是( )A、沸点:Li<Na<<K B、熔点:金刚石>晶体硅>碳化硅 C、第一电离能:S<P<Cl D、元素的电负性:N>O>F14. 科学家利用四种原子序数依次增大的短周期主族元素W、X、Y、Z“组合”成一种超分子,该超分子具有高效的催化性能,其分子结构示意图如下(注:实线代表共价键,其他重复单元的W、X未标注)。已知X、Y位于同一周期,基态Z原子中只有两种形状的电子云,最外层只有一种自旋方向的电子,下列说法正确的是( )
的高
D、基态原子3d轨道上有5个电子的元素位于VIB族或VIIB族
12. 下列事实不能从原子结构角度解释的是( )A、稳定性: B、第一电离能:N>O C、熔点: D、有机物中碳的化学键以共价键为主13. 下列各组性质的比较中,正确的是( )A、沸点:Li<Na<<K B、熔点:金刚石>晶体硅>碳化硅 C、第一电离能:S<P<Cl D、元素的电负性:N>O>F14. 科学家利用四种原子序数依次增大的短周期主族元素W、X、Y、Z“组合”成一种超分子,该超分子具有高效的催化性能,其分子结构示意图如下(注:实线代表共价键,其他重复单元的W、X未标注)。已知X、Y位于同一周期,基态Z原子中只有两种形状的电子云,最外层只有一种自旋方向的电子,下列说法正确的是( ) A、氢化物的沸点: B、Y与Z形成的化合物中只含离子键 C、由X、Y、Z形成的单质分别为共价晶体、分子晶体和金属晶体 D、该超分子反映了超分子“分子识别”的特性
A、氢化物的沸点: B、Y与Z形成的化合物中只含离子键 C、由X、Y、Z形成的单质分别为共价晶体、分子晶体和金属晶体 D、该超分子反映了超分子“分子识别”的特性二、多选题
-
15. 德国科学家发现新配方:他使用了远古地球上存在的 、 、 、 、 和HCN,再使用硫醇和铁盐等物质合成RNA的四种基本碱基。下列说法错误的是( )A、基态 价电子排布为 B、 、 、 分子间均存在氢键 C、 、 、HCN中均存在 键和 键 D、沸点: (乙硫醇)>
三、非选择题
-
16. 1962年首个稀有气体化合物问世,目前已知的稀有气体化合物中,含氙(54Xe)的最多,氪 (36Kr)次之,氩(18Ar)化合物极少。是与分子形成的加合物,其晶胞如下图所示。

回答下列问题:
(1)、基态原子的价电子排布式为。(2)、原子的活泼性依序增强,原因是。(3)、晶体熔点:(填“>”“<”或“=”),判断依据是。(4)、的中心原子的杂化轨道类型为。(5)、加合物中 , 晶体中的微粒间作用力有(填标号)。a.氢键 b.离子键 c.极性共价键 d.非极性共价键
17. [化学——选修3:物质结构与性质]卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)、氟原子激发态的电子排布式有 , 其中能量较高的是。(填标号)a. b. c. d.
(2)、①一氯乙烯分子中,C的一个杂化轨道与的轨道形成键,并且的轨道与C的轨道形成3中心4电子的大键。②一氯乙烷、一氯乙烯、一氯乙炔分子中,键长的顺序是 , 理由:(ⅰ)C的杂化轨道中s成分越多,形成的键越强;(ⅱ)。
(3)、卤化物受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为。解释X的熔点比Y高的原因。(4)、晶体中离子作体心立方堆积(如图所示),主要分布在由构成的四面体、八面体等空隙中。在电场作用下,不需要克服太大的阻力即可发生迁移。因此,晶体在电池中可作为。
已知阿伏加德罗常数为 , 则晶体的摩尔体积(列出算式)。
18. 回答下列问题:(1)、两种有机物的相关数据如表:物质
HCON(CH3)2
HCONH2
相对分子质量
73
45
沸点/℃
153
220
HCON(CH3)2的相对分子质量比HCONH2的大,但其沸点反而比HCONH2的低,主要原因是。
(2)、四种晶体的熔点数据如表:物质
CF4
SiF4
BF3
AlF3
熔点/℃
-183
-90
-127
>1000
CF4和SiF4熔点相差较小,BF3和AlF3熔点相差较大,原因是。
19. 缩二脲的结构为 ,在碱性溶液中与硫酸铜反应生成
,在碱性溶液中与硫酸铜反应生成  ,从而使溶液呈现紫红色。凡是含有两个酰胺链段( )的化合物都能发生这个反应,所以常用此法检验蛋白质。
(1)、从核外电子排布分析,Cu2+和Cu+相比,更稳定,原因是。(2)、N、O、C三种元素的第一电离能从小到大的顺序为 , 最简单氢化物的沸点从低到高的顺序为(填化学式)。(3)、在缩二脲分子中,碳原子的杂化类型为 , 氮原子的价层电子对数为。(4)、黄铜矿的晶胞如图所示,则黄铜矿的化学式为 , 若该晶胞的高为h nm,密度为d g/cm3 , 则该晶胞的底面边长为nm(用含d、h、NA的代数式表示,设NA表示阿伏加德罗常数的值)。
,从而使溶液呈现紫红色。凡是含有两个酰胺链段( )的化合物都能发生这个反应,所以常用此法检验蛋白质。
(1)、从核外电子排布分析,Cu2+和Cu+相比,更稳定,原因是。(2)、N、O、C三种元素的第一电离能从小到大的顺序为 , 最简单氢化物的沸点从低到高的顺序为(填化学式)。(3)、在缩二脲分子中,碳原子的杂化类型为 , 氮原子的价层电子对数为。(4)、黄铜矿的晶胞如图所示,则黄铜矿的化学式为 , 若该晶胞的高为h nm,密度为d g/cm3 , 则该晶胞的底面边长为nm(用含d、h、NA的代数式表示,设NA表示阿伏加德罗常数的值)。 20. 我国的超级钢研究已居于世界领先地位,这种超级钢中含Mn10%、C0.47%、Al2%、V0.7%,其强度很大,在应用时能够实现钢板的轻薄化。回答下列问题:(1)、基态Mn原子和V原子未成对电子数之比为。(2)、下列状态的铝中,电离最外层一个电子所需能量最大的是___________。A、[Ne]3s2 B、[Ne]3s23p1 C、[Ne]3s24s1 D、[Ne]3s1(3)、NH3的VSEPR模型的名称是 , 写出一种和NH3互为等电子体的阳离子的化学式。分子中的大π键可用符号∏ 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为∏ ),则平面分子
20. 我国的超级钢研究已居于世界领先地位,这种超级钢中含Mn10%、C0.47%、Al2%、V0.7%,其强度很大,在应用时能够实现钢板的轻薄化。回答下列问题:(1)、基态Mn原子和V原子未成对电子数之比为。(2)、下列状态的铝中,电离最外层一个电子所需能量最大的是___________。A、[Ne]3s2 B、[Ne]3s23p1 C、[Ne]3s24s1 D、[Ne]3s1(3)、NH3的VSEPR模型的名称是 , 写出一种和NH3互为等电子体的阳离子的化学式。分子中的大π键可用符号∏ 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为∏ ),则平面分子 中的大π键应表示为。 (4)、谷氨酸(HOOC-CH(NH2)-CH2-CH2-COOH)的钠盐-谷氨酸钠(C5H8NO4Na)是味精的主要成分,谷氨酸分子中C原子的杂化方式为 , C原子与O原子所形成的化学键中σ键与π键的数目比n(σ)∶n(π)= , π键的特征是两块电子云呈对称。(5)、Al2O3、N2、CO的沸点从高到低的顺序为。原因是 。(6)、已知NaAlH4晶胞结构如图所示,它由两个正六面体叠加而成,Na+的配位数为。已知正六面体的棱长anm,NA为阿伏加德罗常数的值,则NaAlH4晶体的密度是 g• cm-3 (列出计算式)。
中的大π键应表示为。 (4)、谷氨酸(HOOC-CH(NH2)-CH2-CH2-COOH)的钠盐-谷氨酸钠(C5H8NO4Na)是味精的主要成分,谷氨酸分子中C原子的杂化方式为 , C原子与O原子所形成的化学键中σ键与π键的数目比n(σ)∶n(π)= , π键的特征是两块电子云呈对称。(5)、Al2O3、N2、CO的沸点从高到低的顺序为。原因是 。(6)、已知NaAlH4晶胞结构如图所示,它由两个正六面体叠加而成,Na+的配位数为。已知正六面体的棱长anm,NA为阿伏加德罗常数的值,则NaAlH4晶体的密度是 g• cm-3 (列出计算式)。 21. 研究发现,在 低压合成甲醇反应( )中, 氧化物负载的 氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。
21. 研究发现,在 低压合成甲醇反应( )中, 氧化物负载的 氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)、 位于周期表的第族, 基态原子核外有个未成对电子。(2)、 的电子式为 , 分子中σ键与π键的数目比为。(3)、比较键能: (填“>”、“<”或“=”)。(4)、 晶体的熔点高于干冰的原因是。(5)、锗( )与C同族, 原子比C原子多两个电子层,则 的原子序数为。(6)、镍的氧化物也常用作催化剂, 的晶胞结构如图所示,该晶体中 周围与其等距离且最近的 有个,原子坐标参数表示晶胞内部各原子的相对位置,若该晶胞中原子坐标参数A为 ,B为 ,则C的原子坐标参数为。 22. 元素的金属性、非金属性及有关单质和化合物的性质与其原子结构、分子结构等有着密切的联系。回答。下列问题:(1)、下列基态原子的核外电子排布式正确的是 (填序号)。A、 B、 C、 D、(2)、第IA、IIA族部分元素氯化物的熔点如下表,从NaCl到CsCl熔点依次降低,但BeCl2的熔点比MgCl2的低,其原因是。
22. 元素的金属性、非金属性及有关单质和化合物的性质与其原子结构、分子结构等有着密切的联系。回答。下列问题:(1)、下列基态原子的核外电子排布式正确的是 (填序号)。A、 B、 C、 D、(2)、第IA、IIA族部分元素氯化物的熔点如下表,从NaCl到CsCl熔点依次降低,但BeCl2的熔点比MgCl2的低,其原因是。氯化物
NaCl
KCl
RbCl
CsCl
熔点/℃
801
776
715
645
405
714
(3)、下列物质的变化破坏了极性共价键的是 (填序号)。乙酸中碳原子的杂化方式为 , 1 mol乙酸分子中含有的σ键和π键的个数比为;乙酸易溶于水的原因是相似相溶,以及。A.二氧化硅晶体熔化 B.乙酸溶于水 C.干冰升华 D.冰融化
(4)、某晶体的晶胞如图所示,则该晶体的化学式为;已知该晶体的晶胞边长为540 pm,阿伏加德罗常数的值为 ,则体积为10 cm3晶体的质量为 g(列出计算式即可)。 23.(1)、Ⅰ.主族元素能形成多种化合物,它们是探测器、激光器、微波器的重要材料。
23.(1)、Ⅰ.主族元素能形成多种化合物,它们是探测器、激光器、微波器的重要材料。氧原子价电子层上的电子可以进行重排以便提供一个空轨道与氮原子形成配位键,该氧原子重排后的价电子排布图为 , 电子重排后的氧原子能量有所升高,原因是不符合(填“泡利原理”或“洪特规则”)。
(2)、自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据下表数据分析其原因是。化学键
B-H
B-O
B-B
键能(kJ·mol-1)
389
561
293
(3)、NH3与BF3气体相遇发生反应生成F3B-NH3晶体①F3B-NH3晶体中,B原子的杂化轨道类型为。
②F3B-NH3晶体中不存在的作用力有。
a.σ键 b.π键 c.离子键 d.配位键 e.范德华力
(4)、已知:物质
AsF3
AsCl3
BiF3
沸点/℃
62.8
130.2
900.0
解释表中物质之间沸点差异的原因。
(5)、Ⅱ.储氢合金能有效解决氢气的储存和运输,对大规模使用氢能具有重要意义。某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示。M是(填元素符号),判断理由是。
I1/kJ·mol-1
I2/kJ·mol-1
I3/kJ·mol-1
I4/kJ·mol-1
I5/kJ·mol-1
738
1451
7733
10540
13630
(6)、过渡金属Q与镧(La)形成的合金也是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1;该合金的晶胞结构和z轴方向的投影图如图所示。
若阿伏加德罗常数的值为NA , 则该合金的密度ρ=g·cm-3(用含a、c、NA的代数式表示,列出计算式即可)。
24. 近日,复旦大学、北京大学和上海电力大学等的研究团队共同报道了一种新型NASICON相铁基磷酸盐负极材料Na3Fe2(PO4)P2O7。回答下列问题:(1)、基态Fe2+的价电子排布式为。(2)、Na3Fe2(PO4)P2O7中PO 的空间构型为 , 研究表明,该负极材料发生反应:Na3Fe2(PO4)P2O7-e-=Na2Fe2(PO4)P2O7+Na+ , Na2Fe2(PO4)P2O7-e-=NaFe2(PO4)P2O7+Na+。指出Na2Fe2(PO4)P2O7中Fe2+:Fe3+=。(3)、K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。①铁氰化钾中不存在的作用力有(填标号)。
a.离子键 b.极性键 c.非极性键 d.π键 e.配位键 f.氢键
②1mol[Fe(CN)6]3-中含有的σ键数目为(设NA为阿伏加德罗常数的值)。
(4)、NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的半径分别为6.9×10-2nm和7.8×10-2nm,则熔点:NiO(填“<”、“=”或“>”)FeO,试说明判断理由。(5)、一种铁氮化合物具有高磁导率,密度为ρg·cm-3 , 其结构如图所示:
①该铁氮化合物的化学式为。
②计算Fe(Ⅱ)构成正八面体的体积为cm3。
25. 2019年诺贝尔化学奖授予约翰·古德伊纳夫、斯坦利·惠廷汉和吉野彰三位科学家,以表彰他们在锂电池领域所做出的巨大贡献。请回答下列问题:(1)、LiCoO2、LiFePO4常用作锂离子电池的正极材料。①基态Co原子核外电子排布式为;
②基态磷原子中,电子占据的最高能层符号为;该能层能量最高的电子云在空间有个伸展方向。
(2)、[Co(NO3)4]2-的配体中N原子的杂化方式为 , 该配离子中各元素的第一电离能由小到大的顺序为(填元素符号),1mol该配离子中含σ键数目为NA。(3)、LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
这类磷酸根离子的化学式可用通式表示为(用n代表P原子数)。
(4)、①Li2O被广泛用作玻璃的组分,其熔点Na2O(填高于或者低于),判断理由。②Li2O具有反萤石结构,晶胞如图所示,已知其晶胞参数为0.4665nm,NA为阿伏加德罗常数的值,则Li2O的密度为g·cm-3(列出计算式)。
 26. 铅是一种高密度、柔软的蓝灰色金属。2019年7月23日,铅被列入有害水污染物名录。请回答下列问题。(1)、Pb位于第六周期,与C元素同族。请写出它的外围电子排布式 , 对比以下三种氧化物的熔沸点 、 、 ,从小到大分别为 , 请解释原因:。(2)、铅在自然界主要以方铅矿(PbS)及白铅矿( )的形式存在,也存在于铅矾( )中。 中心原子轨道的杂化类型 , 的空间构型。(3)、四乙基铅[ ]曾广泛用作汽油中的抗爆剂,由Pb提供空轨道,有机原子团提供孤电子对形成,该化合物中存在化学键类型有_____________A、金属键 B、离子键 C、共价键 D、配位键(4)、第三代太阳能电池利用有机金属卤化物碘化铅甲胺( )半导体作为吸光材料, 具有钙钛矿( )的立方结构,其晶胞如图所示:
26. 铅是一种高密度、柔软的蓝灰色金属。2019年7月23日,铅被列入有害水污染物名录。请回答下列问题。(1)、Pb位于第六周期,与C元素同族。请写出它的外围电子排布式 , 对比以下三种氧化物的熔沸点 、 、 ,从小到大分别为 , 请解释原因:。(2)、铅在自然界主要以方铅矿(PbS)及白铅矿( )的形式存在,也存在于铅矾( )中。 中心原子轨道的杂化类型 , 的空间构型。(3)、四乙基铅[ ]曾广泛用作汽油中的抗爆剂,由Pb提供空轨道,有机原子团提供孤电子对形成,该化合物中存在化学键类型有_____________A、金属键 B、离子键 C、共价键 D、配位键(4)、第三代太阳能电池利用有机金属卤化物碘化铅甲胺( )半导体作为吸光材料, 具有钙钛矿( )的立方结构,其晶胞如图所示:
①比较元素电负性:CN(填“>”或“<”),比较基态原子第一电离能:CPb(填“>”或“<”)
② 晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M在晶胞中处于位置,X在晶胞中处于位置。
③ 晶体的晶胞边长为a nm,其晶体密度为d ,则阿伏加德罗常数的值NA的计算表达式为
27. 氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:(1)、氟代硼酸钾中非金属元素原子的电负性大小顺序是 。基态K+的电子排布式为。(2)、NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是 , 中心原子的杂化方式为。NaBH4中存在(填标号)。a.离子键 b.氢键 c.σ键 d.π键
(3)、BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为 , 其中Be的配位数为。(4)、第三周期元素氟化物的熔点如下表:化合物
NaF
MgF2
AlF3
SiF4
PF5
SF6
熔点/℃
993
1261
1291
-90
-83
-50.5
解释表中氟化物熔点变化的原因:。
(5)、CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA , 则CaF2的密度ρ=__g·cm-3(列出计算表达式)。 28. 在人类文明的历程中,改变世界的事物很多,其中铁、聚乙烯、二氧化硅、苯、青霉素、氨等17种“分子”改变过人类的世界。(1)、铁离子的价层电子排布图为。(2)、碳化硅晶体、硅晶体、金刚石均是原子晶体,用化学式表示其熔点由高到低的顺序是。(3)、1mol 苯分子中含有σ键的数目为。(4)、6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子电负性由大到小的顺序是。
28. 在人类文明的历程中,改变世界的事物很多,其中铁、聚乙烯、二氧化硅、苯、青霉素、氨等17种“分子”改变过人类的世界。(1)、铁离子的价层电子排布图为。(2)、碳化硅晶体、硅晶体、金刚石均是原子晶体,用化学式表示其熔点由高到低的顺序是。(3)、1mol 苯分子中含有σ键的数目为。(4)、6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子电负性由大到小的顺序是。
 (5)、铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该产物的化学式。(6)、晶胞有两个基本要素:
(5)、铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该产物的化学式。(6)、晶胞有两个基本要素:①原子坐标参数:表示晶胞内部各微粒的相对位置。如图是CaF2的晶胞,其中原子坐标参数A处为(- ,- ,0);B处为(0,0,0);则C处微粒的坐标参数为。

②晶胞参数:描述晶胞的大小和形状。晶胞参数a pm,求CaF2晶体的密度为g·cm-3 , (NA为阿伏加德罗常数的值,用含a、NA的式子表示)。
29. 自然界中含锰元素的主要矿物有软锰矿(MnO2·xH2O)、黑锰矿Mn3O4 , 大洋底部有大量锰结核矿。锰元素在多个领域中均有重要应用,用于制合金,能改善钢的抗冲击性能等。(1)、Mn在元素周期表中位于区,核外电子占据最高能层的符号是 , 金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用“理论”解释。(2)、Mn3+在水溶液中容易歧化为MnO2和Mn2+ , 下列说法合理的是___。A、Mn3+的价电子构型为3d4 , 不属于较稳定的电子构型 B、根据Mn2+的电子构型可知,Mn2+中不含成对电子 C、第四周期元素中,锰原子价电子层中未成对电子数最多 D、Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似(3)、在K2MnF6中,MnF62-的空间构型是正八面体,则中心原子的价层电子对数为。该化合物中含有的共价键在形成过程中原子轨道的重叠方式为。(4)、二价锰的化合物MnO和MnS熔融态均能导电,熔点MnOMnS(选填“高于”、“等于”、“低于”)并解释原因。(5)、某锰氧化物的晶胞结构如图:
该锰的氧化物的化学式为 , 该晶体中Mn的配位数为 , 该晶体中Mn之间的最近距离为pm(用a、b来表示)。
30. Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。(1)、基态Fe原子中,电子填充的能量最高的能级符号为。(2)、在空气中FeO稳定性小于Fe2O3 , 从电子排布的角度分析,其主要原因是。(3)、铁氰化钾(K3[Fe(CN)6])溶液是检验Fe2+常用的试剂。1mol[Fe(CN)6]3-含σ键的数目为。(4)、Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是。配体N 中心原子的杂化类型为。CoO的熔点是1935℃,CoS的熔点是1135℃,试分析CoO的熔点较高的原因 。(5)、NiO的晶胞结构如图所示,其中原子坐标参数A为(0,0,0) ,B为(1,1,0),则C原子坐标参数为。 31. 用还原铁粉制备二茂铁开辟了金属有机化合物研究的新领域。二茂铁甲酰胺是其中一种重要的衍生物,结构如图所示。
31. 用还原铁粉制备二茂铁开辟了金属有机化合物研究的新领域。二茂铁甲酰胺是其中一种重要的衍生物,结构如图所示。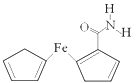 (1)、基态Fe原子价层电子排布式是。(2)、已知二茂铁甲酰胺熔点是176℃,沸点是249℃,难溶于水,易溶于氯仿、丙酮等有机溶剂。据此可推断二茂铁甲酰胺晶体为晶体。(3)、二茂铁甲酰胺中碳原子的杂化方式为 , H、C、N、O四种元素的电负性由大到小的顺序是。(4)、碳、氮元素对应的最简单氢化物分别是CH4和NH3 , 相同条件下CH4的沸点比NH3的沸点(填“高”或“低”),主要原因是。(5)、氢、氮、氧三种元素按照4:2:3的原子个数比形成离子化合物。该离子化合物中,阳离子空间构型是 , 1 mol阴离子含有σ键的数目为。(6)、氮和铁能形成一种磁性材料,其晶胞如图所示,该磁性材料的化学式为。已知晶胞参数为a nm,则该晶胞密度的计算式为ρ=g/cm3(用NA表示阿伏加德罗常数的值)。
(1)、基态Fe原子价层电子排布式是。(2)、已知二茂铁甲酰胺熔点是176℃,沸点是249℃,难溶于水,易溶于氯仿、丙酮等有机溶剂。据此可推断二茂铁甲酰胺晶体为晶体。(3)、二茂铁甲酰胺中碳原子的杂化方式为 , H、C、N、O四种元素的电负性由大到小的顺序是。(4)、碳、氮元素对应的最简单氢化物分别是CH4和NH3 , 相同条件下CH4的沸点比NH3的沸点(填“高”或“低”),主要原因是。(5)、氢、氮、氧三种元素按照4:2:3的原子个数比形成离子化合物。该离子化合物中,阳离子空间构型是 , 1 mol阴离子含有σ键的数目为。(6)、氮和铁能形成一种磁性材料,其晶胞如图所示,该磁性材料的化学式为。已知晶胞参数为a nm,则该晶胞密度的计算式为ρ=g/cm3(用NA表示阿伏加德罗常数的值)。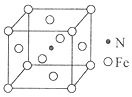 32. 碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:(1)、基态氯原子的价电子排布图是;基态铜原子核外电子占有的空间运动状态有种(2)、碳、氮、氧三种元素中第一电离能最大的是 (填元素符号)CO32-中碳原子的杂化轨道类型为。(3)、相同条件下,水的沸点高于液氨,原因是。(4)、铜与CNˉ可形成络合离子[Cu(CNˉ)4]2- , 写出一种与CNˉ互为等电子体的分子的化学式;1 mol[ Cu(CNˉ)4]2-中含有molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为。(5)、氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为g·cm-3
32. 碳、氮、氧、氯、钠、铜等元素的化合物广泛存在于自然界,回答下列问题:(1)、基态氯原子的价电子排布图是;基态铜原子核外电子占有的空间运动状态有种(2)、碳、氮、氧三种元素中第一电离能最大的是 (填元素符号)CO32-中碳原子的杂化轨道类型为。(3)、相同条件下,水的沸点高于液氨,原因是。(4)、铜与CNˉ可形成络合离子[Cu(CNˉ)4]2- , 写出一种与CNˉ互为等电子体的分子的化学式;1 mol[ Cu(CNˉ)4]2-中含有molσ键;若将[Cu(CNˉ)4]2-中二个CNˉ换为Clˉ,只有一种结构,则[Cu(CNˉ)4]2-中4个氮原子所处空间位置关系为。(5)、氯化钠的晶胞如图所示。晶体中氯离子以面心立方最密堆积排列,钠离子嵌入在氯离子之间的空隙中。一个氯离子周围离氯离子最近的氯离子数目为个。已知:半径r(Clˉ)=apm,r(Na+)=bpm。摩尔质量M(NaCI)=cg·mol-1则氯化钠晶体的密度为g·cm-3 33. B、N、Co均为新型材料的重要组成元素。请回答下列问题:(1)、基态Co原子核外电子占据种不同的能级,其中有个未成对电子。(2)、Co能形成。
33. B、N、Co均为新型材料的重要组成元素。请回答下列问题:(1)、基态Co原子核外电子占据种不同的能级,其中有个未成对电子。(2)、Co能形成。①1mol该离子中含有σ键的数目为。
②相同压强下,CO晶体的熔点高于晶体的原因是。
(3)、氟硼酸铵()用作铝、铜和铝合金焊接助熔剂、镁铸件防氧化添加剂、阻燃剂、农用杀虫、杀菌剂、树脂黏结剂等。是合成氮化硼纳米管的原料之一。①1mol 含有mol配位键。
②第一电离能大小介于B和N之间的基态原子第一电离能由大到小的顺序为(用元素符号表示)。
③的空间立体构型为 , 其中硼原子的杂化轨道类型为。
34. 碳、硅是第ⅣA族相邻元素,其性质既有相似性又有不同。回答下列问题。(1)、下列是碳原子基态电子排布式的是;是碳原子激发态电子排布式且能量较高的是。A.1s22s22p13s1 B.1s22s22p2 C.1s22s22p13d1 D.1s22s23p1
(2)、碳和硅都是非金属元素,由下列键能数据回答:化学键
C=O
Si-O
C-C
Si-Si
键能/kJ•mol-1
799
452
346
222
①金刚石和晶体硅的硬度:金刚石晶体硅(填“>、<、=”);原因是。
②二氧化碳和二氧化硅的熔点:二氧化碳二氧化硅(填“>、<、=”);原因是。
(3)、CO2中C的杂化方式;C、O形成的σ共价键是(填标号)。A.s-s共价键 B.s-p共价键 C.sp-s共价键 D.sp-p共价键
(4)、如图,壳核结构的纳米金属及其氧化物材料做催化剂,在有H2O存在的条件下,利用光能,CO2逐步氢化为甲烷。写出此反应的化学反应方程式(图中“-”表示电子;“+”表示失去电子后带正电荷的空穴。) (5)、SiO2有多种晶体,最常见的低温水晶(α-石英),它具有由硅氧四面体[SiO4]通过共用顶角氧原子形成的螺旋链状结构。如图为硅氧四面体一维连接图,写出12个Si一维连接的化学式。
(5)、SiO2有多种晶体,最常见的低温水晶(α-石英),它具有由硅氧四面体[SiO4]通过共用顶角氧原子形成的螺旋链状结构。如图为硅氧四面体一维连接图,写出12个Si一维连接的化学式。 35. 铁及其化合物在化工、医药、材料等领域具有广泛应用,回答下列问题:(1)、Fe元素位于元素周期表的区,与Fe同周期的所有元素的基态原子中,未成对电子数与Fe3+相同的元素有种。(2)、FeCl3蒸汽状态下以双聚分子(
35. 铁及其化合物在化工、医药、材料等领域具有广泛应用,回答下列问题:(1)、Fe元素位于元素周期表的区,与Fe同周期的所有元素的基态原子中,未成对电子数与Fe3+相同的元素有种。(2)、FeCl3蒸汽状态下以双聚分子(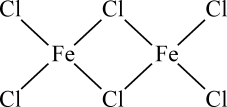 )形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是;FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+ , 结构如图所示。在该双核阳离子中,H—O—H键角(填“大于”、“小于”或“等于”)H2O的H—O—H键角;若对FeCl3水溶液进行加热,该对核阳离子内部首先断开的是键(填“a”或“b”)。
)形式存在,FeCl3的熔点(306℃)是著低于FeF3的熔点(1000℃)的原因是;FeCl3水溶液中Fe3+可水解生成双核阳离子[Fe2(H2O)8(OH)2]4+ , 结构如图所示。在该双核阳离子中,H—O—H键角(填“大于”、“小于”或“等于”)H2O的H—O—H键角;若对FeCl3水溶液进行加热,该对核阳离子内部首先断开的是键(填“a”或“b”)。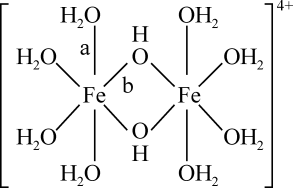 (3)、用K4[Fe(CN)6]可检验溶液中Fe3+的存在,CN-中C原子的杂化方式为 , K4[Fe(CN)6]中存在(填代号)。
(3)、用K4[Fe(CN)6]可检验溶液中Fe3+的存在,CN-中C原子的杂化方式为 , K4[Fe(CN)6]中存在(填代号)。a.离子键|b.氢键 c.配位键 d.金属键
(4)、Fe4N的晶胞沿x、y、z轴投影均如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(4-n)CunN,Fe4N转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为;Fe4N晶胞中与N最近的Fe原子数为;Fe与Fe之间的最短距离为cm。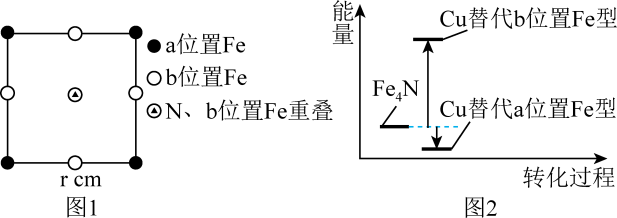
-