高考二轮复习知识点:晶体熔沸点的比较1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
选项
性质差异
结构因素
A
沸点:正戊烷(36.1℃)高于新戊烷(9.5℃)
分子间作用力
B
熔点:(1040℃)远高于(178℃升华)
晶体类型
C
酸性:()远强于()
羟基极性
D
溶解度(20℃):(29g)大于(8g)
阴离子电荷
A、A B、B C、C D、D2. 下列物质中属于耐高温酸性氧化物的是A、 B、 C、 D、3. 下列类比或推理合理的是( )已知
方法
结论
A
沸点:
类比
沸点:
B
酸性:
类比
酸性:
C
金属性:
推理
氧化性:
D
:
推理
溶解度:
A、A B、B C、C D、D4. 下列物质沸点的比较,正确的是A、<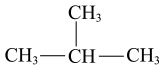 B、
C、
D、
5. 下列物质沸点的比较,正确的是( )A、<
B、
C、
D、
5. 下列物质沸点的比较,正确的是( )A、< B、
C、
D、
6. 黄鸣龙是唯一一个名字写进有机化学课本的中国人,Wolff-Kishner-黄鸣龙还原反应机理如下(R、R’均代表烃基),下列有关说法错误的是
B、
C、
D、
6. 黄鸣龙是唯一一个名字写进有机化学课本的中国人,Wolff-Kishner-黄鸣龙还原反应机理如下(R、R’均代表烃基),下列有关说法错误的是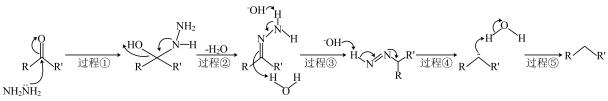 A、肼的沸点高于氨气,原因是分子间氢键数目更多,且相对分子质量更大 B、过程①发生加成反应,过程②、③均发生消去反应 C、过程④的反应历程可表示为:
A、肼的沸点高于氨气,原因是分子间氢键数目更多,且相对分子质量更大 B、过程①发生加成反应,过程②、③均发生消去反应 C、过程④的反应历程可表示为: +OH—
+OH— +N2↑+H2O
D、应用该机理,
+N2↑+H2O
D、应用该机理, 可以在碱性条件下转变为
可以在碱性条件下转变为 7. 叠氮化合物是重要的有机合成试剂,化学兴趣小组的同学在实验室制备了一种叠氮化合物 , 结构如图,下列说法正确的是
7. 叠氮化合物是重要的有机合成试剂,化学兴趣小组的同学在实验室制备了一种叠氮化合物 , 结构如图,下列说法正确的是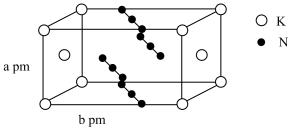 A、该晶体中每个周围离最近且相等的共有8个 B、测定该晶体结构的方法是红外光谱法 C、与相比,的熔点低于的熔点 D、该叠氮化合物的密度为8. “结构决定性质”是化学学科的核心观念。下列有关性质的比较正确的是A、在水中的溶解度:戊醇<乙醇 B、熔点:MgO<CaO C、硬度:金刚石<碳化硅<硅 D、第一电离能:Cl<P<S9. 下列熔点最高的轻金属是( )A、Na B、Mg C、Al D、Fe10. 下列事实不能直接从原子结构角度解释的是( )A、化合物ICl中I为+1价 B、第一电离能:B>Al C、沸点:CS2>CO2 D、热稳定性:NH3>PH311. 一种新型电池电解质阴离子结构式如图所示。W、X、Y、Z为原子序数依次增大的同一短周期元素,X原子的最外层电子数等于其电子层数的2倍。下列说法错误的是( )
A、该晶体中每个周围离最近且相等的共有8个 B、测定该晶体结构的方法是红外光谱法 C、与相比,的熔点低于的熔点 D、该叠氮化合物的密度为8. “结构决定性质”是化学学科的核心观念。下列有关性质的比较正确的是A、在水中的溶解度:戊醇<乙醇 B、熔点:MgO<CaO C、硬度:金刚石<碳化硅<硅 D、第一电离能:Cl<P<S9. 下列熔点最高的轻金属是( )A、Na B、Mg C、Al D、Fe10. 下列事实不能直接从原子结构角度解释的是( )A、化合物ICl中I为+1价 B、第一电离能:B>Al C、沸点:CS2>CO2 D、热稳定性:NH3>PH311. 一种新型电池电解质阴离子结构式如图所示。W、X、Y、Z为原子序数依次增大的同一短周期元素,X原子的最外层电子数等于其电子层数的2倍。下列说法错误的是( ) A、非金属性:Z>Y>X B、Z的简单氢化物的沸点是同主族元素中最大的 C、X、W的最高价氧化物对应的水化物的酸性:W>X D、该阴离子中所有原子最外层均满足8电子稳定结构12. 下列说法正确的是( )A、和分子中均含有s-p键 B、和的VSEPR模型和空间结构均一致 C、熔点:金刚石>碳化硅>晶体硅 D、酸性:13. PH3是一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是( )A、PH3分子呈三角锥形 B、PH3分子是极性分子 C、PH3沸点低于NH3沸点,因为P-H键键能低 D、PH3分子稳定性低于NH3分子,因为N-H键键高
A、非金属性:Z>Y>X B、Z的简单氢化物的沸点是同主族元素中最大的 C、X、W的最高价氧化物对应的水化物的酸性:W>X D、该阴离子中所有原子最外层均满足8电子稳定结构12. 下列说法正确的是( )A、和分子中均含有s-p键 B、和的VSEPR模型和空间结构均一致 C、熔点:金刚石>碳化硅>晶体硅 D、酸性:13. PH3是一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是( )A、PH3分子呈三角锥形 B、PH3分子是极性分子 C、PH3沸点低于NH3沸点,因为P-H键键能低 D、PH3分子稳定性低于NH3分子,因为N-H键键高二、非选择题
-
14. 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物()。回答下列问题:(1)、基态原子的价电子排布式为。橄榄石中,各元素电负性大小顺序为 , 铁的化合价为。(2)、已知一些物质的熔点数据如下表:
物质
熔点/℃
800.7
与均为第三周期元素,熔点明显高于 , 原因是。分析同族元素的氯化物、、熔点变化趋势及其原因。的空间结构为 , 其中的轨道杂化形式为。
(3)、一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有个。该物质化学式为 , B-B最近距离为。 15. 将酞菁—钴钛—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:(1)、图1所示的几种碳单质,它们互为 , 其中属于原子晶体的是 , 间的作用力是。
15. 将酞菁—钴钛—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:(1)、图1所示的几种碳单质,它们互为 , 其中属于原子晶体的是 , 间的作用力是。 (2)、酞菁和钴酞菁的分子结构如图2所示。
(2)、酞菁和钴酞菁的分子结构如图2所示。
酞菁分子中所有原子共平面,其中轨道能提供一对电子的原子是(填图2酞菁中原子的标号)。钴酞菁分子中,钴离子的化合价为 , 氮原子提供孤对电子与钴离子形成键。
(3)、气态通常以二聚体的形式存在,其空间结构如图3a所示,二聚体中的轨道杂化类型为。的熔点为 , 远高于的 , 由此可以判断铝氟之间的化学键为键。结构属立方晶系,晶胞如图3b所示,的配位数为。若晶胞参数为 , 晶体密度(列出计算式,阿伏加德罗常数的值为)。 16. 氯化钠是一种典型且极具魅力的晶体,我们通过学习氯化钠可以更好地了解其他类似物质的结构。已知氯化钠的晶胞如下图所示。
16. 氯化钠是一种典型且极具魅力的晶体,我们通过学习氯化钠可以更好地了解其他类似物质的结构。已知氯化钠的晶胞如下图所示。 (1)、下列关于氯化钠的说法正确的是____。A、基态的电子有5种空间运动状态 B、钠是第一电离能最大的碱金属元素 C、氯原子的价电子排布式可写成 D、每个氯离子周围与它最近且等距的氯离子有12个(2)、已知的密度为 , 的摩尔质量为 , 阿伏加德罗常数的值为 , 则在晶体里和的最短距离为。(3)、温度升高时,晶体出现缺陷,如图2所示,当图中方格内填入时,恰好构成氯化钠晶胞的1/8。晶体出现缺陷时,其导电性大大增强,原因是。
(1)、下列关于氯化钠的说法正确的是____。A、基态的电子有5种空间运动状态 B、钠是第一电离能最大的碱金属元素 C、氯原子的价电子排布式可写成 D、每个氯离子周围与它最近且等距的氯离子有12个(2)、已知的密度为 , 的摩尔质量为 , 阿伏加德罗常数的值为 , 则在晶体里和的最短距离为。(3)、温度升高时,晶体出现缺陷,如图2所示,当图中方格内填入时,恰好构成氯化钠晶胞的1/8。晶体出现缺陷时,其导电性大大增强,原因是。 (4)、、的晶体类型与氯化钠相同,和的离子半径分别为和 , 则熔点:(填“>”“<”或“=”)(5)、钡在氧气中燃烧时得到一种钡的氧化物晶体,其阴阳离子的排布与氯化钠相同,其中存在的化学键的类型为。17. 氮族元素是一类重要元素,广泛应用于生产生活,特别是在医药、纳米材料制备中。回答下列问题:(1)、基态磷原子核外电子的空间运动状态共有种。N、P同族,性质相似。氮原子间可形成键能很大的氮氮三键而磷原子间不能形成类似结构的原因是。(2)、肼(N2H4)和偏二甲肼[(CH3)2NNH2]均为无色液体,属于同系物,是常用的火箭推进剂,其熔沸点如表:
(4)、、的晶体类型与氯化钠相同,和的离子半径分别为和 , 则熔点:(填“>”“<”或“=”)(5)、钡在氧气中燃烧时得到一种钡的氧化物晶体,其阴阳离子的排布与氯化钠相同,其中存在的化学键的类型为。17. 氮族元素是一类重要元素,广泛应用于生产生活,特别是在医药、纳米材料制备中。回答下列问题:(1)、基态磷原子核外电子的空间运动状态共有种。N、P同族,性质相似。氮原子间可形成键能很大的氮氮三键而磷原子间不能形成类似结构的原因是。(2)、肼(N2H4)和偏二甲肼[(CH3)2NNH2]均为无色液体,属于同系物,是常用的火箭推进剂,其熔沸点如表:物质
肼
偏二甲肼
熔点
1.4℃
-58℃
沸点
113.5℃
63.9℃
二者熔沸点差异较大的主要原因是。
(3)、在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键,简称大π键。可用符号Π表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯分子中的大π键可表示为Π。计算表明,N4H结构如图所示,只有一种化学环境的氢原子,其中的大π键可表示为。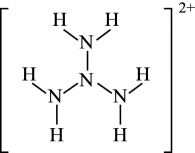 (4)、氮化硼(BN)是由氮原子和硼原子所构成的晶体。工业上制备氮化硼的一种方法为BCl3(g)+NH3(g)=BN(s)+3HCl(g)。形成BCl3时,基态B原子价电子层上的电子先激发再杂化,激发时B原子的价电子轨道表示式可能为____(填标号)。A、
(4)、氮化硼(BN)是由氮原子和硼原子所构成的晶体。工业上制备氮化硼的一种方法为BCl3(g)+NH3(g)=BN(s)+3HCl(g)。形成BCl3时,基态B原子价电子层上的电子先激发再杂化,激发时B原子的价电子轨道表示式可能为____(填标号)。A、 B、
B、 C、
C、 D、
D、 (5)、新型半导体材料立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是;如图所示,砷化镓晶体中砷原子作立方最密堆积,镓原子填入间隔的四面体空隙中。已知晶胞中原子1的坐标为(0,0,0),原子2的坐标为( , , ),则原子3的坐标为。砷化镓的密度为ρg•cm-3 , 阿伏加德罗常数的值为NA , 计算晶体中砷原子和镓原子的核间距pm。
(5)、新型半导体材料立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是;如图所示,砷化镓晶体中砷原子作立方最密堆积,镓原子填入间隔的四面体空隙中。已知晶胞中原子1的坐标为(0,0,0),原子2的坐标为( , , ),则原子3的坐标为。砷化镓的密度为ρg•cm-3 , 阿伏加德罗常数的值为NA , 计算晶体中砷原子和镓原子的核间距pm。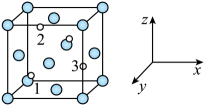 18. 我国提取的月壤样品主要是由硅酸盐组成的辉石、斜长石,回答下列问题:(1)、基态硅原子的价电子排布图为。(2)、CO2与SiO2是同主族氧化物,但熔沸点差距很大,其原因是。(3)、硅酸盐阴离子的基本结构单元如图1所示,其化学式;图2阴离子由两个图1单元共用1个顶角氧组成,其所带的负电荷数为;图3是角项氧相连的硅氧四面体形成螺旋上升的长链,其、O原子的个数比为。
18. 我国提取的月壤样品主要是由硅酸盐组成的辉石、斜长石,回答下列问题:(1)、基态硅原子的价电子排布图为。(2)、CO2与SiO2是同主族氧化物,但熔沸点差距很大,其原因是。(3)、硅酸盐阴离子的基本结构单元如图1所示,其化学式;图2阴离子由两个图1单元共用1个顶角氧组成,其所带的负电荷数为;图3是角项氧相连的硅氧四面体形成螺旋上升的长链,其、O原子的个数比为。 (4)、Mg和Cu形成的晶体中,也存在四面体结构,Mg以金刚石方式堆积,剩余的4个四面体空隙放置Cu4四面体,如图4所示。Cu4四面体结构的镁配位数为 , 已知晶胞参数为 , 为阿伏加德罗常数的值,则该晶体的密度为(列出计算表达式)。
(4)、Mg和Cu形成的晶体中,也存在四面体结构,Mg以金刚石方式堆积,剩余的4个四面体空隙放置Cu4四面体,如图4所示。Cu4四面体结构的镁配位数为 , 已知晶胞参数为 , 为阿伏加德罗常数的值,则该晶体的密度为(列出计算表达式)。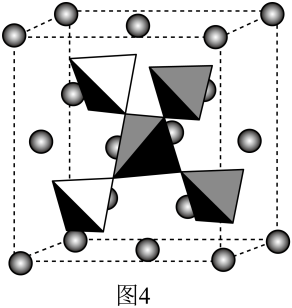 19. 回答下列问题:(1)、NaCl、MgCl2和AlCl3的熔点如表:
19. 回答下列问题:(1)、NaCl、MgCl2和AlCl3的熔点如表:NaCl
MgCl2
AlCl3
熔点/℃
801
714
194
NaCl、MgCl2熔点比AlCl3熔点高的原因是。
(2)、苯甲酸的电离平衡常数为Ka=6.4×10-5 , 为什么邻羟基苯甲酸(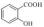 )的电离平衡常数Ka1为苯甲酸的15.9 倍、而间羟基苯甲酸(
)的电离平衡常数Ka1为苯甲酸的15.9 倍、而间羟基苯甲酸( )的电离平衡常数为苯甲酸的1.26倍?。 20. 回答下列问题(1)、锌的四种卤化物晶体的熔点数据如下表:
)的电离平衡常数为苯甲酸的1.26倍?。 20. 回答下列问题(1)、锌的四种卤化物晶体的熔点数据如下表:物质
熔点/℃
827
275
394
446
与熔点相差较大,、、熔点依次增大,原因是。
(2)、已知顺、反丁烯二酸的相关数据如下表:物质
电离平衡常数
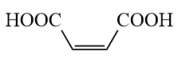

从结构角度分析顺丁烯二酸的小于反丁烯二酸的的原因是。
21. 按要求回答问题(1)、乙醇的沸点远高于环氧乙烷的沸点,原因是。(2)、一些氧化物的熔点如表所示:氧化物
熔点/℃
1570
1132
23.8
-75.5
解释表中氧化物之间熔点差异的原因。
22. 回答下列问题:(1)、氢键存在于分子之间,也可以存在分子内,如邻羟基苯甲醛存在分子内氢键,导致它的沸点比对羟基苯甲醛低,氢键用X—H…Y表示,画出邻羟基苯甲醛分子的内氢键。(2)、苯酚常温下在水中溶解度不大,但高于65°时,它能与水任何比例互溶,原因是。(3)、三种晶体的熔点数据如下:物质
熔点
280℃
3550℃
3652℃
和金刚石熔点相差大,石墨的熔点比金刚石高,原因是。
23. 回答下列问题:(1)、两种无机物的相关信息如表:化学式
P4S3
C3N4
用途
制造火柴及火柴盒摩擦面
可用作切磨机、钻头、轴承
熔点
174℃
1900℃
请从结构和微观作用力的角度解释两种物质的熔点差异。
(2)、将温度传感器探头伸入装有甘油(丙三醇)的试管中,片刻后再取出置于潮湿空气中,探头的温度变化如图。请解释温度升高的原因。 24. 含镍、铜的物质在生产生活中有着广泛应用。回答下列问题:(1)、基态Ni的价电子排布图为。(2)、元素Cu与Ni的第二电离能(I2分别为1959kJ·mol-1、1753kJ·mol-1 , I2(Ni)<I2(Cu)的原因是。(3)、Cu2O和Cu2S都是离子晶体,熔点较高的是。(4)、Cu可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4 , 其阴离子的空间构型是 , 加热该物质时,首先失去的是H2O分子,原因是。(5)、甲基丙烯酸铜是一种重要的有机铜试剂,其结构为
24. 含镍、铜的物质在生产生活中有着广泛应用。回答下列问题:(1)、基态Ni的价电子排布图为。(2)、元素Cu与Ni的第二电离能(I2分别为1959kJ·mol-1、1753kJ·mol-1 , I2(Ni)<I2(Cu)的原因是。(3)、Cu2O和Cu2S都是离子晶体,熔点较高的是。(4)、Cu可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4 , 其阴离子的空间构型是 , 加热该物质时,首先失去的是H2O分子,原因是。(5)、甲基丙烯酸铜是一种重要的有机铜试剂,其结构为 。此有机铜试剂中,与氧原子相连的碳原子的杂化轨道类型为 , 1mol此有机铜试剂中含有σ键的物质的量为mol。 (6)、四方晶系的CuFeS2晶胞结构如图所示。
。此有机铜试剂中,与氧原子相连的碳原子的杂化轨道类型为 , 1mol此有机铜试剂中含有σ键的物质的量为mol。 (6)、四方晶系的CuFeS2晶胞结构如图所示。
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,例如图中原子1的坐标为( , , ),则原子2的坐标为。晶体中距离Fe最近的S有个。
②设阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3(列出计算式即可)。
25. 央视报道《王者归“铼”》:我国利用新技术发现并提纯了超级金属“铼”,其熔点高、耐磨、耐腐蚀,可用来制造航空发动机核心部件,有塑打破美国垄断。工业上用富铼渣(含)制得铼粉,其工艺流程如图1所示:
回答下列问题:
(1)、铼()被称为类锰元素,与锰的价层电子结构相同,写出的价层电子排布式: , 已知元素锰与徕为同族元素,研究发现锰的熔点明显高于铼的熔点,其原因可能是。(2)、酸浸相同时间,测得徕的浸出率与温度关系如图2所示,分析时铼的浸出率最高的原因是;浸出反应中转化为两种强酸,请写出铼浸出反应的离子方程式。 (3)、图3表示萃取液流速与铼吸附率关系。结合实际工业生产效益,萃取液流速宜选用的范围是。
(3)、图3表示萃取液流速与铼吸附率关系。结合实际工业生产效益,萃取液流速宜选用的范围是。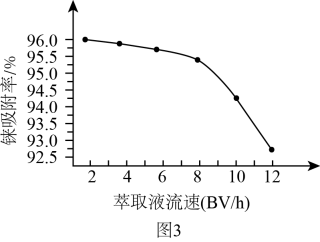 (4)、已知高铼酸铵微溶于冷水,易溶于热水。提纯粗高铼酸铵固体的方法是。(5)、是酸性氧化物,与溶液反应的化学方程式为。(6)、整个工艺流程中可循环利用的物质有、。26. 镍及其化合物的相关研究备受关注。回答下列问题:(1)、基态的M层电子排布式为;下列现象与核外电子跃迁有关的是(填字母)。
(4)、已知高铼酸铵微溶于冷水,易溶于热水。提纯粗高铼酸铵固体的方法是。(5)、是酸性氧化物,与溶液反应的化学方程式为。(6)、整个工艺流程中可循环利用的物质有、。26. 镍及其化合物的相关研究备受关注。回答下列问题:(1)、基态的M层电子排布式为;下列现象与核外电子跃迁有关的是(填字母)。a.金属Ni导电 b.燃烧放热 c.日光灯通电发光 d.乙醇挥发
(2)、镍能形成多种配合物,其中和的相关信息如下:配合物
状态
溶解性
无色挥发性液体
不溶于水,易溶于苯、四氯化碳等有机溶剂
红黄色单斜晶体
易溶于水
熔点高于的原因是;为分子(填“极性”或“非极性”),Ni提供的空轨道数目为。
(3)、科学家研究发现,在含镍催化剂作用下可利用三聚氰胺制备石墨相光催化材料。已知三聚氰胺在冷水中溶解度小而加热时溶解度增大,从氢键的角度解释原因;中含有的σ键的物质的量为mol。 (4)、镍能形成多种氧化物,一种镍的氧化物的结构特征:氧离子形成面心立方结构,镍离子位于氧离子构成的八面体空隙。下图中的(填字母)是从该晶胞中分割出来的结构。
(4)、镍能形成多种氧化物,一种镍的氧化物的结构特征:氧离子形成面心立方结构,镍离子位于氧离子构成的八面体空隙。下图中的(填字母)是从该晶胞中分割出来的结构。a.
 b.
b.  c.
c.  d.
d.  e.
e. 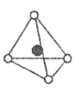
已知该晶体密度为 , NA为阿伏加德罗常数的值,则晶胞中两个镍离子之间的最短距离为pm(用含ρ和NA的代数式表示)。
27. 含镓(Ga)化合物在半导体材料、医药行业等领域发挥重要作用。回答下列问题:(1)、基态Ga原子价电子的轨道表示式为。(2)、Ga与Zn的第一电离能大小关系为:GaZn(填“>”“<”或“=”)。(3)、的熔沸点如下表所示。镓的卤化物
熔点/℃
77.75
122.3
211.5
沸点/℃
201.2
279
346
①100℃,、和呈液态的是(填化学式)。
②的熔点约1000℃,远高于的熔点,原因是。
(4)、镓配合物具有高的反应活性和良好的选择性在药物领域得到广泛的关注。与2-甲基-8-羟基喹啉(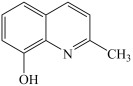 )在一定条件下反应可以得到喹啉类家配合物,2-甲基-8-羟基喹啉分子中碳原子的杂化轨道类型为。 (5)、作为第二代半导体,砷化家单晶因其价格昂贵而素有“半导体贵族”之称。砷化镓是由和在一定条件下制备得到,同时得到另一物质,该物质分子是(填“极性分子”或“非极性分子”),分子的空间形状为。(6)、锰与镓同周期,催化分解: , 其反应机理如图:
)在一定条件下反应可以得到喹啉类家配合物,2-甲基-8-羟基喹啉分子中碳原子的杂化轨道类型为。 (5)、作为第二代半导体,砷化家单晶因其价格昂贵而素有“半导体贵族”之称。砷化镓是由和在一定条件下制备得到,同时得到另一物质,该物质分子是(填“极性分子”或“非极性分子”),分子的空间形状为。(6)、锰与镓同周期,催化分解: , 其反应机理如图: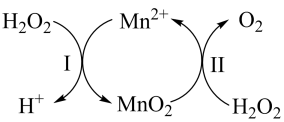
已知反应Ⅱ为: , 写出反应Ⅰ的热化学方程式(焓变用和表示):。
(7)、钙与镓同周期,晶胞结构见图,则距最近且等距的有个。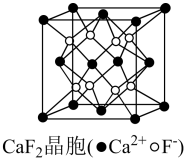 28. 回答下列问题:(1)、有人认为:为非化学变化 , 请为其寻找合理的解释。(2)、石墨和金刚石互为同素异形体,其熔点和摩尔硬度如下:
28. 回答下列问题:(1)、有人认为:为非化学变化 , 请为其寻找合理的解释。(2)、石墨和金刚石互为同素异形体,其熔点和摩尔硬度如下:物质
金刚石
石墨
熔点
3550℃
3652℃
摩尔硬度
10
1
请从结构角度分析两者熔点相近但摩尔硬度有差异的原因。
29. 金属钛(Ti)及化合物在化工、医药、材料等领城具有广泛应用。回答下列问题:(1)、Li4Ti5O12是电池的电极材料。与Li不同族但性质相似的元素是 , 其电子占据最高能级的电子云轮廓图是(2)、K与Ti位于同一周期,K和Ti的第一电离能(I1)较大的是 , 它们的第二电离能(I2)分别为3051kJ/mol、1310kJ/mol,其原因是。(3)、钛与卤素形成的化合物TiX4熔点如下表TiX4
TiF4
TiCl4
TiBr4
TiI4
熔点℃
377
-24
38.3
153
它们熔点差异的原因
(4)、Ti(IV)的某配合物可用于催化环烯烃聚合,其结构如图所示,该配合物中:Ti的配位数为 , 与Ti形成配位键的元素是 , 碳碳键类型是;所含非金属元素的含氧酸根离子中心原子杂化轨道类型是sp2的是、立体构型是V形的是 (5)、已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=g/cm3(阿伏加德罗常数值为NA , N、Ti的相对原子质量分别用Ar(N)和Ar(Ti)表示)
(5)、已知N与Ti形成的化合物的晶胞结构如图所示,晶胞中Ti原子与N原子的最近距离为apm;晶胞的密度为p=g/cm3(阿伏加德罗常数值为NA , N、Ti的相对原子质量分别用Ar(N)和Ar(Ti)表示)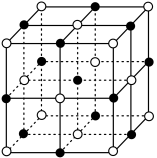 30. 砷化镓 是当前最重要、技术成熟度最高的半导体材料之一、我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。
30. 砷化镓 是当前最重要、技术成熟度最高的半导体材料之一、我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。 (1)、基态 原子核外电子排布式为 , 最高能级电子的电子云形状为。(2)、 和 为结构相似的原子晶体,沸点 (填“>”或“<”,下同),第一电离能 。(3)、成语“信口雌黄”中雌黄的分子式为 ,分子结构如图1, 原子的杂化方式为。(4)、 的晶胞结构如图2,在 晶体中,与 原子最近且等距离的 原子数为 , 原子位于 形成的空隙中。(5)、若砷化镓晶胞边长为 ,则 与最近 的核间距为 。31.(1)、常温下,乙醇在(填“环己烷或乙酸”)中溶解度更大,主要原因是。(2)、Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是。
(1)、基态 原子核外电子排布式为 , 最高能级电子的电子云形状为。(2)、 和 为结构相似的原子晶体,沸点 (填“>”或“<”,下同),第一电离能 。(3)、成语“信口雌黄”中雌黄的分子式为 ,分子结构如图1, 原子的杂化方式为。(4)、 的晶胞结构如图2,在 晶体中,与 原子最近且等距离的 原子数为 , 原子位于 形成的空隙中。(5)、若砷化镓晶胞边长为 ,则 与最近 的核间距为 。31.(1)、常温下,乙醇在(填“环己烷或乙酸”)中溶解度更大,主要原因是。(2)、Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是。化合物
TiF4
TiCl4
TiBr4
TiI4
熔点/℃
377
-24.12
38.3
155
32. 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(注:A、B、C、D、E、F用所对应的元素符号表示):(1)、C、D的第一电离能大小关系为 (用元素符号表示)。(2)、B的氯化物的熔点比MgO的熔点 (填“高”或“低”),理由是。(3)、F的价电子排布式是 , 它位于周期表的区。(4)、Fe和Cu可分别与氧元素形成低价态氧化物FeO和Cu2O。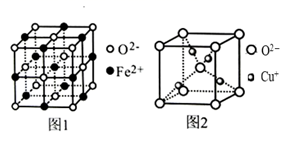
①FeO立方晶胞结构如图1所示,则Fe2+的配位数为。
②Cu2O立方晶胞结构如图2所示,若晶胞边长为acm,则该晶体的密度为g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数)
33. “中国紫”——硅酸铜钡 ,其合成原料为 、孔雀石 和砂子 。回答下列问题:(1)、基态Ba原子的价电子排布式为。(2)、 常用作光导纤维,在生产和生活中有广泛的用途。 属于晶体,在 晶体中,硅原子的杂化类型为。(3)、 不溶于水,但可溶于浓氨水,反应的化学方程式为 。①氨水中存在的化学键有(填标号)。
A.极性键 B.非极性键 C.氢键 D. 键 E. 键
② 中配体是 , 所含元素中电负性最小的非金属元素是(填元素符号)。
(4)、 的熔点比 的(填“高”或“低”),原因是。(5)、Cu和Ba形成的某种合金的晶胞结构如图所示,该合金中Cu与Ba的原子个数比为。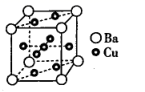 34. 20年11月24日,长征五号遥五运载火箭搭载嫦娥五号月球探测器成功发射升空并将其送入预定轨道,实现了我国首次月球无人采样返回。月球的沙土中含有丰富的钛铁矿,土壤中还含有硅、铝、钾、钡、钴、铷、汞、铜和稀土元素等。(1)、在元素周期表的短周期中,与Al的化学性质最相似的邻族元素是 , Al元素基态原子核外M层电子自旋状态相同的电子数为个。(2)、钠与铝是位于同一周期的金属元素,但NaCl的熔点(801℃)高于AlCl3(194℃),原因是;事实证明熔融态氯化铝可挥发出二聚分子Al2Cl6 , 其结构如图所示,请在图上用“→”标出其配位键;S也是第3周期元素,同周期元素中,第一电离能比S高的有种。
34. 20年11月24日,长征五号遥五运载火箭搭载嫦娥五号月球探测器成功发射升空并将其送入预定轨道,实现了我国首次月球无人采样返回。月球的沙土中含有丰富的钛铁矿,土壤中还含有硅、铝、钾、钡、钴、铷、汞、铜和稀土元素等。(1)、在元素周期表的短周期中,与Al的化学性质最相似的邻族元素是 , Al元素基态原子核外M层电子自旋状态相同的电子数为个。(2)、钠与铝是位于同一周期的金属元素,但NaCl的熔点(801℃)高于AlCl3(194℃),原因是;事实证明熔融态氯化铝可挥发出二聚分子Al2Cl6 , 其结构如图所示,请在图上用“→”标出其配位键;S也是第3周期元素,同周期元素中,第一电离能比S高的有种。 (3)、作为过渡元素的Fe、Cu容易形成配位化合物:如实验室检验Fe3+会用到KSCN溶液,C、N两种元素的电负性大小关系为 , 与SCN-互为等电子体的粒子有(写两种即可)。无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中微粒间不存在的作用力有。
(3)、作为过渡元素的Fe、Cu容易形成配位化合物:如实验室检验Fe3+会用到KSCN溶液,C、N两种元素的电负性大小关系为 , 与SCN-互为等电子体的粒子有(写两种即可)。无水硫酸铜为白色粉末,溶于水形成蓝色溶液,则硫酸铜稀溶液中微粒间不存在的作用力有。A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力
(4)、钴的一种化合物晶胞结构如下图所示: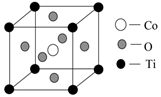
①晶胞中离Ti最近的O有个,其中Co原子位于O原子构成的空隙中。
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
②已知该晶体的密度为ρg·cm-3 , 则晶胞中Ti与O的最近距离是nm(用含ρ、NA的代数式表示,相对原子质量O-16,Co-59,Ti-48)。
35. 镧(La)、镍(Ni)是生产新型储氢材料的原料。HC≡N、CH3CH(OH)COONH4是重要的无机、有机含氮化合物。回答下列问题:(1)、基态镍原子的未成对电子与三价铁离子未成对电子数之比为。(2)、基态氮原子比基态氧原子第一电离能大的原因是。(3)、与HC≡N电子数相等的有机分子的结构简式为。(4)、CH3CH(OH)COONH4 , 中具有相同杂化轨道的碳原子、氮原子的个数比为。(5)、四羰基镍、氧化镍的物理性质如下:名称(化学式)
状态
熔点
溶解性
说明
四羰基镍
[Ni(CO)4]
无色挥发性剧毒液体
-25℃
不溶于水,易溶于苯、四氯化碳等有机溶剂
正四面体分子、分子中碳原子与镍成健
氧化镍(NiO)
绿色粉末状固体
1980℃
不溶于水
阴离子、阳离子构成
由此判断:[Ni(CO)4]是配合物,其配位体是。[Ni(CO)4]分子是分子(填“极性”或“非极性”)。[Ni(CO)4]比NiO熔点低的原因是。
(6)、有一种镧镍合金是重要的储氢材料,其晶体属六方晶系,晶胞结构如图1所示。其储氢原理是氢分子先变为氢原子,氢原子进入合金的孔隙中。图2所示晶体中两个镧原子和2个镍原子组成的四面体孔隙中只能进入1个氢原子,晶胞中的所有类似四面体中都有氢原子进入,即达到储氢稳定状态。当需要氢气时,给储氢合金加热,氢原子变为氢气逸出。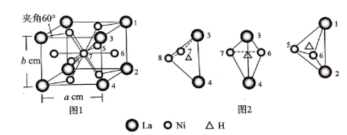
晶体中Ni、La的原子个数比=。每升该储氢材料达到储氢稳定状态,储氢原子mol。