高考二轮复习知识点:金属晶体
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列各组物质的晶体类型相同的是( )A、SiO2和SO3 B、I2和NaCl C、Cu和Ag D、SiC和MgO2. 关于下列4种物质的说法正确的是
 A、①的晶体为共价晶体 B、①与②完全反应时,转移2mol电子 C、室温时,②在水中的溶解度小于其在乙醇中的溶解度 D、③和④体积不同的主要原因是分子数不同3. 类推是化学学习和研究中常用的思维方法,下列类推正确的是( )A、晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子 B、CuSO4溶液在空气中蒸干得到CuSO4固体,故Fe2(SO4)3溶液在空气中蒸干得到Fe2(SO4)3固体 C、适量CO2通入Ca(ClO)2溶液中可生成CaCO3和HClO,故适量SO2通入Ca(ClO)2溶液中可生成CaSO3和HClO D、Fe和S反应生成FeS,则Cu和S反应生成CuS4. Al—Mn—Cu合金的晶胞如图所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置。下列说法正确的是
A、①的晶体为共价晶体 B、①与②完全反应时,转移2mol电子 C、室温时,②在水中的溶解度小于其在乙醇中的溶解度 D、③和④体积不同的主要原因是分子数不同3. 类推是化学学习和研究中常用的思维方法,下列类推正确的是( )A、晶体中有阴离子,必有阳离子,则晶体中有阳离子,也必有阴离子 B、CuSO4溶液在空气中蒸干得到CuSO4固体,故Fe2(SO4)3溶液在空气中蒸干得到Fe2(SO4)3固体 C、适量CO2通入Ca(ClO)2溶液中可生成CaCO3和HClO,故适量SO2通入Ca(ClO)2溶液中可生成CaSO3和HClO D、Fe和S反应生成FeS,则Cu和S反应生成CuS4. Al—Mn—Cu合金的晶胞如图所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置。下列说法正确的是 A、Al原子周围等距且最近的Al原子有6个 B、Al—Mn—Cu合金化学式可表示为AlMnCu2 C、若A原子的分数坐标为(0,0,0),则B原子的为 D、沿晶胞对角面的切面图为
A、Al原子周围等距且最近的Al原子有6个 B、Al—Mn—Cu合金化学式可表示为AlMnCu2 C、若A原子的分数坐标为(0,0,0),则B原子的为 D、沿晶胞对角面的切面图为 5. 下列关于晶体的叙述中,正确的是( )A、在晶体中只要有阳离子就一定有阴离子 B、晶体中分子间作用力越大,分子越稳定 C、HI的相对分子质量大于HF,所以HI的沸点高于HF D、金刚石为网状结构,由共价键形成的碳原子环中,最小环上有6个碳原子6. 下列说法正确的是( )A、北京冬奥会采用石墨烯材料制造户外保暖穿戴设备,石墨烯属于共价化合物 B、晶体X射线衍射实验可以用于键长、键角和晶体结构的测定 C、金属的导电性、导热性和延展性都与金属键有关,金属光泽与金属键无关 D、液晶可用于制造显示器,是一类分子晶体7. 下列叙述正确的是( )A、共价键的方向性使金刚石晶体有脆性,延展性较差 B、三氟氨硼烷()分子中,N和B的杂化方式不同 C、能与HF形成氢键,所以会溶于氢氟酸 D、金属能导电是因为金属在电场作用下先释放自由电子再定向运动8. 下列关于晶体的描述正确的是( )A、分子晶体中一定含有共价键 B、共价晶体中,共价键的键能越大、键长越短,熔点越高 C、金属晶体的导电性和导热性都是通过自由电子的定向移动实现的 D、某晶体溶于水可电离出自由移动的离子,该晶体一定是离子晶体9. 下列说法中,正确的是( )A、原子晶体在熔融态时,共价键被破坏 B、金属晶体的熔点一定比分子晶体的高 C、干冰升华时,分子内共价键会发生断裂 D、分子晶体中,分子间作用力越大,对应的物质越稳定10. 检验灼热的碳投入浓硫酸中产生的气体的成分,实验步骤如下:
5. 下列关于晶体的叙述中,正确的是( )A、在晶体中只要有阳离子就一定有阴离子 B、晶体中分子间作用力越大,分子越稳定 C、HI的相对分子质量大于HF,所以HI的沸点高于HF D、金刚石为网状结构,由共价键形成的碳原子环中,最小环上有6个碳原子6. 下列说法正确的是( )A、北京冬奥会采用石墨烯材料制造户外保暖穿戴设备,石墨烯属于共价化合物 B、晶体X射线衍射实验可以用于键长、键角和晶体结构的测定 C、金属的导电性、导热性和延展性都与金属键有关,金属光泽与金属键无关 D、液晶可用于制造显示器,是一类分子晶体7. 下列叙述正确的是( )A、共价键的方向性使金刚石晶体有脆性,延展性较差 B、三氟氨硼烷()分子中,N和B的杂化方式不同 C、能与HF形成氢键,所以会溶于氢氟酸 D、金属能导电是因为金属在电场作用下先释放自由电子再定向运动8. 下列关于晶体的描述正确的是( )A、分子晶体中一定含有共价键 B、共价晶体中,共价键的键能越大、键长越短,熔点越高 C、金属晶体的导电性和导热性都是通过自由电子的定向移动实现的 D、某晶体溶于水可电离出自由移动的离子,该晶体一定是离子晶体9. 下列说法中,正确的是( )A、原子晶体在熔融态时,共价键被破坏 B、金属晶体的熔点一定比分子晶体的高 C、干冰升华时,分子内共价键会发生断裂 D、分子晶体中,分子间作用力越大,对应的物质越稳定10. 检验灼热的碳投入浓硫酸中产生的气体的成分,实验步骤如下:步骤1:先将该气体通入品红溶液中,观察现象;
步骤2:将步骤1中的气体通入酸性高锰酸钾溶液后再通过品红溶液,观察现象;
步骤3:再将步骤2中的气体通入澄清石灰水中,观察现象。
下列说法错误的是( )
A、步骤1中品红溶液褪色,说明产生气体中含 B、步骤2的目的是除去并证明已除尽 C、步骤3持续时间过长现象会消失,原因是生成了配合物 D、一种碳-铁合金结构如图所示 , 该合金化学式是FeC
11. 有关晶体或晶胞结构如下图所示。下列说法错误的是( )
, 该合金化学式是FeC
11. 有关晶体或晶胞结构如下图所示。下列说法错误的是( )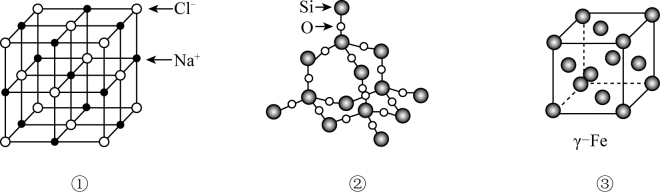 A、晶胞①中Na+的配位数为8 B、晶体②中Si和Si-O个数比为1:4 C、晶胞③中原子堆积方式为面心立方最密堆积 D、三种晶体中微粒间作用力均不相同12. 金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方最密堆积和体心立方堆积,下图分别代表着三种晶体的晶体结构,其晶胞内金属原子个数比为( )
A、晶胞①中Na+的配位数为8 B、晶体②中Si和Si-O个数比为1:4 C、晶胞③中原子堆积方式为面心立方最密堆积 D、三种晶体中微粒间作用力均不相同12. 金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方最密堆积和体心立方堆积,下图分别代表着三种晶体的晶体结构,其晶胞内金属原子个数比为( )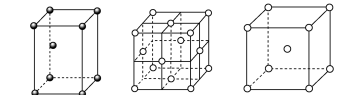 A、1∶2∶1 B、11∶8∶4 C、9∶8∶4 D、9∶14∶913. 下列是典型晶体的结构示意图,从①到⑥对应正确的是( )
A、1∶2∶1 B、11∶8∶4 C、9∶8∶4 D、9∶14∶913. 下列是典型晶体的结构示意图,从①到⑥对应正确的是( ) A、CsCl 金刚石 CaF2 Cu CO2 Fe B、CaF2 SiC 金刚石 Cu CO2 CsCl C、NaCl 单质硅 CaF2 Au CO2 K D、NaCl BN Au CaF2 CO2 Na14. 二硫醇烯与锌的配合物(M)是一种具有光、电、磁等特殊功能的新型材料,合成途径如下:
A、CsCl 金刚石 CaF2 Cu CO2 Fe B、CaF2 SiC 金刚石 Cu CO2 CsCl C、NaCl 单质硅 CaF2 Au CO2 K D、NaCl BN Au CaF2 CO2 Na14. 二硫醇烯与锌的配合物(M)是一种具有光、电、磁等特殊功能的新型材料,合成途径如下:
上述7种物质的晶体类型中不含有( )
A、离子晶体 B、分子晶体 C、共价晶体 D、金属晶体15. 下列关于晶体的说法错误的是( )A、熔融状态导电的晶体不一定是离子晶体 B、金属晶体中一定含有金属键,金属键没有方向性和饱和性 C、熔点是10.31℃,液态不导电,水溶液能导电的晶体一定是分子晶体 D、具有正四面体结构的晶体,可能是共价晶体或分子晶体,其键角都是109°28′16. 下列关于晶体的说法中错误的是( )A、固态不导电而熔融状态导电的晶体一定是离子晶体 B、具有正四面体结构的晶体,可能是共价晶体或分子晶体,其键角都是109°28′ C、熔点是10.31℃,液态不导电,水溶液能导电的晶体一定是分子晶体 D、金属晶体中一定含有金属键,金属键没有方向性和饱和性17. 共价键、离子键、金属键和分子间作用力是微粒间的不同相互作用,下列含有上述两种相互作用的晶体是( )A、SiC晶体 B、CCl4晶体 C、KCl晶体 D、Na晶体18. 有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( ) A、图1和图4为非密置层堆积,图2和图3为密置层堆积 B、图1~图4分别是简单立方堆积、六方最密堆积、面心立方最密堆积、体心立方堆积 C、图1~图4每个晶胞所含有原子数分别为1、2、2、4 D、图1~图4堆积方式的空间利用率大小关系是图1<图2<图3=图419. 工业上制备四氢硼钠的原理为 。上述反应中的物质涉及的晶体类型共有( )A、2种 B、3种 C、4种 D、5种20. 下列说法中,正确的是( )A、冰熔化时,分子中 H—O 键发生断裂 B、金属晶体的熔、沸点一定比分子晶体的高 C、原子晶体中,共价键的键长越短,键能越大,熔点就越高 D、分子晶体中,分子间作用力越大,则分子越稳定21. 下列有关晶体的叙述正确的是( )A、金属晶体含有金属阳离子和自由电子 B、原子晶体一定是单质 C、分子晶体一定是化合物 D、金属晶体的硬度>原子晶体的硬度>分子晶体的硬度22. 下列关于金属晶体和离子晶体的说法中错误的是( )A、都有多种堆积结构 B、都含离子 C、一般具有较高的熔点和沸点 D、都能导电23. 下列说法中正确的是( )A、金属键只存在于金属晶体中 B、分子晶体的堆积均采取分子密堆积 C、水很稳定,因为水中含有大量的氢键 D、ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子24. 构成金属晶体的基本微粒()A、分子 B、阴离子和自由电子 C、阳离子和阴离子 D、阳离子和自由电子25. 如下图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是( )
A、图1和图4为非密置层堆积,图2和图3为密置层堆积 B、图1~图4分别是简单立方堆积、六方最密堆积、面心立方最密堆积、体心立方堆积 C、图1~图4每个晶胞所含有原子数分别为1、2、2、4 D、图1~图4堆积方式的空间利用率大小关系是图1<图2<图3=图419. 工业上制备四氢硼钠的原理为 。上述反应中的物质涉及的晶体类型共有( )A、2种 B、3种 C、4种 D、5种20. 下列说法中,正确的是( )A、冰熔化时,分子中 H—O 键发生断裂 B、金属晶体的熔、沸点一定比分子晶体的高 C、原子晶体中,共价键的键长越短,键能越大,熔点就越高 D、分子晶体中,分子间作用力越大,则分子越稳定21. 下列有关晶体的叙述正确的是( )A、金属晶体含有金属阳离子和自由电子 B、原子晶体一定是单质 C、分子晶体一定是化合物 D、金属晶体的硬度>原子晶体的硬度>分子晶体的硬度22. 下列关于金属晶体和离子晶体的说法中错误的是( )A、都有多种堆积结构 B、都含离子 C、一般具有较高的熔点和沸点 D、都能导电23. 下列说法中正确的是( )A、金属键只存在于金属晶体中 B、分子晶体的堆积均采取分子密堆积 C、水很稳定,因为水中含有大量的氢键 D、ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子24. 构成金属晶体的基本微粒()A、分子 B、阴离子和自由电子 C、阳离子和阴离子 D、阳离子和自由电子25. 如下图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是( ) A、γFe晶体中与每个铁原子距离相等且最近的铁原子有6个 B、αFe晶体中与每个铁原子距离相等且最近的铁原子有6个 C、将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同 D、三种同素异形体的性质相同26. 金属的下列性质中和金属晶体结构无关的是( )A、良好的导电性 B、反应中易失去电子 C、良好的延展性 D、良好的导热性
A、γFe晶体中与每个铁原子距离相等且最近的铁原子有6个 B、αFe晶体中与每个铁原子距离相等且最近的铁原子有6个 C、将铁加热到1 500 ℃分别急速冷却和缓慢冷却,得到的晶体类型相同 D、三种同素异形体的性质相同26. 金属的下列性质中和金属晶体结构无关的是( )A、良好的导电性 B、反应中易失去电子 C、良好的延展性 D、良好的导热性二、非选择题
-
27. [化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)、Zn原子核外电子排布式为。(2)、黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)Ⅰ1(Cu)(填“大于”或“小于”)。原因是。(3)、ZnF2具有较高的熔点(872 ℃),其化学键类型是;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是。(4)、《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为 , C原子的杂化形式为。(5)、金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA , Zn的密度为g·cm-3(列出计算式)。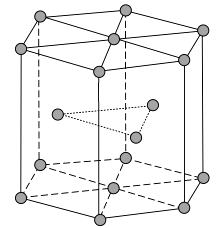 28. 铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。请回答下列问题:(1)、铁元素基态原子的电子排布式为 , 3d能级上的未成对电子数为 , 能量最高能级的电子云形状为。(2)、Fe3+可用KSCN溶液检验,形成的配合物颜色为 , 写出一个与SCN-具有相同空间构型的分子:。(3)、氮元素的最简单氢化物为氨,氨的沸点(填“高于”或“低于”)膦(PH3),原因是。氮元素另一种氢化物联氨(N2H4)是(填“极性”或“非极性”)分子,其中心原子的轨道杂化类型为。(4)、铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是。(5)、铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是g/cm3(设阿伏加德罗常数的值为NA)。
28. 铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。请回答下列问题:(1)、铁元素基态原子的电子排布式为 , 3d能级上的未成对电子数为 , 能量最高能级的电子云形状为。(2)、Fe3+可用KSCN溶液检验,形成的配合物颜色为 , 写出一个与SCN-具有相同空间构型的分子:。(3)、氮元素的最简单氢化物为氨,氨的沸点(填“高于”或“低于”)膦(PH3),原因是。氮元素另一种氢化物联氨(N2H4)是(填“极性”或“非极性”)分子,其中心原子的轨道杂化类型为。(4)、铁的第三电离能(I3),第四电离能(I4)分别为2957kJ/mol,5290kJ/mol,I4远大于I3的原因是。(5)、铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:。若两个最近的Fe原子间的距离为a cm,则该晶体的密度是g/cm3(设阿伏加德罗常数的值为NA)。 29. M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:(1)、单质M的晶体类型为 , 其中M原子的配位数为。(2)、元素Y基态原子的核外电子排布式为 , 其同周期元素中,第一电离能最大的是(写元素符号)。(3)、M与Y形成的一种化合物的立方晶胞如图所示。
29. M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:(1)、单质M的晶体类型为 , 其中M原子的配位数为。(2)、元素Y基态原子的核外电子排布式为 , 其同周期元素中,第一电离能最大的是(写元素符号)。(3)、M与Y形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为 , 已知晶胞参数a=0.542 nm,此晶体的密度为g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②此化合物的氨水溶液遇到空气被氧化为深蓝色,其中阳离子的化学式为。
30. 我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。(1)、Cu2+的未成对电子数有个,H、O、S 电负性由大到小的顺序为。(2)、在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。[Cu(NH3)4]SO4中化学键类型有 , 阴离子中心原子杂化类型为。(3)、铁铜合金晶体类型为;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因。(4)、金铜合金的一种晶体结构为立方晶型,如图所示。已知该合金的密度为d g/cm3 , 阿伏加德罗常数值为NA , 两个金原子间最小间隙为a pm(1pm= 10-10cm)。则铜原子的半径为cm(写出计算表达式)。