高考二轮复习知识点:原子晶体(共价晶体)
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 工业制备高纯硅的主要过程如下:
石英砂粗硅高纯硅
下列说法错误的是
A、制备粗硅的反应方程式为 B、1molSi含Si-Si键的数目约为 C、原料气HCl和应充分去除水和氧气 D、生成的反应为熵减过程2. 、属于第三代半导体材料,二者成键结构与金刚石相似,晶体中只存在键、键。下列说法错误的是( )A、的熔点高于 B、晶体中所有化学键均为极性键 C、晶体中所有原子均采取杂化 D、晶体中所有原子的配位数均相同3. 下列各组物质的晶体类型相同的是( )A、SiO2和SO3 B、I2和NaCl C、Cu和Ag D、SiC和MgO4. 保定文化底蕴深厚,国家级非遗项目众多。下列非遗项目的相关工艺过程所涉及的化学知识错误的是选项
非遗项目的相关工艺过程
化学知识
A
刘伶醉酒酿造技艺中发酵酿酒过程
涉及水解反应和加成反应
B
易水砚制作技艺中的磨光工序使用了SiC作磨料
SiC是共价晶体,熔点高、硬度大
C
清苑区传统制香制作技艺中香料的提取
常采用挥发性溶剂萃取
D
定兴书画毡制作技艺中用沸水反复浇羊毛增加软化度
蛋白质发生了变性
A、A B、B C、C D、D5. 氮化硅(熔点1900℃)具有高强度、高韧性,通过SiH4与NH3发生反应3SiH4+4NH3=Si3N4+12H2制得。下列说法错误的是( )A、Si的电负性小于N的电负性 B、SiH4的稳定性强于NH3的稳定性 C、Si3N4属于共价晶体 D、SiH4为非极性分子6. 一种碳化硅晶体的晶胞如图所示,与金刚石的类似。下列判断正确的是( ) A、该晶体质软 B、熔点:碳化硅>金刚石 C、该晶体熔融时会破坏极性键 D、碳原子轨道的杂化类型为sp杂化7. 是一种重要的半导体材料,熔点为 , 密度为 , 其晶胞结构如图所示。已知阿伏加德罗常数的值为 , 的摩尔质量为 , 下列说法正确的是 ( )
A、该晶体质软 B、熔点:碳化硅>金刚石 C、该晶体熔融时会破坏极性键 D、碳原子轨道的杂化类型为sp杂化7. 是一种重要的半导体材料,熔点为 , 密度为 , 其晶胞结构如图所示。已知阿伏加德罗常数的值为 , 的摩尔质量为 , 下列说法正确的是 ( ) A、该晶体为离子晶体 B、的配位数为2 C、在元素周期表的第15纵列 D、的晶胞边长为8. 1877年人类首次合成的氮化铝是一种硬度、熔点都很高的晶体,是良好的耐热冲击材料,其晶胞结构如图所示。下列说法正确的是( )
A、该晶体为离子晶体 B、的配位数为2 C、在元素周期表的第15纵列 D、的晶胞边长为8. 1877年人类首次合成的氮化铝是一种硬度、熔点都很高的晶体,是良好的耐热冲击材料,其晶胞结构如图所示。下列说法正确的是( ) A、氮化铝属于离子晶体 B、氮化铝可用于制造切割金属的刀具 C、一个氮化铝晶胞中含有 个 原子 D、氮化铝晶体中 的配位数为9. 短周期主族元素W、X、Y、Z的原子序数依次增大,W与氢元素形成的二元化合物为五核10电子;X元素价电子排布式为nsnnpn+2;X、Y同主族相邻。下列说法正确的是( )A、WY2属于极性分子 B、W的某种单质可能是共价晶体 C、YX 的空间构型为平面三角形 D、氧化物对应水化物的酸性:W<Y<Z10. 下列晶体中,任何一个原子都被相邻四个原子包围,以共价健形成正四面体,并向空间伸展成网状结构的是( )A、金刚石 B、石墨 C、足球烯 D、水晶11. 硅是制作光伏电池的关键材料。在Si晶体中掺杂不同种类的元素,可形成多电子的n型或缺电子的p型半导体。n型和p型半导体相互叠加形成p-n结,此时自由电子发生扩散运动,在交界面处形成电场。下列说法正确的是( )
A、氮化铝属于离子晶体 B、氮化铝可用于制造切割金属的刀具 C、一个氮化铝晶胞中含有 个 原子 D、氮化铝晶体中 的配位数为9. 短周期主族元素W、X、Y、Z的原子序数依次增大,W与氢元素形成的二元化合物为五核10电子;X元素价电子排布式为nsnnpn+2;X、Y同主族相邻。下列说法正确的是( )A、WY2属于极性分子 B、W的某种单质可能是共价晶体 C、YX 的空间构型为平面三角形 D、氧化物对应水化物的酸性:W<Y<Z10. 下列晶体中,任何一个原子都被相邻四个原子包围,以共价健形成正四面体,并向空间伸展成网状结构的是( )A、金刚石 B、石墨 C、足球烯 D、水晶11. 硅是制作光伏电池的关键材料。在Si晶体中掺杂不同种类的元素,可形成多电子的n型或缺电子的p型半导体。n型和p型半导体相互叠加形成p-n结,此时自由电子发生扩散运动,在交界面处形成电场。下列说法正确的是( ) A、1 mol Si晶体中含有的Si-Si键数目为4NA B、若在Si晶体中掺入P元素,可得n型半导体 C、p-n结中,n型一侧带负电,p型一侧带正电 D、光伏电池的能量转化形式为:光能→化学能→电能12. 金刚石的熔点为a℃,晶体硅的熔点为b℃,足球烯(分子式为C60)的熔点为c℃,三者熔点的大小关系是( )A、a>b>c B、b>a>c C、c>a>b D、c>b>a.13. 原子晶体具有的性质是()A、熔点高 B、易导热 C、能导电 D、有延展性14. 二氧化硅是制造光导纤维的重要原料,其晶体类型属于( )A、原子晶体 B、离子晶体 C、分子晶体 D、金属晶体15. 设NA表示阿伏加德罗常数的值。下列说法正确的是( )A、1.5 gCH3+含有的电子数为NA B、在1 L 0.1mol/L氯化铝溶液中阳离子总数大于0.1NA C、60g SiO2和12g金刚石中各含有4NA个Si—O键和4NA个C—C键 D、标准状况下,11.2 L四氯化碳中含有的C—Cl键的个数为2NA16. 氮氧化铝(AlON)属于原子晶体,是一种超强透明材料,下列描述错的是( )A、AlON和石英的化学键类型相同 B、电解熔融AlON可得到Al C、AlON的N元素化合价为﹣1 D、AlON和石英晶体类型相同
A、1 mol Si晶体中含有的Si-Si键数目为4NA B、若在Si晶体中掺入P元素,可得n型半导体 C、p-n结中,n型一侧带负电,p型一侧带正电 D、光伏电池的能量转化形式为:光能→化学能→电能12. 金刚石的熔点为a℃,晶体硅的熔点为b℃,足球烯(分子式为C60)的熔点为c℃,三者熔点的大小关系是( )A、a>b>c B、b>a>c C、c>a>b D、c>b>a.13. 原子晶体具有的性质是()A、熔点高 B、易导热 C、能导电 D、有延展性14. 二氧化硅是制造光导纤维的重要原料,其晶体类型属于( )A、原子晶体 B、离子晶体 C、分子晶体 D、金属晶体15. 设NA表示阿伏加德罗常数的值。下列说法正确的是( )A、1.5 gCH3+含有的电子数为NA B、在1 L 0.1mol/L氯化铝溶液中阳离子总数大于0.1NA C、60g SiO2和12g金刚石中各含有4NA个Si—O键和4NA个C—C键 D、标准状况下,11.2 L四氯化碳中含有的C—Cl键的个数为2NA16. 氮氧化铝(AlON)属于原子晶体,是一种超强透明材料,下列描述错的是( )A、AlON和石英的化学键类型相同 B、电解熔融AlON可得到Al C、AlON的N元素化合价为﹣1 D、AlON和石英晶体类型相同二、多选题
-
17. 下列物质的性质变化规律与与键能无关的是( )A、与硅相比,金刚石的硬度大、熔点高 B、HF、HCl、HBr、HI热稳定性依次减弱 C、F2、Cl2、Br2、I2的沸点逐渐升高 D、H2、O2、H2S在水中的溶解性依次为难溶、微溶、可溶18. 石墨烯是单层碳原子排列成的蜂窝状六角平面晶体,具有重要的应用前景。可利用碳化硅制备高品质石墨烯材料。下列说法正确的是( )A、24 g石墨烯约含1 mol六元碳环 B、碳化硅晶胞与金刚石晶胞结构相似 C、石墨烯的熔点低于碳化硅 D、利用碳化硅制备石墨烯的过程属于物理剥离
三、非选择题
-
19. 将酞菁—钴钛—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。回答下列问题:(1)、图1所示的几种碳单质,它们互为 , 其中属于原子晶体的是 , 间的作用力是。
 (2)、酞菁和钴酞菁的分子结构如图2所示。
(2)、酞菁和钴酞菁的分子结构如图2所示。
酞菁分子中所有原子共平面,其中轨道能提供一对电子的原子是(填图2酞菁中原子的标号)。钴酞菁分子中,钴离子的化合价为 , 氮原子提供孤对电子与钴离子形成键。
(3)、气态通常以二聚体的形式存在,其空间结构如图3a所示,二聚体中的轨道杂化类型为。的熔点为 , 远高于的 , 由此可以判断铝氟之间的化学键为键。结构属立方晶系,晶胞如图3b所示,的配位数为。若晶胞参数为 , 晶体密度(列出计算式,阿伏加德罗常数的值为)。 20.(1)、已知3种原子晶体的熔点数据如下表:
20.(1)、已知3种原子晶体的熔点数据如下表:金刚石
碳化硅
晶体硅
熔点/℃
>3550
2600
1415
金刚石熔点比晶体硅熔点高的原因是。
(2)、提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是。21. 氮化硼(BN)是一种高硬度、耐高温、耐腐蚀、高绝缘性的材料。一种获得氮化硼的方法如下:NaBH4B(OH)3→BN
已知:①电负性:H2.1 B2.0 N3.0 O3.5
②SiC与BN晶体的熔点和硬度数据如下:
物质
熔点/℃
硬度
碳化硅(SiC)
2830
9-9.5
氮化硼(BN)
3000
9.5
(1)、NaBH4被认为是有机化学上的“万能还原剂”。从化合价角度分析NaBH4具有强还原性的原因是。(2)、硼酸的化学式为B(OH)3 , 是一元弱酸。硼酸产生H+过程为:B(OH)3+H2O⇌H++[B(OH)4]-①硼酸分子的空间构型为。
②硼酸具有弱酸性是由于B与水中的OH-形成配位键,描述配位键的形成过程。
(3)、某一种氮化硼晶体的晶胞结构如下图:
①氮化硼(BN)属于晶体;B原子的轨道杂化类型为。
②该种氮化硼的熔点和硬度均高于SiC的原因是。
③已知该晶体的密度为ρg·cm-3 , 阿伏加德罗常数为NA , 则晶胞的边长为cm(列计算式)。
22. 我国科学家最近开发了α- B26C@ TiO2/Ti催化剂实现NO制NH3 , 为资源回收利用提供新思路。请回答下列问题:(1)、基态N原子的价层电子排布图为。(2)、上述物质中所含第二周期元素的第一电离能由大到小的顺序为(填元素符号,下同),电负性由大到小的顺序为。(3)、氨硼烷(NH3·BH3)是一种具有潜力的固体储氢材料。NH3·BH3分子中属于sp3杂化的原子有(填元素符号)。H—N—H键角:NH3NH3·BH3(填“>”“<”或“=”),理由是。(4)、已知:BC(碳化硼)、BN(氮化硼)的熔点依次为2450℃、3000℃, BN的熔点较高的主要原因是。(5)、已知TiO2的晶胞如图1所示,“黑球”代表 (填“钛”或“氧")。(6)、钛晶体有两种结构,如图2和图3所示。
图2结构中空间利用率(φ)为 (用含π的代数式表示);已知图3结构中底边长为a nm,高为c nm,NA代表阿伏加德罗常数的值,则该钛晶体的密度为g·m-3(用含a、c、NA的代数式表示)。
23. 硅是地壳中储量仅次于氧的元素,在自然界中主要以和硅酸盐的形式存在。(1)、基态硅原子的价电子排布式为。(2)、硅、金刚石和碳化硅晶体的熔点从高到低依次为。(3)、晶态的晶胞如图。
①硅原子的杂化方式为。
②已知晶胞的棱长均为a pm,则晶体的密度(列出计算式)。
(4)、硅元素最高价氧化物对应的水化物为原硅酸。资料:原硅酸(
 )可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
)可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。①原硅酸钠溶液吸收空气中的会生成 , 结合元素周期律解释原因:。
②从结构的角度解释脱水后溶解度降低的原因:。
24. 铝、磷、硫及其化合物在生产生活及科研中应用广泛。 (1)、可用于制造火柴,其分子结构如图1所示。
(1)、可用于制造火柴,其分子结构如图1所示。①分子中硫原子的杂化类型为 , 分子中P原子的化合价为。
②分子可以形成配合物 , 该配合物中Mo的配位数为;1个该配合物分子中键数目为。
(2)、磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图2所示。①磷化铝晶体中磷与铝微粒间的作用力为 , 晶胞中由4个铝原子围成的空间构型是。
②已知相邻的P原子和Al原子的核间距是d nm,B原子的分数坐标为 , 磷化铝晶胞的密度为。
25. 在短周期元素中有部分元素的原子具有核外电子排布有2个未成对电子的特点。具有这样特点的元素中:(1)、A元素原子的半径最大,写出A在元素周期表中的位置 , 其原子核外电子排布式为 , A与上述元素中原子半径最小的元素B形成的化合物晶体类型为。(2)、C元素的单质能溶解于C与D形成的化合物中,写出该化合物的分子式 , 推断该化合物(难、微、易)溶于水。(3)、C、D元素均可与B元素形成化合物,此2种化合物都可与水反应形成对应的酸,2种酸的分子式相似,写出2种酸的分子式 , 简述证明2种酸酸性相对强弱的方法。Cu2S和CuS均可被KMnO4酸性溶液氧化,在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① + Cu2S + → + SO2↑ + + H2O(未配平)
② + CuS + → + SO2↑ + + H2O(未配平)
(4)、下列关于反应①的说法中错误的是(选填编号)。a.还原性的强弱关系是: > Cu2S
b.氧化剂与还原剂的物质的量之比为
c.生成2.24L(标况下)SO2 , 转移电子的物质的量是0.8mol
d.被氧化的元素是正一价的Cu和负二价的S
(5)、写出反应②中反应物配平后的系数并标出电子转移方向和数目:_ +_CuS +_
已知:KMnO4在稀硫酸存在下能将H2O2氧化为O2 , KMnO4被还原为 ;H2O2在前面反应生成 的催化下能发生分解反应生成H2O和O2。
(6)、稀硫酸中,某KMnO4和H2O2发生氧化还原反应方程式如下:2KMnO4 + 7H2O2 + 3H2SO4 → K2SO4 + 2MnSO4 + 6O2↑ + 10H2O,反应中1mol KMnO4氧化H2O2的物质的量是mol, 反应中的氧化剂是 , 氧化剂与还原剂的物质的量比为。
26. 离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题: (1)、碳原子价层电子的轨道表达式为 , 基态碳原子中,核外电子占据的最高能级的电子云轮廓图为形。(2)、根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是。NH3比PH3的沸点高,原因是。(3)、氮元素的第一电离能比同周期相邻元素都大的原因是。(4)、EMIM+离子中,碳原子的杂化轨道类型为。分子中的大π键可用符号Π 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π ),则EMIM+离子中的大π键应表示为。(5)、立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于晶体,其中硼原子的配位数为。已知:立方氮化硼密度为dg/cm3 , B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA , 则该晶胞中原子的空间利用率为(列出化简后的计算式)。
(1)、碳原子价层电子的轨道表达式为 , 基态碳原子中,核外电子占据的最高能级的电子云轮廓图为形。(2)、根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是。NH3比PH3的沸点高,原因是。(3)、氮元素的第一电离能比同周期相邻元素都大的原因是。(4)、EMIM+离子中,碳原子的杂化轨道类型为。分子中的大π键可用符号Π 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为Π ),则EMIM+离子中的大π键应表示为。(5)、立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于晶体,其中硼原子的配位数为。已知:立方氮化硼密度为dg/cm3 , B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA , 则该晶胞中原子的空间利用率为(列出化简后的计算式)。 27. 绪(Ge)是半导体元素,应用广泛,回答下列问题:(1)、下列为Ge价电子层电子排布图表示的状态中,能量最低和最高的分别为、(填选项)。
27. 绪(Ge)是半导体元素,应用广泛,回答下列问题:(1)、下列为Ge价电子层电子排布图表示的状态中,能量最低和最高的分别为、(填选项)。A.
 B.
B. 
C.
 D.
D.  (2)、GeH4的空间构型为;比较与同锗族的氢化物的沸点如表所示,分析其变化规律及原因。
(2)、GeH4的空间构型为;比较与同锗族的氢化物的沸点如表所示,分析其变化规律及原因。CH4
SiH4
GeH4
沸点/℃
-161.5
-119
-88.1
(3)、有机锗化合物A有一定的医疗保健作用,其结构简式为CF3N=GeH2 , 则Ge的杂化形式为 , 碳原子与其它原子结合的键的种类为。(4)、Li2GeF6可以作为锂电池的电解质,则Li、Ge、F电负性由大到小的顺序为。(5)、Ge晶胞如下,其中原子坐标参数A为(0,0,0);B为( ,0, ),D为( , , )。则C原子的坐标参数为。 (6)、氮化锗具有耐腐蚀、硬度高等优点,晶体中锗原子与氮原子之间存在明显的s-p杂化现象,氮化锗晶体属于晶体。一种氮化锗晶胞的球棍模型如图,晶体中n(Ge)/n(N)= , 若晶胞底面正方形的边长为anm,阿伏加德罗常数值为NA , 晶体的密度为ρg/cm3 , 则长方体的高为nm(列出计算式)。28. 硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:(1)、某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
(6)、氮化锗具有耐腐蚀、硬度高等优点,晶体中锗原子与氮原子之间存在明显的s-p杂化现象,氮化锗晶体属于晶体。一种氮化锗晶胞的球棍模型如图,晶体中n(Ge)/n(N)= , 若晶胞底面正方形的边长为anm,阿伏加德罗常数值为NA , 晶体的密度为ρg/cm3 , 则长方体的高为nm(列出计算式)。28. 硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:(1)、某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。①写出M原子核外能量最高的电子的电子排布式:。
②常温下,不能与R单质发生反应的是(选填序号)。
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)、氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2 Si3N4+CO①Si3N4中氮元素的化合价为-3,请解释Si3N4中氮元素化合价为负价的原因。
②C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:。
③配平上述反应的化学方程式,并标出电子转移的数目和方向。。
(3)、一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:
①将工业硅粉碎的目的是。
②适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。 可能是(选填:“盐酸”“硝酸”或“硫酸”),理由是。
29. C、N和Si能形成多种高硬度材料,如Si3N4 , C3N4 , SiC.(1)、Si3N4和C3N4中硬度较高的是 , 理由是.(2)、C和N能形成一种类石墨结构材料,其合成过程如下图所示。该类石墨结构材料化合物的化学式为。其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有。 (3)、C和N还能形成一种五元环状有机物咪唑(im),其结构为
(3)、C和N还能形成一种五元环状有机物咪唑(im),其结构为 。化合物[Co(im)6]SiF6的结构示意图如下:
。化合物[Co(im)6]SiF6的结构示意图如下:
①Co原子的价层电子轨道表达式(价层电子排布图)为。N与Co之间的化学键类型是 , 判断的理由是。
②阴离子SiF62-中心原子Si的价层电子对数为。阳离子(Co(im)6]2+和SiF62-之间除了阴阳离子间的静电作用力,还存在氢键作用,画出该氢键的表示式。
例如水中氢键的表示式为:
 (4)、SiC为立方晶系晶体,晶胞参数为a,已知Si原子半径为rSi , C原子半径为rC , 该晶胞中原子的分数坐标为:
(4)、SiC为立方晶系晶体,晶胞参数为a,已知Si原子半径为rSi , C原子半径为rC , 该晶胞中原子的分数坐标为:
则SiC立方晶胞中含有个Si原子、个C原子,该晶胞中原子的体积占晶胞体积的百分率为(列出计算式即可)。
30. [化学一一选修3:物质结构与性质]碳族元素的单质和化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:(1)、锗是重要半导体材料,基态Ge原子中,核外电子占据最高能级的符号是 , 该能级的电子云轮廓图为。金属Ge晶胞结构与金刚石类似,质地硬而脆,沸点2830℃,锗晶体属于晶体。(2)、①(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为 , (CH3)3C+中碳骨架的几何构型为。②治疗铅中毒可滴注依地酸钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是(填标号)

A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
D.依地酸具有良好的水溶性是由于其分子间能形成氢键
(3)、下表列出了碱土金属碳酸盐的热分解温度和阳离子半径:碳酸盐
MgCO3
CaCO3
SrCO3
BaCO3
热分解温度/℃
402
900
1172
1360
阳离子半径/pm
66
99
112
135
碱土金属碳酸盐同主族由上到下的热分解温度逐渐升高,原因是:。
(4)、有机卤化铅晶体具有独特的光电性能,下图为其晶胞结构示意图:
①若该晶胞的边长为anm,则Cl-间的最短距离是。
②在该晶胞的另一种表达方式中,若图中Pb2+处于顶点位置,则Cl-处于位置。原子坐标参数B为(0,0,0);A1为(1/2,1/2,1/2),则X2为。
31. 已知X、Y、Z、M、N是原子序数依次增大的前四周期元素,其中Y是地壳中含量第二的元素,X、Y、Z是核外未成对电子数均为2的非金属元素,ZX3的空间结构为平面三角形,M的价层电子数为6,N与Z同族。请回答下列问题:(1)、X为(填元素名称,下同),Y为 , Z为。(2)、M在元素周期表的位置是 , 基态N原子的价层电子排布式为。(3)、X、Y、Z的第一电离能由大到小的顺序为(填元素符号)。(4)、Z与N的最简单氢化物的稳定性比较: (写化学式),原因为。(5)、YX2的晶体类型为 , 其熔点(填“高于”或“低于”)NX2。32. 我国科学家研发的全球首套“液态阳光”项目使双碳目标更近一步。该项目通过太阳能发电电解水制氢,再将加氢合成。(1)、太阳能电池板的主要材料为单晶硅。①单晶硅属于晶体。
②单晶硅的熔点低于金刚石的,原因是。
(2)、在催化剂作用下,与反应得到。①分子的空间结构为。
②和分子中键数目之比为。
③比在水中的溶解度大,这是因为。
(3)、催化剂可实现高选择性加氢合成 , 其晶胞结构如图所示。
①B代表(填“”或“”),理由是。
②晶胞的棱长分别为、、 , 其晶体密度为(列算式)。已知: , 为阿伏加德罗常数的值
33. 回答下列问题:(1)、现有六种物质:①碘晶体②晶体硅③晶体④晶体⑤晶体⑥铁,其中属于原子晶体的化合物是(填序号);③在熔化时破坏的作用力为。(2)、①②③ ④金刚石,这四种物质中碳原子采取杂化的是(填序号);乳酸分子中有个手性碳。 34. 第IVA族元素及其化合物是结构化学研究的热点。几种晶体结构如图所示:
④金刚石,这四种物质中碳原子采取杂化的是(填序号);乳酸分子中有个手性碳。 34. 第IVA族元素及其化合物是结构化学研究的热点。几种晶体结构如图所示: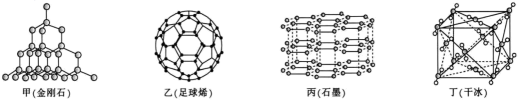 (1)、基态锗(G)的价电子排布图为。(2)、上述四种晶体中,石墨中碳原子之间具有的作用有。(3)、在碳族元素中,最简单气态氢化物中最稳定的是(填分子式)。(4)、在碳的氢化物中,既含σ键,又含π键的分子有许多,其中含σ键与π键数目之比为5:1的分子的结构简式为(写一种)。(5)、硅晶体结构类似于金刚石(如图甲),则14g硅晶体中含mol共价键。1mol石墨如图丙晶体中含mol共价键。(6)、设NA为阿伏加德罗常数的值,已知干冰(如图丁)的晶胞边长为apm,则干冰的密度为g•cm-3(用含a和NA的代数式表示)。35. 碳元素的单质有多种形式,如图依次是金刚石、石墨和C60的结构示意图:
(1)、基态锗(G)的价电子排布图为。(2)、上述四种晶体中,石墨中碳原子之间具有的作用有。(3)、在碳族元素中,最简单气态氢化物中最稳定的是(填分子式)。(4)、在碳的氢化物中,既含σ键,又含π键的分子有许多,其中含σ键与π键数目之比为5:1的分子的结构简式为(写一种)。(5)、硅晶体结构类似于金刚石(如图甲),则14g硅晶体中含mol共价键。1mol石墨如图丙晶体中含mol共价键。(6)、设NA为阿伏加德罗常数的值,已知干冰(如图丁)的晶胞边长为apm,则干冰的密度为g•cm-3(用含a和NA的代数式表示)。35. 碳元素的单质有多种形式,如图依次是金刚石、石墨和C60的结构示意图:
分析上图可知:
(1)、金刚石的晶体类型是 , 晶体中每个最小环上的碳原子的个数是。(2)、石墨晶体呈层状结构,层内每个正六边形拥有的碳原子的个数是 , 层与层之间的作用力是。(3)、C60分子中每个碳原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则Co分子中σ键与π键数目之比为。