高考二轮复习知识点:离子晶体
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列各组物质的晶体类型相同的是( )A、SiO2和SO3 B、I2和NaCl C、Cu和Ag D、SiC和MgO2. 钛酸钙是典型的钙钛矿型化合物,该类化合物具有特殊的理化性质,比如吸光性、电催化性等,其晶体结构如图所示。

下列说法错误的是
A、该晶体为离子晶体 B、钛酸钙的化学式为 C、每个晶胞中含有8个 D、每个Ca²⁺周围距离最近且等距的有12个3. 氯化铬酰()常温下为深红色液体,能与、等互溶,沸点117℃,不存在立体异构,遇水反应并生成两种酸。下列说法错误的是A、中Cr的化合价数与基态原子的价电子数相等 B、结构为四面体而非平面形 C、为离子晶体 D、遇水可发生反应:4. 下列物质所属晶体类型分类正确的是( )选项
A
B
C
D
共价晶体
石墨
生石灰
碳化硅
金刚石
分子晶体
冰
固态氨
氯化铯
干冰
离子晶体
氮化铝
食盐
明矾
芒硝
金属晶体
铜
汞
铝
铁
A、A B、B C、C D、D5. 非金属元素之间形成的化合物,不可能是( )A、离子化合物 B、共价分子 C、金属晶体 D、原子晶体6. 如图1是立方晶胞结构,图2为结构,图3为晶胞结构。
下列说法错误的是( )
A、晶胞中,的配位数是8 B、晶胞中,与H之间的最短距离为 C、中存在离子键、配位键和共价键 D、1个晶胞中含有2个钠原子7. 下列说法正确的是( )A、氯化铝、氢氟酸都属于强电解质 B、用丁达尔效应可鉴别氯化钠溶液和淀粉溶液 C、离子化合物都含有金属元素 D、按性质分类二氧化氮属于酸性氧化物8. Cu2ZnSnS4是太阳能薄膜电池的重要成分,其晶胞结构(棱边夹角均为90°)如图所示,下列说法错误的是( ) A、第一电离能:Cu<Zn B、1个晶胞中含有Cu2ZnSnS4单元数为2个 C、距离每个Zn原子最近的S原子数为2个 D、四种元素基态原子中,核外电子空间运动状态最多的为Sn原子9. 由相邻短周期元素W、X、Y、Z组成的穴状配体结构如图(部分W和X未标注)X、Y、Z同周期,W原子半径在周期表中最小,下列说法错误的是( )
A、第一电离能:Cu<Zn B、1个晶胞中含有Cu2ZnSnS4单元数为2个 C、距离每个Zn原子最近的S原子数为2个 D、四种元素基态原子中,核外电子空间运动状态最多的为Sn原子9. 由相邻短周期元素W、X、Y、Z组成的穴状配体结构如图(部分W和X未标注)X、Y、Z同周期,W原子半径在周期表中最小,下列说法错误的是( ) A、第一电离能:Y>Z>X B、W、X、Y三种元素可形成直线型或平面型化合物 C、X、Y、Z分别与W形成的简单化合物,其熔沸点在同主族元素中均为最高 D、含W、X、Y、Z元素的化合物,既可以形成分子晶体也可以形成离子晶体10. 下列描述中正确的是( )。A、原子晶体中只含共价键 B、离子晶体中只含离子键,不含有共价键 C、分子晶体中只存在分子间作用力,不含其它化学键 D、任何晶体中,若含阳离子也一定还有阴离子11. 关于晶体的叙述中,正确的是( )A、原子晶体中,共价键的键能越大,熔、沸点越高 B、分子晶体中,分子间的作用力越大,该分子越稳定 C、分子晶体中,共价键的键能越大,熔、沸点越高 D、某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体12. 具有下列性质的物质可能属于离子晶体的是( )
A、第一电离能:Y>Z>X B、W、X、Y三种元素可形成直线型或平面型化合物 C、X、Y、Z分别与W形成的简单化合物,其熔沸点在同主族元素中均为最高 D、含W、X、Y、Z元素的化合物,既可以形成分子晶体也可以形成离子晶体10. 下列描述中正确的是( )。A、原子晶体中只含共价键 B、离子晶体中只含离子键,不含有共价键 C、分子晶体中只存在分子间作用力,不含其它化学键 D、任何晶体中,若含阳离子也一定还有阴离子11. 关于晶体的叙述中,正确的是( )A、原子晶体中,共价键的键能越大,熔、沸点越高 B、分子晶体中,分子间的作用力越大,该分子越稳定 C、分子晶体中,共价键的键能越大,熔、沸点越高 D、某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体12. 具有下列性质的物质可能属于离子晶体的是( )
A、熔点113 ℃,能溶于CS2 B、熔点44℃,液态不导电 C、熔点1124℃,易溶于水 D、熔点180 ℃,固态能导电13. 下列说法中正确的是( )A、晶体中分子间作用力越大分子越稳定 B、原子晶体中共价键越强熔点越高 C、冰融化时水分子中共价键发生断裂 D、氢氧化钠熔化时离子键、共价键均被破坏14. 具有下列性质的物质可能属于离子晶体的是( )A、熔点801℃,易溶于水 B、熔点10.31℃,液态不导电 C、熔点112.8℃,能溶于CS2 D、熔点97.81℃,固态能导电二、多选题
-
15. 锌与硫所形成化合物晶体的晶胞结构如图所示。下列判断正确的是( )
 A、该晶体属于离子晶体 B、该晶胞中Zn2+和S2-数目不相等 C、氧化锌的熔点大于硫化锌 D、阳离子的配位数为616. 对晶胞的研究有助于我们了解整个晶体的结构。Cu晶胞的结构如图1所示(晶胞参数为a pm),CuSe晶胞的结构如图2所示,设NA为阿伏加德罗常数的值,下列说法正确的是( )
A、该晶体属于离子晶体 B、该晶胞中Zn2+和S2-数目不相等 C、氧化锌的熔点大于硫化锌 D、阳离子的配位数为616. 对晶胞的研究有助于我们了解整个晶体的结构。Cu晶胞的结构如图1所示(晶胞参数为a pm),CuSe晶胞的结构如图2所示,设NA为阿伏加德罗常数的值,下列说法正确的是( ) A、Cu晶胞的密度为 B、图1中最近的两个Cu之间的距离为 C、填充在形成的正四面体空隙中 D、图2中1个晶胞含14个17. 以Li2O晶胞的某一顶点为原点建立坐标系,沿x、y、z轴的晶胞投影均如图所示。下列说法错误的是( )
A、Cu晶胞的密度为 B、图1中最近的两个Cu之间的距离为 C、填充在形成的正四面体空隙中 D、图2中1个晶胞含14个17. 以Li2O晶胞的某一顶点为原点建立坐标系,沿x、y、z轴的晶胞投影均如图所示。下列说法错误的是( ) A、熔点:Li2O>Na2O>K2O B、Li2O晶体中,O2-的配位数为6 C、Li2O晶体中,与O2-等距且最近的O2-个数为12 D、若Li2O的晶胞参数为anm,则Li+与O2-的最近距离为anm18. 下列图中结构是从不同晶体中分割出来的一部分,其中是从NaCl晶体中分割出来的是( )A、
A、熔点:Li2O>Na2O>K2O B、Li2O晶体中,O2-的配位数为6 C、Li2O晶体中,与O2-等距且最近的O2-个数为12 D、若Li2O的晶胞参数为anm,则Li+与O2-的最近距离为anm18. 下列图中结构是从不同晶体中分割出来的一部分,其中是从NaCl晶体中分割出来的是( )A、 B、
B、 C、
C、 D、
D、 19. 下列关于晶体的说法中,正确的是( )A、SiO2晶体中每个硅原子与两个氧原子以共价键相结合 B、NaCl晶体中每个Na+周围同时吸引6个Cl- C、干冰晶体中每个CO2分子周围与它距离最近且等距的CO2分子有12个 D、共价键可决定分子晶体的熔、沸点20. 下列有关晶体的叙述中,正确的是( )A、氯化钠和氯化铯晶体中,阳离子的配位数均为6 B、金刚石为三维网状结构,由碳原子以sp3杂化轨道形成共价键 C、金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8 D、干冰晶体中,每个CO2分子周围紧邻8个CO2分子
19. 下列关于晶体的说法中,正确的是( )A、SiO2晶体中每个硅原子与两个氧原子以共价键相结合 B、NaCl晶体中每个Na+周围同时吸引6个Cl- C、干冰晶体中每个CO2分子周围与它距离最近且等距的CO2分子有12个 D、共价键可决定分子晶体的熔、沸点20. 下列有关晶体的叙述中,正确的是( )A、氯化钠和氯化铯晶体中,阳离子的配位数均为6 B、金刚石为三维网状结构,由碳原子以sp3杂化轨道形成共价键 C、金属钠的晶体采用体心立方堆积,每个晶胞含2个原子,配位数为8 D、干冰晶体中,每个CO2分子周围紧邻8个CO2分子三、非选择题
-
21.(1)、乙醇的挥发性比水的强,原因是。(2)、金属氢化物是应用广泛的还原剂。的还原性比的强,原因是。22.(1)、用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰,原因是。(2)、金属镓(Ga)位于元素周期表中第4周期IIIA族,其卤化物的熔点如下表:
GaF3
GaCl3
GaBr3
熔点/℃
> 1000
77. 75
122. 3
GaF3熔点比GaCl3熔点高很多的原因是。
23. 2020年12月17日凌晨1时59分,“嫦娥五号”首次实现了我国地外天体采样返回,标志着我国航天事业迈出了一大步。带回的月壤中包含了H、O、N、Al、S、Cd、Zn、Ti、Cu、Au、Cr等多种元素。回答下列问题:(1)、锌(Zn)、镉(Cd)位于同一副族相邻周期,Cd的原子序数更大,则基态Cd原子的价电子轨道表示式(电子排布图)为。(2)、S与O可形成多种微粒,其中SO 的空间构型为;液态SO3冷却到289.8K时,能得到一种螺旋状单链结构的固体,其结构如图所示,此固态SO3中S原子的杂化轨道类型是 。 (3)、重铬酸铵为桔黄色单斜结晶,常用作有机合成催化剂,Cr2O 的结构如图所示。则1mol重铬酸铵中含σ键与π键个数比为。
(3)、重铬酸铵为桔黄色单斜结晶,常用作有机合成催化剂,Cr2O 的结构如图所示。则1mol重铬酸铵中含σ键与π键个数比为。 (4)、α-Al2O3是“嫦娥五号”中用到的一种耐火材料,具有熔点高(2054℃)、硬度大的特点,主要原因为。(5)、一种铜金合金具有储氢功能,其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为。该储氢材料储氢时,氢分子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与ZnS的结构相似(如图),该晶体储氢后的化学式为。
(4)、α-Al2O3是“嫦娥五号”中用到的一种耐火材料,具有熔点高(2054℃)、硬度大的特点,主要原因为。(5)、一种铜金合金具有储氢功能,其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为。该储氢材料储氢时,氢分子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与ZnS的结构相似(如图),该晶体储氢后的化学式为。 (6)、“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),已知该结构单元底面(正六边形)边长为anm,该合金的密度为ρg·cm-3 , 则高为h=nm(列出计算式,NA为阿伏加德罗常数的值)。
(6)、“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),已知该结构单元底面(正六边形)边长为anm,该合金的密度为ρg·cm-3 , 则高为h=nm(列出计算式,NA为阿伏加德罗常数的值)。 24. Co、Se、Fe、Cr、Ni、C等元素化合物在生产、生活中应用广泛。回答下列问题:(1)、金属可导电、导热,有金属光泽和延展性,这些性质都可以用“理论”解释。(2)、已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合(选填编号),每个Mn原子周围紧邻的原子数为。
24. Co、Se、Fe、Cr、Ni、C等元素化合物在生产、生活中应用广泛。回答下列问题:(1)、金属可导电、导热,有金属光泽和延展性,这些性质都可以用“理论”解释。(2)、已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合(选填编号),每个Mn原子周围紧邻的原子数为。A.
 B.
B.  C.
C.  D.
D.  (3)、无水CoCl2的熔点是735℃,沸点1049℃,CoCl2属于晶体;砷酸 分子中As原子的杂化方式为杂化。(4)、碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞, 分子占据顶点和面心处, 占据的是 分子围成的正四面体空隙和空隙(填几何空间构型)。
(3)、无水CoCl2的熔点是735℃,沸点1049℃,CoCl2属于晶体;砷酸 分子中As原子的杂化方式为杂化。(4)、碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞, 分子占据顶点和面心处, 占据的是 分子围成的正四面体空隙和空隙(填几何空间构型)。 (5)、Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+ , 则晶体中Ni2+与Ni3+的最简整数比为 , 晶胞参数为428pm,则晶体密度为g/cm3( 表示阿伏加德罗常数的值,列出表达式)25. 腐蚀、防腐以及催化等化学化工过程都涉及金属纳米团簇的研究,团簇已经成为化学和材料研究的前言和热点。金属纳米团簇最外层需要配体来稳定,常见有硫醇配体、磷配体和炔配体。卤素作为第二配体或第三配体,其体积比硫醇配体、磷配体和炔配体更小,在形成纳米团簇的过程中空间位阻更小,而且卤素与金、银具有较好的配位能力。
(5)、Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+ , 则晶体中Ni2+与Ni3+的最简整数比为 , 晶胞参数为428pm,则晶体密度为g/cm3( 表示阿伏加德罗常数的值,列出表达式)25. 腐蚀、防腐以及催化等化学化工过程都涉及金属纳米团簇的研究,团簇已经成为化学和材料研究的前言和热点。金属纳米团簇最外层需要配体来稳定,常见有硫醇配体、磷配体和炔配体。卤素作为第二配体或第三配体,其体积比硫醇配体、磷配体和炔配体更小,在形成纳米团簇的过程中空间位阻更小,而且卤素与金、银具有较好的配位能力。 (1)、银位于元素周期表第五周期第IB族元素,其价电子排布式为。(2)、金(Au)溶于王水的原理是金与强氧化性的硝酸生成微量的Au3+和NO,盐酸提供的Cl-与Au3+形成[AuCl4]-配离子,写出总反应的离子方程式:。(3)、[Au80Ag30(
(1)、银位于元素周期表第五周期第IB族元素,其价电子排布式为。(2)、金(Au)溶于王水的原理是金与强氧化性的硝酸生成微量的Au3+和NO,盐酸提供的Cl-与Au3+形成[AuCl4]-配离子,写出总反应的离子方程式:。(3)、[Au80Ag30( )42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是。 (4)、第三周期部分主族元素的氟化物的熔点(见表)
)42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是。 (4)、第三周期部分主族元素的氟化物的熔点(见表)化合物
NaF
AlF3
SiF4
SF6
熔点/℃
993
1040
-90
-50.5
由表中数值可以判断AlF3晶体类型为 , SiF4比SF6熔点低的原因;SF6分子的空间构型为正八面体,如图所示,它的二氯代物SF4Cl2有种。
(5)、固态五氯化磷为离子晶体,结构单元可以写作PCl 、PCl ,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:若密度为d g/cm3 , 则晶胞参数a=pm(已知阿伏加德罗常数的值为NA , 列出计算式即可)。 26. [化学———选修3:物质结构与性质]
26. [化学———选修3:物质结构与性质]黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)、Cu2+ 基态核外电子排布式为。(2)、在较低温度下 CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体 X产生。①X分子的立体构型为 , 中心原子杂化类型为。
②X的沸点比水低的主要原因是。
(3)、CuFeS2与氧气反应生成 SO2 , SO2中心原子的价层电子对数为 , 其中基态 S原子中,核外电子占据的最高能层的符号是 , 占据最高能级电子的电子云轮廓图为形。分子中的大 π 键可用符号 表示,其中 m代表参与形成的大π 键原子数,n代表参与形成的大π 键电子数(如苯分子中的大π 键可表示为 Π66),则 SO2中的大 π 键应表示为。
(4)、四方晶系 CuFeS2晶胞结构如图所示。①Cu+的配位数为 , S2- 的配位数为。
②已 知:a=b=0.524nm,c=1.032nm,NA 为阿伏加德罗常数的值,CuFeS2晶体的密度是g• cm3(列出计算式)。
 27. 已知A、B、C为常见的晶体,其中A为离子晶体,A中含短周期中金属性最强的元素,B中元素基态原子的3P轨道上有2个电子,C是空气的成分之一。
27. 已知A、B、C为常见的晶体,其中A为离子晶体,A中含短周期中金属性最强的元素,B中元素基态原子的3P轨道上有2个电子,C是空气的成分之一。 (1)、图中分别代表A , C(填化学式),B为晶体(填晶体类型)。(2)、碳、硅的一种化合物晶胞如下图,在该晶胞中,含硅原子的数目为;该化合物的化学式为。
(1)、图中分别代表A , C(填化学式),B为晶体(填晶体类型)。(2)、碳、硅的一种化合物晶胞如下图,在该晶胞中,含硅原子的数目为;该化合物的化学式为。 (3)、某钛配合物可用于催化环烯烃聚合,其结构如下图所示:。
(3)、某钛配合物可用于催化环烯烃聚合,其结构如下图所示:。
①钛的配位数为。
②该配合物中存在的化学键有(填字母)。
A.离子键 B.配位键 C.金属键 D.共价键 E.氢键
(4)、钛与卤素形成的化合物熔、沸点如下表所示:TiCl4
TiBr4
TiI4
熔点/℃
-24.1
38.3
155
沸点/℃
136.5
233.5
377
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因。
(5)、中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是:将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如下图。已知T-碳晶胞参数为apm,阿伏加德罗常数为NA , 则T-碳的密度为g/cm3(列出计算式)。 28. 回答下列问题:(1)、1987年诺贝尔化学奖授予三位化学家,以表彰他们在超分子化学理论方面的开创性工作。钾离子可以嵌入冠醚(如:18-冠-6)的空穴中形成超分子,如图所示。
28. 回答下列问题:(1)、1987年诺贝尔化学奖授予三位化学家,以表彰他们在超分子化学理论方面的开创性工作。钾离子可以嵌入冠醚(如:18-冠-6)的空穴中形成超分子,如图所示。
KCl与18-冠-6形成的化合物的晶体类型为 , 这种化合物的熔点比氯化钾(填“高”或“低”),理由是。
(2)、研究发现,反应 ,在加入18-冠-6以后,相同时间内的产率从24%提高到95%,而18-冠-6没有参与反应过程,18-冠-6的作用是。 (3)、钾元素与氧元素形成的某些化合物可以作为宇宙飞船的供氧剂。其中一种化合物的晶胞在XY平面、XZ平面、YZ平面上的投影如图(2)所示,该晶胞中存在的微粒间作用力有 , 钾元素和氧元素形成的化合物的化学式为 , 其晶胞边长为anm,为阿伏加德罗常数的值,该晶体的密度为(列出计算式,不必计算)。
,在加入18-冠-6以后,相同时间内的产率从24%提高到95%,而18-冠-6没有参与反应过程,18-冠-6的作用是。 (3)、钾元素与氧元素形成的某些化合物可以作为宇宙飞船的供氧剂。其中一种化合物的晶胞在XY平面、XZ平面、YZ平面上的投影如图(2)所示,该晶胞中存在的微粒间作用力有 , 钾元素和氧元素形成的化合物的化学式为 , 其晶胞边长为anm,为阿伏加德罗常数的值,该晶体的密度为(列出计算式,不必计算)。 29. 我国科学家在铁基高温超导体的研究上取得重大突破,发现了该超导体是由Fe、Ba、As三种元素组成,这为进一步理解超导配对机理及其与电荷密度波的关系提供了重要实验证据。
29. 我国科学家在铁基高温超导体的研究上取得重大突破,发现了该超导体是由Fe、Ba、As三种元素组成,这为进一步理解超导配对机理及其与电荷密度波的关系提供了重要实验证据。回答下列问题:
(1)、Ba元素属于元素周期表的区元素。(2)、基态Fe原子核外电子排布式为 , 同周期中基态原子未成对电子数比Fe多的有种元素。(3)、As为第四周期第ⅤA族元素,与其同周期且相邻的元素分别为32Ge、34Se,三种元素的基态原子第一电离能由大到小的顺序为 , 原因为。(4)、的晶胞结构如图1所示。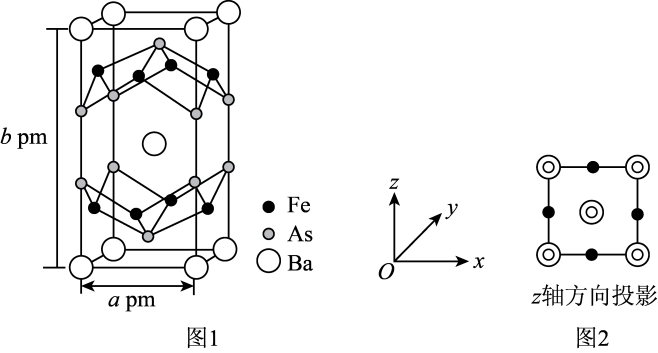
该晶体的化学式为 , 设NA表示阿伏加德罗常数的值,该晶体的密度是(用含a、b、NA的代数式表示)。
30. 将高温水蒸气通到硫氰化钾的表面,会发生如下反应:4KSCN+9H2O(g)→K2CO3+K2S+3CO2+3H2S+4NH3。完成下列填空:
(1)、画出硫原子的结构示意图 , 写出K2S的电子式。(2)、K2CO3中含有的化学键有 , 属于晶体。(3)、K2S水溶液呈(选填“酸性”、“碱性”或“中性”),溶液中c(K+)与c(S2-)之比2:1(选填“>”、“<”或“=”)。(4)、K2S接触潮湿银器表面时,出现黑色斑点(Ag2S),其化学反应如下:2K2S+4Ag+O2+2H2O→2Ag2S+4KOH①标出上述反应电子转移方向和数目。
②标准状况下,每消耗224mLO2 , 转移电子的数目为个。
31. 硒化物(如KCu4Se8)可用于太阳能电池、光传感器、热电发电与制冷等。回答下列问题; (1)、基态Cu原子的价电子排布式为。(2)、O、S、Se均位于元素周期表第VIA族,H2O、H2S、H2Se的沸点由高到低排序为 , 这是因为。(3)、配合物[Cu(CH3CN)4]BF4中,共价键的类型是 , 阴离子的空间构型为 , 配体中提供孤对电子的原子是 , 配体中碳原子的杂化方式是。配体中各元素的电负性由强到弱排序为。(4)、Cu、Sb、Se组成的热电材料,其晶胞结构如图所示,a=b=566 pm,c=1128 pm,该晶体的密度为g/cm3 (列出计算式)。32. 2020年12月17日我国月球探测器“嫦娥五号”成功携带月壤,返回地球。月壤主要由氧(O)、硅(Si)、铝(Al)、铁(Fe)、铜(Cu)、镍(Ni)等多种元素组成。回答下列问题:(1)、是“嫦娥五号”中用到的一种耐火材料,其熔点高、硬度大。工业上电解熔融冶炼Al,属于晶体,第一电离能Ⅰ1 (Mg)与Ⅰ1 (Al)的关系是Ⅰ1 (Mg) Ⅰ1 (Al)(填“>”、“<”或“=”)。(2)、可与邻二氮菲(
(1)、基态Cu原子的价电子排布式为。(2)、O、S、Se均位于元素周期表第VIA族,H2O、H2S、H2Se的沸点由高到低排序为 , 这是因为。(3)、配合物[Cu(CH3CN)4]BF4中,共价键的类型是 , 阴离子的空间构型为 , 配体中提供孤对电子的原子是 , 配体中碳原子的杂化方式是。配体中各元素的电负性由强到弱排序为。(4)、Cu、Sb、Se组成的热电材料,其晶胞结构如图所示,a=b=566 pm,c=1128 pm,该晶体的密度为g/cm3 (列出计算式)。32. 2020年12月17日我国月球探测器“嫦娥五号”成功携带月壤,返回地球。月壤主要由氧(O)、硅(Si)、铝(Al)、铁(Fe)、铜(Cu)、镍(Ni)等多种元素组成。回答下列问题:(1)、是“嫦娥五号”中用到的一种耐火材料,其熔点高、硬度大。工业上电解熔融冶炼Al,属于晶体,第一电离能Ⅰ1 (Mg)与Ⅰ1 (Al)的关系是Ⅰ1 (Mg) Ⅰ1 (Al)(填“>”、“<”或“=”)。(2)、可与邻二氮菲( )中N原子通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定浓度,基态离子的价层电子排布式为 , 价层电子占据的原子轨道数为 , 邻二氮菲中N原子的杂化类型为。 (3)、将金属铜投入氨水与的混合溶液中,铜片溶解,溶液呈深蓝色,该反应的离子方程式为。(4)、月壤中含有丰富的珍贵的 , 中国科学家在2017年成功合成钠氦化合物,使这个最稳定的元素“脱单”。该化合物晶胞中的排布如图所示,电子对()和原子交替分布填充在小立方体的中心,晶胞中距最近的He原子数目为 , 该化合物的化学式可表示为 , 则x=(用z表达),晶胞参数为a pm,该晶体密度为(写出表达式)。
)中N原子通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定浓度,基态离子的价层电子排布式为 , 价层电子占据的原子轨道数为 , 邻二氮菲中N原子的杂化类型为。 (3)、将金属铜投入氨水与的混合溶液中,铜片溶解,溶液呈深蓝色,该反应的离子方程式为。(4)、月壤中含有丰富的珍贵的 , 中国科学家在2017年成功合成钠氦化合物,使这个最稳定的元素“脱单”。该化合物晶胞中的排布如图所示,电子对()和原子交替分布填充在小立方体的中心,晶胞中距最近的He原子数目为 , 该化合物的化学式可表示为 , 则x=(用z表达),晶胞参数为a pm,该晶体密度为(写出表达式)。 33. 镍的化合物是一组多彩的物质。(1)、 呈黄色,其中 的价电子轨道表示式为。(2)、 呈绿色,晶体结构与氯化钠类似,每个 周围有个最近距离的 。(3)、 是一种无色挥发性液体,沸点为 ,熔点为 。
33. 镍的化合物是一组多彩的物质。(1)、 呈黄色,其中 的价电子轨道表示式为。(2)、 呈绿色,晶体结构与氯化钠类似,每个 周围有个最近距离的 。(3)、 是一种无色挥发性液体,沸点为 ,熔点为 。①它形成的晶体类型为。
②配体 中 键和 键的个数比为。
(4)、丁二酮肟镍呈鲜红色,其结构如下图。
①分子中第二周期元素的第一电离能由大到小的顺序为。
②丁二酮肟镍分子中存在的化学键有。
A.共价键 B.氢键 C.离子键 D.金属键 E.配位键
34.(1)、下列物质在固态时,属于分子晶体的有 , 属于原子晶体的 , 属于离子晶体的有(以上均填序号)①金刚石 ②氩 ③水晶 ④水银 ⑤氟化钙 ⑥P4 ⑦苯
(2)、某常见固体能导电,质软,它可能属于__________A、分子晶体 B、原子晶体 C、离子晶体 D、金属晶体 E、混合晶体(3)、在氯化钠晶体(见图1)中,每个钠离子与个最近且等距离的氯离子以 键相结合,与每个氯离子最近的且等距离的氯离子有 个。由于晶体中离子按一定的规律排列,必然造就了一颗完美晶体特定的几何外形,其中氯化钠单晶的宏观外形为 。 35. 氟在自然界中常以CaF2的形式存在。(1)、下列关于CaF2的表述正确的是。
35. 氟在自然界中常以CaF2的形式存在。(1)、下列关于CaF2的表述正确的是。a.F-的离子半径小于Cl- , 则CaF2的熔点高于CaCl2
b.Ca2+与F-间仅存在静电吸引作用
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)、CaF2难溶于水,但可溶于含Al3+的溶液中,原因是(用离子方程式表示)。 已知AlF63-在溶液中可稳定存在。(3)、F2通入稀NaOH溶液中可生成OF2 , OF2分子构型为 , 其中氧原子的杂化方式为。(4)、F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1 , F-F键键能为159kJ·mol-1 , Cl-Cl键键能为242kJ·mol-1 , 则ClF3中Cl-F键的平均键能为kJ·mol-1。ClF3的熔、沸点比BrF3的(填“高”或“低”)。