高考二轮复习知识点:“等电子原理”的应用
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 等电子体是指含有相同电子数和原子数的分子、离子或基团。下列各组微粒间互为等电子体的是A、和 B、HCl和 C、和CO D、与2. 根据等电子原理可知,由短周期元素组成的粒子,只要其原子总数和价电子总数相同,均可互称为等电子体。下列各组粒子不能互称为等电子体的是( )A、和 B、和 C、和 D、和3. 徐光宪在《分子共和国》一书中介绍了许多分子,如、、、CO等。下列有关说法错误的是( )A、为非极性分子 B、的结构式为:
 C、分子中键的键角为120°
D、CO与互为等电子体
4. 已知 CN- 与 N2互为等电子体,则下列有关 HCN 的说法正确的是( )A、HCN 分子的立体构型为 V 形 B、HCN 分子中σ 键与π键个数比为1:2 C、已知 HCN 标况下为液态,与水、乙醇互溶,则其固态时为分子晶体 D、HCN 制备:C2H4+NH3=HCN+CH4+H2 , 该方程式涉及到的非极性分子有2种5. 下列说法中正确的是( )A、在二氧化硅晶体中 ,最小的环上的原子个数为 6 B、HCl分子里含有一个s-p σ键 C、3p3 表示 3p 能级有三个轨道 D、SO3与 互为等电子体 ,且它们中心原子都是 sp3 杂化6. 金刚石结构如图所示,晶体 Si、立方 SiC 具有类似金刚石结构。下列说法错误的是( )
C、分子中键的键角为120°
D、CO与互为等电子体
4. 已知 CN- 与 N2互为等电子体,则下列有关 HCN 的说法正确的是( )A、HCN 分子的立体构型为 V 形 B、HCN 分子中σ 键与π键个数比为1:2 C、已知 HCN 标况下为液态,与水、乙醇互溶,则其固态时为分子晶体 D、HCN 制备:C2H4+NH3=HCN+CH4+H2 , 该方程式涉及到的非极性分子有2种5. 下列说法中正确的是( )A、在二氧化硅晶体中 ,最小的环上的原子个数为 6 B、HCl分子里含有一个s-p σ键 C、3p3 表示 3p 能级有三个轨道 D、SO3与 互为等电子体 ,且它们中心原子都是 sp3 杂化6. 金刚石结构如图所示,晶体 Si、立方 SiC 具有类似金刚石结构。下列说法错误的是( ) A、熔沸点:金刚石>晶体Si B、晶体 Si 晶胞中含有 8 个 Si C、根据等电子原理推测,BN 可形成类似金刚石的晶体 D、立方 SiC 晶胞顶点从1号位分别平移至2号位和3号位,所得晶胞中Si 位置相同7. 下列说法错误的是( )A、O2、CO2、N2都是非极性分子 B、酸性: C、C3H8中碳原子都采用sp3杂化 D、CO的一种等电子体为NO+ , 它的电子式为
A、熔沸点:金刚石>晶体Si B、晶体 Si 晶胞中含有 8 个 Si C、根据等电子原理推测,BN 可形成类似金刚石的晶体 D、立方 SiC 晶胞顶点从1号位分别平移至2号位和3号位,所得晶胞中Si 位置相同7. 下列说法错误的是( )A、O2、CO2、N2都是非极性分子 B、酸性: C、C3H8中碳原子都采用sp3杂化 D、CO的一种等电子体为NO+ , 它的电子式为 8. 下列说法中正确的是( )A、CH4、BCl3、SO2都是含有极性键的非极性分子 B、甲烷分子失去一个H+ , 形成 ,其碳原子的杂化类型发生了改变 C、SO2和O3、 和 互为等电子体 D、元素的基态原子核外电子排布都遵循构造原理
8. 下列说法中正确的是( )A、CH4、BCl3、SO2都是含有极性键的非极性分子 B、甲烷分子失去一个H+ , 形成 ,其碳原子的杂化类型发生了改变 C、SO2和O3、 和 互为等电子体 D、元素的基态原子核外电子排布都遵循构造原理二、多选题
-
9. 与NO3﹣互为等电子体的是( )A、SO3 B、BF3 C、CH4 D、NO2
三、非选择题
-
10. [选修3:物质结构与性质]
KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(1)、在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是(填离子符号)。(2)、原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用- 表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为。(3)、已知有关氨、磷的单键和三键的键能(kJ•mol-1)如表:N—N
N≡N
P—P
P≡P
193
946
197
489
从能量角度看,氮以N2、而白磷以P4(结构式可表示为
 )形式存在的原因是。(4)、已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 , 其中P采取杂化方式。(5)、与PO 电子总数相同的等电子体的分子式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如:
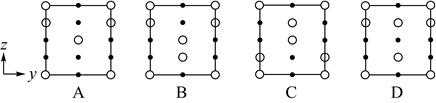
)形式存在的原因是。(4)、已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 , 其中P采取杂化方式。(5)、与PO 电子总数相同的等电子体的分子式为。(6)、磷酸通过分子间脱水缩合形成多磷酸,如: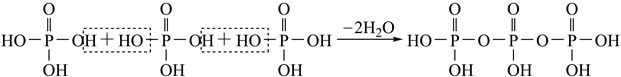 如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。(7)、分别用○、●表示H2PO 和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。(7)、分别用○、●表示H2PO 和K+ , KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA , 晶体的密度__g•cm-3(写出表达式)。
②晶胞在x轴方向的投影图为__(填标号)。
 11. 【物质结构与性质】以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵((NH4)3Fe(C6H5O7)2)。(1)、Fe基态核外电子排布式为; 中与Fe2+配位的原子是(填元素符号)。(2)、NH3分子中氮原子的轨道杂化类型是;C、N、O元素的第一电离能由大到小的顺序为。(3)、与NH 互为等电子体的一种分子为(填化学式)。(4)、柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为mol。
11. 【物质结构与性质】以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵((NH4)3Fe(C6H5O7)2)。(1)、Fe基态核外电子排布式为; 中与Fe2+配位的原子是(填元素符号)。(2)、NH3分子中氮原子的轨道杂化类型是;C、N、O元素的第一电离能由大到小的顺序为。(3)、与NH 互为等电子体的一种分子为(填化学式)。(4)、柠檬酸的结构简式见图。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为mol。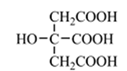 12. 氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:(1)、H、B、N中,原子半径最大的是。根据对角线规则,B的一些化学性质与元素的相似。(2)、NH3BH3分子中,N—B化学键称为键,其电子对由提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH3+ +9H2 , 的结构如图所示:
12. 氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:(1)、H、B、N中,原子半径最大的是。根据对角线规则,B的一些化学性质与元素的相似。(2)、NH3BH3分子中,N—B化学键称为键,其电子对由提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH3+ +9H2 , 的结构如图所示: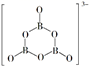
在该反应中,B原子的杂化轨道类型由变为。
(3)、NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是。与NH3BH3原子总数相等的等电子体是(写分子式),其熔点比NH3BH3(填“高”或“低”),原因是在NH3BH3分子之间,存在 , 也称“双氢键”。(4)、研究发现,氦硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
氨硼烷晶体的密度ρ=g·cm−3(列出计算式,设NA为阿伏加德罗常数的值)。
13. [物质结构与性质][Zn(CN)4]2﹣在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2﹣+4H++4H2O═[Zn(H2O)4]2++4HOCH2CN
(1)、Zn2+基态核外电子排布式为 .(2)、1molHCHO分子中含有σ键的数目为mol.(3)、HOCH2CN分子中碳原子轨道的杂化轨道类型是 .(4)、与H2O分子互为等电子体的阴离子为 .(5)、[Zn(CN)4]2﹣中Zn2+与CN﹣的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2﹣的结构可用示意图表示为 .14. 钛及其化合物在科技、生物、材料领域均有广泛应用。回答下列问题:(1)、基态钛原子核外s能级和p能级的电子数之比为;钛元素处于元素周期表的区。(2)、含钛新型正极材料KTiPO4F具有高化学电位。①PO的立体构型为。与PO互为等电子体的分子为(任写一种,填化学式)。
②KTiPO4F中所含元素的第一电离能由大到小的顺序为(用元素符号表示)。
③一些氢化物的沸点如表所示:
氢化物
PH3
H2O
HF
沸点/℃
-87.5
100
19.5
解释表中氢化物之间沸点存在差异的原因:。
(3)、Ti(IV)在酸溶液中可形成多种离子。其中如图1所示结构的离子符号为;[Ti(OH)2(H2O)4]2+中配位键的数目为。 (4)、CaTiO3晶体中Ca、O原子在立方晶胞中的位置如图2所示,其中Ti原子填充在O原子围成的(填“正八面体”或“正四面体”)空隙中;若阿伏加德罗常数的值为NA , 晶体密度为ρg·cm-3 , 则O原子间的最近距离为pm(用含NA、ρ的代数式表示)。
(4)、CaTiO3晶体中Ca、O原子在立方晶胞中的位置如图2所示,其中Ti原子填充在O原子围成的(填“正八面体”或“正四面体”)空隙中;若阿伏加德罗常数的值为NA , 晶体密度为ρg·cm-3 , 则O原子间的最近距离为pm(用含NA、ρ的代数式表示)。 15. 尿素(
15. 尿素( )是最简单的有机物之一,其合成揭开了人工合成有机物的序幕。回答下列问题: (1)、尿素各组成元素(氢除外,下同)电负性最强的是(填元素名称),第一电离能由大到小的顺序为(填元素符号),氮原子价层电子的轨道表达式为。(2)、尿素分子中碳、氮原子的杂化方式分别为、。(3)、德国化学家维勒首次使用无机物质氰酸铵(NH4CNO)与硫酸铵合成了尿素,写出氰酸根离子(CNO-)的一种等电子体(分子、离子均可),氰酸根离子的空间构型为。(4)、尿素可与多种金属形成配合物,其配位原子可以是。(5)、现从尿素和草酸的水溶液中获得一种超分子晶体(超分子是由两种或两种以上的分子依靠特殊作用力结合而成的),形成该晶体的特殊作用力是。X射线衍射实验证实,一定温度下该晶体的晶胞与钠相同,晶胞中两种分子的个数比为1:1,若晶胞参数为505.8pm,则该晶体的密度为g/cm3(列出计算式)。16. 2020年诺贝尔化学奖正式授予法国科学家Emmanuelle Charpentier和美国科学家Jennifer A.Doudna,以表彰其“开发出一种基因组编辑方法”,利用 基因剪刀,极其精确地改变动物、植物和微生物的DNA。该“基因剪刀”中的 蛋白质可以水解产生20种氨基酸,其中含量最多的一种氨基酸是赖氨酸,其结构如图所示。
)是最简单的有机物之一,其合成揭开了人工合成有机物的序幕。回答下列问题: (1)、尿素各组成元素(氢除外,下同)电负性最强的是(填元素名称),第一电离能由大到小的顺序为(填元素符号),氮原子价层电子的轨道表达式为。(2)、尿素分子中碳、氮原子的杂化方式分别为、。(3)、德国化学家维勒首次使用无机物质氰酸铵(NH4CNO)与硫酸铵合成了尿素,写出氰酸根离子(CNO-)的一种等电子体(分子、离子均可),氰酸根离子的空间构型为。(4)、尿素可与多种金属形成配合物,其配位原子可以是。(5)、现从尿素和草酸的水溶液中获得一种超分子晶体(超分子是由两种或两种以上的分子依靠特殊作用力结合而成的),形成该晶体的特殊作用力是。X射线衍射实验证实,一定温度下该晶体的晶胞与钠相同,晶胞中两种分子的个数比为1:1,若晶胞参数为505.8pm,则该晶体的密度为g/cm3(列出计算式)。16. 2020年诺贝尔化学奖正式授予法国科学家Emmanuelle Charpentier和美国科学家Jennifer A.Doudna,以表彰其“开发出一种基因组编辑方法”,利用 基因剪刀,极其精确地改变动物、植物和微生物的DNA。该“基因剪刀”中的 蛋白质可以水解产生20种氨基酸,其中含量最多的一种氨基酸是赖氨酸,其结构如图所示。 (1)、基态C原子价层电子的轨道表达式为。基态C原子核外电子占据最高能级的电子云轮廓图为形。(2)、赖氨酸中N原子的杂化轨道类型为。(3)、C、N、O三种元素的第一电离能由小到大的顺序为 , 原因是。(4)、氨硼烷 是一种潜在的储氢材料,它可由六元环状化合物 通过反应 制得。
(1)、基态C原子价层电子的轨道表达式为。基态C原子核外电子占据最高能级的电子云轮廓图为形。(2)、赖氨酸中N原子的杂化轨道类型为。(3)、C、N、O三种元素的第一电离能由小到大的顺序为 , 原因是。(4)、氨硼烷 是一种潜在的储氢材料,它可由六元环状化合物 通过反应 制得。① 分子中有 键。
②与 互为等电子体的一种分子为(填分子式)。
③氨硼烷在高温下释放氢后生成的立方氮化硼晶体具有类似金刚石的结构,晶胞结构如图所示。它的硬度比金刚石低,原因是。设 为阿伏加德罗常数的值,若晶胞参数为 ,则晶体密度为 (列出计算式)。
 17. 硼的化合物或合金在储氢、有机合成、超导等方面用途非常广泛。(1)、Mn(BH4)2是一种储氢材料,Mn2+基态核外电子排布式为。(2)、与环硼氮六烷[分子式为(HNBH)3]互为等电子体的常见分子是(填结构简式);推测环硼氮六烷在热水、CH3OH中的溶解性:(填“难”或“易”)溶于热水、CH3OH。(3)、化合物X(如图所示)可由CH2CHCH2MgBr与B(OCH3)3制备。X分子中碳原子的轨道杂化类型为;1molX分子中含σ键数目为。
17. 硼的化合物或合金在储氢、有机合成、超导等方面用途非常广泛。(1)、Mn(BH4)2是一种储氢材料,Mn2+基态核外电子排布式为。(2)、与环硼氮六烷[分子式为(HNBH)3]互为等电子体的常见分子是(填结构简式);推测环硼氮六烷在热水、CH3OH中的溶解性:(填“难”或“易”)溶于热水、CH3OH。(3)、化合物X(如图所示)可由CH2CHCH2MgBr与B(OCH3)3制备。X分子中碳原子的轨道杂化类型为;1molX分子中含σ键数目为。 (4)、YxNiyBzCw在临界温度15.6K时可实现超导,其晶胞结构如图所示,则其化学式为。
(4)、YxNiyBzCw在临界温度15.6K时可实现超导,其晶胞结构如图所示,则其化学式为。 18. 氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:(1)、氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>。基态K+电子占据最高能级的电子云轮廓图为形。(2)、NaBH4是有机合成中常用的还原剂,其中阴离子的键角为。(3)、下列硼原子电子排布图表示的状态中,能量最低和最高的分别为、(填字母标号)。
18. 氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:(1)、氟代硼酸钾中各元素原子的第一电离能大小顺序是F>O>。基态K+电子占据最高能级的电子云轮廓图为形。(2)、NaBH4是有机合成中常用的还原剂,其中阴离子的键角为。(3)、下列硼原子电子排布图表示的状态中,能量最低和最高的分别为、(填字母标号)。A.
 B.
B. 
C.
 D.
D.  (4)、硼元素的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
(4)、硼元素的简单氢化物BH3不能游离存在,常倾向于形成较稳定的B2H6或与其他分子结合。
①B2H6分子结构如图,则B原子的杂化方式为。
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是 , 写出一种与氨硼烷互为等电子体的分子(填化学式)。
(5)、磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。P的配位数为 , 磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是 , 已知晶胞边长为apm,则磷化硼晶体的密度是g·cm-3。 19. 铬的化合物在医药、材料领域有重要作用,认识铬及其化合物有重要意义。(1)、基态铬原子中,电子占据的最高能级符号为。(2)、研究表明,当化合物的阳离子有未成对电子时,该化合物具有磁性。下列物质可用作录音带磁粉的是__________。A、V2O5 B、Fe2O3 C、ZnO D、CrO2(3)、已知Cr3+在水溶液中的存在形式为[Cr(H2O)6]3+。在不同条件下,可从CrCl3水溶液中获得紫色、蓝绿色或绿色等不同颜色的配合物,其实验式均为CrCl3•6H2O。现取蓝绿色配合物0.1mol,加入足量AgNO3溶液,经过滤、洗涤、干燥得28.7g沉淀,则该化合物中的化学键类型有 , 写出该蓝绿色配合物的电离方程式:。(4)、常温下,氯化酰铬(CrO2Cl2)是暗红色液体,能与CCl4、CS2等有机溶剂互溶。
19. 铬的化合物在医药、材料领域有重要作用,认识铬及其化合物有重要意义。(1)、基态铬原子中,电子占据的最高能级符号为。(2)、研究表明,当化合物的阳离子有未成对电子时,该化合物具有磁性。下列物质可用作录音带磁粉的是__________。A、V2O5 B、Fe2O3 C、ZnO D、CrO2(3)、已知Cr3+在水溶液中的存在形式为[Cr(H2O)6]3+。在不同条件下,可从CrCl3水溶液中获得紫色、蓝绿色或绿色等不同颜色的配合物,其实验式均为CrCl3•6H2O。现取蓝绿色配合物0.1mol,加入足量AgNO3溶液,经过滤、洗涤、干燥得28.7g沉淀,则该化合物中的化学键类型有 , 写出该蓝绿色配合物的电离方程式:。(4)、常温下,氯化酰铬(CrO2Cl2)是暗红色液体,能与CCl4、CS2等有机溶剂互溶。①固体氯化酰铬属于(填“极性”或“非极性”)分子,判断依据是。
②等电子体是具有相同的价电子数和原子数的分子或离子。写出一种与CCl4分子互为等电子体的阴离子:(填化学式);写出CS2分子的电子式:。
(5)、氮化铬(CrN)在超级电容器领域有良好应用前景,其晶体结构类型与氯化钠相同。①氮化铬的熔点比氯化钠高的主要原因是。
②与Cr3+次邻近的N3–有个。
③已知Cr3+和N3–半径分别为apm、bpm,设Cr3+和N3–都是紧密接触的刚性小球,NA代表阿伏加德罗常数的值,晶体的密度为ρg•cm–3 , 则CrN的摩尔质量为。(用含a、b、NA、ρ的算式表示)
20. 金属钛因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。(1)、基态 Ti 原子核外电子排布的最高能级符号是。与钛同周期的元素中基态原子未成对电子数与钛相同的有种。(2)、钛比钢轻,比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是。(3)、半夹心结构催化剂 M 其结构如图所示:
①组成该物的质元素中,电负性最大的是(填元素符号)
②M中不含(填标号)
a.π键 b.σ键 c.配位键 d.离子键 e.氢键
(4)、TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式是 写出一种与阴离子 互为等电子体的分子 。 (5)、钛单质的晶胞如图所示,该晶胞为堆积(填堆积方式),钛原子的配位数是 , 已知晶胞参数:a=0.295nm,c=0.469nm。则该钛晶体的密度为g·cm-3(NA表示阿伏加德罗常数的数值,列出计算式即可)
(5)、钛单质的晶胞如图所示,该晶胞为堆积(填堆积方式),钛原子的配位数是 , 已知晶胞参数:a=0.295nm,c=0.469nm。则该钛晶体的密度为g·cm-3(NA表示阿伏加德罗常数的数值,列出计算式即可) 21. 含第VA族的磷、砷(As)等元素的化合物在研究和生产中有许多重要用途。回答下列问题:(1)、基态P原子的核外电子排布式为 , 有个未成对电子。(2)、常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图甲所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为 , 其中心原子杂化轨道类型为 , B为。(3)、PO43-的空间构型为 , 其等电子体有(请写出一种)。(4)、砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图乙,晶胞参数a= 565pm。
21. 含第VA族的磷、砷(As)等元素的化合物在研究和生产中有许多重要用途。回答下列问题:(1)、基态P原子的核外电子排布式为 , 有个未成对电子。(2)、常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如图甲所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为 , 其中心原子杂化轨道类型为 , B为。(3)、PO43-的空间构型为 , 其等电子体有(请写出一种)。(4)、砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。已知砷化镓的晶胞结构如图乙,晶胞参数a= 565pm。
①砷化镓的化学式为 , 镓原子的配位数为。
②砷化镓的晶胞密度=g/cm3(列式并计算,精确到小数点后两位),m位置Ga原子与n位置As原子之间的距离为pm(列式表示)。
22. [化学——选修3:物质结构与性质]铁是重要的工业元素。
(1)、铁元素位于周期表中的区,Fe的外围电子排布的轨道表示式为 , Fe的7个能级中能量最高的是。(2)、(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其中H2O的VSEPR模型名称为。写出一种与SO42-互为等电子体的分子的化学式。(3)、金属Fe具有导电性,温度越高其导电性越 , 其原因是。(4)、ZnCl2浓溶液常用于除去Fe表面的氧化物,反应可得[Zn(OH)2Cl2]2-溶液。[Zn(OH)2Cl2]2-中肯定不存在的微粒间作用力有(填选项字母);A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键。
(5)、某种磁性氮化铁的结构如图所示,Fe为堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为 ,则该化合物的化学式为。其中铁原子最近的铁原子的个数为;氮化铁晶胞底边长为anm,高为cnm,则这种磁性氮化铁的晶体密度为g·cm-3(用含a、c和NA的计算式表示)。
23. 由B、N及Mg、Ni等元素组成的新型材料有着广泛的用途,回答下列向题:(1)、Ni2+元素基态原子的电子排布式为。(2)、经测定发现,N2O5固体由NO2+和NO3-同种离子组成,该固体中N原子杂化类型为;与NO2+互为等电子体的微粒有(写出一种)。(3)、铵盐大多不稳定。NH4F、NH4I中,较易分解的是 , 原因是。(4)、第二周期中,第一电离能介于B元素和N元素间的元素为(填元素符号)(5)、已知NiO的晶体结构如图所示。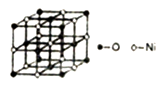
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm,则熔点MgONiO(填“>”、“<”或“=”),理由是。
(6)、硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似B、N原子相互交替排列如图左下图,其晶胞结构如右下图所示。设层内B-N核间距为apm,面间距为bpm,则该氮化硼晶体的密度为g/cm3(用含a、b、NA的代数式表示)。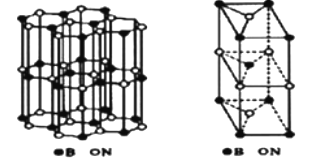 24. [化学一一选修3物质结构与性质]
24. [化学一一选修3物质结构与性质]钒和镍及其化合物是重要合金材料和催化剂,其储氨合金可作为一种新型锌离子电池的负极材料,该电池以Zn(Cl3SO3)2 为电解质,以有缺陷的阳离子型ZnMn2O4 为电极,成功获得了稳定的大功率电流。
(1)、基态钒原子的核外电子排布式为 , 其排布时能量最高电子所占据能级的原子轨道有个伸展方向。(2)、 VO2+可与多种物质形成配合物,与氧同周期且第一电离能比氧大的主族元素有(写元素符号)。(3)、镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为 , 与CN-互为等电体的一种分子的化学式为。(4)、三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF3、H2O2等为主要原料来制取。①H2O2分子中O原子的杂化方式为。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为。
(5)、硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为。 (6)、镧镍合金是重要储氢材料,其储氢后的晶胞如图3所示。
(6)、镧镍合金是重要储氢材料,其储氢后的晶胞如图3所示。①储氢前该镧镍合金的化学式为。
②该镧镍合金储氢后氢气的密度为(用NA表示阿伏加德罗常数的数值)g·cm-3。
25. 下表为元素周期表的一部分,其中的编号代表对应的元素。
请回答:
(1)、在周期表给出的10种元素中,电负性最小的元素基态原子的电子排布式为。(2)、在周期表给出的10种元素中,最外层未成对电子数与最外层成对电子数的个数比为3:2的元素与短周期最外层没有未成对电子数的元素形成的化合物是(填化学式),所含化学键类型是。(3)、关于元素①与元素⑤形成的1:1的化合物,下列说法正确的是_____(填字母序号)。A、该化合物中的所有原子都满足最外层8电子稳定结构 B、该化合物分子中σ键和π键数目比为1:1 C、该化合物是由极性键和非极性键形成的极性分子 D、该化合物分子的空间构型为直线形(4)、在①与③形成的相对分子质量最小的化合物A中,元素③的杂化类型是 , 写出与化合物A互为等电子体的一种阳离子(填离子符号)。(5)、元素⑧的+3价化合物MCl3·6H2O有三种不同颜色的异构体,为探究MCl3溶液析出的暗绿色晶体的化学式,取0.010molMCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀2.870g,该晶体的化学式为_______(填字母序号)。A、[M(H2O)6]Cl3 B、[M(H2O)5Cl]Cl2·H2O C、[M(H2O)4Cl2]Cl·2H2O(6)、元素⑩与元素⑤形成一种化合物其晶胞结构如下图所示,该化合物的化学式为 , 若该晶体密度为dg/cm3 , 晶胞参数为apm,则阿伏加德罗常数的值NA 为。 26. 非金属硼的合金及其化合物有着广泛的用途。(1)、硼钢合金的硬度是普通钢材的 4 倍,其主要成分是铁。 画出基态铁原子的价电子排布图。(2)、氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键, 则氨硼烷分子结构式为。写出一种与氨硼烷互为等电子体的分子(填化学式)。(3)、常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如右图所示。
26. 非金属硼的合金及其化合物有着广泛的用途。(1)、硼钢合金的硬度是普通钢材的 4 倍,其主要成分是铁。 画出基态铁原子的价电子排布图。(2)、氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键, 则氨硼烷分子结构式为。写出一种与氨硼烷互为等电子体的分子(填化学式)。(3)、常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如右图所示。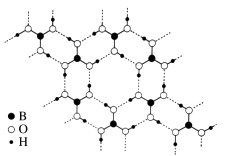
①1 mol H3BO3晶体中含有mol 氢键。
②请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因:。
(4)、硼氢化钠是一种常用的还原剂。其晶胞结构如右图所示: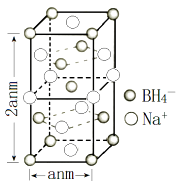
①该晶体中Na+的配位数为。
②H3BO3 分子中的 O—B—O 的键角(填“大于”、“等于”或“小于”) BH4-中的 H—B—H 的键角,判断依据是。
③已知硼氢化钠晶体的密度为 ρ g/cm3 , NA代表阿伏加德罗常数的值,则 a=(用含 ρ、 NA的代数式表示);④若硼氢化钠晶胞上下底心处的 Na+被 Li+取代,得到的晶体的化学式为。
27. C、Ti的单质及其化合物在现代社会有广泛用途。(1)、基态钛原子的电子排布式为。(2)、CS2分子中含有σ键和π键之比为;NO2+与CO2是等电子体,NO2+的电子式为 ,键角为。(3)、CH3CHO沸点低于CH3CH2OH的原因是 ;CH3 CHO分子中碳原子杂化类型为。(4)、钛酸钡(BaTiO3)晶体的某种晶胞如图所示。NA为阿伏加德罗常数值,Ba2+、O2-、Ti4+的半径分别为a pm、b pm、c pm。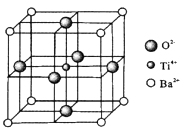
①与钡离子等距离且最近的氧离子有个;
②假设晶体中的Ti4+、Ba2+分别与O2-互相接触,则该晶体的密度表达式为g.cm-3。
28. 镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用。(1)、Ni在元素周期表中的位置是 , 其价电子层中有个未成对电子。(2)、镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+等。①Ni(CO)4熔点为-19.3℃,沸点43℃,则其熔、沸点较低的原因是。
②其分子中σ键与π键数目之比为。
③写出一种与配体CO互为等电子体的阴离子符号。
④[Ni(NH3)6]2+中配体NH3中N原子的杂化类型为 , 若[Ni(NH3)6]2+为正八面体构型,则[Ni(CO)2(NH3)4]2+的结构有种。
(3)、金属Ni与富勒烯(C60)可制备一种低温超导材料,晶胞如图所示, Ni 原子位于晶胞的棱上与内部,该超导材料的化学式为。(4)、NiO的晶体结构与氯化钠的晶体结构相同。将NiO晶体在氧气中加热,部分Ni2+被氧化为Ni3+ , 晶体结构产生镍离子缺位的缺陷,其组成为Ni0.97O,但晶体仍保持电中性,则晶体中Ni2+与Ni3+离子的数目之比为;若阿伏加德罗常数的值为NA , 晶体密度为d g·cm-3 , 则该晶胞中最近的O2-之间的距离为pm。 29. 铁是重要的工业元素。(1)、铁元素位于周期表中的区,Fe的外围电子排布的轨道表示式为 , Fe的7个能级中能量最高的是。(2)、(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其中H2O的VSEPR模型名称为。写出一种与SO42-互为等电子体的分子的化学式。(3)、金属Fe具有导电性,温度越高其导电性越 , 其原因是。(4)、ZnCl2浓溶液常用于除去Fe表面的氧化物,反应可得[Zn(OH)2Cl2]2-溶液。[Zn(OH)2Cl2]2-中肯定不存在的微粒间作用力有(填选项字母);
29. 铁是重要的工业元素。(1)、铁元素位于周期表中的区,Fe的外围电子排布的轨道表示式为 , Fe的7个能级中能量最高的是。(2)、(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其中H2O的VSEPR模型名称为。写出一种与SO42-互为等电子体的分子的化学式。(3)、金属Fe具有导电性,温度越高其导电性越 , 其原因是。(4)、ZnCl2浓溶液常用于除去Fe表面的氧化物,反应可得[Zn(OH)2Cl2]2-溶液。[Zn(OH)2Cl2]2-中肯定不存在的微粒间作用力有(填选项字母);A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键。
(5)、某种磁性氮化铁的结构如图所示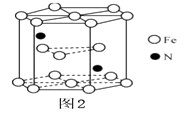 ,Fe为堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为 ,则该化合物的化学式为。 其中铁原子最近的铁原子的个数为;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为g·cm-3(用含a、c和NA的计算式表示)。 30. 铜是人类最早使用的金属之一,金属铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:(1)、基态+2价铜离子M能层电子排布式是;第4周期中基态原子未成对电子数与铜原子相同的元素有种。(2)、Cu+能与SCN-形成CuSCN沉淀。请写出一种与SCN-互为等电子体的微粒。SCN-对应的酸有硫氰酸(H-S-C
,Fe为堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为 ,则该化合物的化学式为。 其中铁原子最近的铁原子的个数为;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为g·cm-3(用含a、c和NA的计算式表示)。 30. 铜是人类最早使用的金属之一,金属铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:(1)、基态+2价铜离子M能层电子排布式是;第4周期中基态原子未成对电子数与铜原子相同的元素有种。(2)、Cu+能与SCN-形成CuSCN沉淀。请写出一种与SCN-互为等电子体的微粒。SCN-对应的酸有硫氰酸(H-S-C N)和异硫氰酸(H-N=C=S),这两种酸熔点更高的是(填名称),原因是。 (3)、Cu2+能与NH3形成平面正方形的[Cu(NH3)4]2+。NH3分子的空间构型为;[Cu(NH3)4]2+中Cu采取dspx杂化,x的值是。(4)、已知Cu2O 熔点为1235 ℃,K2O熔点为770℃,前者熔点较高,其原因是。(5)、Cu3N 的晶胞(立方)结构如下图所示:
N)和异硫氰酸(H-N=C=S),这两种酸熔点更高的是(填名称),原因是。 (3)、Cu2+能与NH3形成平面正方形的[Cu(NH3)4]2+。NH3分子的空间构型为;[Cu(NH3)4]2+中Cu采取dspx杂化,x的值是。(4)、已知Cu2O 熔点为1235 ℃,K2O熔点为770℃,前者熔点较高,其原因是。(5)、Cu3N 的晶胞(立方)结构如下图所示:
①距离最近的两个Cu+间的距离为nm。(保留两位小数)
②Cu3N 晶体的密度为 g·cm-3。(NA表示阿伏加德罗常数的值,列出计算式,不必计算出结果)
31. A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,A、B、C同周期,A与D、B与F分别同主族,E是生活中用量最大的金属。请回答下列问题:(1)、E比较稳定的离子核外电子排布式 .(2)、A、B、C的第一电离能由小到大的顺序为 用元素符号表示 、B、C的简单氢化物中最易汽化的物质的化学式 .(3)、C与D形成的物质的晶体类型是 , IT产业中该晶体用于生产 .(4)、由A、B、C三种元素中的一种或两种元素形成的分子中,有的互为等电子体,写出其中一组等电子体的化学式:. 并写出对应的结构式 .(5)、B的单质晶胞与 的相似,则一个晶胞中含B的原子个数为 与氢形成的分子空间构型是 .(6)、“砒霜”是一种含C,F的化合物,其分子结构如图1所示,该化合物的分子式为F4C6 , F原子采取杂化;C,D,E组成的化合物的晶胞如图2,其晶胞参数为a pm,则其密度为g/cm3(列出式子即可,阿伏加德罗常数为NAmol-1)。 32. 根据要求回答下列问题:(1)、基态氮原子最高能级上电子的自旋方向有种,硒原子的电子排布式为[Ar]。(2)、铁的一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4 , 据此可以判断Fe(CO)5晶体属于(填晶体类型)。(3)、与BF3互为等电子体的分子和离子分别为(各举1例);已知分子中的大π键可用符号Ⅱnm表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ66),则BF3中的大π键应表示为。(4)、金属晶体的四种堆积如下图,金属钠的晶体堆积模型为(填字母)。
32. 根据要求回答下列问题:(1)、基态氮原子最高能级上电子的自旋方向有种,硒原子的电子排布式为[Ar]。(2)、铁的一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4 , 据此可以判断Fe(CO)5晶体属于(填晶体类型)。(3)、与BF3互为等电子体的分子和离子分别为(各举1例);已知分子中的大π键可用符号Ⅱnm表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Ⅱ66),则BF3中的大π键应表示为。(4)、金属晶体的四种堆积如下图,金属钠的晶体堆积模型为(填字母)。 (5)、砷化硼(BAs)晶体结构与金刚石相似,则:
(5)、砷化硼(BAs)晶体结构与金刚石相似,则:①BAs晶体中,As的杂化形式为.
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有(填字母)。
A.离子键
B.金属键
C.极性键
D.氢键 E.配位键 F.σ键 G.π键
③BAs晶体的晶胞参数为bpm,则其晶体的密度为(列出表达式,设NA为阿伏加德罗常数的数值)g/cm3。
33. “摩尔盐”是分析化学中的重要试剂,化学式为(NH4)2Fe(SO4)2·6H2O。“摩尔盐”在一定条件下分解的方程式为:4[(NH4)2Fe(SO4)2·6H2O] 2Fe2O3+3SO3+5SO2↑+N2↑+6NH3↑+31H2O。回答下列问题:(1)、铁元素在元素周期表中的位置为 , 其价层电子排布图为。(2)、组成“摩尔盐”的非金属元素中第一电离能最大的元素为。“摩尔盐”的分解产物中属于非极性分子的化合物是。(3)、NH3的沸点比N2O的沸点(填“高”或“低”),其主要原因是。(4)、K3[Fe(CN)6]常用于检验Fe2+ , K3[Fe(CN)6]中除了离子键以外还存在的化学键为 , 与CN—互为等电子体的单质的分子式为。HCN分子中σ键和π键的个数之比为。(5)、FeO晶胞结构如下图所示,FeO晶体中Fe2+配位数为 , 若该晶胞边长为acm,则该晶胞密度为g/cm3。 34. 明代宋应星所著《天工开物》中已经记载了我国古代用炉甘石(主要成分ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:(1)、Zn原子基态核外电子排布式为。(2)、硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
34. 明代宋应星所著《天工开物》中已经记载了我国古代用炉甘石(主要成分ZnCO3)和煤冶锌工艺,锌的主要用途是制造锌合金和作为其他金属的保护层。回答下列问题:(1)、Zn原子基态核外电子排布式为。(2)、硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。①与SO42-互为等电子体的阴离子化学式为(写出一种)
②氨的热稳定性强于膦(PH3),原因是。
(3)、黄铜是由铜和锌所组成的合金,元素铜与锌的第一电离能分别为ICu=746 kJ·mol-1 , IZn=906 kJ·mol-1 , ICu< IZn的原因是。(4)、《本草纲目》中记载炉甘石(主要成分ZnCO3)可止血,消肿毒,生肌,明目……。Zn、C、O电负性由大至小的顺序是。ZnCO3中阴离子的立体构型是。(5)、ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶胞结构如图所示,每个Zn原子周围最近的Zn原子数目为。晶胞边长为apm,阿伏加德罗常数的值为NA , 则ZnS晶体的密度为 g·cm-3(列出计算式即可)。 35.
35.含氮化合物种类繁多,卟吩(图A)连有取代基时即称为卟啉,卟啉的四个氮原子易与金属离子结合生成叶绿素(图B)等多种物质.请回答:
 (1)、卟吩中N原子采用的轨道杂化方式是(2)、下列有关叶绿素分子的说法正确的是 (填选项序号).A、图1中1﹣5号C中有三个具有手性 B、分子中存在配位键 C、图1中1、2、3、4号C共面 D、N的第一电离能大于O(3)、卟啉与Fe2+合即可形成血红素,Fe2+的电子排布式为(4)、氰化氢(HCN)是一种含氮剧毒化合物,其分子中σ键与π键的个数比为 . 由分子结构推测,氰化氢(填“易”或“不易”)溶于水,原因是 . 氰化氢进人人体后产生的CN﹣能使人迅速中毒,请举出两种CN﹣的等电子体 .(5)、N与B能够形成一种硬度接近金刚石的物质,其晶体结构如图2,若其晶胞边长为apm,则其密度为g.cm﹣3(只列算式).
(1)、卟吩中N原子采用的轨道杂化方式是(2)、下列有关叶绿素分子的说法正确的是 (填选项序号).A、图1中1﹣5号C中有三个具有手性 B、分子中存在配位键 C、图1中1、2、3、4号C共面 D、N的第一电离能大于O(3)、卟啉与Fe2+合即可形成血红素,Fe2+的电子排布式为(4)、氰化氢(HCN)是一种含氮剧毒化合物,其分子中σ键与π键的个数比为 . 由分子结构推测,氰化氢(填“易”或“不易”)溶于水,原因是 . 氰化氢进人人体后产生的CN﹣能使人迅速中毒,请举出两种CN﹣的等电子体 .(5)、N与B能够形成一种硬度接近金刚石的物质,其晶体结构如图2,若其晶胞边长为apm,则其密度为g.cm﹣3(只列算式).
-