高考二轮复习知识点:判断简单分子或离子的构型3
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 少量与反应生成和。下列说法正确的是( )A、的电子式为
 B、的空间构型为直线形
C、中O元素的化合价为-1
D、仅含离子键
2. 磷酰三叠氮是一种高能分子,结构简式为。下列关于该分子的说法正确的是( )A、为非极性分子 B、立体构型为正四面体形 C、加热条件下会分解并放出 D、分解产物的电子式为3. 北京冬奥会首次选用CO2跨临界直冷制冰系统。下列关于CO2的说法错误的是( )A、固态CO2是分子晶体 B、电子式为
B、的空间构型为直线形
C、中O元素的化合价为-1
D、仅含离子键
2. 磷酰三叠氮是一种高能分子,结构简式为。下列关于该分子的说法正确的是( )A、为非极性分子 B、立体构型为正四面体形 C、加热条件下会分解并放出 D、分解产物的电子式为3. 北京冬奥会首次选用CO2跨临界直冷制冰系统。下列关于CO2的说法错误的是( )A、固态CO2是分子晶体 B、电子式为 C、是直线型分子
D、是非极性分子
4. 北京冬奥会的雪花造型火炬台令人耳目一新,有关雪花的说法正确的是( )
C、是直线型分子
D、是非极性分子
4. 北京冬奥会的雪花造型火炬台令人耳目一新,有关雪花的说法正确的是( ) A、构成微粒的空间构型为直线型 B、晶体类型是分子晶体 C、融化时破坏共价键 D、融化后密度会变小5. 羰基硫(COS)的结构与类似,可作粮食熏蒸剂,防治虫类、真菌对粮食的危害。下列说法错误的是( )A、COS属于极性分子 B、COS沸点高于的沸点 C、COS空间构型为直线形 D、COS热稳定性大于6. 催化剂作用下,SO2与Cl2反应生成SO2Cl2;对SO2水溶液的光谱分析可以检测到、和痕量的 , 三氧化硫在液态时有单分子SO3和三聚的(SO3)3(结构如下图所示)两种形式,在高温时能将HBr氧化为Br2。关于说法正确的是( )
A、构成微粒的空间构型为直线型 B、晶体类型是分子晶体 C、融化时破坏共价键 D、融化后密度会变小5. 羰基硫(COS)的结构与类似,可作粮食熏蒸剂,防治虫类、真菌对粮食的危害。下列说法错误的是( )A、COS属于极性分子 B、COS沸点高于的沸点 C、COS空间构型为直线形 D、COS热稳定性大于6. 催化剂作用下,SO2与Cl2反应生成SO2Cl2;对SO2水溶液的光谱分析可以检测到、和痕量的 , 三氧化硫在液态时有单分子SO3和三聚的(SO3)3(结构如下图所示)两种形式,在高温时能将HBr氧化为Br2。关于说法正确的是( ) A、SO2、SO3都是非极性分子 B、SO2Cl2为正四面体结构 C、SO3、中S原子都是sp2杂化 D、1 mol (SO3)3分子中含有12 mol σ键7. 已知NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4。下列说法正确的是( )A、该配合物中阴离子为平面正方形 B、该配合物的配体为NO,配位数为1 C、Fe2+的价层电子排布式为3d54s1 , 易被氧化为Fe3+ D、H2O的VSEPR模型为四面体型,空间结构为V形8. 关于CH≡CH和
A、SO2、SO3都是非极性分子 B、SO2Cl2为正四面体结构 C、SO3、中S原子都是sp2杂化 D、1 mol (SO3)3分子中含有12 mol σ键7. 已知NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4。下列说法正确的是( )A、该配合物中阴离子为平面正方形 B、该配合物的配体为NO,配位数为1 C、Fe2+的价层电子排布式为3d54s1 , 易被氧化为Fe3+ D、H2O的VSEPR模型为四面体型,空间结构为V形8. 关于CH≡CH和 的结构与性质,下列说法错误的是( ) A、CH≡CH是非极性分子 B、
的结构与性质,下列说法错误的是( ) A、CH≡CH是非极性分子 B、 存在单双键交替的结构
C、两者的最简式都是CH
D、CH≡CH的空间构型是直线形
9. 已知W、X、Y、Z均为短周期元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( )
存在单双键交替的结构
C、两者的最简式都是CH
D、CH≡CH的空间构型是直线形
9. 已知W、X、Y、Z均为短周期元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( ) A、电负性:Z<Y B、简单离子半径:Z>Y>W>X C、元素W形成的某阳离子空间构型为正四面体 D、化合物中含有极性共价键和非极性共价键10. A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的变化情况如图所示,则下列说法中错误的是 ( )
A、电负性:Z<Y B、简单离子半径:Z>Y>W>X C、元素W形成的某阳离子空间构型为正四面体 D、化合物中含有极性共价键和非极性共价键10. A、B、C、D、E为原子序数依次增大的五种短周期元素,其中C为第三周期简单离子半径最小的元素,A、B、D的最高价氧化物对应的水化物溶液加水稀释时溶液的变化情况如图所示,则下列说法中错误的是 ( ) A、浓的D溶液在加热条件下可以与C发生反应 B、分子空间结构为三角锥形 C、B,D,E的单质或者化合物能作漂白剂 D、具有两性,既能和酸反应也能和碱反应11. 下列关于B、S、C及其化合物的结构与性质的论述错误的是( )A、C的电负性比B大,则C、B形成的二元化合物中,C显负化合价 B、和中B、S杂化轨道类型相同,二者均为正三角形结构 C、常温下为液体,说明是非极性分子 D、的硬度可与金刚石媲美,且熔点高,则为共价晶体12. 晶胞结构如图所示,它由两个正六面体叠加而成,已知正六面体的棱长。下列说法错误的是( )
A、浓的D溶液在加热条件下可以与C发生反应 B、分子空间结构为三角锥形 C、B,D,E的单质或者化合物能作漂白剂 D、具有两性,既能和酸反应也能和碱反应11. 下列关于B、S、C及其化合物的结构与性质的论述错误的是( )A、C的电负性比B大,则C、B形成的二元化合物中,C显负化合价 B、和中B、S杂化轨道类型相同,二者均为正三角形结构 C、常温下为液体,说明是非极性分子 D、的硬度可与金刚石媲美,且熔点高,则为共价晶体12. 晶胞结构如图所示,它由两个正六面体叠加而成,已知正六面体的棱长。下列说法错误的是( ) A、晶体中,与紧邻且等距的有8个 B、设阿伏加德罗常数的值为 , 则晶体的密度为 C、制备的反应选择在乙醚()中进行,也可以在水中进行 D、的空间构型为正四面体形
A、晶体中,与紧邻且等距的有8个 B、设阿伏加德罗常数的值为 , 则晶体的密度为 C、制备的反应选择在乙醚()中进行,也可以在水中进行 D、的空间构型为正四面体形二、非选择题
-
13. 【选修3:物质结构与性质】
含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)、基态S原子的价电子中,两种自旋状态的电子数之比为。(2)、Cu与Zn相比,第二电离能与第一电离能差值更大的是 , 原因是。(3)、SnCl的几何构型为 , 其中心离子杂化方式为。(4)、将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是____(填标号)。A、[Cu(NH3)2]Cl B、[Cu(NH3)4]SO4 C、[Zn(NH3)4]SO4 D、Na2[Zn(OH)4](5)、如图是硫的四种含氧酸根的结构:A.
 B.
B. C.
C. D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO的是(填标号),理由是。
(6)、如图是CZTS四元半导体化合物的四方晶胞。
①该物质的化学式为。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为( , , ),则B原子的坐标为。
14. [选修3:物质结构与性质]铁和硒( )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。回答下列问题:
(1)、乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下:
①基态 原子的核外电子排布式为 ;
②该新药分子中有种不同化学环境的C原子;
③比较键角大小:气态 分子 离子(填“>”“<”或“=”),原因是。
(2)、富马酸亚铁 是一种补铁剂。富马酸分子的结构模型如图所示:
①富马酸分子中 键与 键的数目比为;
②富马酸亚铁中各元素的电负性由大到小的顺序为。
(3)、科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化 ,将 转化为 ,反应过程如图所示:
①产物中N原子的杂化轨道类型为;
②与 互为等电子体的一种分子为(填化学式)。
(4)、钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
①该超导材料的最简化学式为;
② 原子的配位数为;
③该晶胞参数 、 。阿伏加德罗常数的值为 ,则该晶体的密度为 (列出计算式)。
15. 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含 的新型 分子 的合成路线如下: (1)、 与S同族,基态硒原子价电子排布式为。(2)、 的沸点低于 ,其原因是。(3)、关于I~III三种反应物,下列说法正确的有_________。A、I中仅有 键 B、I中的 键为非极性共价键 C、II易溶于水 D、II中原子的杂化轨道类型只有 与 E、I~III含有的元素中,O电负性最大(4)、IV中具有孤对电子的原子有。(5)、硒的两种含氧酸的酸性强弱为 (填“>”或“<”)。
(1)、 与S同族,基态硒原子价电子排布式为。(2)、 的沸点低于 ,其原因是。(3)、关于I~III三种反应物,下列说法正确的有_________。A、I中仅有 键 B、I中的 键为非极性共价键 C、II易溶于水 D、II中原子的杂化轨道类型只有 与 E、I~III含有的元素中,O电负性最大(4)、IV中具有孤对电子的原子有。(5)、硒的两种含氧酸的酸性强弱为 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。 的立体构型为。
(6)、我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图a,沿x、y、z轴方向的投影均为图b。
①X的化学式为。
②设X的最简式的式量为 ,晶体密度为 ,则X中相邻K之间的最短距离为 (列出计算式, 为阿伏加德罗常数的值)。
16. 氮的化合物应用广泛:(1)、Reineckesalt的结构如图所示:
其中配位原子为(填元素符号),阳离子的空间结构为 , NCS-中碳原子杂化方式为。
(2)、重铬酸铵[(NH4)2Cr2O7]为桔黄色单斜结晶,常用作有机合成催化剂,Cr2O 的结构如图。(NH4)2Cr2O7中N、O、Cr三种元素第一电离能由大到小的顺序是(填元素符号),1mol该物质中含σ键的数目为NA。 (3)、[Zn(IMI)4](ClO4)2是Zn2+的一种配合物,IMI的结构为
(3)、[Zn(IMI)4](ClO4)2是Zn2+的一种配合物,IMI的结构为 ,IMI的某种衍生物与甘氨酸形成的离子化合物
,IMI的某种衍生物与甘氨酸形成的离子化合物  常温下为液态而非固态。原因是。 (4)、已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为 。
常温下为液态而非固态。原因是。 (4)、已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用 表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中大π键表示为 。①下列微粒中存在“离域Π键”的是。
A.CH2=CH—CH=CH2 B.CCl4 C.H2O D.SO2
②NaN3中阴离子N 与CO2互为等电子体,均为直线型结构,N 中的2个大π键可表示为。
(5)、氮化铝(AlN)陶瓷是一种新型无机非金属材料,晶体结构如图所示,1个Al原子周围距离最近的Al原子数为个;若晶胞结构的高为anm,底边长为bnm,NA表示阿伏加德罗常数的值,则其密度为g·cm-3(列出计算式)。 17. 根据元素在体内含量不同,可将体内元素分为常量元素和微量元素。其中H、C、O、N、S、P等为常量元素,Fe、Zn等为微量元素。回答下列问题:(1)、基态Fe原子的核外电子排布式为[Ar] , 有组相同能量的电子。(2)、数据表明,S的第一电离能小于P的第一电离能,其原因可能有两种:一种是S失去的是已经配对的电子,配对电子相互排斥,电离能较低,另一种是。(3)、氧与氮可形成正离子NO ,其空间构型为 , 碳与氢也可形成正离子CH ,该离子中,碳的杂化方式为。(4)、原子的电子亲和能是指在0K下的气相中,原子获得电子变成负离子时所释放的能量。氧原子的第二电子亲和能(O-+e-→O2-的能量)不能直接在气相中测定,但可通过如图的born-Haber循环计算得到。
17. 根据元素在体内含量不同,可将体内元素分为常量元素和微量元素。其中H、C、O、N、S、P等为常量元素,Fe、Zn等为微量元素。回答下列问题:(1)、基态Fe原子的核外电子排布式为[Ar] , 有组相同能量的电子。(2)、数据表明,S的第一电离能小于P的第一电离能,其原因可能有两种:一种是S失去的是已经配对的电子,配对电子相互排斥,电离能较低,另一种是。(3)、氧与氮可形成正离子NO ,其空间构型为 , 碳与氢也可形成正离子CH ,该离子中,碳的杂化方式为。(4)、原子的电子亲和能是指在0K下的气相中,原子获得电子变成负离子时所释放的能量。氧原子的第二电子亲和能(O-+e-→O2-的能量)不能直接在气相中测定,但可通过如图的born-Haber循环计算得到。
由图可知,Mg原子的第一电离能为kJ·mol-1 , O=O键键能为kJ·mol-1 , 氧原子的第二电子亲和能为kJ·mol-1。
(5)、氢化镁(MgH2)与金属锌在一定条件下研磨,可制得化合物Mg2ZnH4 , X-射线衍射分析表明,该化合物的立方晶胞的面心和顶点均被锌原子占据,所有镁原子的配位数都相等。①该晶胞中镁原子个数为。
②已知Mg2ZnH4晶体的晶胞参数为a pm,镁原子分布在该晶胞中锌原子形成的四面体中心。该晶胞中相邻镁原子与锌原子之间距离为pm,Mg2ZnH4晶体密度为g·cm-3(阿伏加德罗常数的值用NA表示)。
18. 2019年诺贝尔化学奖授予约翰·B·古迪纳夫、M·斯坦利·威廷汉、吉野彰等三位科学家,以表彰他们在锂电池研究作出的卓越贡献。常用的锂电池用镍钴锰酸锂Li(NiCoMn)O2或磷酸铁锂(LiFePO4)等为正极材料。请回答下列问题:(1)、基态Ni原子的价电子排布图为。(2)、 的空间构型为 , 其中心原子的杂化类型是。(3)、|Co(NH3)4Cl2|Cl是一种钴常见的配合物,其中Co的配位数是 , 1mol该配合物含σ键数目为 , 若1mol该配合物与足量AgNO3溶液反应,生成沉淀的质量为g。(4)、Fe、Co、Ni三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为。(5)、硫化锂Li2S的纳米晶体是开发先进锂电池的关键材料,Li2S晶体为反萤石(萤石CaF2)结构,其晶胞结构如图。
S2-的配位数是 , 设NA为阿伏加德罗常数的值,若Li2S晶体的密度为ρg·cm-3 , 则晶胞边长是nm(用含ρ、NA的计算式表示)。
19. 我国云南镍白铜(铜镍合金)闻名中外,曾主要用于制作仿银饰品和造币。请回答:(1)、铜元素在元素周期表中的位置为。(2)、基态镍原子的价层电子排布式为 , 未成对的电子数为 , 位于周期表区。(3)、铜元素的第二电离能为 ,镍元素的第二电离能为 ,铜的第二电离能较大,其主要原因是。(4)、向硫酸铜溶液逐渐滴加氨水可得到 溶液, 中阴离子的立体构型是 , NH3中N的杂化方式为。(5)、铜原子与氯原子形成化合物的晶胞如下图所示。该晶体的化学式为 , 每个铜原子周围距离最近的铜原子数目为个。已知该晶体的密度为 ,阿伏加德罗常数的值为NA , 则该晶体中铜原子和氯原子之间的最短距离为pm(列出计算式即可)。 20. 氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂(主要成分Na2B4O7)为起始物,经过一系列反应可以得到BN和火箭高能燃料及有机合成催化剂BF3的过程如下:(1)、BF3中B原子的杂化轨道类型为 , BF3分子空间构型为;(2)、在硼、氧、氟、氮中第一电离能由大到小的顺序是(用元素符号表示);(3)、已知硼酸的电离方程式为H3B03+H2O⇌[B(OH)4]﹣+H+ , 试依据上述反应判断[Al(OH)4]﹣的中存在下列哪些键;
20. 氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂(主要成分Na2B4O7)为起始物,经过一系列反应可以得到BN和火箭高能燃料及有机合成催化剂BF3的过程如下:(1)、BF3中B原子的杂化轨道类型为 , BF3分子空间构型为;(2)、在硼、氧、氟、氮中第一电离能由大到小的顺序是(用元素符号表示);(3)、已知硼酸的电离方程式为H3B03+H2O⇌[B(OH)4]﹣+H+ , 试依据上述反应判断[Al(OH)4]﹣的中存在下列哪些键;a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
并写出结构式 , 及推测1mol NH4BF4(氟硼酸铵)中含有个配位键.
(4)、氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性 (晶体结构如图)。
①关于这两种晶体的说法,错误的是(填字母);
a.两种晶体均为分子晶体 b.两种晶体中的B﹣N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软 d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体内B﹣N键数与硼原子数之比为 , 其结构与石墨相似却不导电,原因是;
③立方相氮化硼晶体中,每个硼原子连接个六元环。
21. 硫及其化合物有许多用途,请回答下列问题。(1)、基态硫原子的价电子排布式为 , 其电子占据最高能级的电子云轮廓图形状为;(2)、常见含硫的物质有单质硫(S8)、SO2、Na2S、K2S等,四种物质的熔点由高到低的顺序依次为 , 原因是。(3)、炼铜原料黄铜矿中铜的主要存在形式是CuFeS2 , 煅烧黄铜矿生成SO2 , CuFeS2中存在的化学键类型是 , SO2中心原子的价层电子对数为。(4)、方铅矿(即硫化铅)是一种比较常见的矿物,酸溶反应为:PbS+4HCl(浓)= H2[PbCl4]+H2S↑。H2S分子属于(填“极性”或“非极性”)分子,其中心原子的杂化方式为。下列分子的空间构型与H2S相同的有;A.H2O B.CO2 C.SO2 D.CH4
(5)、方铅矿的立方晶胞如图所示,硫离子采取面心立方堆积,铅离子填在由硫离子形成的空隙中。已知晶体密度为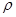 g•cm-3 , 阿伏加德罗常数的值为NA , 则晶胞中硫离子与铅离子最近的距离为nm
g•cm-3 , 阿伏加德罗常数的值为NA , 则晶胞中硫离子与铅离子最近的距离为nm 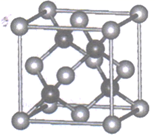 22. 硫铁矿(主要成分FeS2)是接触法制硫酸的主要原料,接触法制硫酸的生产原理分三步。
22. 硫铁矿(主要成分FeS2)是接触法制硫酸的主要原料,接触法制硫酸的生产原理分三步。I.4FeS2+11O2 2Fe2O3+8SO2;
II.2SO2+O2 2SO3;
III.SO3+H2O=H2SO4。
回答下列问题:
(1)、①基态O原子的核外电子排布式为;基态Fe原子共有种运动状态不同的电子。②Fe2+形成的配合物亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,可用于检验Fe3+。写出两种与CN-互为等电子体的分子的化学式:;含有12molσ键的K4[Fe(CN)6]的物质的量为mol。
③已知Fe2+半径为61pm,Co2+半径为65pm,则在隔绝空气条件下分别加热FeCO3和CoCO3 , FeCO3受热分解温度(填“低于”或“高于”)CoCO3。
(2)、①H2SO4的酸性强于H2SO3的酸性的原因是。②SO2中S原子的杂化方式为;SO3的立体构型为。第一电离能:SO(填“>”或“<”)。
(3)、FeS2晶体的晶胞结构如图所示。
①FeS2晶体中距离Fe2+最近的Fe2+的数目为。
②FeS2晶体的晶胞参数为anm,密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则FeS2的摩尔质量M=g·mol-1(用含a、ρ、NA的代数式表示)。
23. 中国古代文献中记载了大量古代化学的研究成果,《本草纲目》中记载:“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以为烽燧铳机诸药者”,反应原理为S+2KNO3+3C=K2S+N2↑+3CO2↑。(1)、氮原子的价层电子排布图为 , 烟花燃放过程中,钾元素中的电子跃迁的方式是 , K、S、N、O四种元素第一电离能由大到小的顺序为。上述反应涉及的元素中电负性最大的是(填元素符号)。(2)、碳元素除可形成常见的氧化物CO、CO2外,还可形成C2O3(其结构如图 )。C2O3与水反应可生成草酸(HOOC-COOH)。
)。C2O3与水反应可生成草酸(HOOC-COOH)。 ①C2O3中碳原子的杂化轨道类型为 , CO2分子的立体构型为。
②草酸与正丁酸(CH3CH2CH2COOH)的相对分子质量相差2,二者的熔点分别为101℃、-7.9℃,导致这种差异的最主要原因可能是。
③CO分子中π键与σ键个数比为。
(3)、磷化硼是一种超硬耐磨涂层材料,晶胞如右图所示,其密度为ρg·cm-3 , 设NA是阿伏加德罗常数的值,则磷原子的配位数为 , 晶胞参数为pm。 24. VA族元素及其化合物在生产生活中用途广泛。(1)、①P4S3常用于制造火柴,P和S的第一电离能较小的是。
24. VA族元素及其化合物在生产生活中用途广泛。(1)、①P4S3常用于制造火柴,P和S的第一电离能较小的是。②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar] , 有个未成对电子。
(2)、NH3、PH3、AsH3的沸点由高到低的顺序为 , 键角由大到小的顺序为。已知NF3与NH3的立体构型均是三角锥形,向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+ , 但NF3不易与Cu2+形成配离子,其原因是。(3)、①白磷在氯气中燃烧可以得到PCl3和PCl5 , 其中气态PCl3分子的立体构型为。②研究发现固态PCl5和PBr5均为离子晶体,但其结构分别为[PCl4]+[PCl6]-和[PBr4]+Br- , 分析PCl5和PBr5结构存在差异的原因是。
(4)、锑酸亚铁晶胞如图所示,其晶胞参数分别为anm、bnm、cnm,α=β=γ=90°,则:
①锑酸亚铁的化学式为。
②晶体的密度为g·cm-3(设NA为阿伏加德罗常数的值)。
25. 半导体芯片的关键材料是我国优先发展的新材料。经过半个多世纪的发展,硅基材料的半导体器件性能已经接近其物理极限,以碳化硅、氮化镓等为代表的第二代半导体材料成为当今热点。回答如下问题:(1)、材料所涉及的四种元素中,原子半径最大的是(填元素符号,下同),这四种元素中第一电离能最大的是 , 基态Si原子的电子占据的轨道数目是个。(2)、原硅酸根SiO 的空间构型是 , 其中Si的价层电子对数目为、杂化轨道类型为。(3)、材料所涉及的四种元素对应的单质中,熔沸点最低的是 , 原因是。(4)、GaN被誉为21世纪引领5G时代的基石材料,是目前全球半导体研究的前沿和热点。有一种氮化镓的六方晶胞结构如图所示,请在图中构建一个以Ga原子为中心的四面体结构(涂成◎)。 (5)、材料密度是制作芯片的重要参数之一,已知Si的共价半径是125pm。求每立方厘米体积的单晶硅中硅的原子数目为(保留2位有效数字)。26. CdSnAs2是一种高迁移率的新型热电材料。回答下列问题:(1)、砷和磷为同一主族的元素,则As的价层电子排布式为 , 第一电离能:磷砷(填“大于”、“小于”或“等于”)。(2)、SnCl4是制备有机锡化合物的原料,染色的媒染剂,缩合剂。SnCl4中锡原子的杂化方式为 , SnCl4的空间结构为(用文字描述)。(3)、砷化镉(Cd,As)是一种验证三维量子霍尔效应的材料。
(5)、材料密度是制作芯片的重要参数之一,已知Si的共价半径是125pm。求每立方厘米体积的单晶硅中硅的原子数目为(保留2位有效数字)。26. CdSnAs2是一种高迁移率的新型热电材料。回答下列问题:(1)、砷和磷为同一主族的元素,则As的价层电子排布式为 , 第一电离能:磷砷(填“大于”、“小于”或“等于”)。(2)、SnCl4是制备有机锡化合物的原料,染色的媒染剂,缩合剂。SnCl4中锡原子的杂化方式为 , SnCl4的空间结构为(用文字描述)。(3)、砷化镉(Cd,As)是一种验证三维量子霍尔效应的材料。①砷和卤素可形成多种卤化物,AsBr3、AsCl3、AsF3的熔点由低到高的顺序为
②砷元素的常见化合价有+3和+5,它们对应的含氧酸有H3AsO3和H3AsO4两种,其中H3AsO4的酸性比H3AsO3的酸性强,从物质结构与性质的关系来看,H3AsO4的酸性比H3AsO3的酸性强的原因是
③Cd2+与 形成配离子[Cd(NH3)4]2+中,中心离子的配位数为 , 画出配离子的结构式(不考虑立体构型)。
(4)、灰锡的晶胞结构如图。已知:晶胞边长为648.9pm。晶体密度为5.75g•cm-3 , =1.414, =1.732.则锡原子的半径为pm,锡的相对原子质量为(只需写出计算表达式)。 27. 电动汽车电池材料的发展技术之一是使用三元材料镍锰钴酸锂。回答下列问题:(1)、基态Mn2+中成对电子数与未成对电子数之比为.。(2)、[Co(NO2)(NH3)5]Cl2中Co3+的配位数为 , 粒子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则配体中NO 的大π键可表示为 , 空间构型为。(3)、①已知:过渡金属价层达到18电子时,配位化合物较稳定。比较稳定性:[Ni(CO)4][Co(C5H5)2](填“>”“<”)。
27. 电动汽车电池材料的发展技术之一是使用三元材料镍锰钴酸锂。回答下列问题:(1)、基态Mn2+中成对电子数与未成对电子数之比为.。(2)、[Co(NO2)(NH3)5]Cl2中Co3+的配位数为 , 粒子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则配体中NO 的大π键可表示为 , 空间构型为。(3)、①已知:过渡金属价层达到18电子时,配位化合物较稳定。比较稳定性:[Ni(CO)4][Co(C5H5)2](填“>”“<”)。②正负离子的半径比是决定晶体结构和配位数的重要因素。根据图(a)、图(b)推测晶体中离子半径比(r+/r-)与配位数的关系.。
 (4)、镍锰钴酸锂三元材料为六方最密堆积,其晶胞结构如下图所示,以R表示过渡金属离子,其化学式为。若过渡金属离子的平均摩尔质量为MRg·mol-1 , 该晶体的密度是ρg·cm-3 , 阿伏加德罗常数是NA , 则NA=。(列出计算表达式)
(4)、镍锰钴酸锂三元材料为六方最密堆积,其晶胞结构如下图所示,以R表示过渡金属离子,其化学式为。若过渡金属离子的平均摩尔质量为MRg·mol-1 , 该晶体的密度是ρg·cm-3 , 阿伏加德罗常数是NA , 则NA=。(列出计算表达式) 28. 锂离子电池让电动汽车飞速发展,有利于实现节能减排。LiCoO2、LiFePO4、Li4TisO12常用作电池的电极材料,LiPF6、LiAsF6常用作锂离子聚合物电池的载体材料。
28. 锂离子电池让电动汽车飞速发展,有利于实现节能减排。LiCoO2、LiFePO4、Li4TisO12常用作电池的电极材料,LiPF6、LiAsF6常用作锂离子聚合物电池的载体材料。回答下列问题:
(1)、LiCoO2中基态Co原子的电子排布式为 , 其核外电子的空间运动状态有种。(2)、LiFePO4与LiPF6中所含的非金属元素电负性由大到小的顺序为 , PF 的空间构型为。(3)、含氧酸的通式可写为(HO)mROn , 根据含氧酸的结构规律,下列酸中酸性与H3PO4相近的有。a.HClO b.H2SO4 c.HNO2 d.HNO3
(4)、电池工作时,Li+可在电解质LiPF6或LiAsF6的中发生迁移,相同条件下,Li+在(选填“LiPF6”或“LiAsF6”)中迁移较快,原因是。(5)、Li4Ti5O12中Ti元素的化合物TiO2是一种重要的瓷器釉料。研究表明,在TiO2中通过氮掺杂反应可生成TiO2-aNb , 能使TiO2对可见光具有活性,掺杂过程如图所示。
则TiO2-aNb晶体中a= , b=。
29. 【物质结构与性质】Cu(Inl-xGaxSe2)(简称CIGS)可作多晶膜太阳能电池材料,具有非常好的发展前景。
回答下列问题:
(1)、已知铟的原子序数为49,基态铟原子的电子排布式为[Kr];Ga、In、Se,第一电离能从大到小顺序为。(2)、硅与碳位于同主族,碳的化合物中往往有碳碳双键、碳碳三键,但是硅的化合物中只存在硅硅单键,其主要原因是。常温常压下,SiF4呈气态,而SiCl4呈液态,其主要原因是。(3)、31Ga可以形成GaCl3·xNH3 (x=3、4、5、6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成:过滤后,充分加热滤液有氨气逸出,且又有沉淀生成,两次沉淀的物质的量之比为1:2。则该溶液中溶质的化学式为。(4)、Seo32-的立体构型为;SeO2中硒原子采取杂化类型是。(5)、常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图l所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图如图2所示。已知CuS和Cu2S的晶胞参数分别为a pm和b pm,阿伏加德罗常数的值为NA。
①CuS晶体中,相邻的两个铜离子间的距离为pm。
②Cu2S晶体中,S2-的配位数为。
⑨Cu2S晶体的密度为p=g·cm-3(列出计算式即可)。
30. N、P、S、 、 元素形成的化合物质性质丰富,研究较多。(1)、基态 原子核外电子排布式为。(2)、硫脲( )分子中氮、碳的杂化类型分别为、。 (3)、P、S的第二电离能 的大小关系为 (填“>”“<”或“=”),原因是。(4)、 不稳定遇到氧气被氧化成深蓝色的 ,试回答下列问题:
)分子中氮、碳的杂化类型分别为、。 (3)、P、S的第二电离能 的大小关系为 (填“>”“<”或“=”),原因是。(4)、 不稳定遇到氧气被氧化成深蓝色的 ,试回答下列问题:① 配位数为 , 含有 键的数目为个。
② 的空间结构为。
③上述反应可用于检验氨气中的痕量 ,写出该反应的离子方程式。
(5)、 属于立方晶体,如下图所示,
其晶胞参数为 ,阿伏加德罗常数为 ,S原子填充在 构成的正四面体空隙中,则晶胞中正四面体的空隙填充率为 , 则 密度为 (列出计算式)。
三、多选题
-
31. NH3和BF3可以通过配位键形成化合物NH3·BF3 , 下列说法正确的是( )A、NH3和BF3的立体构型都是三角锥形 B、NH3和BF3的中心原子的杂化方式不同 C、NH3和BF3形成的化合物NH3·BF3中各原子都达到8电子稳定结构 D、NH3和BF3形成的化合物NH3·BF3中N和B都采取的是sp3杂化32. 硫代硫酸钠(Na2S2O3)可作定影剂,反应的化学方程式为AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr,产物中的Na3[Ag(S2O3)2]常用于切花保鲜。下列说法错误的是( )A、基态Na+的核外电子存在10种运动状态 B、S2O 的空间结构为四面体形,中心原子S的杂化方式为sp3 C、欲测定切花保鲜液中Na3[Ag(S2O3)2]的浓度,可用NaCl标准溶液滴定Ag+ D、NaBr的晶体结构与NaCl晶体相似,每个Br-周围有8个Na+33. 下列描述中正确的是( )A、CS2为空间构型为V形的极性分子 B、双原子或多原子形成的气体单质中,一定有σ键,可能有π键 C、氢原子电子云的一个小黑点表示一个电子 D、SiF4和SO32-的中心原子均为sp3杂化34. 晶体复杂结构的三维表示往往难以在二维图上绘制和解释,可以从晶胞的一个方向(通常选择晶胞的一个轴的方向)往下看,得到该方向的投影图,原子分数坐标(将原子位置的坐标表示为晶胞棱长的分数)标注原子位置,如图1为面心立方晶胞的投影。已知某硅的硫化物晶胞的投影如图2所示,其晶胞参数为anm,晶胞密度为ρg·cm-3.下列说法正确的是( )
 A、该硅的硫化物化学式为SiS2 B、Si与S原子的最近距离为nm C、与Si紧邻的4个S原子呈四面体构型 D、阿伏加德罗常数可表示为35. 下列说法错误的是( )A、除去96%的乙醇中的少量水制无水乙醇:加入生石灰,振荡、静置、分液 B、除去溴苯中混有的少量单质溴:加入足量的NaOH溶液,振荡、静置、分液 C、NH3和BF3都是三角锥型,CH4、CCl4都是正四面体结构 D、CH3CH=C (CH3)2系统命名法为:2﹣甲基﹣2-丁烯
A、该硅的硫化物化学式为SiS2 B、Si与S原子的最近距离为nm C、与Si紧邻的4个S原子呈四面体构型 D、阿伏加德罗常数可表示为35. 下列说法错误的是( )A、除去96%的乙醇中的少量水制无水乙醇:加入生石灰,振荡、静置、分液 B、除去溴苯中混有的少量单质溴:加入足量的NaOH溶液,振荡、静置、分液 C、NH3和BF3都是三角锥型,CH4、CCl4都是正四面体结构 D、CH3CH=C (CH3)2系统命名法为:2﹣甲基﹣2-丁烯