高考二轮复习知识点:判断简单分子或离子的构型2
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是A、和的VSEPR模型均为四面体 B、和的空间构型均为平面三角形 C、和均为非极性分子 D、与的键角相等2. 下列化学用语表示正确的是A、中子数为18的氯原子: B、碳的基态原子轨道表示式:
 C、的空间结构:
C、的空间结构: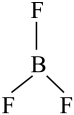 (平面三角形)
D、的形成过程:
(平面三角形)
D、的形成过程: 3. 理论化学模拟得到一种离子,结构如图。下列关于该离子的说法错误的是( )
3. 理论化学模拟得到一种离子,结构如图。下列关于该离子的说法错误的是( )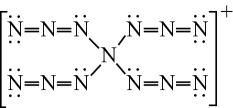 A、所有原子均满足8电子结构 B、N原子的杂化方式有2种 C、空间结构为四面体形 D、常温下不稳定4. 下列符号表征或说法正确的是( )A、电离: B、位于元素周期表p区 C、空间结构:平面三角形 D、电子式:
A、所有原子均满足8电子结构 B、N原子的杂化方式有2种 C、空间结构为四面体形 D、常温下不稳定4. 下列符号表征或说法正确的是( )A、电离: B、位于元素周期表p区 C、空间结构:平面三角形 D、电子式: 5. 合成氨工业中,原料气(、及少量CO、的混合气)在进入合成塔前常用乙酸二氨合铜(Ⅰ)溶液来吸收CO,其反应为: 。下列说法正确的是A、分子的空间构型为三角锥形 B、CO的相对分子质量大于 , 则沸点比高 C、中给出孤电子对,提供空轨道 D、工业上吸收CO适宜的条件是低温、高压,压强越大越好6. NH3和N2H4是氮的两种常见氢化物。下列说法错误的是A、两种氢化物均能形成分子间氢键 B、两种氢化物溶于水后均能形成配位键 C、NH3的VSEPR模型为三角锥形 D、N2H4中既含极性键又含非极性键7. 某中德联合研究小组制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是A、“水瓶”是纯净物 B、水分子空间构型是V型 C、C60是极性分子 D、富勒烯与石墨是同位素8. 分子构型可能为平面型的是A、 B、 C、 D、
5. 合成氨工业中,原料气(、及少量CO、的混合气)在进入合成塔前常用乙酸二氨合铜(Ⅰ)溶液来吸收CO,其反应为: 。下列说法正确的是A、分子的空间构型为三角锥形 B、CO的相对分子质量大于 , 则沸点比高 C、中给出孤电子对,提供空轨道 D、工业上吸收CO适宜的条件是低温、高压,压强越大越好6. NH3和N2H4是氮的两种常见氢化物。下列说法错误的是A、两种氢化物均能形成分子间氢键 B、两种氢化物溶于水后均能形成配位键 C、NH3的VSEPR模型为三角锥形 D、N2H4中既含极性键又含非极性键7. 某中德联合研究小组制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是A、“水瓶”是纯净物 B、水分子空间构型是V型 C、C60是极性分子 D、富勒烯与石墨是同位素8. 分子构型可能为平面型的是A、 B、 C、 D、 9. 下列化学用语的表达正确的是A、原子核内有10个中子的氧原子: B、2-丁烯的键线式:
9. 下列化学用语的表达正确的是A、原子核内有10个中子的氧原子: B、2-丁烯的键线式: C、的空间结构:
C、的空间结构: (平面三角形)
D、基态铜原子的价层电子排布图:
(平面三角形)
D、基态铜原子的价层电子排布图: 10. 分子构型可能为平面型的是( )A、 B、 C、 D、
10. 分子构型可能为平面型的是( )A、 B、 C、 D、 11. 我国科研团队对嫦娥五号月壤的研究发现,月壤中存在一种含“水”矿物Ca5(PO4)3(OH)。下列化学用语或图示表达错误的是A、-OH的电子式:
11. 我国科研团队对嫦娥五号月壤的研究发现,月壤中存在一种含“水”矿物Ca5(PO4)3(OH)。下列化学用语或图示表达错误的是A、-OH的电子式: B、的结构示意图:
B、的结构示意图: C、H2O中O原子的杂化轨道类型为
D、的空间结构为正四面体形
12. 下列化学用语表达错误的是A、的结构式: B、分子VSEPR模型为平面三角形 C、基态价电子的轨道表示式:
C、H2O中O原子的杂化轨道类型为
D、的空间结构为正四面体形
12. 下列化学用语表达错误的是A、的结构式: B、分子VSEPR模型为平面三角形 C、基态价电子的轨道表示式: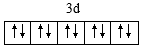 D、用电子式表示水分子的形成过程:
D、用电子式表示水分子的形成过程: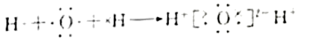 13. 下列分子结构的空间构型为正四面体的是A、四氯化碳 B、1,2-二氯乙烯 C、二氯甲烷 D、氨气14. 下列“类比”结果错误的是A、受热分解生成和 , 则受热分解生成和S B、的分子构型为直线形,则的分子构型也为直线形 C、与溶液反应得到 , 则与溶液反应也得到 D、溶解度大于 , 则溶解度大于
13. 下列分子结构的空间构型为正四面体的是A、四氯化碳 B、1,2-二氯乙烯 C、二氯甲烷 D、氨气14. 下列“类比”结果错误的是A、受热分解生成和 , 则受热分解生成和S B、的分子构型为直线形,则的分子构型也为直线形 C、与溶液反应得到 , 则与溶液反应也得到 D、溶解度大于 , 则溶解度大于二、非选择题
-
15. 硅材料在生活中占有重要地位。请回答:(1)、分子的空间结构(以为中心)名称为 , 分子中氮原子的杂化轨道类型是。受热分解生成和 , 其受热不稳定的原因是。(2)、由硅原子核形成的三种微粒,电子排布式分别为:①、②、③ , 有关这些微粒的叙述,正确的是____。A、微粒半径:③>①>② B、电子排布属于基态原子(或离子)的是:①② C、电离一个电子所需最低能量:①>②>③ D、得电子能力:①>②(3)、Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 , 该化合物的化学式为。
 16. 2020年9月,中国向联合国大会宣布“30.60目标”,即二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。目前我国正在大力发展新能源车。磷酸铁锂电池主要成分为LiFePO4 , 可采用二价铁盐或三价铁盐、H3PO4、NH3∙H2O等作为原料制备。(1)、H3PO4中PO空间构型为(2)、Fe2+的电子排布式为。Fe3+比Fe2+更稳定的原因是。(3)、NH3和PH3结构相似,但NH3易溶于水,PH3难溶于水,原因是(4)、LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
16. 2020年9月,中国向联合国大会宣布“30.60目标”,即二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。目前我国正在大力发展新能源车。磷酸铁锂电池主要成分为LiFePO4 , 可采用二价铁盐或三价铁盐、H3PO4、NH3∙H2O等作为原料制备。(1)、H3PO4中PO空间构型为(2)、Fe2+的电子排布式为。Fe3+比Fe2+更稳定的原因是。(3)、NH3和PH3结构相似,但NH3易溶于水,PH3难溶于水,原因是(4)、LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
这类磷酸根离子的化学式可用通式表示为(用n代表P原子数)。
(5)、石墨可用作锂离子电池的负极材料,Li+嵌入石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物。某石墨嵌入化合物的平面结构如图甲所示,则x=;若每个六元环都对应一个Li+ , 则化学式为。 (6)、某金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+ , 阴离子是由12个硼原子和12个氢原子所构成的离子团。阴离子在晶胞中的位置如图乙所示,其堆积方式为 , Li+占据阴离子组成的所有正四面体空隙中心,该化合物的化学式为(用最简整数比表示)。假设晶胞边长为a nm,则该晶胞的密度为g/cm-3(用含a、NA的代数式表示)。
(6)、某金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+ , 阴离子是由12个硼原子和12个氢原子所构成的离子团。阴离子在晶胞中的位置如图乙所示,其堆积方式为 , Li+占据阴离子组成的所有正四面体空隙中心,该化合物的化学式为(用最简整数比表示)。假设晶胞边长为a nm,则该晶胞的密度为g/cm-3(用含a、NA的代数式表示)。 17. 铜及其合金广泛应用于生活生产中。如黄铜合金可作首饰、镀层等。请回答下列问题:(1)、基态铜原子价电子排布式为。(2)、在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。
17. 铜及其合金广泛应用于生活生产中。如黄铜合金可作首饰、镀层等。请回答下列问题:(1)、基态铜原子价电子排布式为。(2)、在Cu(NO3)2溶液中加入氨水至过量,生成[Cu(NH3)4]2+。①中N原子的杂化类型是;NH3分子的立体构型是。
②[Cu(NH3)4]2+中提供孤对电子的基态原子有个未成对电子。1 mol该阳离子含有的σ键数目为
③NH3能与Cu2+形成[Cu(NH3)4]2+ , 而NF3不能,其原因是 , NH3的沸点比NF3 ( 选填“高”或“低”),原因是。
(3)、黄铜合金采取面心立方堆积,其晶胞结构如图所示:
已知:晶胞参数为a nm。
①合金中粒子间作用力类型是。
②与Cu原子等距离且最近的Cu原子有个。
③黄铜合金晶体密度为g·cm-3。(设NA为阿伏加德罗常数的值)
18. C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:(1)、科学家常利用区分晶体SiO2和非晶体SiO2. , 基态Ge原子价电子排布图为 , 第四周期与基态Ge原子具有相同数目未成对电子数的元素有(填元素符号)。(2)、SnCl2极易水解生成Sn(OH)Cl沉淀,Sn(OH)Cl中四种元素电负性由小到大的顺序为。SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3 , Na2SnO3中阴离子的空间构型为。(3)、灰锡的晶体结构与金刚石相似(如图所示),其中A处原子的原子分数坐标为(0,0,0)。
①B处原子的原子分数坐标为。
②已知灰锡的密度为ρg·m-3 , 设NA为阿伏加德罗常数的值,根据硬球接触模型,则Sn原子半径r(Sn)=pm(可只列式不计算)。
19. 金属钛有“生物金属、海洋金属、太空金属”的美称。有些含钛的化合物在耐高温、环保或者抑菌方面有着重要的应用,钛元素也被称为“健康钛”。(1)、Ti元素位于元素周期表的区,基态原子电子排布式为。(2)、TiCl4与SiCl4互为等电子体。SiCl4可以与N-甲基咪唑

 发生反应。
发生反应。①TiCl4分子的空间构型为。
②N-甲基咪唑分子中碳原子的杂化轨道类型为 , C、N、Si的电负性由大到小的顺序为 , 1个
 含有个π键。(3)、TiCl4可以与胺形成配合物,如TiCl4(CH3NH2)2、TiCl4(H2NCH2CH2NH2)。
含有个π键。(3)、TiCl4可以与胺形成配合物,如TiCl4(CH3NH2)2、TiCl4(H2NCH2CH2NH2)。① TiCl4 (H2NCH2CH2NH2)中提供电子对形成配位键的原子是。
②乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性较差的是(填“Mg2+”或“Cu2+”)。
(4)、有一种氮化钛晶体的晶胞与NaCl晶胞相似(如图),其中阴离子(N3-)采用面心立方最密堆积方式,X-射线衍射实验测得氮化钛的晶胞参数(晶胞边长)为a pm,则r(N3-)为pm。该氮化钛的密度为g·cm-3(NA为阿伏加德罗常数的值,只列计算式)。 20. [选修3:物质结构与性质]
20. [选修3:物质结构与性质]氯乙酸(ClCH2COOH)是重要的有机化工原料,实验室中先用KMnO4 , 和浓盐酸制备干燥、纯净的Cl2 , 然后将Cl2通入冰醋酸中生成氯乙酸。回答下列问题:
(1)、K的焰色试验呈紫红色,紫色对应的辐射波长为 nm(填标号)。A、670.8 B、589.2 C、553.5 D、404.4(2)、氯乙酸的组成元素电负性由大到小的顺序为;其分子中碳原子的杂化方式为;占据基态C原子中最高能级电子的电子云轮廓图形状为形。(3)、基态Mn原子核外电子排布式为;KMnO4的阴离子的空间构型为。(4)、氯乙酸的熔点高于冰醋酸的原因可能为。(5)、KMnO4中两种金属元素单质的晶体结构堆积方式相同,晶胞结构如下图所示。
①下列立方堆积模型中符合钾、锰堆积方式的为(填标号)。
A、

B、

C、

②NA为阿伏加德罗常数的值。锰的摩尔质量为Mg·mol-1 , 晶胞的密度为d g·cm-3 , 则锰的晶胞参数为nm(用含Nλ、M、d的式子表示)。
21. 氨、磷、砷、铁、钛等元素及其化合物在现代农业、科技和国防建设中有着许多独特的用途。(1)、I.如 ,是新型锂离子电池的电极材料,可采用 、 、LiCl和苯胺等作为原料制备。基态铁原子的价电子排布式为 , 中,除氢元素外,其余三种元素第一电离能最大的是(填元素符号)。
(2)、 的熔点为306℃,沸点为315℃, 的晶体类型是。(3)、苯胺( )和 中的N原子杂化方式分别为。 (4)、苯胺和甲苯相对分子质量接近,但苯胺熔点比甲苯的高,原因是。(5)、II.氨、磷、砷、锑等第ⅤA族元素及其化合物在生产、生活中用途广泛。
)和 中的N原子杂化方式分别为。 (4)、苯胺和甲苯相对分子质量接近,但苯胺熔点比甲苯的高,原因是。(5)、II.氨、磷、砷、锑等第ⅤA族元素及其化合物在生产、生活中用途广泛。白磷在氯气中燃烧可以得到 和 ,其中气态 分子的立体构型为。
(6)、研究发现固态 和 均为离子晶体,但其结构分别为 和 ,分析 和 结构存在差异的原因是。(7)、锑酸亚铁晶胞如图所示,其晶胞参数分别为a nm、b nm、c nm, ,则:
①锑酸亚铁的化学式为。
②晶体的密度为 (设 为阿伏加德罗常数的值)。
22. 下图为钠的某种氧化物D的晶胞和H3BO3(层状结构)的结构示意图。请回答下列问题: (1)、基态硼原子的电子排布图为:其第一电离能小于Be,原因是。(2)、三价B易形成多种配离子如[B(OH)4]-、BH 离子[B(OH)4]-的空间构型为。硼酸显弱酸性与该配离子有关写出硼酸的电离方程式。写出一种与BH 互为等电子体的分子的电子式。(3)、在硼酸的层状结构中B的杂化类型是层内存在的作用力有。(4)、D的化学式为;晶胞中O原子的配位数为;已知该晶体F的密度为dg·cm-3 , 晶胞参数a=nm。23. IIIA和VA元素形成化合物在生产、生活中具有广泛用途。回答下列问题:(1)、下列状态的铝中,能量较小的是 , 其原因是。
(1)、基态硼原子的电子排布图为:其第一电离能小于Be,原因是。(2)、三价B易形成多种配离子如[B(OH)4]-、BH 离子[B(OH)4]-的空间构型为。硼酸显弱酸性与该配离子有关写出硼酸的电离方程式。写出一种与BH 互为等电子体的分子的电子式。(3)、在硼酸的层状结构中B的杂化类型是层内存在的作用力有。(4)、D的化学式为;晶胞中O原子的配位数为;已知该晶体F的密度为dg·cm-3 , 晶胞参数a=nm。23. IIIA和VA元素形成化合物在生产、生活中具有广泛用途。回答下列问题:(1)、下列状态的铝中,能量较小的是 , 其原因是。A.[Ne]3s13p2 B.[Ne]3s23p1
(2)、由元素周期律,推出元素电负性Al(填“大于”、“小于”)Si。(3)、科学家合成了“N4H4”离子晶体。阴离子为“ ”,其空间构型为 , 阳离子的中心原子轨道杂化方式为。(4)、AlF3熔点远高于AlCl3的原因是;AlCl3晶体变成气体时,测得气体的相对分子质量接近267,其中氯只有两种化学环境,比例为2:1,试画出该气体分子的结构式。(5)、原子晶体AlN的晶胞参数为a=x pm,它的晶体的晶胞结构如图。
①该晶胞内存在共价键数目为;
②紧邻的N原子之间距离为b,紧邻Al、N原子间距离为d,则b:d=;
③该晶体的密度为g·cm-3(阿伏加德罗常数的值用NA表示)。
24. 水滑石(LDHs)阻燃剂,是由带正电荷的主体层板和插入层板间的阴离子组装而成。引入Ca2+、Mg2+、Al3+、B(OH) 、SiO 等离子可改变其性能。回答下列问题:(1)、基态Ca原子中,核外电子占据最高能层的符号是 , 占据该能层电子的电子云轮廓图形状为。(2)、元素镁和铝的第一电离能I1(Mg)I1(Al)(填“>”或“<”)。(3)、B(OH) 中B原子的杂化形式为 , 空间立体构型为;“水滑石”层间阴离子通过作用力与层板结合。(4)、原硅酸(H4SiO4)较稳定,为原酸结构 。而类似结构的原碳酸(H4CO4)则不能稳定存在,试从结构角度解释其原因。 (5)、Li、Al、Si三元化合物晶胞结构如下图所示。
。而类似结构的原碳酸(H4CO4)则不能稳定存在,试从结构角度解释其原因。 (5)、Li、Al、Si三元化合物晶胞结构如下图所示。
①该化合物的化学式是。
②已知晶胞参数为5.93A,Si与Al之间的共价键长是(写出计算表达式)。
25. Fe—Cr—Si系合金是一种新型耐磨耐腐蚀的材料,具有较好的发展前景。按要求回答下列问题。(1)、基态Cr2+与Fe的未成对电子数之比为。试从电子排布角度分析水溶液中Fe2+具有强还原性。若是形成将其转化为(NH4)2Fe(SO4)2 , 在空气中相对稳定, 的空间构型为。(2)、由环戊二烯(C5H6 , )与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知 的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为 , 结构中的大π键可用符号表示 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。则 结构中含有的大π键可表示为。 (3)、某含铬配合物,[Cr3O(CH3COO)6(H2O)3]Cl·8H2O,指出其中Cr的化合价为。几种Cr的卤化物的部分性质如表所示:
)与FeCl2在一定条件下反应得到二茂铁[双环戊二烯基合亚铁,Fe(C5H5)2],已知 的空间构型为所有碳原子一定处于同一平面,指出碳原子的杂化形式为 , 结构中的大π键可用符号表示 ,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。则 结构中含有的大π键可表示为。 (3)、某含铬配合物,[Cr3O(CH3COO)6(H2O)3]Cl·8H2O,指出其中Cr的化合价为。几种Cr的卤化物的部分性质如表所示:卤化物
CrCl3
CrBr3
CrI3
熔点/℃
1150
600
试预测CrBr3的熔点范围。
(4)、某晶体中含有K+、Ni2+、Fe2+、CN- , 其部分微粒在晶胞结构的位置如图所示。1个晶胞中含有CN-个。该物质常用于吸附Cs+ , 将取代晶胞中的K+ , 取代后的物质的化学式为。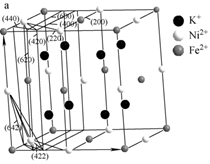 26. 人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛。试回答下列问题。(1)、Cu+的核外电子排布式为。(2)、CuSO4和Cu(NO3)2是自然界中重要的铜盐, 的立体构型是 , S、O、N三种元素的第一电离能由大到小为。(3)、金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 , 反应的离子方程式为。(4)、丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO OHC—CH2CH2OH。则OHC—CH2CH2OH中碳原子杂化方式有。(5)、利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
26. 人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛。试回答下列问题。(1)、Cu+的核外电子排布式为。(2)、CuSO4和Cu(NO3)2是自然界中重要的铜盐, 的立体构型是 , S、O、N三种元素的第一电离能由大到小为。(3)、金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 , 反应的离子方程式为。(4)、丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO OHC—CH2CH2OH。则OHC—CH2CH2OH中碳原子杂化方式有。(5)、利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为( , , )。则D原子的坐标参数为 , 它代表原子。
②若Cu2O晶体密度为dg·cm-3 , 晶胞参数为apm,则阿伏加德罗常数值NA=。
27. N、P、As都是VA族元素,且原子序数依次增大,它们的单质和化合物在生产、生活中有广泛应用。请回答下列相关问题。(1)、基态砷原子的价电子排布式为。(2)、从结构分析硝酸符合形成氢键的条件但硝酸的沸点较低,其可能的原因是。(3)、 与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。 离子的VSEPR模型名称为 , K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是。(用元素符号表示)(4)、磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图1所示,在BP晶胞中B原子配位数是 , P原子占据的是B原子堆积的(选填“立方体”“正四面体”或“正八面体”)空隙。建立如图2所示坐标系,可得晶胞中A、C处原子的分数坐标,则M处的P原子分数坐标为 , 若晶胞中B原子和P原子之间的最近核间距为a pm,则晶胞边长为cm。 28. 钴及其化合物在催化剂、磁性材料、电池等领域应用十分广泛。回答下列问题:(1)、纳米氧化钴可以在室温下将甲醛完全催化氧化为CO2和H2O。
28. 钴及其化合物在催化剂、磁性材料、电池等领域应用十分广泛。回答下列问题:(1)、纳米氧化钴可以在室温下将甲醛完全催化氧化为CO2和H2O。①基态钴原子的核外电子排布式为[Ar]。
②甲醛分子中三种元素电负性由大到小的顺序为(填元素符号);甲醛分子的立体构型为;分子中σ键与π键数目比为。
(2)、[Co(NH3)6]Cl3是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是 , NH3分子中氮原子的杂化轨道类型为 , NH3是(填“极性”或“非极性”)分子。(3)、LiCoO2可用作锂离子电池的电极材料。在元素周期表中,与Li的化学性质最相似的邻族元素是(填元素符号),该元素基态原子核外M层电子的自旋状态(填“相同”或“相反”);LiF的熔点为848℃,属于晶体,LiF的熔点高于LiCl熔点(605℃)的原因是。(4)、某钻化合物纳米粉可以提高碱性电池的性能。该化合物晶胞结构如图所示,已知晶胞参数为a nm,则此晶体的密度为(列出计算式即可)g·cm-3。 29. 微量元素硼(B)对人体健康有着十分重要的作用,其化合物也应用广泛。请回答下列问题:(1)、B的核外电子排布式为 , 其第一电离能比Be(填“大”或“小”)。(2)、氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。NH3BH3分子中,N—B键是配位键,其空轨道由提供(填元素符号)。写出一种与氨硼烷互为等电子体的分子(填分子式)。(3)、硼酸晶体是片层结构,图甲中表示的是其中一层的结构,每一层内存在的作用力有。
29. 微量元素硼(B)对人体健康有着十分重要的作用,其化合物也应用广泛。请回答下列问题:(1)、B的核外电子排布式为 , 其第一电离能比Be(填“大”或“小”)。(2)、氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。NH3BH3分子中,N—B键是配位键,其空轨道由提供(填元素符号)。写出一种与氨硼烷互为等电子体的分子(填分子式)。(3)、硼酸晶体是片层结构,图甲中表示的是其中一层的结构,每一层内存在的作用力有。 (4)、①乙硼烷(B2H6)具有强还原性,它和氢化锂反应生成硼氢化锂(LiBH4),硼氢化锂常用于有机合成。LiBH4由Li+和BH 构成,BH 中B原子的杂化轨道类型为 , BH 的空间构型为。
(4)、①乙硼烷(B2H6)具有强还原性,它和氢化锂反应生成硼氢化锂(LiBH4),硼氢化锂常用于有机合成。LiBH4由Li+和BH 构成,BH 中B原子的杂化轨道类型为 , BH 的空间构型为。②B的三卤化物熔点如表所示,自BF3至BI3熔点依次升高的原因是。
化合物
BF3
BCl3
BBr3
BI3
熔点/℃
-126.8
-107.3
-46
44.9
(5)、立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图乙所示。立方氮化硼属于晶体,其中氮原子的配位数为。已知:立方氮化硼密度为ρg·cm-3 , B原子半径为anm,N原子半径为bnm,阿伏加德罗常数的值为NA , 则该晶胞中原子的空间利用率为(用含字母的代数式表示)。30. 光刻胶是微电子技术中芯片微细图形加工的关键材料之一,其国产化势在必行。根据显影原理,光刻胶可分为正、负型胶,原理如图1.回答下列问题: (1)、光刻胶常含C、N等元素,在基态C原子中,核外存在对自旋方向相反的电子,N的3个2p轨道的取向为。(2)、近年来光刻胶的发展趋势是应用含有多羟基的二苯甲酮类化合物,如:
(1)、光刻胶常含C、N等元素,在基态C原子中,核外存在对自旋方向相反的电子,N的3个2p轨道的取向为。(2)、近年来光刻胶的发展趋势是应用含有多羟基的二苯甲酮类化合物,如: ,其C的杂化方式为。 (3)、紫外负型光刻胶常含有—N3 , 形成的阴离子 的等电子体是(填化学式,任写一种),其空间构型为。(4)、某光刻胶受紫外光照射后,发生反应如下,用稀碱水作为溶剂浸泡。根据茚羧酸结构分析该材料为型光刻胶(填“正”或“负”),理由是。
,其C的杂化方式为。 (3)、紫外负型光刻胶常含有—N3 , 形成的阴离子 的等电子体是(填化学式,任写一种),其空间构型为。(4)、某光刻胶受紫外光照射后,发生反应如下,用稀碱水作为溶剂浸泡。根据茚羧酸结构分析该材料为型光刻胶(填“正”或“负”),理由是。 (5)、 与K+能形成图2中的超分子加合物,该晶胞中K+的数目为 , 已知晶胞参数为αnm,阿伏加德罗常数的值为NA , 则该晶胞的密度为g/cm3(列出计算表达式)。
(5)、 与K+能形成图2中的超分子加合物,该晶胞中K+的数目为 , 已知晶胞参数为αnm,阿伏加德罗常数的值为NA , 则该晶胞的密度为g/cm3(列出计算表达式)。 31. 过渡金属硫族化合物 为具有良好可控性的半导体材料,可用于太阳能电池制备、激光技术、光催化水的裂解等领域。 的其中一种制备方法是以CuS、ZnS、 和Cu为原料高能球磨后,在 气氛中退火。回答下列问题:(1)、所给电子排布图中,能表示基态S原子3p轨道电子状态的是_______(填标号)。A、
31. 过渡金属硫族化合物 为具有良好可控性的半导体材料,可用于太阳能电池制备、激光技术、光催化水的裂解等领域。 的其中一种制备方法是以CuS、ZnS、 和Cu为原料高能球磨后,在 气氛中退火。回答下列问题:(1)、所给电子排布图中,能表示基态S原子3p轨道电子状态的是_______(填标号)。A、 B、
B、 C、
C、 D、
D、 (2)、基态 的价层电子排布式是。(3)、CuS由 与 反应制备。根据价层电子对互斥模型, 中心原子价层电子对数为。 的空间构型为。(4)、 的晶体类型与CuS相同,除上述用途外, 也用于制作火柴头。火柴燃烧时, 转化为 和 ,这三种物质熔点由高到低的顺序是。(5)、 的四方晶胞如图所示。
(2)、基态 的价层电子排布式是。(3)、CuS由 与 反应制备。根据价层电子对互斥模型, 中心原子价层电子对数为。 的空间构型为。(4)、 的晶体类型与CuS相同,除上述用途外, 也用于制作火柴头。火柴燃烧时, 转化为 和 ,这三种物质熔点由高到低的顺序是。(5)、 的四方晶胞如图所示。
①Sb位于晶胞的顶点和体心,则图中A代表的原子是。
②原子A的坐标为 ,原子B的坐标为 ,则原子C的坐标为。
③设阿伏加德罗常数的值为 ,则 的密度为 (列出计算表达式)。
32. 铁的化合物在生活生产中应用广泛。回答下列问题:(1)、基态Fe原子共有种不同能级的电子,Fe2+的核外电子排布式为。(2)、氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的原因是。(3)、高氯酸三三氮唑合铁(II)的化学式为[Fe(Htrz)3](ClO4)2 , 其中Htrz为1,2,4-三氮唑( )。
)。 ①配合物中非金属元素的电负性最大的是;
②1,2,4-三氮唑分子中碳原子的杂化方式是。含σ键数为个;
③ 的空间构型为。
(4)、某种磁性氮化铁的结构如图所示,Fe原子构成六方最密堆积,N原子随机排列在其正四面体空隙中。
六棱柱底边长为apm,高为cpm,晶体的密度为ρg·cm-3.铁原子半径为 , 阿伏加德罗常数的值NA为。(列出计算式即可,sin60°= )
33. 一水合甘氨酸锌是一种饲料添加剂,结构简式如图所示:
回答下列问题:
(1)、基态Zn原子价电子排布图为;一水合甘氨酸锌中Zn2+的配位数为。(2)、甘氨酸(H2N—CH2—COOH)易溶于水,其原因为。(3)、以氧化锌矿物为原料,提取锌的过程中涉及反应:ZnO+2NH3+2NH =[Zn(NH3)4]2++H2O。NH 的空间构型为 , 与NH 互为等电子体的分子为 (写出1种即可)。(4)、[Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为 ,则1molIMI中含有molσ键,IMI的某种衍生物与甘氨酸形成的离子晶体
,则1molIMI中含有molσ键,IMI的某种衍生物与甘氨酸形成的离子晶体  熔点较低,其原因是。 (5)、金属Zn晶体中的原子堆积方式如图所示,六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA , 则Zn的密度为 g·cm-3(列出计算式)。
熔点较低,其原因是。 (5)、金属Zn晶体中的原子堆积方式如图所示,六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA , 则Zn的密度为 g·cm-3(列出计算式)。 34. 近年来,有机-无机杂化金属卤素钙钛矿作为优良的光电材料受到广泛研究和关注,回答下列问题。(1)、Ca、Ti元素基态原子核外电子占据能级数之比为 , 与 Ti 处于同周期单电子数与Ti相同的元素还有种,Ca的前三级电离能数据分别为589.8 kJ/mol、1145.4 kJ/mol、4912.4 kJ/mol,第三电离能增大较多的原因是。(2)、卤族元素可与N和P元素形成多种稳定卤化物,其中NCl3分子构型为 , P元素可形成稳定的PCl3和PCl5 , 而氮元素只存在稳定的NCl3 , 理由是。(3)、Ti的配合物有多种。Ti(CO)6、Ti(H2O) 、TiF 中的配体所含原子中电负性最小的是;Ti(NO3)4的球棍结构如图,Ti4+的配位数是。
34. 近年来,有机-无机杂化金属卤素钙钛矿作为优良的光电材料受到广泛研究和关注,回答下列问题。(1)、Ca、Ti元素基态原子核外电子占据能级数之比为 , 与 Ti 处于同周期单电子数与Ti相同的元素还有种,Ca的前三级电离能数据分别为589.8 kJ/mol、1145.4 kJ/mol、4912.4 kJ/mol,第三电离能增大较多的原因是。(2)、卤族元素可与N和P元素形成多种稳定卤化物,其中NCl3分子构型为 , P元素可形成稳定的PCl3和PCl5 , 而氮元素只存在稳定的NCl3 , 理由是。(3)、Ti的配合物有多种。Ti(CO)6、Ti(H2O) 、TiF 中的配体所含原子中电负性最小的是;Ti(NO3)4的球棍结构如图,Ti4+的配位数是。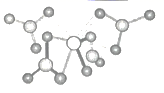 (4)、研究表明,TiO2通过氮掺杂反应生成TiO2-aNb , 能使TiO2对可见光具有活性,反应如图所示。
(4)、研究表明,TiO2通过氮掺杂反应生成TiO2-aNb , 能使TiO2对可见光具有活性,反应如图所示。
已知TiO2晶胞为长方体,设阿伏加德罗常数的值为NA , TiO2的密度为g/cm3(列出计算式)。TiO2-aNb晶体中a= , b=。
35. 硼酸(H3BO3)是玻璃工业、电子元件行业的重要原料。回答下列问题:(1)、与B、O同周期,第一电离能介于二者之间的有(填元素符号)。(2)、硼酸晶体结构为平面层状结构(如图I),四硼酸根为立体结构(如图Ⅱ)。
①硼酸为晶体;晶体中各层之间的作用力为。
②四硼酸根中硼原子的杂化方式为。
(3)、工业上曾用碳氨法制备硼酸,先用MgO·B2O3与NH4HCO3、H2O制得(NH4)H2BO3和MgCO3 , 然后再将(NH4)H2BO3脱NH3生成H3BO3。①NH 与CO 的空间构型:NH :CO 。
②MgO晶体结构属于NaCl型(如图),图中表示Mg2+的为(填“大球”或“小球”),其配位数是;MgO晶胞参数为a pm,则MgO晶胞的密度为g·cm-3(NA表示阿伏加德罗常数的值,用含a、NA的式子表示)。
