高考二轮复习知识点:判断简单分子或离子的构型1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列化学用语或图示表达正确的是( )A、的电子式为 B、的模型为
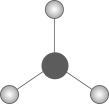 C、电子云图为
C、电子云图为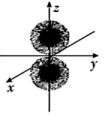 D、基态原子的价层电子轨道表示式为
D、基态原子的价层电子轨道表示式为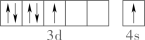 2. 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄褪色的主要原因是发生了以下两种化学反应:
2. 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄褪色的主要原因是发生了以下两种化学反应:
下列说法正确的是
A、和的空间结构都是正四面体形 B、反应Ⅰ和Ⅱ中,元素和S都被氧化 C、反应Ⅰ和Ⅱ中,参加反应的:Ⅰ<Ⅱ D、反应Ⅰ和Ⅱ中,氧化转移的电子数之比为3∶73. 下列化学用语表述错误的是A、HClO的电子式: B、中子数为10的氧原子:O
C、NH3分子的VSEPR模型:
B、中子数为10的氧原子:O
C、NH3分子的VSEPR模型: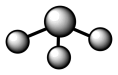 D、基态N原子的价层电子排布图:
D、基态N原子的价层电子排布图: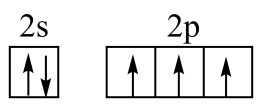 4. 下列化学用语或表述正确的是
4. 下列化学用语或表述正确的是 A、BeCl2的空间结构:V形 B、P4中的共价键类型:非极性键 C、基态Ni原子价电子排布式:3d10 D、顺—2—丁烯的结构简式:
A、BeCl2的空间结构:V形 B、P4中的共价键类型:非极性键 C、基态Ni原子价电子排布式:3d10 D、顺—2—丁烯的结构简式:二、非选择题
-
5. 硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根可看作是中的一个原子被原子取代的产物。(1)、基态原子价层电子排布式是。(2)、比较原子和原子的第一电离能大小,从原子结构的角度说明理由:。(3)、的空间结构是。(4)、同位素示踪实验可证实中两个原子的化学环境不同,实验过程为。过程中,断裂的只有硫硫键,若过程所用试剂是和 , 过程含硫产物是。(5)、的晶胞形状为长方体,边长分别为、 , 结构如图所示。

晶胞中的个数为。已知的摩尔质量是 , 阿伏加德罗常数为 , 该晶体的密度为。
(6)、浸金时,作为配体可提供孤电子对与形成。分别判断中的中心原子和端基原子能否做配位原子并说明理由:。6. 金属铑(Rh)是一种高效催化剂,在有机合成中发挥重要作用。一种以高铜铑精矿(主要含Rh,还含有少量的Cu、Fe等杂质)为原料提取的工艺如下: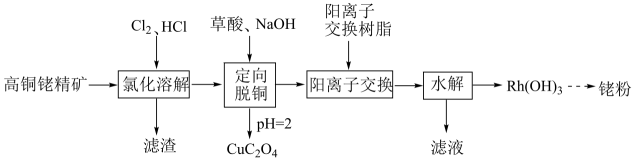
已知:阳离子交换过程可表示为
回答下列问题:
(1)、基态Cu原子的价电子排布式为。(2)、“氯化溶解”后,Rh元素以的形式存在,其中Rh元素的化合价为。(3)、“定向脱铜”时,铜与铑的沉淀率随pH变化如下图所示,该过程需将溶液pH调至2,结合图像说明原因。 (4)、“阳离子交换”过程中,溶液中被阳离子交换树脂吸附的金属阳离子主要有。(5)、“水解”过程中,发生反应的离子方程式为。(6)、铑锰催化剂可催化反应:。下列有关该反应的说法正确的是____(填标号)。A、存在极性共价键的断裂与形成 B、所有分子均为非极性分子 C、含碳化合物中心原子杂化轨道类型有与 D、的VSEPR模型为V形 E、催化剂可降低该反应的焓变,从而增大反应速率(7)、铑掺杂形成的催化剂,在光催化还原反应中有很高的催化效率。的晶胞结构如图所示。
(4)、“阳离子交换”过程中,溶液中被阳离子交换树脂吸附的金属阳离子主要有。(5)、“水解”过程中,发生反应的离子方程式为。(6)、铑锰催化剂可催化反应:。下列有关该反应的说法正确的是____(填标号)。A、存在极性共价键的断裂与形成 B、所有分子均为非极性分子 C、含碳化合物中心原子杂化轨道类型有与 D、的VSEPR模型为V形 E、催化剂可降低该反应的焓变,从而增大反应速率(7)、铑掺杂形成的催化剂,在光催化还原反应中有很高的催化效率。的晶胞结构如图所示。
①其中位于晶胞的体心,则所处的位置为晶胞的(填“顶角”或“棱心”);每个周围紧邻的共有个。
②当有1%的被替代后,晶体中会失去部分产生缺陷,此时平均每个晶胞所含数目为(保留三位小数)。
7. 研究金属原子结构及晶体结构具有重大意义。(1)、价电子轨道表示式为。(2)、原子发射光谱法是通过处于激发态的待测元素微粒回到基态时发射的特征谱线对其进行鉴别的方法。下列状态的铁粒子处于激发态的是____(填标号)。A、 B、 C、 D、(3)、利用配合物的特征颜色可检验补铁药片中的和 , 部分配合物的结构如下:
①取等量碾碎的药片放入两支试管中,试管1加盐酸溶解,试管2加等体积蒸馏水溶解。分别滴加溶液,发现试管1溶液变红,试管2溶液不变色。依据图示信息,解释检验须在酸性条件下进行的原因。
②配体SCN的空间构型为。
③邻二氮菲中N原子的价层孤电子对占据。(填标号)。
A.轨道 B.轨道 C.杂化轨道 D.杂化轨道
(4)、金属合金的结构可看作以四面体(相互共用顶点)替换立方金刚石结构中的碳原子,形成三维骨架,在晶胞空隙处,有序地放置原子(四面体的4个顶点代表原子,圆球代表原子),结构如图所示。
①。
②若原子A的原子坐标为(0.25,0.25,0.75),则C的原子坐标为。
③晶胞参数为a nm,则AB原子之间的距离为nm。
8.(1)、Ⅰ.元素Fe、C、卤素元素等形成的材料在工业、生活、国防中有很大的作用。请回答下列问题:基态Fe原子核外电子的空间运动状态有种,实验室常用邻二氮菲(
 )检验Fe2+ , 生成橙红色的邻二氮菲亚铁络离子,邻二氮菲中N原子参与杂化的原子轨道为。(2)、Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
)检验Fe2+ , 生成橙红色的邻二氮菲亚铁络离子,邻二氮菲中N原子参与杂化的原子轨道为。(2)、Ⅱ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。拟卤素( CN)2、( SCN)2与卤素单质结构相似、性质相近,分子中所有原子都满足8电子结构。(SCN)2对应的酸有两种,测得硫氰酸(H- S- C≡N )的沸点低于异硫氰酸(H -N=C=S),其原因是。
(3)、卤化物RbICl2在加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为 ;属于多卤素阳离子,其空间构型为。(4)、碳的一种同素异形体---石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为个。已知石墨的密度为ρg· cm-3 , C-C键键长为r cm ,阿伏加德罗常数的值为NA , 计算石墨晶体的层间距d为cm。 9. 我国中科院天津工业技术研究所,首次实现人工通过二氧化碳合成淀粉。请回答下列问题:(1)、基态碳原子的核外电子排布图为。(2)、原子中运动的电子有2种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋量子数。对于基态碳原子,其价电子自旋量子数的代数和为。(3)、结合如表所示键能数据,分析CO和N2相对活泼性并说明原因:。
9. 我国中科院天津工业技术研究所,首次实现人工通过二氧化碳合成淀粉。请回答下列问题:(1)、基态碳原子的核外电子排布图为。(2)、原子中运动的电子有2种相反的自旋状态,若一种自旋状态用+表示,与之相反的用-表示,称为电子的自旋量子数。对于基态碳原子,其价电子自旋量子数的代数和为。(3)、结合如表所示键能数据,分析CO和N2相对活泼性并说明原因:。CO
C-O
C=O
C
 O
O键能/kJ·mol-1
357.7
798.9
1071.9
N2
N-N
N=N
N≡N
键能/kJ·mol-1
154.8
418.4
941.7
(4)、CO2分子的空间构型为 , 与CO2互为等电子体,写出的结构式。(5)、一种新型Na-Fe3O4/HZSM-5多功能复合催化剂成功实现了CO2直接加氢制取高辛烷值汽油。该催化剂成分Fe3O4的晶胞如图所示。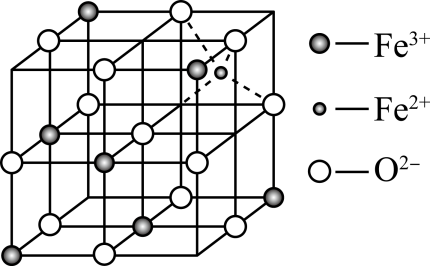
①晶胞中Fe3+处于O2-围成的空隙(填“正四面体”“正八面体”或“正十六面体”)。
②若晶胞体对角线为anm,阿伏加德罗常数为NA , 晶体的密度为g·cm-3(写出表达式)。
10. “空气变馒头不是梦”,中国科学家在国际上首次实现了到淀粉的从头合成,不依赖植物光合作用,原料只需、和电,相关成果发表在《科学》上。请回答下列问题:(1)、的空间构型为 , 其中C原子的杂化方式为。基态氧原子的最外层的成单电子和成对电子之比为。(2)、试推测(填“能”或“不能”)溶于 , 理由是。(3)、淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是(用离子方程式表示)。(4)、淀粉在一定条件下可水解成葡萄糖( ),葡萄糖分子中键角(填“>”、“<”或“=”)。 (5)、干冰的晶胞结构如下图所示,1个分子周围与其距离相等且最近的分子个数为。若干冰晶胞沿x轴投影,试在图中画出的投影位置(用“·”表示分子)。
),葡萄糖分子中键角(填“>”、“<”或“=”)。 (5)、干冰的晶胞结构如下图所示,1个分子周围与其距离相等且最近的分子个数为。若干冰晶胞沿x轴投影,试在图中画出的投影位置(用“·”表示分子)。 11. 近年,我国科学家通过热磷化法制备出了电催化分解水的催化剂Co-Fe-P和Ni-Fe-P等过渡金属磷化物,将推动电解水制氢技术的快速发展。回答下列问题:(1)、铁元素在元素周期表中的位置 , Fe3+的价电子排布式。(2)、磷的一些卤化物的熔沸点如表所示,试解释PF3、PCl3、PBr3、PI3熔沸点逐渐升高的原因
11. 近年,我国科学家通过热磷化法制备出了电催化分解水的催化剂Co-Fe-P和Ni-Fe-P等过渡金属磷化物,将推动电解水制氢技术的快速发展。回答下列问题:(1)、铁元素在元素周期表中的位置 , Fe3+的价电子排布式。(2)、磷的一些卤化物的熔沸点如表所示,试解释PF3、PCl3、PBr3、PI3熔沸点逐渐升高的原因卤化磷
熔点/K
沸点/K
PF3
121.5
171.5
PCl3
161
348.5
PBr3
233
451.2
PI3
334
573
(3)、磷酸具有很强的配位能力,PO的中心原子杂化类型为 , 写出与PO互为等电子体的一种分子(4)、钴的配合物种类很多,如[Co(NO2)(NH3)5]Cl2和[Co(NH3)4Cl2]Cl等,[Co(NO2)(NH3)5]2+的配位数是 , 其配体中的NH3的分子空间构型为;等物质的量的[Co(NO2)(NH3)5]Cl2和[Co(NH3)4Cl2]Cl分别与足量的硝酸银溶液反应,两者生成氯化银的质量比为。(5)、钴蓝晶体结构如图(a)所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,求晶体的化学式为 , 密度为g·cm-3。 12. 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:(1)、基态F原子的外围电子排布式为。(2)、N2F2(二氟氮烯)分子中,氮原子的杂化类型为sp2 , 则N2 F2的结构式为。(3)、NaHF2熔点为160℃(分解),电解可制得氟气,推测NaHF2中所含作用力的类型有。(4)、OF2主要用于火箭工程液体助燃剂,其分子的空间构型为;OF2的熔、沸点Cl2O(填“高于”或“低于”),原因是。(5)、XeF2在无机氟化物制备中有广泛的应用,其晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图中A点原子的分数坐标为( , , )。已知Xe-F键长为r pm,则B点原子的分数坐标为;晶胞中O、C间距离d=pm。
12. 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:(1)、基态F原子的外围电子排布式为。(2)、N2F2(二氟氮烯)分子中,氮原子的杂化类型为sp2 , 则N2 F2的结构式为。(3)、NaHF2熔点为160℃(分解),电解可制得氟气,推测NaHF2中所含作用力的类型有。(4)、OF2主要用于火箭工程液体助燃剂,其分子的空间构型为;OF2的熔、沸点Cl2O(填“高于”或“低于”),原因是。(5)、XeF2在无机氟化物制备中有广泛的应用,其晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图中A点原子的分数坐标为( , , )。已知Xe-F键长为r pm,则B点原子的分数坐标为;晶胞中O、C间距离d=pm。 13. 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。(1)、基态硒原子的价层电子排布式为。(2)、H2SeO3的中心原子杂化类型是: , 的立体构型是。与互为等电子体的分子有(写一种物质的化学式即可)。(3)、H2Se属于(填“极性”或“非极性”)分子;比较H2Se与H2O沸点高低,并说明原因:。(4)、硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为;若该晶胞密度为ρg·cm-3 , 硒化锌的摩尔质量为Mg·mol-1 , NA代表阿伏加德罗常数的值,则晶胞参数a为。
13. 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。(1)、基态硒原子的价层电子排布式为。(2)、H2SeO3的中心原子杂化类型是: , 的立体构型是。与互为等电子体的分子有(写一种物质的化学式即可)。(3)、H2Se属于(填“极性”或“非极性”)分子;比较H2Se与H2O沸点高低,并说明原因:。(4)、硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为;若该晶胞密度为ρg·cm-3 , 硒化锌的摩尔质量为Mg·mol-1 , NA代表阿伏加德罗常数的值,则晶胞参数a为。 14. 我国科学家构建了新型催化剂“纳米片”(Co-N-C),该“纳米片“可用于氧化SO和吸附Hg2+。回答下列问题:(1)、基态Co原子的价层电子排布式为 , N、C、Co中第一电离能最大的是(填元素符号)。(2)、在空气中SO会被氧化成SO。SO的空间构型是 , SO中S原子采用杂化。(3)、[Co(NH3)4(H2O)Cl]Cl2是钴的一种配合物,含1mol[Co(NH3)4(H2O)Cl]Cl2的溶液与足量AgNO3溶液能生成molAgCl,[Co(NH3)4(H2O)Cl]Cl2中Co2+的配位数为。(4)、氰气[(CN)2]称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则(CN)2分子中σ键、π键个数之比为。(5)、氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如图1所示。它的化学式为 , 它的硬度超过金刚石的主要原因是。
14. 我国科学家构建了新型催化剂“纳米片”(Co-N-C),该“纳米片“可用于氧化SO和吸附Hg2+。回答下列问题:(1)、基态Co原子的价层电子排布式为 , N、C、Co中第一电离能最大的是(填元素符号)。(2)、在空气中SO会被氧化成SO。SO的空间构型是 , SO中S原子采用杂化。(3)、[Co(NH3)4(H2O)Cl]Cl2是钴的一种配合物,含1mol[Co(NH3)4(H2O)Cl]Cl2的溶液与足量AgNO3溶液能生成molAgCl,[Co(NH3)4(H2O)Cl]Cl2中Co2+的配位数为。(4)、氰气[(CN)2]称为拟卤素,它的分子中每个原子最外层都达到8电子结构,则(CN)2分子中σ键、π键个数之比为。(5)、氮和碳组成的一种新型材料,硬度超过金刚石,其部分结构如图1所示。它的化学式为 , 它的硬度超过金刚石的主要原因是。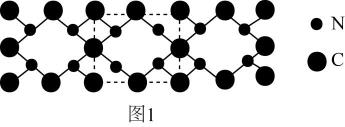 (6)、氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为( , , ),则原子3的原子分数坐标为。若氮化馆的晶体密度为ρg·cm-3 , 则晶胞中Ga-N键的键长为(用含ρ、NA的代数式表示)pm。已知NA为阿伏加德罗常数的值。
(6)、氮化镓是新型半导体材料,其晶胞结构可看作金刚石晶胞内部的碳原子被N原子代替,顶点和面心的碳原子被Ga原子代替。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。图2为沿y轴投影的氮化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为( , , ),则原子3的原子分数坐标为。若氮化馆的晶体密度为ρg·cm-3 , 则晶胞中Ga-N键的键长为(用含ρ、NA的代数式表示)pm。已知NA为阿伏加德罗常数的值。
图2
15. 近年来,我国科学家对硫及其化合物进行广泛研究。硫及化合物应用于医药、半导体、颜料、光致发光装置、太阳能电池、红外检测器、光纤维通讯等。回答下列问题:(1)、硫原子的价电子轨道表示式为。(2)、硫化钠的熔点 (填“大于”“小于”或“等于”)硫化钾的熔点,原因是。(3)、硫酸根和硫代硫酸根的结构如下图所示:
S2O的空间构型为 , 中心硫原子的杂化轨道类型为。
(4)、硫原子和氧原子可形成多种链式硫酸根离子,连二硫酸根离子、连三硫酸根离子如下图所示:
这类硫原子数可变的多硫氧合阴离子的化学式可用通式表示为(用n代表硫原子数)。
(5)、天然硫化锌以闪锌矿和纤锌矿存在,ZnS的晶体结构如下图所示,闪锌矿中Zn2+的配位数为 , 已知原子A、B的分数坐标为(0, 0, 0)和(1, 1, 1),原子C的分数坐标为。 纤锌矿晶体堆积模型为。 (6)、闪锌矿中,设晶胞边长为a, Zn2+和 S2-的离子半径分别为和 , 则Zn2+和S2-离子的空间占有率为% (列出计算表达式)。16. 过渡元素等在生产、生活和科研中都有着广泛用途和重要的研究价值。回答下列问题:(1)、基态Co原子中,核外电子占据的最高能层符号为;基态的价电子排布式为。(2)、Ag元素在元素周期表中与Cu处于相邻周期,则Ag元素在元素周期表分区中属于区。(3)、①有顺式和反式两种结构,则分子的空间构型为 (填“平面四方”或“正四面体”)形,其中心原子杂化方式推断合理的是(填标号)。
(6)、闪锌矿中,设晶胞边长为a, Zn2+和 S2-的离子半径分别为和 , 则Zn2+和S2-离子的空间占有率为% (列出计算表达式)。16. 过渡元素等在生产、生活和科研中都有着广泛用途和重要的研究价值。回答下列问题:(1)、基态Co原子中,核外电子占据的最高能层符号为;基态的价电子排布式为。(2)、Ag元素在元素周期表中与Cu处于相邻周期,则Ag元素在元素周期表分区中属于区。(3)、①有顺式和反式两种结构,则分子的空间构型为 (填“平面四方”或“正四面体”)形,其中心原子杂化方式推断合理的是(填标号)。A.sp B. C. D.
②电子亲和能反映的是元素的气态原子结合电子的难易程度。N、Cl的第一电子亲和能:NCl(填“>”或“<”)。
(4)、熔点为 , 熔点为 , 熔点更高的原因是。(5)、一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为 , z方向垂直于x、y方向,底面棱长均为anm,侧面棱长为cnm),其晶胞结构如图甲所示;晶胞中碳原子的投影位置如图乙所示。
①该钛硅碳新型材料的化学式为。
②已知该新型材料的摩尔质量为 , 密度为 , 阿伏加德罗常数的值用表示,则c的长度为nm(用含a、b、的计算式表示)。
17. 铝、铁、铜等金属在日常生活中应用广泛,钛由于其特殊的性能被誉为“未来世纪的金属”。其单质及化合物在化工、医药、材料等领域具有广泛应用。回答下列问题:(1)、基态Cu原子的价电子轨道表示式为;的空间构型为。(2)、1mol配合物中键的数目为 , 其组成元素的电负性大小顺序是。(3)、与形成配位键的能力(填“强于”或“弱于”)与形成配位键的能力,请用实验事实加以说明:。(4)、TiN具有高硬度和优良的耐磨损性,用Al部分代替TiN中Ti后可以提升耐磨性5倍以上。其晶胞结构如下图所示,掺杂Al后的晶体密度是TiN晶体的倍(精确到小数点后第2位),设原子①的原子坐标为(0,0,0),则原子②的原子坐标为 , 已知相邻的Ti-N原子距离为anm,则晶胞中原子①与②距离为nm。 18. 锰的氧化物主要有一氧化锰(MnO)、二氧化锰(MnO2)、三氧化二锰(Mn2O3)、四氧化三锰(Mn3O4)、亚锰酸酐( Mn2O5)、锰酸酐( MnO3 )和高锰酸酐(Mn2O7)。回答下列问题:(1)、基态Mn原子的核外电子排布式是。(2)、下列锰元素的不同微粒中,电离最外层一个电子所需能量最大的是____(填编号)。A、
18. 锰的氧化物主要有一氧化锰(MnO)、二氧化锰(MnO2)、三氧化二锰(Mn2O3)、四氧化三锰(Mn3O4)、亚锰酸酐( Mn2O5)、锰酸酐( MnO3 )和高锰酸酐(Mn2O7)。回答下列问题:(1)、基态Mn原子的核外电子排布式是。(2)、下列锰元素的不同微粒中,电离最外层一个电子所需能量最大的是____(填编号)。A、 B、
B、 C、
C、 D、
D、 (3)、以MnSO4为原料,六次甲基四胺为弱碱介质,通过水解氧化法可制备不同粒径的磁性纳米Mn3O4。
(3)、以MnSO4为原料,六次甲基四胺为弱碱介质,通过水解氧化法可制备不同粒径的磁性纳米Mn3O4。①的空间构型是 , 写出两种与互为等电子体的离子。
②六次甲基四胺也称乌洛托品(结构如图甲所示),其所含元素的电负性从大到小的顺序是 , 中心原子N的杂化方式是 , N原子数与σ键数目之比为。
 (4)、实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图乙所示)和NO2。
(4)、实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图乙所示)和NO2。
①该锰的氧化物中Mn的化合价为。
②请画出z方向投影图。
③已知Mn和O的离子半径分别是mpm和npm,则该晶体的空间利用率为; (列出计算式即可)。
19. 最近科研人员发现,用[Ni(cyclam)]2+(结构如图a)作电催化剂、二茂铁(结构如图c)作为牺牲电子供体,NH4PF6作为电解质和质子供体,CH3CN作溶剂,可实现有效催化还原CO2。
回答下列问题:
(1)、基态Ni原子转化为基态Ni2+失去轨道的电子;基态Fe原子核外电子排布式为。(2)、NH4PF6中NH空间构型为;N、P、F的电负性由大到小的顺序为。(3)、CH3CN分子中碳原子杂化方式为。(4)、已知3个及以上原子构成的离子团或分子中,原子有彼此平行的未参与杂化的p轨道电子,连贯重叠在一起构成π型化学键,又称为大π键,可用符号表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯中的大π键可表示为。二茂铁[(C5H5)2Fe]中五元环的大π键可表示为。(5)、[Ni (cyclam)]2+可由某些镍的化合物与cyclam 反应制得。[Ni(cyclam)]2+中,Ni2+的配位数为;cyclam可溶于水,而环十四烷不溶于水,其原因是。(6)、某镍、砷晶体结构如图所示。该晶体的密度为g·cm-3(列出计算式即可)。 20. 砷化镓(GaAs)、碲化镉(CdTe)等太阳能电池适合光电转换,可以直接把光能转化成电能。回答下列问题:(1)、元素As与N同族,预测As的氢化物分子的立体结构为 , 其基态原子最外层p轨道电子的自旋状态(填“相同”或“相反”)。(2)、元素Cd与Zn是同一副族的相邻元素,Cd的价层电子排布为4d105s2 , Cd2+的价层电子排布为。(3)、经X射线衍射实验证明在碲酸(H6TeO6)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为。(4)、Te、Se都是第ⅥA族的元素,SeF6与SF6具有相似的结构,则熔沸点SeF6SF6(填“>”或“<”或“=");二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用如图表示,已知光的波长与其能量成反比,则图中实现光响应的波长:λ1λ2(填“>”或“<”或“="),其原因是。
20. 砷化镓(GaAs)、碲化镉(CdTe)等太阳能电池适合光电转换,可以直接把光能转化成电能。回答下列问题:(1)、元素As与N同族,预测As的氢化物分子的立体结构为 , 其基态原子最外层p轨道电子的自旋状态(填“相同”或“相反”)。(2)、元素Cd与Zn是同一副族的相邻元素,Cd的价层电子排布为4d105s2 , Cd2+的价层电子排布为。(3)、经X射线衍射实验证明在碲酸(H6TeO6)分子内的6个羟基排列在碲原子的周围呈八面体结构,碲酸中碲原子的价层电子对数为。(4)、Te、Se都是第ⅥA族的元素,SeF6与SF6具有相似的结构,则熔沸点SeF6SF6(填“>”或“<”或“=");二硒键和二硫键是重要的光响应动态共价键,其光响应原理可用如图表示,已知光的波长与其能量成反比,则图中实现光响应的波长:λ1λ2(填“>”或“<”或“="),其原因是。 (5)、CdTe的晶胞属立方晶系,晶胞参数如图1所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。如原子M的坐标为(0,0,0),则原子N的坐标为。
(5)、CdTe的晶胞属立方晶系,晶胞参数如图1所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。如原子M的坐标为(0,0,0),则原子N的坐标为。
该晶胞沿其面对角线方向上的投影如图2所示,则代表Te原子的位置是(填序号),晶胞中原子6和11之间的距离为pm(用含a的代数式表示)。
21. 铁及含铁的化合物在生产生活中的应用广泛。回答下列问题:(1)、基态铁原子的核外电子排布式为。前四周期元素中,基态原子未成对电子数比铁原子多的元素有种。(2)、 是工业制硫酸的主要反应, 的VSEPR模型名称是; 分子中 键与 键的数目之比为。(3)、血红素是血红蛋白的辅基,其结构如图1所示,结构中C原子的杂化方式为 , 所含非金属原子的电负性由大到小的顺序为;所含化学键的类型有(填标号)。a.极性键 b.非极性键 c.氢键 d.配位键 e.金属键
 (4)、温度在1183K以下,纯铁晶体(甲)的晶胞结构如图2所示,温度在1183K以上,纯铁晶体(乙)的晶胞结构如图3所示,两种晶体中铁原子之间的最短距离相等,甲晶体中铁原子的配位数与乙晶体中铁原子的配位数之比为;甲晶体的晶胞边长与乙晶体的晶胞边长之比为;甲晶体的密度与乙晶体的密度之比为。22. 硼、钛、铁、铜等元素的化合物具有广泛的应用价值。回答下列问题:(1)、Ti(BH4)3(硼氢化钛)可由TiCl4和LiBH4反应制得。基态钛原子的价层电子排布图(轨道表示式)为。 的立体构型为 , B原子的杂化轨道类型为。电负性大小顺序为HB(填“>”或“<")。(2)、基态铁原子核外电子运动状态有种。Fe成为阳离子时首先失去轨道电子。FeCl3的熔点为306℃、沸点315℃,FeCl3的晶体类型为。(3)、元素Cu的一种氯化物立方晶胞结构如图所示:
(4)、温度在1183K以下,纯铁晶体(甲)的晶胞结构如图2所示,温度在1183K以上,纯铁晶体(乙)的晶胞结构如图3所示,两种晶体中铁原子之间的最短距离相等,甲晶体中铁原子的配位数与乙晶体中铁原子的配位数之比为;甲晶体的晶胞边长与乙晶体的晶胞边长之比为;甲晶体的密度与乙晶体的密度之比为。22. 硼、钛、铁、铜等元素的化合物具有广泛的应用价值。回答下列问题:(1)、Ti(BH4)3(硼氢化钛)可由TiCl4和LiBH4反应制得。基态钛原子的价层电子排布图(轨道表示式)为。 的立体构型为 , B原子的杂化轨道类型为。电负性大小顺序为HB(填“>”或“<")。(2)、基态铁原子核外电子运动状态有种。Fe成为阳离子时首先失去轨道电子。FeCl3的熔点为306℃、沸点315℃,FeCl3的晶体类型为。(3)、元素Cu的一种氯化物立方晶胞结构如图所示:
①原子坐标参数可用来表示晶胞内各原子的相对位置,图中各原子坐标参数如下:A为(0,0,0)、B为(0,1,1)、C为(1,0,0),则D原子的坐标参数为。
②该晶体中,铜、氯的微粒个数之比为。
③若晶胞边长为apm,铜元素微粒半径为bpm,氯元素微粒半径为cpm,则该晶胞的空间利用率(即晶胞中原子体积占晶胞体积的百分率)为(列出计算式)。
23. 最近,妖“镍”横行,价格飙涨。镍是一种硬而有延展性并具有铁磁性的金属,在许多领域应用广泛。回答下列问题:(1)、基态Ni原子核外电子的运动状态有种;Ni的熔点明显高于Ca,其原因是。(2)、Ni—NTA—Nangold可用于检测或定位6x组氨酸(His)或Poly—His标记的重组蛋白。Ni(Ⅱ)—NTA的结构简式如图所示。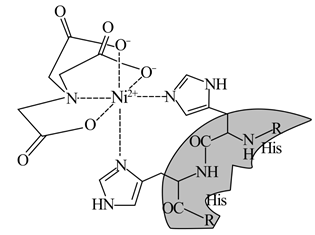
①与Ni2+配位的原子形成的空间构型为。
②配体N(CH2COO-)3中4种元素的I1从大到小的顺序为(用元素符号表示)。
③已知N……Ni存在大π键,其结构中氮原子的杂化方式为。
(3)、Ni可以形成多种氧化物,其中一种NixO晶体晶胞结构为NaCl型,由于晶体缺陷,部分Ni2+被Ni3+取代,如图所示,其结果晶体仍呈电中性。则x1(填“>”“<”或“=”)。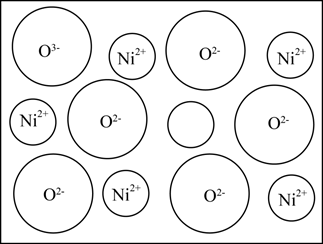 (4)、镍掺杂的稀磁半导体DMS的立方晶胞结构如图所示。已知晶体密度为dg/cm3 , 设NA为阿伏加德罗常数的值,则Ni原子与Mg原子间的距离为cm(列出计算表达式)。
(4)、镍掺杂的稀磁半导体DMS的立方晶胞结构如图所示。已知晶体密度为dg/cm3 , 设NA为阿伏加德罗常数的值,则Ni原子与Mg原子间的距离为cm(列出计算表达式)。 24. 2022年春晚节目《只此青绿》取材于宋代名画《千里江山图》,该画描绘了山清水秀的美丽景色,历经千年色彩依然,其中青色来自蓝铜矿颜料[主要成分为Cu3(CO3)2(OH)2]。请回答下列问题:(1)、基态铜原子价电子排布式为。从原子结构角度分析,第二电离能I2(Fe)与I2(Cu)的关系是I2(Fe)I2(Cu) (填“>”“<”或“=”),并解释有关原因。(2)、 的空间构型为。(3)、我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是(填元素符号),该配合物中采用sp2杂化的碳原子与sp3杂化的碳原子个数比为。
24. 2022年春晚节目《只此青绿》取材于宋代名画《千里江山图》,该画描绘了山清水秀的美丽景色,历经千年色彩依然,其中青色来自蓝铜矿颜料[主要成分为Cu3(CO3)2(OH)2]。请回答下列问题:(1)、基态铜原子价电子排布式为。从原子结构角度分析,第二电离能I2(Fe)与I2(Cu)的关系是I2(Fe)I2(Cu) (填“>”“<”或“=”),并解释有关原因。(2)、 的空间构型为。(3)、我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是(填元素符号),该配合物中采用sp2杂化的碳原子与sp3杂化的碳原子个数比为。 (4)、黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。
(4)、黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。
①Fe3+周围距离最近的S2-的个数为。
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3 , 则阿伏加德罗常数(NA)为mol-1(用a、b、ρ表示,并化成最简)。
25. 金属元素Mg、Al、Ti、Fe、Cu等在电池、储氢材料、催化剂等方面都有广泛应用。请回答下列问题:(1)、Ti(BH4)2是一种储氢材料。BH的空间构型是 , H、B、Ti的电负性由小到大的顺序为。(2)、原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用—表示,即称为电子的自旋磁量子数。对于基态Fe原子,其价电子自旋磁量子数的代数和为。(3)、Cu(NO3)2是有机催化剂,其水溶液为天蓝色。使溶液呈现天蓝色的四水合铜离子,其空间构型为平面正方形,则Cu2+的杂化轨道类型为(填标号)。A.dsp2 B.sp C.sp2 D.sp3
如图为一种Cu2+形成的配离子的结构,加热时该离子先失去的配位体是(填化学式),此时生成的配离子溶液的颜色为色。
 (4)、已知Mg、Al、O三种元素组成的晶体结构如图所示,其晶胞由4个A型小晶格和4个B型小晶格构成,其中Al3+和O2-都在小晶格内部,Mg2+部分在小晶格内部,部分在小晶格顶点。
(4)、已知Mg、Al、O三种元素组成的晶体结构如图所示,其晶胞由4个A型小晶格和4个B型小晶格构成,其中Al3+和O2-都在小晶格内部,Mg2+部分在小晶格内部,部分在小晶格顶点。
该物质的化学式为 , Mg2+的配位数为 , 两个Mg2+之间最近的距离是pm。
26. 铁、铜和镁是生命必需的元素,也是人类使用广泛的金属,铁和铜及其重要化合物在生产中有着重要的应用。回答下列问题:(1)、某元素X与铜同周期,基态X原子是该周期基态原子中未成对电子最多的,其原子结构示意图为。(2)、Fe2+变为基态铁原子时所得的电子填充到能级。(3)、新制备的Cu(OH)2可将乙醛氧化成乙酸(CH3COOH),而自身还原成Cu2O。1个乙酸分子中共平面的原子最多为个。图所示的Cu2O晶胞中,铜周围紧邻且等距的氧有个,已知其晶胞密度为bg/cm3 , 则该晶胞棱长为pm(设NA为阿伏加德罗常数的值)。 (4)、叶绿素的结构示意如图所示。
(4)、叶绿素的结构示意如图所示。
①该结构中包含的作用力有(用字母填空)。
a.离子键 b.σ键 c.π键 d.分子间作用力
②其中碳原子的杂化类型为 , 碳、氮、氧三种元素的电负性由大到小的顺序是。元素As与N同族预测As的简单氢化物的VSEPR模型为 , 其键角109º28´(填“大于”、“小于”或“等于”)原因是。
27. 可从铜转炉烟灰(主要成分为ZnO)和闪锌矿(主要成分是ZnS)得到锌。(1)、Zn2+基态核外电子排布式为。(2)、铜转炉烟灰(主要成分为ZnO),加入氯化铵和水,浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式。氨分子的VSEPR模型为 , 中心原子的杂化轨道类型为。(3)、CuSO4能活化ZnS,地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS,慢慢转变为铜蓝(CuS),试推测其原因是。(4)、ZnS的晶胞结构如图所示:
在ZnS的晶体中与S2-离子距离相等且最近的Zn2+的个数是。其晶胞边长为540.0pm,密度为(列式并计算)。
(5)、取mg活性氧化锌样品,预处理后配成待测液,加入指示剂3~4滴,再加入适量六亚甲基四胺,用amol·L-1EDTA标准液进行滴定,消耗标准液VmL。已知:与1.0mLEDTA标准液[c(EDTA)=1.000mol·L-1]相当的以克表示的氧化锌质量为0.08139g,则样品中氧化锌的质量分数为(用代数式表示),若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果。28. Be、Mg、Ca均为ⅡA族元素,这些元素及其化合物在人类生产、生活和科学研究中具有广泛的用途。回答下列问题:(1)、金属单质的熔点:MgCa(填“>”或“<”),原因是;最高价氧化物对应水化物的碱性:(填“>”或“<”)。(2)、氯化铍晶体易吸湿、水解、升华,可溶于有机溶剂。一定条件下有下列存在形式:
氯化铍晶体的晶体类型是 , 甲的空间构型是 , 乙中Be的杂化轨道类型是 , 从化学键角度分析形成丙的原因:。
(3)、是某些太阳能薄膜电池的材料,有人认为这种太阳能电池将取代硅基太阳能电池的统治地位。下图所示为的晶胞结构:
1、3号O的坐标分别为、(用分数坐标表示),与Ca等距离且最近的O有个,若的密度为 , 则阿伏加德罗常数=(列出计算式)。
29. 近年来我国在高温超导材料的研究取得了重大突破,高温超导体仅出现在共价性很强的氧化物中,例如带有直线形的Cu-O-Cu链节的网格层对超导性有重要的作用。回答下列问题:(1)、基态Cu原子核外电子排布式为。(2)、氧与其同周期且相邻两元素的第一电离能由大到小的顺序为。(3)、氧的常见氢化物有两种,分别为H2O和H2O2。其中H2O的VSEPR模型为;H2O2中氧原子的杂化方式为。(4)、硫酸铜溶于水后形成的水合铜离子的结构式为 , 向硫酸铜溶液中逐滴加入氨水直至过量,观察到的现象为 , 所得结论:与Cu2+形成配位键的能力H2O(填“强于”或“弱于”)NH3(5)、由Y、Ba、Cu、O四种元素构成的高温超导材料晶胞结构如图甲,图乙为沿z轴的投影图;其中CuO2网格层如图丙。
已知:网格层之间相互垂直或平行;z轴方向上的晶胞参数为cpm。
①该高温超导材料的化学式为。
②若阿伏加德罗常数的值为NA , 则晶体的密度为g·cm-3(用含a、b、c和NA的表达式表示)。
30. 聚合物锂离子电池具有超薄化特征,适用于多种设备,电极材料涵盖、、、等物质。(1)、磷酸为磷的最高价含氧酸,其空间结构如图:
①键角大小比较:(填“大于”“等于”或“小于”)。
②纯净的磷酸黏度极大,随温度升高黏度迅速下降,原因是。
(2)、聚合物锂离子电池工作时,沿聚乙二醇分子中的碳氧链迁移,过程如图所示(图中阴离子未画出)。
①迁移过程中与聚乙二醇分子中O原子间的作用力为(填标号)。
a.分子间作用力 b.离子键 c.共价键
②的阴离子的空间构型为;基态As原子的最高能级组轨道排布式为。
(3)、二茂镍 是具有导电性的有机配合物。镍在周期表中的位置是(填写对应周期、族)。x个原子共用y个电子可表示为 , 则环戊二烯离子中的大键可表示为。 (4)、图1为NiO晶胞,与距离最近的有个。
是具有导电性的有机配合物。镍在周期表中的位置是(填写对应周期、族)。x个原子共用y个电子可表示为 , 则环戊二烯离子中的大键可表示为。 (4)、图1为NiO晶胞,与距离最近的有个。
一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为作密置单层排列,填充其中(如图2),该“单分子层”面积密度为 , 则的半径为nm。(用m、表示)
31. 2020年12月17日凌晨1时59分,“嫦娥五号”首次实现了我国地外天体采样返回,标志着我国航天事业迈出了一大步。带回的月壤中包含了H、O、N、Al、S、Cd、Zn、Ti、Cu、Au、Cr等多种元素。回答下列问题:(1)、锌(Zn)、镉(Cd)位于同一副族相邻周期,Cd的原子序数更大,则基态Cd原子的价电子轨道表示式(电子排布图)为。(2)、S与O可形成多种微粒,其中SO的空间构型为;液态SO3冷却到289.8K时,能得到一种螺旋状单链结构的固体,其结构如图所示,此固态SO3中S原子的杂化轨道类型是 。 (3)、重铬酸铵为桔黄色单斜结晶,常用作有机合成催化剂,Cr2O的结构如图所示。则1mol重铬酸铵中含σ键与π键个数比为。
(3)、重铬酸铵为桔黄色单斜结晶,常用作有机合成催化剂,Cr2O的结构如图所示。则1mol重铬酸铵中含σ键与π键个数比为。 (4)、α—Al2O3是“嫦娥五号”中用到的一种耐火材料,具有熔点高(2054℃)、硬度大的特点,主要原因为。(5)、一种铜金合金具有储氢功能,其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为。该储氢材料储氢时,氢分子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与ZnS的结构相似(如图),该晶体储氢后的化学式为。
(4)、α—Al2O3是“嫦娥五号”中用到的一种耐火材料,具有熔点高(2054℃)、硬度大的特点,主要原因为。(5)、一种铜金合金具有储氢功能,其晶体为面心立方最密堆积结构,晶胞中Cu原子处于面心,Au原子处于顶点,则Au原子的配位数为。该储氢材料储氢时,氢分子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与ZnS的结构相似(如图),该晶体储氢后的化学式为。 (6)、“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),已知该结构单元底面(正六边形)边长为anm,该合金的密度为ρg·cm-3 , 则高为h=nm(列出计算式,NA为阿伏加德罗常数的值)。
(6)、“嫦娥五号”某核心部件主要成分为纳米钛铝合金,其结构单元如图所示(Al、Ti原子各有一个原子在结构单元内部),已知该结构单元底面(正六边形)边长为anm,该合金的密度为ρg·cm-3 , 则高为h=nm(列出计算式,NA为阿伏加德罗常数的值)。 32. Zn2+、三乙撑二胺和对苯二甲酸根离子可形成晶体M,其晶胞示意图如下。
32. Zn2+、三乙撑二胺和对苯二甲酸根离子可形成晶体M,其晶胞示意图如下。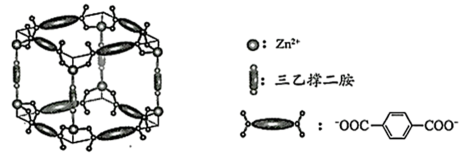 (1)、 Zn2+的价层电子排布式是。(2)、C、O、N的电负性从大到小的顺序是。(3)、三乙撑二胺(
(1)、 Zn2+的价层电子排布式是。(2)、C、O、N的电负性从大到小的顺序是。(3)、三乙撑二胺(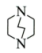 )与Zn2+能形成配位键的原因是。 (4)、在晶体M每个空腔中装入一个顺式偶氮苯分子后形成晶体M1 , 晶胞示意图如图。一定条件下随着偶氮苯顺反结构的变化,晶体骨架发生畸变,晶体在M1和M2两种结构之间相互转化,可以吸收和释放N2 , 被称为“会呼吸”的晶体。
)与Zn2+能形成配位键的原因是。 (4)、在晶体M每个空腔中装入一个顺式偶氮苯分子后形成晶体M1 , 晶胞示意图如图。一定条件下随着偶氮苯顺反结构的变化,晶体骨架发生畸变,晶体在M1和M2两种结构之间相互转化,可以吸收和释放N2 , 被称为“会呼吸”的晶体。
晶体
装载分子
晶胞中Zn2+个数
晶胞体积/cm3
M1
顺式偶氮苯
x
M2
反式偶氮苯
4
资料:ⅰ.
ⅱ.M1和M2相互转化时,Zn2+的配体和配体数均不变
①N2的电子式是。
②偶氮苯(
 )中N的杂化轨道类型是。偶氮苯存在顺反异构的原因是分子中两个氮原子间存在(填“σ键”或“π键”)。
)中N的杂化轨道类型是。偶氮苯存在顺反异构的原因是分子中两个氮原子间存在(填“σ键”或“π键”)。③x=。
④晶胞密度小则晶体内部的空隙大。能让“会呼吸”的晶体吸收N2的条件是光照射。
33. 中科院大连物化所成功利用具有尖晶石结构的Co3O4电催化剂电解水。(1)、Co在周期表中的位置是 , 基态Co的电子占据的最高能层符号为。(2)、钴盐引发动物中毒时,通常可以用EDTA(结构如图)解毒。其中,N的杂化方式均为 , N的I1(第一电离能)大于O的I1 , 其原因是;自由基是指含单电子的基团,1mol -COOH(羧基自由基)中存在mol σ键和mol π键。 (3)、EDTA可以由乙二胺与甲醛、氰化钠间接得到。离子化合物氰化钠的晶体类型为 , 甲醛分子的空间构型为。(4)、Co3O4晶体中O作面心立方最密堆积(如图),Co随机填充在晶胞中O构成的8个四面体空隙和4个八面体空隙中,则Co的配位数分别为 , Co总的空隙填充率为 , 如果晶胞边长为a nm,Co3O4的摩尔质量为M g/mol,NA为阿伏加德罗常数的值,则Co3O4的晶体密度为g/cm3(列出计算式)。
(3)、EDTA可以由乙二胺与甲醛、氰化钠间接得到。离子化合物氰化钠的晶体类型为 , 甲醛分子的空间构型为。(4)、Co3O4晶体中O作面心立方最密堆积(如图),Co随机填充在晶胞中O构成的8个四面体空隙和4个八面体空隙中,则Co的配位数分别为 , Co总的空隙填充率为 , 如果晶胞边长为a nm,Co3O4的摩尔质量为M g/mol,NA为阿伏加德罗常数的值,则Co3O4的晶体密度为g/cm3(列出计算式)。 34. 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
34. 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
回答下列问题:
(1)、基态铝原子的核外电子排布式为。(2)、基态氮原子的价层电子排布图为____(填编号)。A、 B、
B、 C、
C、 D、
D、 (3)、化合物I中碳原子的杂化轨道类型为 , 化合物II中阳离子的空间构型为。(4)、化合物III中O、F、S电负性由大到小的顺序为。(5)、传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是。(6)、铝离子电池的其中一种正极材料为AlMn2O4 , 其晶胞中铝原子的骨架如图所示。
(3)、化合物I中碳原子的杂化轨道类型为 , 化合物II中阳离子的空间构型为。(4)、化合物III中O、F、S电负性由大到小的顺序为。(5)、传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是。(6)、铝离子电池的其中一种正极材料为AlMn2O4 , 其晶胞中铝原子的骨架如图所示。
①晶体中与Al距离最近的Al的个数为。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为( , , ),原子2的坐标为( , , ),则原子3的坐标为。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA , 则晶体的密度为g·cm-3(列出计算式)。
35. 推广磷酸亚铁锂电池的新能源汽车对减少二氧化碳排放和大气污染具有重要意义。工业上用FeCl3、NH4H2PO4、LiCl及苯胺( )为原料制磷酸亚铁锂材料。
)为原料制磷酸亚铁锂材料。回答下列问题:
(1)、基态铁原子核外电子运动状态有种;基态Fe3+较基态Fe2+稳定的原因是。(2)、在NH4H2PO4中的N、P、O三种元素的电负性由大到小的顺序是;NH的空间构型为;H2PO中P原子的杂化轨道类型为。(3)、1mol 中含有molσ键;苯胺水溶性大于苯的主要原因是。 (4)、构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。
中含有molσ键;苯胺水溶性大于苯的主要原因是。 (4)、构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。
①石墨的硬度小、熔沸点高的原因分别是。
②如图晶体的化学式为;该晶体中最近的两个碳原子核间距离为142pm,石墨烯层间距离为335pm,则该晶体的密度为g•cm-3(用NA表示阿伏加德罗常数,列式即可)。