高考二轮复习知识点:键能、键长、键角及其应用1
试卷更新日期:2023-07-31 类型:二轮复习
一、选择题
-
1. 下列事实不能通过比较氟元素和氯元素的电负性进行解释的是( )A、键的键能小于键的键能 B、三氟乙酸的大于三氯乙酸的 C、氟化氢分子的极性强于氯化氢分子的极性 D、气态氟化氢中存在 , 而气态氯化氢中是分子2. 价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是A、和的VSEPR模型均为四面体 B、和的空间构型均为平面三角形 C、和均为非极性分子 D、与的键角相等3. 由键能数据大小,不能解释下列事实的是( )
化学键
键能/
411
318
799
358
452
346
222
A、稳定性: B、键长: C、熔点: D、硬度:金刚石>晶体硅4. 植物对氮元素的吸收过程如下,下列说法错误的是A、NH3中的键角小于中的键角 B、、中N的杂化方式不同 C、P原子间难形成三键而N原子间可以,是因为P的原子半径大于N,难形成P-Pπ键 D、当有9.2g生成时,过程②转移的电子为1.2mol5. 下列事实不能用键能的大小来解释的是( )A、N2的化学性质稳定 B、H2O比H2S沸点高 C、HF、HCl、HBr的稳定性逐渐减弱 D、金刚石比晶体硅的熔点高6. 硫化氢可与氧气发生反应:;生成的硫单质有多种组成形式,如: 、:
、: (冠状)等。下列有关说法中正确的是 A、熔点 B、键角 C、、中S原子均为杂化 D、生成的硫单质为共价晶体7. 对下列事实的解释错误的是
(冠状)等。下列有关说法中正确的是 A、熔点 B、键角 C、、中S原子均为杂化 D、生成的硫单质为共价晶体7. 对下列事实的解释错误的是选项
事实
解释
A
稳定性:HF>HI
HF分子间存在氢键,HI分子间不存在氢键
B
键角:NH>H2O
中心原子均采取sp3杂化,孤电子对有较大的斥力
C
熔点:石英>干冰
石英是共价晶体,干冰是分子晶体;共价键比分子间作用力强
D
酸性:CF3COOH>CCl3COOH
F的电负性大于Cl,F-C的极性大于Cl-C,使F3C-的极性大于Cl3C-的极性
A、A B、B C、C D、D8. 硒()在医药、催化、材料等领域有广泛应用,乙烷硒啉(Ethaselen)是一种抗癌新药,其结构式如下图所示。关于硒及其化合物,下列说法错误的是 A、Se原子在周期表中位于p区 B、乙烷硒啉分子中,C原子的杂化类型有、 C、乙烷硒啉分子中有5种不同化学环境的氢原子 D、键角大小:气态9. 硫及其化合物有着广泛的作用。硫元素具有多种化合价,在一定条件下能发生相互转化。不同温度下硫单质的状态和分子结构不同,环状分子的结构为
A、Se原子在周期表中位于p区 B、乙烷硒啉分子中,C原子的杂化类型有、 C、乙烷硒啉分子中有5种不同化学环境的氢原子 D、键角大小:气态9. 硫及其化合物有着广泛的作用。硫元素具有多种化合价,在一定条件下能发生相互转化。不同温度下硫单质的状态和分子结构不同,环状分子的结构为 。合理应用和处理含硫的化合物,在生产生活中有重要意义。下列有关说法正确的是 A、的空间构型为正四面体 B、是共价晶体 C、和中的键角相等 D、的沸点高于10. 叠氮化铅用作水下引爆剂,可由以下方法制得
。合理应用和处理含硫的化合物,在生产生活中有重要意义。下列有关说法正确的是 A、的空间构型为正四面体 B、是共价晶体 C、和中的键角相等 D、的沸点高于10. 叠氮化铅用作水下引爆剂,可由以下方法制得I:;
Ⅱ:。下列说法正确的是
A、的键角大于的键角 B、为非极性分子 C、反应I中氧化剂和还原剂的物质的量之比可能为 D、反应I每消耗钠,共转移电子11. 工业上制备粗硅的反应为 , 若C过量,还会生成SiC.下列叙述错误的是A、1个CO分子内只含有1个键和2个键 B、键能:C-H>Si-H,因此甲硅烷没有甲烷稳定 C、键长:C-Si<Si-Si,因此熔点:SiC>Si D、键长:C-C<Si-Si,因此C的还原性大于Si的还原性12. Cu2+可以与缩二脲(H2NCONHCONH2)形成紫色配离子,结构如图所示。下列说法正确的是 A、该配离子需在碱性条件下制备 B、该配离子中碳原子和氮原子都采取sp3杂化 C、该配离子中配位键强度:Cu—N<Cu—O D、1mol该配离子中含有的配位键数目为6NA13. 我国科研工作者利用冷冻透射电子显微镜同步辐射等技术,在还原氧化石墨烯膜上直接观察到了自然环境下生成的某二维晶体,其结构如图所示。下列说法正确的是
A、该配离子需在碱性条件下制备 B、该配离子中碳原子和氮原子都采取sp3杂化 C、该配离子中配位键强度:Cu—N<Cu—O D、1mol该配离子中含有的配位键数目为6NA13. 我国科研工作者利用冷冻透射电子显微镜同步辐射等技术,在还原氧化石墨烯膜上直接观察到了自然环境下生成的某二维晶体,其结构如图所示。下列说法正确的是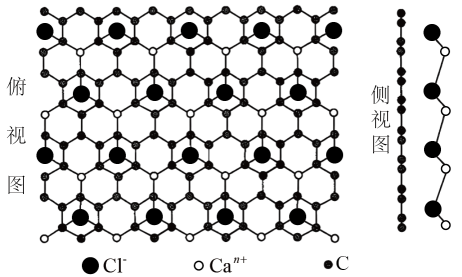 A、该二维晶体的化学式为CaCl2 B、Ca-Cl-Ca的键角为60° C、Can+和Cl-的配位数均为3 D、该晶体可由钙在氯气中燃烧制得14. 下列关于HF、、的说法错误的是( )A、HF、、都是由极性键形成的极性分子 B、HF、、中共价键键长逐渐增大,键能逐渐减小 C、、的中心原子杂化方式相同 D、比HF的沸点高是由于HF分子间不能形成氢键15. 下列叙述正确的是( )A、酸性: B、键能: C、第一电离能:O>N D、键角:16. 煤和石油是重要的能源物质,一方面对其开发利用推动人类社会快速进入工业文明时代,另一方面化石燃料燃烧产生带来的环境问题日益凸显,“碳中和”已成为新时代绿色发展理念。煤经汽化、液化后再利用,可提高效能、降低污染,其常见原理为:
A、该二维晶体的化学式为CaCl2 B、Ca-Cl-Ca的键角为60° C、Can+和Cl-的配位数均为3 D、该晶体可由钙在氯气中燃烧制得14. 下列关于HF、、的说法错误的是( )A、HF、、都是由极性键形成的极性分子 B、HF、、中共价键键长逐渐增大,键能逐渐减小 C、、的中心原子杂化方式相同 D、比HF的沸点高是由于HF分子间不能形成氢键15. 下列叙述正确的是( )A、酸性: B、键能: C、第一电离能:O>N D、键角:16. 煤和石油是重要的能源物质,一方面对其开发利用推动人类社会快速进入工业文明时代,另一方面化石燃料燃烧产生带来的环境问题日益凸显,“碳中和”已成为新时代绿色发展理念。煤经汽化、液化后再利用,可提高效能、降低污染,其常见原理为:等产物在化工生产中都有广泛用途。下列有关的说法正确的是( )
A、中的键角比中的大 B、的水溶液不能导电 C、的空间构型为平面正三角形 D、和形成的中有6个配位键17. (CH3NH3)PbI3是钙钛矿太阳能电池的重要吸光材料,其晶胞结构如图1所示,Walsh提出H2O降解(CH3NH3)PbI3的机理如图2所示。
下列说法错误的是( )
A、H3O+的键角小于H2O的键角 B、1个(CH3NH3)PbI3晶胞含有3个I- C、机理中的反应均为非氧化还原反应 D、H2O可与CH3NH反应生成H3O+和CH3NH218. 乙腈(CH3CN)在酸性条件水解,CH3CN+H++2H2O→CH3COOH+NH。下列说法错误的是( )A、CH3CN、CH3COOH都是极性分子 B、键角:NH<NH3<NH C、CH3COOH的酸性比ClCH2COOH的弱 D、反应中部分碳原子的杂化方式发生了改变19. 工业上用CH3OH与H2O重整生产原料气H2 , 并有少量的CO、CH3OCH3等副产物。CO会使催化剂中毒,可用CH3COO[Cu(NH3)2]溶液吸收。下列说法正确的是( )A、CH3OCH3是非极性分子 B、CH3COO[Cu(NH3)2]中N—H键角大于NH3分子中N—H键角 C、CH3OH和CH3OCH3分子之间均只存在范德华力 D、CH3COO[Cu(NH3)2]中C原子的杂化方式都为sp320. 下列有关 、 、 、 的说法正确的是( )A、 和 中的键角 前者大 B、 和 的空间构型相同 C、 和 中N原子的杂化方式相同 D、 与 形成的 中,提供孤电子对形成配位键的是二、多选题
-
21. 已知 , 的酸性比强。下列有关说法正确的是( )A、HCl的电子式为
 B、Cl-Cl键的键长比I-I键短
C、分子中只有σ键
D、的酸性比强
22. 下列说法正确的是( )A、标准状况下,HF呈液态,NH3呈气态,原因是HF分子间存在氢键,而NH3分子间只存在范德华力 B、H2S的分解温度高于H2Se,原因是H—S键的键能大于H-Se键 C、用浓氨水可以除去Mg(OH)2中的少量Cu(OH)2 , 原因是Cu(OH)2与NH3形成较稳定的[Cu(NH3)4]2+ D、北京冬奥会采用CO2作制冷剂,原因是断裂共价键需要吸收大量的热量23. Beckmann反应是肟指在一定条件下生成酰胺的反应,机理中与羟基处于反位的基团迁移到缺电子的氢原子上,具体反应历程如图所示。
B、Cl-Cl键的键长比I-I键短
C、分子中只有σ键
D、的酸性比强
22. 下列说法正确的是( )A、标准状况下,HF呈液态,NH3呈气态,原因是HF分子间存在氢键,而NH3分子间只存在范德华力 B、H2S的分解温度高于H2Se,原因是H—S键的键能大于H-Se键 C、用浓氨水可以除去Mg(OH)2中的少量Cu(OH)2 , 原因是Cu(OH)2与NH3形成较稳定的[Cu(NH3)4]2+ D、北京冬奥会采用CO2作制冷剂,原因是断裂共价键需要吸收大量的热量23. Beckmann反应是肟指在一定条件下生成酰胺的反应,机理中与羟基处于反位的基团迁移到缺电子的氢原子上,具体反应历程如图所示。
已知:R、R′代表烷基。
下列说法不正确的是( )
A、H+在该反应过程中作催化剂 B、N—O—H键角:物质Ⅰ>物质Ⅱ C、物质Ⅲ→物质Ⅳ有配位键的形成 D、 发生上述反应生成
发生上述反应生成
三、非选择题
-
24. 工业中可利用生产钛白的副产物和硫铁矿联合制备铁精粉和硫酸,实现能源及资源的有效利用。(1)、结构示意图如图1。
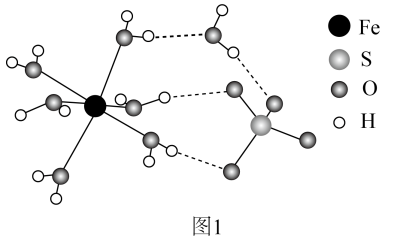
①的价层电子排布式为。
②中O和中S均为杂化,比较中键角和中键角的大小并解释原因。
③中与与的作用力类型分别是。
(2)、晶体的晶胞形状为立方体,边长为 , 结构如图2。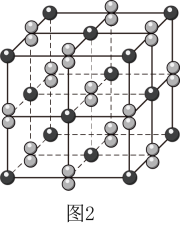
①距离最近的阴离子有个。
②的摩尔质量为 , 阿伏加德罗常数为。
该晶体的密度为。
(3)、加热脱水后生成 , 再与在氧气中掺烧可联合制备铁精粉和硫酸。分解和在氧气中燃烧的能量示意图如图3。利用作为分解的燃料,从能源及资源利用的角度说明该工艺的优点。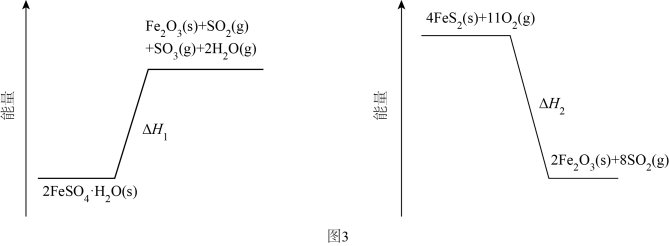 25. 铁及其化合物在生产、生活中有重要应用。回答下列问题:(1)、基态Fe3+的价电子排布式为。(2)、某铁的配合物结构如图1所示,可由(CH3)3SiCl与K[Fe(C5H5)(CO)2CO2]混合加热制得。
25. 铁及其化合物在生产、生活中有重要应用。回答下列问题:(1)、基态Fe3+的价电子排布式为。(2)、某铁的配合物结构如图1所示,可由(CH3)3SiCl与K[Fe(C5H5)(CO)2CO2]混合加热制得。
①在(CH3)3SiCl、(CH3)3SiF、(CH3)4Si中,C-Si-C键角最大的是 , 原因是。
②C5H表示环戊二烯负离子,已知分子中的大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π),则C5H中的大π键应表示为。
③该铁的配合物中碳原子的杂化方式共有种。
(3)、普鲁士蓝晶体属立方晶系,晶胞棱长为apm。铁-氰骨架组成小立方体,Fe粒子在顶点,CN-在棱上,两端均与Fe相连,立方体中心空隙可容纳K+ , 如图2所示(CN-在图中省略)。
①普鲁士蓝中Fe2+与Fe3+个数之比为;该晶胞的化学式为。
②若所有铁粒子为等径小球,则K+与Fe2+之间最近距离为pm;该晶体的密度为g•cm-3(阿伏加德罗常数为NA)。
26. 锂-磷酸氧铜电池正极的活性物质是 , 可通过下列反应制备:(1)、基态Cu的价电子排布式:。(2)、试从物质结构角度解释分子中键角小于分子中键角的原因:。(3)、在硫酸铜溶液中加入过量氨水,生成配离子 , 则1mol该配离子中含有键的数目为。(4)、中P原子的杂化方式为 , 试从物质结构角度解释晶体熔点高于的原因:。(5)、砷与氮同主族,最近合成的一种含砷的铁基超导材料 , 在低温高压下能显示出独特的电子性质,晶胞结构如图所示,该材料的化学式为。 27. 氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi),在性质上表现出从典型的非金属元素到典型的金属元素的一个完整的过渡。(1)、下列氮原子的能量最低的是____。A、
27. 氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi),在性质上表现出从典型的非金属元素到典型的金属元素的一个完整的过渡。(1)、下列氮原子的能量最低的是____。A、 B、
B、 C、
C、 D、
D、 (2)、①氮族元素简单氢化物的键角NH3>PH3>AsH3 , 其原因是。
(2)、①氮族元素简单氢化物的键角NH3>PH3>AsH3 , 其原因是。②南开大学某课题组成功合成了无机二茂铁类似物[Fe(η4- P4)2]2-。环状是芳香性π配体,P的杂化方式是 ,中的大π键应表示为(分子中的大π键可用符号表示,其中m代表形成大π键的原子数,n代表形成大π键的电子数)
 (3)、雌黄的分子式为As2S3 , 1个As2S3分子中孤电子对数目为。(4)、天津理工大学科研团队制备出一种智能离子交换剂,由平行堆积的一维链阴离子(部分结构如下图)和K+阳离子组成,含有n个最简单元的阴离子可表示为。
(3)、雌黄的分子式为As2S3 , 1个As2S3分子中孤电子对数目为。(4)、天津理工大学科研团队制备出一种智能离子交换剂,由平行堆积的一维链阴离子(部分结构如下图)和K+阳离子组成,含有n个最简单元的阴离子可表示为。 (5)、①基态铋原子的价电子排布式为。
(5)、①基态铋原子的价电子排布式为。②铋的一种氧化物的立方晶胞结构如图所示,已知最近的两个铋离子之间的距离为a pm,阿伏加德罗常数为NA , 则该晶体的密度为g·cm-3(列出计算式即可)。
 28. 上海交大郑浩、贾金锋教授,利用低温强磁场扫描隧道显微镜在体系中成功产生并探测到分段费米面,发表于《Science》杂志。回答下列问题:(1)、Bi与N、P同主族。基态Bi原子的价层电子排布式为;三者简单氢化物的还原性最强的是(填化学式)。(2)、Se、Te与O同主族,Bi、Te、Se三种元素的电负性由大到小的顺序为 , 中心原子的杂化方式为 , Se与O分别与H形成的简单氢化物键角较大的是(填化学式)。(3)、金属铌原子价电子构型为 , 其盐六氟铌酸铵是重要工业原料,结构如图。该盐的阴离子中含有的化学键为____(填标号)。
28. 上海交大郑浩、贾金锋教授,利用低温强磁场扫描隧道显微镜在体系中成功产生并探测到分段费米面,发表于《Science》杂志。回答下列问题:(1)、Bi与N、P同主族。基态Bi原子的价层电子排布式为;三者简单氢化物的还原性最强的是(填化学式)。(2)、Se、Te与O同主族,Bi、Te、Se三种元素的电负性由大到小的顺序为 , 中心原子的杂化方式为 , Se与O分别与H形成的简单氢化物键角较大的是(填化学式)。(3)、金属铌原子价电子构型为 , 其盐六氟铌酸铵是重要工业原料,结构如图。该盐的阴离子中含有的化学键为____(填标号)。 A、键 B、键 C、金属键 D、配位键 E、离子键(4)、硒化锌是制作高功率激光器的最佳光学材料,其晶胞结构可看作是金刚石晶胞内部的碳原子被Se原子代替,顶点和面心的碳原子被Zn原子代替。如图为沿y轴投影的硒化锌晶胞中所有原子的分布图。与Zn最近的Se原子构成的立体结构为;若原子1的分数坐标为(0.75,0.25,0.25),则原子2的分数坐标为;若硒化锌的晶体密度为 , 阿伏加德罗常数的值为 , 则晶胞中Se和Zn的最近距离为pm(用代数式表示)。
A、键 B、键 C、金属键 D、配位键 E、离子键(4)、硒化锌是制作高功率激光器的最佳光学材料,其晶胞结构可看作是金刚石晶胞内部的碳原子被Se原子代替,顶点和面心的碳原子被Zn原子代替。如图为沿y轴投影的硒化锌晶胞中所有原子的分布图。与Zn最近的Se原子构成的立体结构为;若原子1的分数坐标为(0.75,0.25,0.25),则原子2的分数坐标为;若硒化锌的晶体密度为 , 阿伏加德罗常数的值为 , 则晶胞中Se和Zn的最近距离为pm(用代数式表示)。 29. 我国科学家发现AgCrS2(AMX2家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:(1)、一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用和表示,称为电子的自旋磁量子数,则基态硫原子核外最多有个电子顺时针旋转。基态铬原子自旋磁量子数的代数和为。(2)、①的电负性由大到小的顺序为(填元素符号)。
29. 我国科学家发现AgCrS2(AMX2家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:(1)、一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用和表示,称为电子的自旋磁量子数,则基态硫原子核外最多有个电子顺时针旋转。基态铬原子自旋磁量子数的代数和为。(2)、①的电负性由大到小的顺序为(填元素符号)。②科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。SeO的空间构型为 , TeO中碲原子的杂化类型是。
③H2O、H2S、H2Se、H2Te的键角依次(填“变大”、“变小”或“不变”)。
(3)、配合物[Cr(OH)3(H2O)en](en为H2NCH2CH2NH2)中(Cr与O、N均形成了配位键),H2O形成[[Cr(OH)3(H2O)en])]后,H-O-H键角将(填“变大”、“变小”或“不变”)。(4)、Cu2S呈黑色或灰黑色,已知:晶胞中S2-的位置如图1所示,Cu+位于S2-所构成的四面体中心,晶胞的侧视图如图2所示。
Cu+填充了晶胞中四面体空隙的百分率是 , S2-配位数为。已知图1中A原子的原子分数坐标为(0,0,0),则与A原子距离最近的Cu+的原子分数坐标为。若晶胞参数a nm,晶体的密度为d g·cm-3 , 则阿伏加德罗常数的值为(用含a和d的式子表示)。
30. 氢键对生命活动具有重要意义。DNA中四种碱基间的配对方式如图。(~代表糖苷键)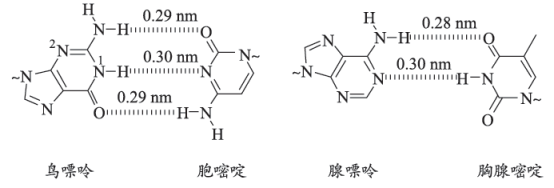 (1)、基态N的核外电子排布式为。(2)、碱基中的—NH2具有一定的碱性,可以结合H+形成—NH , 从结构角度解释可以结合的原因:。(3)、鸟嘌呤是一种常见的碱基。
(1)、基态N的核外电子排布式为。(2)、碱基中的—NH2具有一定的碱性,可以结合H+形成—NH , 从结构角度解释可以结合的原因:。(3)、鸟嘌呤是一种常见的碱基。①鸟嘌呤中2号N的杂化类型为。
②鸟嘌呤中N—H键的平均键长。(填“大于”“小于”或“等于”)0.29nm。
(4)、氢键在DNA复制过程中起重要作用①碱基中,O、N能与H形成氢键而C不能,原因是。
②下列说法正确的是(填序号)。
a.氢键的强度较小,在DNA解旋和复制时容易断裂和形成
b.鸟嘌呤与胞嘧啶之间的相互作用比腺嘌呤与胸腺嘧啶之间的更强
c.碱基配对时,一个H可以同时与多个原子形成氢键
(5)、一定条件下鸟嘌呤会发生异构化,其1号N上的H会转移到O上形成-OH。①鸟嘌呤异构化后的结构简式为。
②鸟嘌呤异构化后最有可能配对的嘧啶碱基是。。
31. 2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。(1)、基态钛原子的py原子轨道上的电子数为个。 与钛同周期的第ⅡA族和ⅢA族两种元素中第一电离能较大的是 (写 元素符号)。(2)、Ti的配合物有多种。在Ti(CO)6、T(H2O) 和TiF 三种微粒的配体中,所含原子电负性由大到小排序后,排第3位的元素是(写元素符号), Ti(H2O) 中∠H-O-H(填大于、小于或等于)单个水分子中∠H-O-H,原因为 ; Ti(NO3)4的球棍结构如图,Ti 的配位数是 , N原子的杂化方式为 , 与NO 互为等电子体的分子为 (写分子式) (3)、钛白粉学名为二氧化钛,它是一种染料及颜料,其化学式为TiO2 , 如图为TiO2的晶胞结构图,回答:已知微粒1、2的坐标分别为(0,0, 0)和(0.31, 0.31, 0), 则微粒3的坐标为 ; 设阿伏加德罗常数的值为NA , TiO2的密度为g·cm-3(列出计算式)。
(3)、钛白粉学名为二氧化钛,它是一种染料及颜料,其化学式为TiO2 , 如图为TiO2的晶胞结构图,回答:已知微粒1、2的坐标分别为(0,0, 0)和(0.31, 0.31, 0), 则微粒3的坐标为 ; 设阿伏加德罗常数的值为NA , TiO2的密度为g·cm-3(列出计算式)。 32. 元素周期表中的p区元素尽管种类不多,但其化合物种类繁多,在生产、生活和科研中应用广泛。回答下列问题:(1)、 分子的极性(填“大于”或“小于”) ,原因是。(2)、 可以稳定存在但是 不存在的主要原因是。(3)、乙二胺 在配合物结构图中常用 表示, 的结构如图所示,中心原子 的配位数是 , 该配离子中的键角 (填“大于”、“等于”或“小于”)乙二胺。(4)、基态 原子的d轨道与p轨道上的电子数之比为。晶体 (相对分子质量为M)是重要的热电材料之一,该晶体晶胞(以 为顶点)的棱长均为 ,棱边夹角均为 , 和 形成类似 晶胞的结构, 在 形成的四面体空隙处,则晶体的密度为 ( 表示阿伏加德罗常数的值),距离 最近的 有个。纳米材料的量子尺寸效应可以显著提高材料的热电性能,表面原子占总原子数的比例是重要的影响因素,假设某 材料颗粒恰好是由1个上述 晶胞构成的小立方体,该颗粒的表面原子数与总原子数的最简整数比为。
32. 元素周期表中的p区元素尽管种类不多,但其化合物种类繁多,在生产、生活和科研中应用广泛。回答下列问题:(1)、 分子的极性(填“大于”或“小于”) ,原因是。(2)、 可以稳定存在但是 不存在的主要原因是。(3)、乙二胺 在配合物结构图中常用 表示, 的结构如图所示,中心原子 的配位数是 , 该配离子中的键角 (填“大于”、“等于”或“小于”)乙二胺。(4)、基态 原子的d轨道与p轨道上的电子数之比为。晶体 (相对分子质量为M)是重要的热电材料之一,该晶体晶胞(以 为顶点)的棱长均为 ,棱边夹角均为 , 和 形成类似 晶胞的结构, 在 形成的四面体空隙处,则晶体的密度为 ( 表示阿伏加德罗常数的值),距离 最近的 有个。纳米材料的量子尺寸效应可以显著提高材料的热电性能,表面原子占总原子数的比例是重要的影响因素,假设某 材料颗粒恰好是由1个上述 晶胞构成的小立方体,该颗粒的表面原子数与总原子数的最简整数比为。 33. 锌及其化合物在工业、农业方面用途广泛。(1)、基态Zn原子的价电子排布式为。(2)、Zn原子能形成多种配位化合物。一种锌的配合物结构如图:
33. 锌及其化合物在工业、农业方面用途广泛。(1)、基态Zn原子的价电子排布式为。(2)、Zn原子能形成多种配位化合物。一种锌的配合物结构如图:
①其中C、N、O、Zn元素的第一电离能大小关系是 , 结构中参与sp3杂化原子有个。
②配位键①和②相比。较稳定的是;键角③键角④(填“>”、“<”、“=”)。
(3)、(CH3COO)2Zn和ZnC2O4中阴离子对应的酸中沸点较高的是(写结构简式),原因是。(4)、ZnO存在多种晶体结构,其中纤锌矿型和闪锌矿型是最常见的晶体结构,下图为这两种晶体的局部结构。
①图a纤锌矿型ZnO晶体中O2-的配位数为。
②闪锌矿型中Zn2+填入O2-所形成的“正四面体”空隙中,闪锌矿晶胞中含有个“正四面体”空隙。
③图b闪锌矿型晶胞密度为ρg/cm3.则Zn2+与O2-的距离为nm。(设NA为阿伏加德罗常数的值)
34. 由氧元素形成的常见物质有H2O、H2O2、O2和O3等。(1)、基态氧原子的电子排布式是。(2)、H2O分子的VSEPR模型是形。(3)、对H2O2分子结构的研究,曾有以下推测:
①根据测定H2O2分子中(填字母序号),确定其结构一定不是甲。
a.H-O键长 b.O-O键能 c.H-O-O键角
②由于H2O2不稳定,很难得到晶体。20世纪40年代初,卢嘉锡等化学家用尿素(
 )与H2O2形成较稳定的尿素过氧化氢复合物晶体,进而测得H2O2结构为乙。上述晶体中尿素与H2O2分子交替排列且二者中的O均与另外分子的H之间形成氢键。
)与H2O2形成较稳定的尿素过氧化氢复合物晶体,进而测得H2O2结构为乙。上述晶体中尿素与H2O2分子交替排列且二者中的O均与另外分子的H之间形成氢键。a.H2O2为(填“极性”或“非极性”)分子。
b.用“X—H…Y”表示出上述晶体中形成的氢键:。
(4)、O2的晶胞为立方体,结构如下。
根据图中信息,可计算O2晶体密度是g·cm-3。
(5)、已知O3分子空间结构为V形,中心O为sp2杂化。除σ键外,O3分子中还形成了含4个电子的大π键。每个O3分子中用于成键的电子总数是个,中心O提供参与成键的电子数是个。35. 如NOx是大气中主要的污染物。大气中过量的NOx和水体中过量的NH、NO、NO均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为2NO(g)+2CO(g)2CO2(g)+N2(g) △H=-746.5kJ·mol-1];也可将水体中的NO、NO转化为N2。下列有关NO2、NO、NO的说法正确的是( )A、NO的空间构型为V形 B、NO2与NO中的键角相同 C、NO2易溶于水是因NO2能与H2O形成分子间氢键 D、配位离子[Fe(NO)]2+中NO提供空轨道